Острый лимфобластный лейкоз критерии диагноза
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
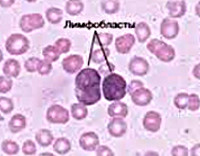
- Причины острого лимфобластного лейкоза
- Симптомы острого лимфобластного лейкоза
- Диагностика острого лимфобластного лейкоза
- Лечение и прогноз при остром лимфобластном лейкозе
- Цены на лечение
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей. У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
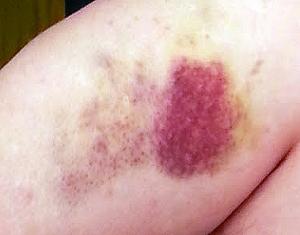
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Лейкемия – это злокачественный процесс в кроветворном органе, нарушающий функционирование органов и систем человека. Известны разновидности лейкозов, отличающихся способами формирования атипичных клеток. Лейкозы бывают острыми и хроническими. Для хронических характерно длительное развитие заболевания без явных симптомов. Острые формы развиваются быстро и активно поражают весь организм человека.
Острый лимфобластный лейкоз (ОЛЛ) – это гетерогенный процесс, вызывающий онкологическую патологию, при которой поражается система кроветворения, а именно костный мозг. Патологию провоцирует неконтролируемый процесс деления лимфобластов.
Для болезни характерны анемия, интоксикация всего организма, воспаление печени, лимфатических узлов и селезёнки, нарушение функций дыхания и спонтанные кровотечения. Лечением занимаются онкогематологи. Диагноз определяется по результатам инструментальных и лабораторных исследований. Код по МКБ-10 у рака крови С91.
В сравнении с другими видами заболевания, острая лимфобластная лейкемия может поражать головной и спинной мозг. Прогрессируют изменения в центральной нервной системе.
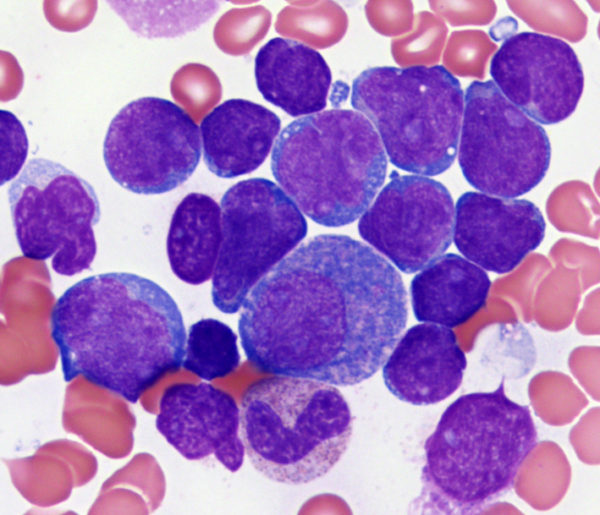
По определению Всемирной организации здравоохранения патология классифицируется как:
- Пре-пре-В-клеточный рак;
- Пре-В-клеточная лейкемия;
- В-клеточный лейкоз;
- Т-клеточный рак крови.
В-клеточная острая лимфобластная лейкемия определяется у 85% людей с ОЛЛ. В зону риска попадает трехлетний возраст детей или развивается после 60 лет. Распространена опухоль обычного типа В2.
Т-линейный рак определяется у 15% пациентов обычно в подростковом периоде.
Этиология заболевания
При патологии нарушается кроветворение под воздействием клона злокачественного характера. Его представляют неконтролируемые, постоянно делящиеся бласты. Клон создается из-за генетических нарушений, в ходе которых наблюдается обмен участками хромосом (транслокация), потеря участка (делеция), переворот участка (инверсия) и создание подобного участка (амплификация).
Раковая клетка закладывается на генетическом уровне во время формирования плода. Долгие годы она находится в спящем состоянии, но активируется при внешних агрессивных влияниях на организм.
Вторая группа крови сильней остальных подвержена острой лимфобластной лейкемии.
Заболевание развивается под действием следующих факторов:

- Повышенный радиационный фон в месте проживания человека.
- Работа с ионизирующим излучением.
- Частые рентгенологические исследования. Взаимосвязь с патологией только предполагается. Во время проведения диагностики под негативное влияние попадает кроветворный процесс организма, однако доза излучений невелика и онкология развивается в крайнем случае.
- Радиационное облучение при лечении злокачественных опухолей. 10% онкобольных сталкиваются с острым раковым состоянием крови после лечебного курса. Рак может проявляться в течение 10 лет.
- Острая форма лимфобластной лейкемии развивается на фоне инфекционных заболеваний.
- История болезни кровных родственников содержит онкологические процессы.
- У ребёнка болезнь может развиться, если родители с рождения создавали стерильные условия. Иммунитет не будет работать при контакте с патогенными возбудителями болезней. Ребёнок должен знакомиться с окружающим миром, контактировать с животными и чужими людьми. Простуды закаляют защитные силы организма, поэтому не нужно их бояться.
Причины развития острого течения лейкоза заключаются в контакте беременной женщины с опасными химическими элементами, при генетических отклонениях плода, к примеру, синдромах Дауна, Швахмана, Фанкони, Клайнфельтера, Вискотта-Олдрича. Педиатрия изучает влияние других патологий на раковый процесс. Рак ребёнка связывают с курением матери в период вынашивания плода.
В патогенезе отмечается развитие атипичных клеток в костном мозге, которые провоцируют нарушение кроветворения. Возникновение цитопений может сопровождаться кровотечениями слизистых и внутренними кровотечениями.

Острую лимфобластную лейкемию взрослых ассоциируют с филадельфийской хромосомой, характерной для В-клеточного рака. Другая форма острого течения заболевания – миелобластный лейкоз. В костном мозге пролиферируется предшественник гранулоцитов. Нелимфобластный рак связывают с переносом участка филадельфийской хромосомы.
Стадии патологии
В онкологической практике острый лейкоз делится на следующие стадии:
- Первая фаза имеет скрытое течение. В костном мозге зарождается злокачественный процесс, падает или поднимается уровень лейкоцитов. Формируются бласты.
- При развернутом этапе болезнь проявляется классическими симптомами. Процесс кроветворения нарушен. Инфекции активно поражают организм. Анализ крови определяет патологическое состояние.
- Рак крови проходит временно или полностью. Во время полной ремиссии восстанавливается уровень кровяных телец. Прекращаются мутации в кроветворном органе. Если болезнь отступает не полностью, на фоне хорошего самочувствия лимфоидный орган содержит повышенное количество бластов.
- Вторичный рак или рецидив характеризуется повторным поражением костного мозга или развитием новообразования в другом органе.
- На терминальной стадии незрелые лейкоциты распространяются по всем тканям и органам. Угнетаются функции систем человеческого тела. Лечение не приносит результатов. Присутствует постоянная угроза жизни пациента.
Клиническая картина
Симптомы для острого лейкоза развиваются в течение одного месяца. Лимфобласт делится, его количество стремительно растет. Увеличение бластов провоцирует замену здоровых клеток костного мозга на атипичные. Кроветворительный процесс нарушается, начинается метастазирование. Вторичное новообразование возникает в любом органе тела.
Для больного ребёнка характерны следующие синдромы:
- Сонливость.
- Бледность кожных покровов вследствие анемии.
- Снижение активности. Ребёнок не хочет играть.
- Потеря веса и отсутствие аппетита.
Симптомы вызывает снижение эритроцитов в сыворотке крови. Снижается уровень кислорода в тканях.
Частые инфекционные заболевания развиваются но фоне снижения лимфоцитов и полном или частичном отсутствии гранулоцитов. К симптомам присоединяется высокая температура. При снижении уровня тромбоцитов происходит поражение кожных покровов ярко-розовой сыпью. Болезнь может характеризоваться воспалениями слизистой рта.
В процесс вовлекается лимфатическая система. Отмечается увеличение узлов на шее, в области подмышек и в паху. Лимфоузлы болят и мешают активным действиям.
Когда опухоль развивается в полостях костей, у ребёнка нарушается двигательная активность. Наблюдается ломота и боль в конечностях.
Внутренние органы при контакте со злокачественными клетками отекают и увеличиваются. Печень и селезёнка значительно выпирают над уровнем кожи. Пациент испытывает боль при пальпации органов. Характерны острые боли в органах брюшной полости, расстройства стула.
Когда лейкоз добирается до головного мозга, развиваются эпилептические припадки, тошнота, головокружение, расстройство координации и зрения. Возникают симптомы менингита, при которых пациент испытывает невыносимые головные боли. Повышается внутричерепное давление. При этом прогноз на жизнь сводится к нулю.
Развитие анемии вызывает учащённое сердцебиение, головокружение и бледность кожных покровов. Снижается уровень тромбоцитов. Развиваются тромбозы. Слабые ушибы провоцируют масштабные подкожные кровоизлияния. Кровь плохо сворачивается. Носовые кровотечения и кровоточивость слизистых возникают внезапно и часто. Для кровотечений внутренних органов характерны рвота с включениями крови и чёрный стул.
Иммунологический аспект представлен покраснением, зудом и нагноением ран после инъекций и порезов. К раку присоединяются микозы, вирусы и бактерии, активно поражающие здоровье человека. Может уменьшаться объём лёгких вследствие увеличения лимфатических узлов. При этом больной ощущает одышку, не может вдохнуть полной грудью, кожные покровы становятся с голубым оттенком, синеют губы, появляется утомляемость и другие признаки кислородного голодания.
Способы определения диагноза
Диагностика подразумевает проведение комплекса лабораторно-инструментальных исследований. Важны показатели формулы крови и миелограммы.
- Развернутый анализ крови показывает уменьшение гемоглобина в 2 раза от нормы. Показатели снижаются при значительных кровопотерях, поэтому не всегда связываются с лейкозами.
- Число эритроцитов и тромбоцитов в сыворотке крови уменьшается в 2-4 раза.
- Снижается количество предшественников эритроцитов.
- Лимфоцит может потерять способность к делению или наоборот ускоренно размножаться. Показатели не будут в норме при лейкозе.
- Базофильные и эозинофильные клетки отсутствуют.
- Скорость оседания эритроцитов увеличивается в 5-10 раз.
- Для лейкоцитов характерен незрелый вид.
При лейкозе миелограмма показывает увеличенное количество бластов.
Для уточнения диагноза и диагностики внутренних органов проводят ультразвуковое исследование органов брюшной полости, эхокардиографию, рентген грудины и биопсию ликвора.
С помощью биохимического исследования крови определяют работоспособность и состояние печени с почками.
К методам диагностики острой онкологической патологии крови относятся магнитно-резонансная и компьютерная томографии. Они актуальны для выявления вторичных очагов. Способ исследований позволяет просканировать все участки человеческого тела.
Лечебная тактика
Лечением занимаются врачи в онкогематологическом центре. Протокол лечения подбирается индивидуально. Зависит от симптомов, стадии рака, состояния больного.
Первый этап в выздоровлении занимает химиотерапия. Препараты вводят внутривенно, реже внутримышечно или перорально. Компоненты цитостатиков проникают в структуру злокачественных клеток, блокируют размножение и развитие. Клинические рекомендации включают комплексное использование химиопрепаратов для достижения максимального эффекта. Люди с положительной динамикой выздоровления быстро входят в ремиссию.
При поражении головного или костного мозга используют лечение ионизирующим излучением. Лучевая терапия снимает болевой синдром и убивает аномальные лейкоциты.
В тяжёлых случаях пациентам необходима пересадка костного мозга. Операцию проводят после уничтожения собственного кроветворного органа путём ударных доз химиотерапии. После процедуры выживаемость пациентов возрастает. Метод имеет противопоказания и побочные эффекты:
- Донорский материал тяжело найти.
- Для проведения трансплантации уничтожается иммунитет пациента. В это время человек особо подвержен патогенным бактериям. ОРВИ и другие простые заболевания становятся причиной летального исхода.
- Трансплантируемый материал может не прижиться или начать отвергать организм пациента, распознавая все клетки и органы как чужеродные.
- Операция противопоказана больным с патологиями сердечно-сосудистой системы и почечной недостаточностью.
При достижении положительных результатов пациент отправляется на домашнее лечение. Долгое время ребёнок принимает слабые химиопрепараты для окончательного уничтожения злокачественного процесса.
Прогноз на жизнь
Современные методы диагностики и лечения увеличили шансы на выживаемость среди пациентов. 90% больных острым лимфобластным лейкозом проживают 5 лет со дня определения диагноза. Затем они снимаются с онкологического учёта и считаются здоровыми.
Шансы снижаются при отрицательной реакции на химиотерапию и при высоком уровне лейкоцитов на момент начала лечения болезни.
Каждый седьмой пациент встречается с возникновением рецидива в течение 3 лет после химиотерапии. Вторичное лечение рака эффективно у половины онкобольных.
При хороших жизненных показателях лейкоз может спонтанно ухудшить состояние пациента. При обнаружении подозрительных симптомов необходима срочная диагностика и лечение.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

