Как диагностировать острый лимфобластный лейкоз
Врач-гематолог, доктор медицинских наук Сергей Семочкин про острый лимфобластный лейкоз

Врач-гематолог, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова Минздрава России, доктор медицинских наук Сергей Семочкин рассказал: можно ли распознать острый лимфобластный лейкоз (ОЛЛ) на ранней стадии и поставить диагноз по анализу крови; объяснил, как лечат ОЛЛ и кому показана трансплантация костного мозга (ТКМ).
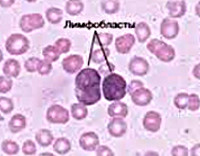
Как правило, в анализе крови есть ярко выраженные показатели: изменены ростки кроветворения, количество лейкоцитов выходит за пределы нормы - может упасть ниже нормальных значений, а может стать запредельно огромным. Мне встречались пациенты, у которых количество лейкоцитов при норме от 4 до 9 тысяч повышалось до 200 тысяч на мкл. Тромбоциты тоже в ряде случаев очень сильно снижены, но главное – изменение количества лейкоцитов. Очень важным маркером является выход опухолевых клеток в кровь, когда в крови появляются незрелые ранние клетки, которые называют бластными. Если в анализе крови выявили бластные клетки, то это, скорее всего, либо острый лейкоз, либо миелодиспластический синдром.
Анализ крови с характерными изменениями - повод для немедленного вызова скорой помощи и госпитализации пациента в профильный стационар. При лечении детей и подростков у онкогематолога, как правило, есть один-два дня ни диагностику, лечение необходимо начинать, как можно раньше. В диагностику входит повторный анализ крови, затем – верификация диагноза, для которой проводят биопсию костного мозга. У маленьких детей ее проводят под общей анестезией, у взрослых - под местной. С помощь небольшой иглы делаю прокол грудины или подвздошной кости. У детей пункцию грудины не делают. Полученный образец костного мозга, который выглядит как обычная пробирка с кровью, отправят в лабораторию, где для подтверждения диагноза проведут целый спектр исследований. Главный критерий – увеличение количества бластных клеток. Только по внешнему виду и по количеству бластных клеток определить вариант лейкоза – невозможно. Еще в 1913 году установили, что есть лимфоидный, а есть миелоидный вариант лейкоза. Для верификации применяются специальные лабораторные методы: иммунологические и химические. Существует специальный прибор – проточный цитометр, с помощью которого определяют маркеры, характеризующие данный тип клеток. Для определения подвида острого лейкоза, применяют целый спектр генетических исследований, чтобы выйти на более целевую терапию у этих пациентов.
Истинную причину возникновения лейкоза у взрослых можно выявить только в 5% случаев, в 95% совершенно непонятно, что там к чему привело. У детей все несколько интересней.
Как возникает лейкоз? В генетическом материале клетки возникает некая первичная мутация, которая сама по себе далеко не всегда приводит к лейкозу. В дальнейшем к этой мутации присоединяются другие, и когда болезнь все же возникает, в клетке накоплено уже много молекулярных событий, сочетание которых привело возникновению заболевания. Пик острого лимфобластного лейкоза приходится на детей от двух до четырех лет, потом заболеваемость падает. Следующий пик приходится на 18-29 лет, потом снова спад. После 60 лет - опять небольшой рост.
У части детей раннего возраста прослеживается некая врожденная составляющая этой проблемы. Встречаются случаи ОЛЛ у плода или новорожденного, когда ребенок рождается уже с заболеванием, либо заболевает в течение первого года жизни. Исследования пуповинной крови показали, что у новорожденных встречаются лейкемические поломки, врожденные мутации, которые могут привести к возникновению лейкоза. И мутацию эту вызывает наследственный фактор, сработавший во время внутриутробного развития. По разным данным, общее количество таких младенцев составляет от 1 до 5%. Дальше многое зависит от инфекционной обстановки, сложившейся вокруг ребенка. Многочисленные инфекции, перенесенные в детстве, способствуют формированию нормальной иммунной системы, которая нейтрализует наследственный фактор.
Если говорить про экологические проблемы, то с ними четкой связи не выявлено.
В Хиросиме и Нагасаки повышенная заболеваемость держалась около 12 лет. После Чернобыля у многих пострадала щитовидная железа, но заболеваемость лейкозами не выросла. Все зависит от типа изотопов попавших в окружающую среду. В Фукусиме тоже этого не случилось, потому что концентрация радиоактивных веществ сильно разбавилась морской водой.
Вред ультрафиолета научно доказан только в отношении меланомы. Четкой связи с ОЛЛ нет. Своим бывшим пациентам мы не разрешаем посещать солярий и не рекомендуем загорать, потому что хотя связь и не доказана, совсем исключать этот фактор тоже нельзя.
Если говорить об СВЧ-излучении, домашние микроволновые печи абсолютно безопасны.
В отличие от острого миелоидного лейкоза, показаний к аллогенной (от донора) ТКМ меньше. Ее назначают пациентам, которые не достигли ремиссии в указанные протоколом сроки или имеют неблагоприятный цитогенетический вариант заболевания. В детской практике выздоравливают более 90% детей, и примерно 15-20% являются кандидатами для аллогенной ТКМ. У взрослых процент пациентов нуждающихся в трансплантации несколько выше, за счет того, что генетических операций высокого риска становится намного больше и ответ на стандартное лечение хуже. Когда мы обсуждали хронический миелолейкоз, там фигурировала филадельфийская хромосома - транслокация (9;22). При ОЛЛ это абсолютно негативный фактор прогноза. У детей такая мутация встречается меньше чем в 5% случаев, у людей старше 50-60 лет примерно половина В-линейных ОЛЛ будет с филадельфийской хромосомой. В отличие от хронического миелолейкоза, применение ингибиторов тирозинкиназы при остром лимфобластном лейкозе не столь успешно. Вот поэтому во взрослой практике ТКМ необходимо проводить примерно 30% пациентов. Возрастной порог для аллогенной ТКМ - в районе 55 лет, это разумно.
Если мы говорим про взрослых людей, то рецидивы случаются почти в 40% случаев. Бывают ранние рецидивы, которые случаются прямо на терапии. В таком случае необходимо менять лечение, делать его более интенсивным и тяжелым. В таких случаях, как правило, показана ТКМ. Поздний рецидив может случиться и через 20 лет. К сожалению мы не можем убрать причину, которая вызывает это заболевание - оно может вернуться.
Длительная химиотерапия нарушает фертильность, поэтому лучше провести криоконсервацию спермы/яйцеклетки, а еще лучше эмбриона - это более надежный способ. У мужчин, как правило, серьезно нарушается сперматогенез, но у женщин дело обстоит несколько лучше. Вероятность забеременеть и выносить здорового ребенка высока. Если прошло не менее пяти лет в ремиссии, никаких ограничений нет.
Скорее, нет. Это не такое частое явление, как при некоторых других заболеваниях, где беременность действительно может стать провоцирующим фактором.
Лимфобластный лейкоз – редкое заболевание, поэтому вероятность того, что он случится у ребенка, рожденного от родителей после ОЛЛ, крайне мала.
Представляется, что в основе лечения онкологических заболеваний в будущем станет активация собственного иммунитета. Нам необходимо настроить иммунную систему таким образом, чтобы она распознавала и убирала раковые клетки. Сейчас мы находимся на раннем этапе развития CAR-T-терапии, но через какое-то время технологии настолько усовершенствуются, что, скорее всего, она станет одним из основных методов терапии при целом ряде онкогематологических заболеваний. Суть метода заключается в том, что у пациента собирают его собственные Т-лимфоциты и отправляют в специальную лабораторию. Эта лаборатория может быть в другом городе, стране - не важно. В лаборатории эти Т-лимфоциты перепрограммируются: в них появляется информация об опухолевых клетках, присутствующих в организме пациента. После перепрограммирования Т-лимфоциты вводят обратно пациенту, она находят раковые клетки и возникает ремиссия. Основные проблемы – создать качественный процесс распознавания и разработать стандартные протоколы лечения.
Много вопросов возникает в понимания биологии заболевания, потому как каждый конкретный случай весьма индивидуален. Мы знакомы только с грубыми поломками, но каждая отдельная поломка провоцирует различное течение болезни. Мы уже сейчас можем полностью секвенировать геном опухолевой клетки и главное научиться понимать, что в патогенезе является ключевым и как на это можно воздействовать, тогда мы ближе подойдем к полному излечению болезни. За этим будущее.
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
- Причины острого лимфобластного лейкоза
- Симптомы острого лимфобластного лейкоза
- Диагностика острого лимфобластного лейкоза
- Лечение и прогноз при остром лимфобластном лейкозе
- Цены на лечение
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей. У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.

Что такое острый лимфобластный лейкоз

Острый лейкоз бывает лимфобластного и нелимфобластного типа, частота их у детей составляет 72-80% и 16-19% соответственно. Оставшиеся 1-3% приходятся на хронический миелолейкоз.
Острый лимфобластный лейкоз (ОЛЛ) — это злокачественное новообразование, возникающее из клеток кроветворной системы, являющихся клетками-предшественницами лимфоцитов в красном костном мозге (ККМ).
Родоначальником лейкозного клона является полипотентная стволовая клетка ККМ, подвергающаяся генетическим мутациям, в результате чего она приобретает черты атипии, не созревает до нужной клеточной генерации и множественно делится, вытесняя из костного мозга клетки остальных ветвей гемопоэза. В результате костный мозг остаётся заполненным лимфобластами, которые также наводняют собой кровоток и некоторые органы (лимфоузлы, селезёнку, печень, головной мозг). Опухолевый процесс поддерживается и мутациями генов, регулирующих апоптоз клеток — их запрограммированную гибель в случае дефектов.
Причины возникновения ОЛЛ у детей

Острый лейкоз является полиэтиологическим заболеванием, то есть, в появлении его могут играть роль несколько факторов.
- Генетический фактор: врождённые генетические дефекты, генные и хромосомные мутации различного типа, наследственные заболевания.
- Повреждающие ДНК клеток внешние факторы:
- ионизирующая радиация;
- тяжёлые металлы, пестициды, гербициды, бензол, индол, нитрокраски;
- лекарственные средства (необоснованное и массивное применение цитостатиков, иммуносупрессоров, антибиотиков, НПВС);
- некоторые долго живущие вирусы, персистирующие в органах человека (вирус простого герпеса, вирус Эпштейн-Барр, ВПЧ).
Симптомы и признаки ОЛЛ у детей

Не специфические симптомы лейкоза — недомогание и слабость
Симптомы общей интоксикации: недомогание, вялость, сонливость, повышение температуры тела, потливость.
Симптомы анемии: одышка, тахикардия, бледность кожи, слизистой рта, конъюнктив, сердечные и сосудистые шумы.
Симптомы иммунных нарушений: некротические и гнойные процессы различной локализации (гнойнички кожи, некротическая ангина, некроз кожи, слизистой рта, кишечника, пневмония).
Симптомы ухудшения свёртываемости крови: кровотечения из носа, рта (дёсневые), мест инъекций, кожные гематомы в местах лёгкой травматизации, кровь в моче.
Симптомы гиперплазии лимфоидных органов:
- увеличение лимфоузлов, печени, селезёнки;
- боли в плоских костях (кости таза, рёбра, грудина, кости черепа), диафизах трубчатых костей и суставах за счёт давления увеличенного в объёме костного мозга на надкостницу;
- гиперплазия кожи — редко;
- уплотнение яичек, семенных канатиков, яичников при их инфильтрации;
- инфильтрация лёгких, сердца — появление клиники бронхита, пневмонии, миокардита.

Ребенка может беспокоить тошнота и рвота
- головные боли, усиление их может провоцироваться ярким светом, громкими звуками, прикосновением к коже;
- тошнота, рвота, ригидность мышц шеи;
- нарушение зрения, слуха, речи, двигательной активности;
- повышенный аппетит, жажда, нарушения психики, коматозное состояние.
Стадии заболевания ОЛЛ

Начальная стадия напоминает ОРВИ
1) Начальный период ОЛЛ зачастую не диагностируется, так как симптомы болезни напоминают клинику ОРВИ, ангины. Больной ребёнок становится вялым, может чувствовать головные боли, головокружение, боли в животе, мышцах, суставах. Часто возникает одышка, ускоренное сердцебиение, температура тела повышается до субфебрильных цифр (в среднем, до 37,5 о С). На коже могут появляться гнойничковые высыпания, появляются или учащаются носовые кровотечения, на нёбных миндалинах могут возникнуть обильные гнойные наложения или некротические массы. Важным симптомом, который должен заставить родителя отвести ребёнка к врачу, является преходящее увеличение разных групп лимфатических узлов.
2) Первично-активная стадия или развёрнутая стадия ОЛЛ.
Разгар болезни протекает с бурным началом. Выражена общая интоксикация: усиливается слабость, головные боли, температура тела волнообразно меняется в течение суток, к вечеру наблюдается субфебрилитет. Усиливаются суставные и костные боли, одышка, тахикардия, бледность кожи и слизистых. Значительно увеличены лимфоузлы (особенно шейные, подмышечные и паховые), слюнные и слёзные железы, печень и селезёнка, которые могут занимать около половины брюшной полости. Повышается кровоточивость, на коже возникают полиморфные высыпания, усиливаются носовые кровотечения, которые трудно купировать.

Лейкоз может уходить в ремиссию
3) Стадия ремиссии:
- полная ремиссия — нет жалоб и объективных симптомов болезни, нет бластных клеток в периферической крови и не более 5% в ККМ;
- неполная ремиссия — те же особенности, но бластов к ККМ может быть 5-20%.
- костномозговой рецидив — часто увеличены лимфоузлы, печень и селезёнка, наблюдаются симптомы анемии, либо клинических проявлений болезни нет, но анализы крови и ККМ изменены;
- экстрамедуллярный рецидив — выраженная клиника без изменения миелограммы (в ККМ до 0% бластов).
5) Терминальная стадия: выраженное угнетение кроветворения с угрожающими жизни ребёнка вторичными инфекционными осложнениями и спонтанными кровотечениями.
6) Стадия выздоровления: полное купирование клиники и лабораторных изменений без остаточных последствий лейкемии. Бывает крайне редко.
Диагностика

Лабораторные тесты указывают на патологию кроветворения
- В общем анализе крови: уменьшение гемоглобина, эритроцитов, тромбоцитов, гранулоцитов, увеличение количества бластных атипичных клеток, ускорение СОЭ.
- В биохимическом анализе крови: увеличение ЛДГ, билирубина, АСТ, щелочной фосфатазы, уменьшение общего белка, альбумина, глюкозы, железа, электролитов.
- В общем анализе мочи: белок, лейкоциты, цилиндры, бактерии.
- В миелограмме (анализ, отражающий клеточный состав ККМ):
- в начальную стадию — до 25% бластов;
- в развёрнутую стадию — более 25% бластов, феномен лейкемического зияния, уменьшение предшественников эритроцитов и тромбоцитов;
- в стадию полной ремиссии — менее 5% бластов, при неполной ремиссии — менее 20% бластов, ростки других клеток в ККМ не угнетены;
- в стадию рецидива — более 5% бластов, либо без изменений.
- Цитохимическое (на ферменты) и иммуногистохимическое (на клеточные маркеры) исследование.
- Генетическое исследование: транслокация генов на 4, 11, 9, 22 хромосоме.
- Спинномозговая пункция: бластоз, увеличение белка в ликворе.
Виды лечения:

Химиопрепараты — терапия выбора при лейкозе
- Полихимиотерапия — лечение сочетанием цитостатических и стероидных препаратов, действие которых направлено на уничтожение клона атипичных клеток.
Фазы лечения: Лекарства: индукция ремиссии преднизолон, винкристин, аспарагиназа, метотраксат, 6-меркаптопурин, циклофосфамид консолидация ремиссии 6-меркаптопурин, аспарагиназа, метотрексат реиндукция ремиссии лекарства первой фазы поддерживающая терапия 6-меркаптопурин и метотрексат
Химиотерапия проводится по специальным протоколам лечения:
- ALL-BFM 95m — утверждён в 1990 году, рассчитан на 6 месяцев интенсивной терапии и до 2 лет поддерживающей терапии;
- ALL-MB — утверждён в 2002 году, рассчитан на 8 месяцев интенсивной терапии с поддержкой лекарствами до 2 лет.
Профилактика ОЛЛ:

Здоровый образ жизни- неотъемлемая часть профилактики
- Исключить воздействие радиации, химикатов, необоснованно назначенных лекарств.
- Использовать доброкачественные продукты питания, безопасные средства ухода за ребёнком.
- Исключить самолечение. Вовремя обратиться к врачу при возникновении у ребёнка: внезапного увеличения лимфоузлов, клиники анемии, некротической ангины, кровотечений, повышенной температуры.
- Женщинам рекомендуется планировать беременность, исследоваться на носительство вирусов, избегать вредные воздействия на организм при беременности (радиация, антибиотики, цитостатики, алкоголь, никотин, наркотики).
Прогноз

Прогноз благоприятный в возрасте 1-9 лет
Прогноз благоприятен при возникновении ОЛЛ у детей 1-9 лет, сравнительно невысоких цифрах бластов в ККМ и периферической крови, хорошем отклике организма на химиотерапию (снижение бластов ККМ до 5% за 1 месяц лечения), при отсутствии повреждения ЦНС.
Неблагоприятным прогнозом считается ОЛЛ у новорождённых и детей старше 9-10 лет, с вовлечением головного мозга, высоким бластозом ликвора, крови, костного мозга, при плохом ответе на терапию (5-25% бластов в ККМ через 1 месяц лечения), при выявлении Т-клеточного иммунофенотипа и транслокаций генов между 9 и 22, 4 и 11 хромосомами.
Читайте также:

