Восстановление после удаления опухоли средостения
Следует еще раз подчеркнуть, что двусторонний пневмоторакс опасен при операциях на средостении и его органах, проводимых под местной анестезией, и в значительно меньшей степени опасен при операциях под интратрахеальным наркозом. Вовремя распознанный пневмоторакс при интратрахеальном наркозе ликвидируется раздуванием легких с помощью мехов аппарата для наркоза или включением спиропульсатора. Под местной анестезией нельзя полностью осуществить расправление легкого. Однако и в этих случаях с помощью герметичной маски можно некоторое время поддерживать кислородное дыхание. Затем мы пользовались следующим оригинальным способом герметизации средостения, описанным нами в 1950 г.
При небольшом отверстии в медиастинальнои плевре мы применяли медиастинальную пневмопексию. Для этой цели противоположное легкое окончатыми щипцами через отверстие в медиастинальнои плевре захватывалось, слегка выводилось в рану и подшивалось к краям отверстия в средостении. Последнее как бы тампонировалось, причем разобщались правая и левая плевральные полости.
При большом отверстии в медиастинальнои плевре необходима иная методика, так как в этих случаях трудно фиксировать легкое к краям истонченной и рвущейся медиастинальнои плевры. В данных обстоятельствах мы выводили противоположное легкое через отверстие в средостении на сторону операции и здесь сшивали его несколькими кетгутовыми швами с легким другой стороны вблизи от широкого отверстия в медиастинальнои плевре. При этом отверстие в плевре тампонируется легочной тканью, что также приводит к герметизации средостения.
Медиастинальную пневмопексию и сшивание легких через отверстие в медиастинальнои плевре мы с успехом применяли при операциях по поводу рака пищевода, когда, как известно, чаще всего возникает двусторонний пневмоторакс.
Всего нами произведено 8 медиастинальных пневмопексий и 5 сшиваний правого и левого легкого при двустороннем пневмотораксе. Большинство этих операций выполнено при раке пищевода и только одна — при опухоли средостения.
После каждой операции, осложнившейся двусторонним пневмотораксом, необходимо систематическое удаление воздуха и жидкости из обеих плевральных полостей с помощью пункции.
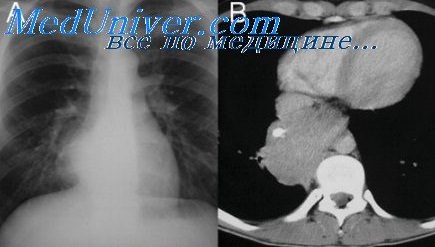
Послеоперационный период у больных, перенесших хирургическое вмешательство на средостении, характеризуется рядом особенностей, присущих большинству торакальных операций. Эти особенности в свою очередь определяются следующими факторами :
1) вскрывается плевральная полость, наступает пневмоторакс, вызывающий коллапс легкого и нарушение легочного кровообращения ;
2) травмируется скелет грудной клетки, плевра, нервы и сосуды средостения, что ведет к кровотечению, раздражению нервных стволов и нервных окончаний, высыханию плевры и ее охлаждению;
3) в связи с близостью сердца во время операций на средостении может иметь место прямое травмирование перикарда и сердца.
В результате действия этих факторов развиваются нарушения функции органов дыхания и кровообращения, которые у отдельных больных могут вызвать тяжелые осложнения.
Чаще всего, даже при тяжелых и длительных операциях на средостении, защитные и компенсаторные механизмы, проявляющиеся при каждой операции, в том числе и при операции в грудной полости, а также активные профилактические мероприятия (см. выше) помогают организму справиться с указанными функциональными нарушениями. Кроме того, в предоперационном периоде организм больного в известной мере приспосабливается к патологическому процессу в средостении. Оперативное вмешательство устраняет патологический очаг и создает оптимальные условия для развития компенсаторных процессов. Однако вышеупомянутые факторы, сопутствующие каждой операции на грудной полости, приводят к быстрой смене ряда функциональных и морфологических изменений, обусловливающих реакцию организма на операционную травму. Происходит мобилизация резервных возможностей организма, перестраивается нервная регуляция.
Описание удаления опухоли средостения
Это операция по удалению опухоли в области грудной клетки, которая отделяет легкие от остальных органов.
Причины удаления опухоли средостения
Злокачественная (раковая) опухоль должна быть удалена, чтобы предотвратить распространение рака. Без удаления или лечения рак может распространиться на другие части тела. Рак может также начать сжимать органы грудной клетки, такие как сердце, легкие, или пищевод.
Пациенты, проходящие операцию по удалению опухоли средостения, часто имеют лучший прогноз, чем те, кто проходит курс лучевой или химиотерапии.
Возможные осложнения удаления опухоли средостения
Осложнения встречаются редко, но процедура не гарантирует отсутствие риска. Если планируется удаление опухоли средостения, нужно знать о возможных осложнениях, которые могут включать:
- Повреждение органов, прилегающих к опухоли, в том числе сердца, легких и спинного мозга;
- Накопление жидкости между покровом легочной ткани и стенкой грудной полости;
- Дренаж, инфекции или кровотечения.
Факторы, которые могут увеличить риск ослонений:
Как проводится удаление опухоли средостения?
Перед операцией врач может провести или назначить следующее:
- Медицинский осмотр;
- Анализы крови;
- Рентген – это тест, который использует излучение, чтобы выполнить снимки структур внутри тела;
- МРТ – тест, который использует магнитные волны, чтобы выполнить снимки структуры внутри тела;
- Компьютерная томография брюшной полости – типа рентгена, который использует компьютер, чтобы сделать снимки органов тела;
- Позитронно-эмиссионная томография – тест, который использует радиационные метки, которые показывают активность в тканях организма.
В преддверии операции:
- Обратитесь к врачу по поводу принимаемых лекарств. За неделю до операции вас могут попросить прекратить принимать некоторые препараты:
- Противовоспалительные препараты (например, аспирин);
- Разжижающие кровь (например, клопидогрель);
- Антитромбоцитарные препараты (например, варфарин);
- Можно съесть легкую пищу вечером перед операцией. Не ешьте и не пейте ничего на ночь;
- Нужно организовать возвращение домой из больницы. Кроме того, нужно организовать помощь на дому.
Применяется общая анестезия, которая блокирует боль и поддерживает пациента в состоянии сна во время операции.
Перед началом операции пациенту вводят дыхательную трубку и внутривенный катетер. Катетер используется для введения лекарств и жидкостей во время операции.
Чтобы удалить опухоль, врач выполняет один большой, разрез в центральной части груди или несколько маленьких разрезов. Если выполняется несколько маленьких надрезов, в один из них будет вставлена камера. Камера позволяет врачу видеть область операции на мониторе. Через другие разрезы будут вставлены хирургические инструменты. Опухоль и по необходимости окружающие ткани будут удалены.
Врач может вставить в грудь дренажные трубки, которые помогут удалить жидкость и воздух из грудной полости. Разрез будет закрыт с помощью скоб или швов.
Дыхательная трубка будет удалена. Вы будете направлены в послеоперационную палату для наблюдения за состоянием здоровья.
Сколько времени займет удаление опухоли средостения?
Около 1-4 часов (в зависимости от типа операции).
Удаление опухоли средостения – будет ли это больно?
Анестезия облегчит дискомфорт после операции. Область операции может обладать повышенной чувствительностью. Врач предоставит обезболивающие лекарства для снятия дискомфорта.
Среднее пребывание в больнице после удаления опухоли средостения
Эта операция проводится в условиях стационара. Обычно длительность пребывания составляет четыре дня. Врач может продлить срок пребывания, если возникают осложнения.
Процедуры по уходу после удаления опухоли средостения
После операции дополнительно может потребоваться химиотерапия и/или лучевая терапия.
В больнице вы будете принимать жидкую пищу. Нужно практиковать глубокое дыхание и кашель, чтобы помочь легким восстановиться.
Когда вы находитесь дома, обязательно следуйте указаниям врача, в том числе:
- Избегайте подъема объектов тяжелее, чем 3 кг;
- Не садитесь за руль в течение 4-6 недель;
- Выполняйте несложные упражнения. Это поможет вам восстановиться.
Необходимо уточнить у врача, когда можно безопасно принимать душ, ванну или подвергать место операции воздействию воды.
Связь с врачом после удаления опухоли средостения
После выписки из больницы нужно обратиться к врачу, если появились следующие симптомы:
- Признаки инфекции, включая лихорадку и озноб;
- Покраснение, отек, усиление боли, кровотечение, или любые выделения из операционного разреза;
- Боль, которая не проходит после приема назначенных обезболивающих лекарств;
- Кашель, затрудненное дыхание или боли в груди;
- Боль, жжение, частое мочеиспускание или постоянное наличие крови в моче;
- Постоянная тошнота и/или рвота;
- Потеря аппетита;
- Боль и/или отек ног, икр и ступней;
- Любые другие болезненные симптомы.
Ведение послеоперационного периода связано с определенными трудностями.
После операции больные получают увлажненный кислород, ингаляции антибиотиков, соды и химотрипсина, камфору, строфантин, корглюкон (в зависимости от частоты сердечных сокращений), 40% раствор глюкозы с витаминами С и В внутривенно, обезболивающие средства (2% раствор промедола, 50% раствор анальгина), антибиотики парентерально с учетом чувствительности микрофлоры. Таким образом, при гладком течении послеоперационного периода лечебные мероприятия ограничиваются профилактикой сердечно-сосудистых и дыхательных расстройств, инфекции, борьбой с болями.
При нарушении водноэлектролитного баланса, щелочного резерва соответственно назначают препараты калия, хлориды, соду. Учет количества выпитой и выведенной жидкости позволяет своевременно производить коррекцию водного баланса. При явлениях олигурии исследуется содержание остаточного азота, мочевины и электролитов крови. Лечение проявлений почечной недостаточности заключается в повторных вливаниях 20% раствора глюкозы по 200 мл с витаминами B, С, маннитола, гидрокортизона.
Основное внимание уделяется состоянию легких после операции (В. С. Карпенко, А. М. Тарнопольский, В. М. Кравец, 1966). С этой целью в плевральной полости создается эффективное разрежение с помощью вакуум-аппарата. Дренаж из плевральной полости извлекают на следующие сутки, если разрежение стойко удерживается. В этот же день производят рентгеноскопию грудной клетки. Рентгенологический контроль в последующие сутки начинают в зависимости от общего состояния больного, данных аускультации. При наличии в плевральной полости воздуха и экссудата производят пункцию плевральной полости с аспирацией содержимого и введением антибиотиков.
У некоторых больных в послеоперационном периоде усиливается секреция в трахеобронхиальных путях, что приводит к дыхательной гипоксии. В этих случаях мы широко пользовались эндотрахеальным введением антибиотиков на физиологическом растворе путем прокола трахеи. При неэффективности этих мероприятий и рентгенологических признаках ателектаза мы немедленно применяем лечебную бронхоскопию под наркозом.
Кровопотерю восполняют во время операции, поэтому переливание крови обычно применяем для стимуляции в послеоперационном периоде. Повышение температуры в первые трое суток — обычное явление, однако если температура становится выше, чем в предыдущие 2 дня после операции, и удерживается в последующем, это свидетельствует о присоединении инфекции. Поэтому мы производили ревизию раны, рентгеноскопию грудной клетки, осматривали вены, через которые вливали жидкости или проводили анестезию.
При исключении экстраторакальных причин повышения температуры основное внимание уделялось лечению начинающейся пневмонии, рентгенологические признаки которой могут отсутствовать в первые дни. Важное значение приобретают данные аускультации, частота дыхания и пульса, состояние кожных покровов, адинамия. Пневмония, как осложнение после операции по поводу новообразований средостения, имела место у 9 больных.
Флебиты и тромбофлебиты вен нижних конечностей мы наблюдали у 4 больных. Среди осложнений, связанных с техническими погрешностями при укладке больных на операционном столе, мы наблюдали плекситы (6 больных). Травматические плекситы отличаются торпидным течением, что нередко несколько задерживает выздоровление больных несмотря на полный благополучный исход хирургического лечения основного заболевания. Лечение плекситов заключалось в назначении прозерина, витаминов, алоэ и стекловидного тела, пирабутола (бутадиона, реопирина), массажа, ЛФК. В среднем лечение плексита занимает 3—4 недели.
У 18 больных после перенесенной операции мы наблюдали явления астенизации. У таких больных нарушается сон, появляется раздражительность, быстрая утомляемость, отсутствие аппетита, подавленное настроение и другие проявления психогенного дискомфорта. Лечение заключалось в назначении седативных средств (бромиды, андаксин и др.), переливаний крови, плазмы, применении гормональных анаболитов (метиландростендиол), препаратов китайского лимонника, женьшеня, пантокрина, витаминов группы В, лечебной физкультуры. В последующем после выписки из больницы показано санаторно-курортное лечение.
После заживления раны у 7 больных имела место длительная экссудация в плевральную полость на стороне операции (реактивный плеврит). Обычно в экссудате количество лейкоцитов не превышает 10—20 в поле зрения. Введение антибиотиков в плевральную полость усиливает экссудацию. Наилучшие результаты дает десенсибилизирующая терапия (вливание 10% раствора хлористого кальция, супрастина). Местно в плевральную полость мы вводили по 50—100 мг гидрокортизона 1 раз в неделю, что привело к значительному уменьшению экссудации в ближайшие дни, а затем к ее ликвидации.
Нагноение раны имело место у 5 больных в связи с незамеченной серомой или гематомой. При этом мы снимали частично швы и производили обкалывание краев раны раствором антибиотиков.
Тяжелые осложнения послеоперационного периода наблюдались у 5 больных и явились одной из причин смертельного исхода.
У одной больной во время операции имело место повреждение безымянной вены и двусторонний пневмоторакс в связи с повреждением обеих медиастинальных плевр. Это осложнение не было распознано в послеоперационном периоде. Состояние больной было крайне тяжелым и расценивалось как результат массивной кровопотери и сердечно-сосудистого коллапса.
Другой больной умер от тромбоза сосудов головного мозга на 6-е сутки после операции. При вскрытии обнаружен атеросклероз с преимущественным поражением сосудов головного мозга и обширный очаг серого размягчения левой гемисферы.
У третьего больного во время операции была повреждена верхняя полая вена, что сопровождалось массивной кровопотерей. После лигирования сосуда появился острый венозный застой в головном мозгу; больной умер спустя 1 час после оперативного вмешательства. На секции установлено наличие огромной двусторонней нейрогенной саркомы передне-нижнего средостения с прорастанием сердечной сорочки, легких и метастазами в легкие, выраженный отек легких мозговых оболочек и вещества мозга.
У четвертой больной смерть наступила от легочно-сердечной недостаточности спустя 2 суток после дренирования больших размеров нагноившейся тератоидной медиастинальной кисты.
На вскрытии выявлена незрелая тератома средостения с некрозом и метастазами в легкие, лимфоузлы средостения и оба яичника. Кроме того, обнаружены фибринозный перикардит, зернистая дистрофия миокарда, печени, почек, левосторонний гидроторакс. У пятого больного внезапно развилась острая сердечно-сосудистая и легочная недостаточность, закончившаяся летальным исходом. Непосредственными причинами смерти 3 больных с тяжелой миастенией, умерших после тимэктомии на 3-й, 5-и и 17-е сутки, оказались: обширные ателектазы легких, двусторонняя аспирационная пневмония, ограниченный медиастинит на фоне часто повторяющихся миастенических и холинэргических кризов.
Как видно из приведенных данных, у 8 (3,5%) из 225 больных, оперированных по поводу опухолей и кист средостения, в ближайшем послеоперационном периоде наступила смерть.
Анализируя послеоперационные осложнения, закончившиеся летальным исходом, следует подчеркнуть, что у 2 из 8 умерших во время операции и на секции были выявлены злокачественные медиастинальные и внемедиастинальные опухоли с метастазами в отдаленные органы. Иноперабельное их состояние, к сожалению, до операции не было выявлено, а оперативное вмешательство предпринималось по жизненным показаниям. Разумеется, в этих случаях операция была паллиативной. Прогрессирующий рост опухоли, бластоматозная интоксикация, усугубившаяся операционной травмой, явились теми отягощающими моментами, которые привели к тяжелым осложнениям, повлекшим за собой смертельный исход.
Таким образом, ведение послеоперационного периода после удаления опухолей и кист средостения преследует цели своевременного распознавания тех или иных осложнений и своевременной их ликвидации.
Записаться на консультацию 8-921-389-56-85
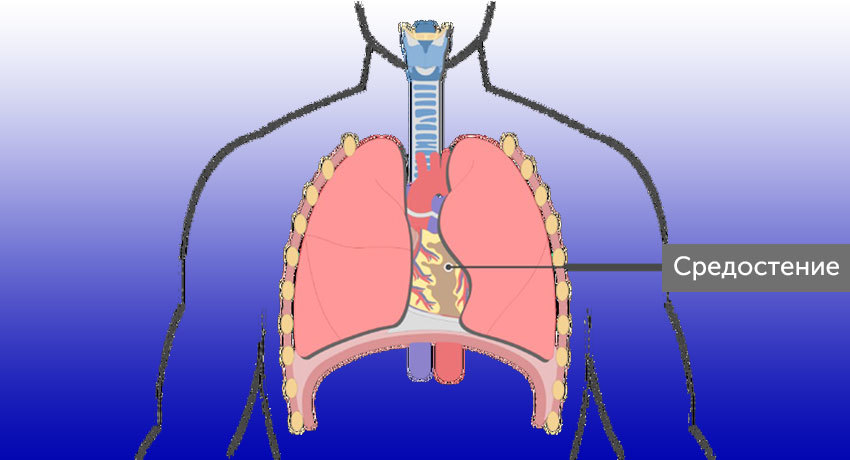
Средостение ( mediastinum ) – комплекс органов, расположенных в грудной полости между левой и правой медиастинальной плеврой, задней поверхностью грудины и грудным отделом позвоночника и шейками ребер.
Чаще всего средостение делится на 3 отдела (переднее — периваскулярное, среднее — висцеральное, заднее — паравертебральное). Опухоли и кисты — новообразования различного гистогенеза, объединенные в общую нозологическую группу благодаря расположению в одной анатомической области.
Патоморфологические формы характеризуются чрезвычайным многообразием. Развитие опухолей и кист среди жизненно важных органов в ограниченном пространстве приводит к сдавлению, смещению элементов средостения, создавая риск для жизни больного.
Опухоли могут исходить из самих органов, эктопированных и тканей между ними. Кисты являются следствием патологических процессов и пороков развития с формированием полостей.
Особенностями проблем опухолей и кист являются морфологические и анатомо-физиологические характеристики средостения, трудности морфологической верификации, неопределенность лечебной тактики при ряде заболеваний.
Цены на платные услуги
Клиника и методы диагностики опухолей средостения
В структуре онкологических заболеваний опухоли и кисты составляют 3–7 %, из них 80 % — доброкачественные, 20 % — злокачественные. Озлокачествление доброкачественных опухолей отмечается в 17–41 % случаев.
Чаще встречаются в возрасте 18–45 лет. Рак развивается из тканей органов средостения, нервной и соединительной ткани, клеток стволовых и появляющихся при нарушенном внутриутробном развитии.
Причины заболевания до конца не выяснены. По мнению большинства ученых-медиков, патология развивается из-за воздействия:
- ионизирующего излучения;
- контакта с канцерогенами в быту и профессиональной среде;
- вирусов Энштейна – Барра, ВИЧ и других.
- одышка, головные боли, синюшность губ, расширенные вены и отечность лица и шеи;
- истощение, утомляемость, мышечная слабость;
- нарушение сердечного ритма, его замедление или учащение;
- повышение температуры тела до 37 о С;
- плеврит;
- кашель;
- боль в грудной клетке и суставах;
- кровохарканье;
- значительная потеря массы тела – до 15 кг.
Заболевание может маскироваться под вялотекущий бронхит или пневмонию, что затрудняет диагностику. У трети больных на начальных стадиях симптомов нет.
В клинике опухолей и кист средостения выделяют два периода:
- скрытый бессимптомный — опухоль случайно выявлена на рентгене легких или компьютерной томографии;
- выраженную клинику — боль, затруднение дыхания, кашель, субфебрилитет, признаки компрессии органов (верхней полой вены, пищевода, трахеи, нервов и спинного мозга, сердца).
Для диагностики используют:
- рентгеноскопию грудной клетки в нескольких проекциях;
- УЗИ;
- КТ и МРТ, позитронно-эмиссионную томографию;
- эндоскопические методики – фибробронхоскопию, медиастиноскопию, видеоторакоскопию;
- пункционную биопсию, в том числе увеличенных лимфоузлов;
- лабораторные анализы.
Злокачественные опухоли средостения имеют короткий бессимптомный период развития, быстро увеличиваются в размерах, метастазируют, дают симптомы компрессии органов.
Лечение опухоли средостения
Тактика зависит от стадии заболевания. Хирургический метод приоритетен при всех формах опухолей и кист, за исключением лимфом, при которых тактика требует индивидуализации (приоритет — химиолучевой метод). При злокачественных опухолях средостения хирургический метод может сочетаться с лучевым, химиотерапией, которые повышают эффективность терапии.
Показанием к хирургическому лечению являются опухоли и кисты средостения независимо от наличия клиники, локального и местного распространения, за исключением лимфом. При герминогенных опухолях возможна неоадъювантная химиотерапия.
Показанием к хирургическому лечению являются опухоли и кисты средостения независимо от наличия клиники, локального и местного распространения, за исключением лимфом. При герминогенных опухолях возможна неоадъювантная химиотерапия.
Противопоказания к хирургическому лечению:
- выраженный синдром сдавления верхней полой вены (венозное давление выше 200 мм вод. столба.);
- генерализация злокачественного процесса;
- прорастание пищевода, трахеи, главных бронхов с невозможностью их резекции;
- сопутствующая органная недостаточность.
При невозможности хирургического лечения показано проведение химиолучевой терапии.
На данный момент известно почти 100 разновидностей доброкачественных и злокачественных опухолей в средостении — комплексе органов, расположенных между легкими. Подходы к их лечению различаются, зачастую основным методом является хирургическое вмешательство.

Существуют две разновидности операций:
- Торакотомические — открытым способом через разрез на грудной стенке.
- Видео-ассистированная торакоскопия (VATS) — малоинвазивное вмешательство через проколы. Главные преимущества торакоскопии в том, что она сопровождается меньшей кровопотерей и более низким риском осложнений, после нее не так сильно беспокоят боли, быстрее происходит возврат пациента к нормальной жизни. Но такие вмешательства возможны не всегда — к ним прибегают на ранних стадиях, при небольших размерах новообразований. Кроме того, VATS сложны в техническом исполнении, они требуют от хирурга определенных навыков и профессионализма.
Врачи клиники Медицина 24/7 имеют большой успешный опыт проведения операций VATS при раке легкого и опухолях средостения. Наши операционные оснащены новейшим оборудованием от лучших производителей.
Оставьте свой номер телефона
Операции при новообразованиях вилочковой железы
При злокачественных опухолях тимуса без признаков распространения в соседние органы и лимфатические узлы выполняют операцию, во время которой, помимо вилочковой железы, удаляют всю клетчатку средостения и регионарные лимфоузлы. Иногда выполняют резекцию диафрагмального нерва, перикарда, кровеносных сосудов, легкого — если есть подозрение, что в них вторглась опухоль. Если на момент диагностики уже имеется инвазия в органы средостения, лечение начинают с химиотерапии и/или лучевой терапии. Они уменьшают размеры новообразования и делают его резектабельным. При этом операция имеет некоторые технические особенности изменений в тканях средостения.
При нерезектабельных злокачественных опухолях вилочковой железы и при опухолях с метастазами проводят лучевую терапию и химиотерапию.
Показания к адъювантной (после операции) лучевой терапии и химиолучевой терапии:
- Прорастание опухолевой ткани в капсулу.
- Позитивный край резекции: при исследовании удаленных тканей под микроскопом рядом с линией разреза обнаружены опухолевые клетки — это означает, что часть их могла остаться в организме.
- Макроскопическая (заметная без микроскопа) остаточная опухоль.
- По результатам гистологического исследования удаленного новообразования диагностирована карцинома тимуса. Эта опухоль агрессивна и более склонна к рецидивированию.
Операции при опухолях из зародышевых клеток
Радикальная операция является основным методом лечения доброкачественной тератомы. Эта опухоль возникает нарушения развития половых клеток. Чаще всего тератомы обнаруживают в женских яичниках и мужских яичках, в головном мозге, области крестца и копчика. Средостение — редкая локализация.
При тератомах в средостении развивается процесс, опухоль может быть соединена спайками с пищеводом, трахеей, крупными сосудами. Они создают сложности во время операции. Зачастую приходится удалять часть диафрагмального нерва, перикарда (околосердечной сумки). В редких случаях необходима резекция крупных сосудов с последующей пластикой.
Прогноз после радикального удаления доброкачественной тератомы благоприятный.
При внегонадных несеминомных опухолях и семиномах лечение начинают с химиотерапии.
Операции при опухолях мягких тканей
При различных типах мезенхимальных опухолей хирургическое вмешательство является основным видом лечения:
- Липомы и липосаркомы — доброкачественные и злокачественные опухоли из жировой ткани. Низкодифференцированные агрессивные новообразования часто распространяются в окружающие ткани, метастазируют, и поэтому склонны к рецидивированию. В таких случаях после операции проводят курс лучевой терапии.
- Фибромы и фибросаркомы — доброкачественные и злокачественные опухоли из соединительной ткани. При доброкачественных новообразованиях прогноз благоприятный, при злокачественных зависит от стадии, после операции удается достигать ремиссии до 4–5 лет.
- Доброкачественные и злокачественные мезенхимомы — опухоли из хрящевой, жировой, костной ткани, мышц, сосудов.
- Сосудистые опухоли и лимфангиомы.
- Ангиосаркомы — злокачественные опухоли из кровеносных сосудов, характеризуются высокой агрессивностью, быстрым распространением в окружающие ткани, метастазированием. После операций высок риск рецидива, поэтому хирургическое лечение дополняют лучевой терапией, химиотерапией. Радикальные хирургические вмешательства возможны не всегда, многим больным показана паллиативная терапия.
- Опухоли из мышечной ткани.
Операции при нейрогенных опухолях средостения
Радикальное хирургическое лечение показано как при доброкачественных (ганглионеврома, нейрофиброма, невринома, шваннома), так и при злокачественных (нейросаркома, нейробластома) нейрогенных опухолях средостения. Первые чаще встречаются у взрослых, вторые — у детей. Прогноз главным образом зависит от злокачественности и агрессивности новообразования. Например, при нейробластоме он неблагоприятный.
Операции при лимфомах средостения
При ходжкинских и неходжкинских лимфомах средостения к хирургическим вмешательствам прибегают очень редко. Основу лечения этих опухолей составляет лучевая терапия и химиотерапия. Дополнительные возможности в борьбе с лимфомами открывают современные иммунопрепараты.
Реабилитация после удаления опухоли — один из основных методов лечения пациента с онкологическим заболеванием на пути к выздоровлению.
Максимальное улучшение функциональных возможностей играет важную роль, которая заключается в физиологической и психоэмоциональной адаптации пациента. Возвращение человека, прошедшего все этапы операции, в социальную среду является главной задачей специалистов. В этом процессе принимают участие врачи разных уровней. Они оценивают состояние больного и определяют варианты восстановительной терапии.
Задачи восстановительного периода
Необходимо обозначить мероприятия, которые будут преследовать такие цели:
- Улучшение адаптационных возможностей.
- Восполнение потерянных функций.
- Получение новых навыков.
- Возвращение к привычному образу жизни.
Поэтому реабилитацию начинают сразу, как только разрешит врач.
Особенности реабилитации пациентов с онкологией
Каждый пациент требует индивидуального подхода на этом этапе терапии. Специалисты составляют план, согласно которому происходит восстановление организма. Для человека, перенесшего рак, нужно ставить задачи, которые он сможет выполнить. Из более простых функций складываются более сложные цели. При освоении определенного навыка переходят к следующему, а через время оценивают полученный эффект и делают выводы.
Это связано с тем, что онкологическая патология — это не только патологическое состояние, приносящее физические страдания. В такой ситуации человек переживает огромную психоэмоциональную травму, которая отражается не только на нем самом, но и влияет на окружающих. Восприятие мира меняется у близких людей. Поэтому большая моральная ответственность при оказании помощи лежит на психологах и психотерапевтах. Они работают не только с больным, но и с родственниками.
Кроме этого, в разработке плана реабилитационных мероприятий принимают участие:
- хирурги-онкологи;
- радиологи;
- физиотерапевты;
- врачи по лечебной физкультуре;
- средний и младший медицинский персонал.
Выбор методик восстановительной терапии зависит от многих факторов. Специалисты при принятии решения опираются на следующие данные:
- вид опухоли;
- размеры;
- локализация новообразования;
- возрастной критерий;
- наличие осложнений;
- проведенный объем лечения;
- сопутствующая патология;
- динамика состояния пациента.
Направления реабилитации
Реабилитационные мероприятия в программе лечения злокачественной патологии направлены на улучшение качества жизни пациента. При этом варианты терапии должны быть подобраны таким образом, чтобы не допустить развития рецидива опухоли. Курс восстановления подразумевает следующие виды методик:
- проведение физиотерапии;
- выполнение массажа;
- занятия лечебной физкультурой.
Внимание! Выбор восстановительных процедур зависит от особенностей онкологической патологии и определяется врачом.
Физическое воздействие применяется в качестве симптоматической терапии. Лечение помогает устранить болевой синдром, уменьшает воспалительные процессы, возвращает утраченные функции. Однако некоторые виды физиотерапии противопоказаны. Это связано с биологической стимуляцией клеток, что может вызвать пролиферацию раковых клеток. Также ограничение касается использования такого вида восстановления при метастазировании опухоли.
Некоторые физиотерапевтические мероприятия назначают при реабилитации после удалении опухоли головного мозга. Применяют магнитотерапию, которая убирает отечность тканей и болевые ощущения.
Миостимуляция способствует улучшению работы мышечной системы, таким образом, предупреждая развитие парезов конечностей. Лазеротерапия и фототерапия используются реже, учитывая их активное воздействие на клетки. Такие методы физического воздействия эффективны и в процессе реабилитации после удаления опухоли спинного мозга.
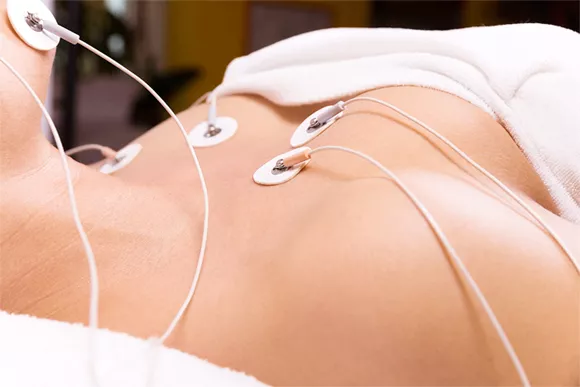
Миостимуляция
Физиотерапия хорошо зарекомендовала себя в качестве метода реабилитации после удаления опухоли прямой кишки. Используют воздействие магнитных волн, лазер. Быстрый восстановительный эффект обеспечивает:
- электрофорез,
- диадинамотерапия,
- УВЧ-терапия.
Следует отметить, что физическое воздействие не показано в случае, когда имеют место злокачественные новообразования костных структур. Реабилитация после удаления опухоли подвздошной кости исключает физиотерапевтические мероприятия. Фантомные боли купируют медикаментозными средствами.
После хирургического вмешательства единственным средством полноценного восстановления двигательной функции у пациента является эндопротезирование. Искусственная трансплантация позволяет быстро вернуться к нормальной жизни, что особенно важно для людей молодого возраста.
При злокачественных новообразованиях, опухолях с высокой вероятностью рецидива общая и локальная мануальная стимуляция не проводится. Это связано с возможным распространением видоизмененных клеток по организму во время манипуляций.
Массаж в послеоперационном периоде назначается, как метод реабилитации после трепанации черепа. Удаление опухоли центральной нервной системы не проходит без последствий. Изменения касаются двигательных и вербальных функций. Чаще всего отмечаются неврологические расстройства в виде парезов, параличей конечностей, нарушение чувствительности определенных областей иннервации. Процедура восстанавливает кровообращение, улучшает лимфодренаж в тканях, способствует нормальной нейромышечной проводимости.
Восстановительный этап после оперативного вмешательства на различных органах включает выполнение дыхательной гимнастики. Специальные упражнения можно проводить в период, когда пациент соблюдает постельный режим. Сразу после резекции опухоли двигательная активность больного снижена. Однако правильный ритм и частота дыхания во время вынужденного положения предупреждают такое осложнение, как застойная пневмония. Занятия до 4-6 раз в день:
- улучшают кровообращение в малом и большом круге;
- увеличивают концентрацию кислорода в тканях;
- нормализуют обменные процессы на клеточном уровне.
- уменьшают вероятность развития неврологических расстройств, связанных с недостаточным кровоснабжением головного мозга.
Лечебная физкультура является неотъемлемой частью реабилитации после удаления опухоли мозга и периферических отделов нервной системы. При онкологических заболеваниях другой локализации также необходима физическая активность. Это может быть пассивная помощь медицинского персонала в послеоперационном периоде с целью профилактики пролежней и улучшения кровообращения в органах. Однако особую роль играют специальные упражнения, которые помогают восстановить утраченные двигательные функции.
Гимнастику подбирают с учетом особенностей пациента, возрастного критерия, вида патологии. ЛФК при реабилитации после удаления опухоли позвоночника может отличаться от упражнений, которые необходимы для восстановления больного, перенесшего операцию на костях с последующей трансплантацией или эндопротезированием. В каждом конкретном случае работает специалист по лечебной физкультуре. В процессе терапии используются вспомогательные средства. Выполняют следующий комплекс:
- Вводная часть — позволяет настроить пациента на предстоящую физическую нагрузку. В положении лежа, а затем, сидя на кровати, производят простейшие движения верхними и нижними конечностями в медленном темпе. Длительность — до 5 минут.
- Основная часть — преследует цель улучшить общий тонус организма, положительно воздействовать на координацию, повысить устойчивость тела при движениях. Для лучшего результата используют палки, мячи и другой инвентарь. При этом активные действия сочетают с упражнениями на расслабление и дыхание. Проводят в течение 15 минут. Сюда включают:
— одноименные и разноплановые движения конечностями, с постепенным усложнением элементов;
— гимнастика для равновесия с поэтапным уменьшением площади опорной поверхности и увеличением центра тяжести;
— тренировка равновесия в ходьбе. - Заключительная часть — в течение 3 минут нагрузку снижают, выполняют дыхательные упражнения и произвольные расслабляющие движения в конечностях.
Требования к питанию в послеоперационном периоде
После удаления определенного вида опухолей в послеоперационном периоде необходимо придерживаться специальной диеты. Особое питание — важное условие реабилитации после удаления почки с раковой опухолью, а также при онкологических процессах кишечника. Ограничение питьевого режима касается первых суток после хирургического вмешательства. Односторонняя нефроэктомия подразумевает снижение нагрузки на оставшийся здоровый орган. В этом случае придерживаются следующих рекомендаций:
- Постепенное расширение объема пищи, начиная с минимального количества легкоусвояемых блюд.
- Ограничивают потребление белка. Предпочтение отдают диетическим сортам мяса — индейке, телятине, кролику. Лучше готовить нежирную рыбу. Растительная белковая пища на время исключается.
- Кратность приема еды должна составлять не менее пяти раз в сутки небольшими порциями.
- Количество соли в день допускается не более 5 грамм. Общее количество включает содержание ее в других продуктах.
- Нельзя употреблять продукты консервации. Это связано с избыточным содержанием химических элементов при производстве.
Особенности реабилитации после удаления опухоли мочевого пузыря заключаются в употреблении повышенного количества воды уже с первых суток после операции. В течение 24 часов необходимо выпить не менее 1, 5 литров жидкости, в дальнейшем — до 3 литров. При этом врач обязательно должен контролировать объем поступившего питья и выделенной мочи, а также ее качество. Ограничивают употребление соленых, копченых, жареных, острых блюд.
При операциях на кишечнике также необходимо соблюдение диеты. В первые сутки пациенту назначается инфузионная терапия с целью профилактики обезвоживания. Начиная со второго дня, проводят оральную регидратацию. Врач разрешает принимать жидкую протертую пищу по мере появления признаков восстановления перистальтики в нижних отделах пищеварительного тракта. К концу недели рацион постепенно расширяют. А через 10-14 дней — ограничения диеты снимают. Однако пациенту нельзя допускать возникновения запоров. Поэтому необходимо учитывать эту особенность во время приготовления пищи.
Правильный подход к организации реабилитационного периода с учетом индивидуальных особенностей организма помогает быстро восстановить нарушенные функции и улучшить качество жизни пациента.
Читайте также:





