Уколы от рака после операции
Процесс лечения онкологических заболеваний очень долгий и сложный. Единого лекарства против рака пока не существует, но комбинация различных препаратов при онкологии позволяет добиться торможения роста опухоли, снятия болевого синдрома и общего улучшения состояния пациента.
Роль лекарственных препаратов в терапии онкозаболеваний
Современные препараты при лечении рака решают несколько задач, потому и назначаются они чаще всего комплексно. Одни лекарства от рака разрушают пораженные клетки, другие останавливают их рост и предотвращают возникновение новых раковых клеток. На поздних стадиях активно применяются обезболивающие препараты, а также средства, которые сами по себе никак не влияют на рост опухоли, но улучшают общее состояние человека, снимая неприятную симптоматику.
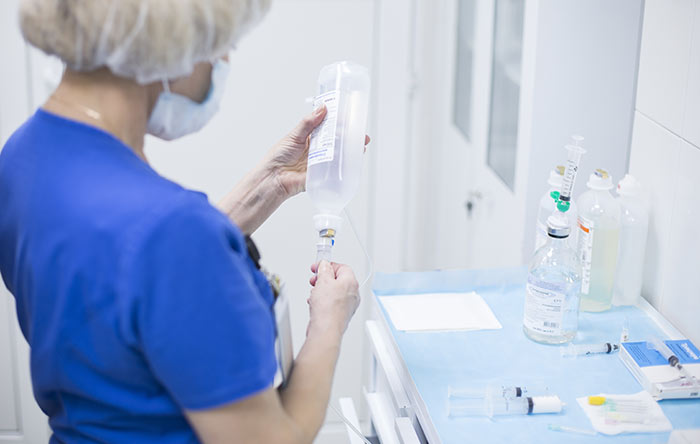
Химиотерапия — высокотехнологичный и эффективный способ лечения онкологических заболеваний, пусть и не лишенный недостатков. Препараты для химиотерапии подавляют рост раковых клеток или уничтожают их, однако многие их них воздействуют также и на здоровые клетки. Из-за этого химиотерапия переносится тяжело, а пациенты после каждого курса нуждаются в реабилитации. Побочными эффектами препаратов для химиотерапии являются рвота и тошнота, выпадение волос, снижение массы тела, ухудшение иммунитета, постоянное чувство усталости, нарушение свертываемости крови.
Специалисты различают цитостатическую и цитотоксическую химиотерапию. Они различаются по механизму воздействия на клетки. Цитостатические препараты замедляют размножение клеток опухоли. Цитотоксические убивают пораженные клетки, вследствие чего начинается некроз опухоли.
К препаратам для химиотерапии относятся следующие группы средств:
- Алкилирующие агенты . Эти лекарства против рака разрушают белки, ответственные за формирование ДНК раковых клеток. Самые распространенные препараты этой группы — средства на основе действующего вещества циклофосфамид.
- Препараты платины. Этот благородный металл токсичен. Препараты платины обладают тем же действием, что и алкилирующие агенты, а именно — разрушают ДНК раковых клеток. Цитостатические средства алкилирующего типа действия широко используются для лечения рака.
- Антиметаболиты. Они воздействуют на генетический аппарат клетки, убивая ее при делении. Наиболее известными антиметаболитами являются препараты на основе гемцитабина.
- Антрациклины. Эти препараты образуют свободные радикалы, повреждающие ДНК больных клеток. Самые известные представители группы антрациклинов — средства с действующим веществом даунорубицин.
- Таксаны нарушают процесс деления раковых клеток. Препараты на основе паклитаксела — самые распространенные в этой группе.
- Винкалкалоиды разрушают цитоскелет раковых клеток, что приводит к их гибели. Относятся к мягким средствам химиотерапии, так как раковые клетки гораздо более чувствительны к воздействию этого препарата, чем здоровые. В этой группе выделяют средства с действующими веществами винбластин и винкристин.
При лечении многих видов опухолей хорошие результаты дает применение гормональных препаратов. Они наиболее эффективны при лечении гормонозависимых опухолей — рака молочной железы, матки, простаты, а также при опухолях поджелудочной железы, почек, при меланомах.
Эстрогенсодержащие препараты назначаются для подавления андрогенов (например, при раке простаты), а андрогенсодержащие, наоборот, подавляют выделение эстрогенов. Препараты последней группы назначают при таких видах онкологии, как рак молочной железы и т.д.
Несмотря на эффективность, у гормональных препаратов много минусов — они способны ослаблять действие химиотерапевтических препаратов, при долгом лечении у многих больных вырабатывается резистентность к подобным средствам.
Некоторые виды рака развиваются вследствие деятельности вирусов (например, вируса папилломы человека). Кроме того, организм, ослабленный агрессивной химиотерапией, подчас не может самостоятельно защитить себя от вирусных инфекций. Именно поэтому в комплексной терапии рака используются и противовирусные лекарства, в частности — препараты на основе тилорона и их аналоги.
К ферментам относятся активные белковые соединения, которые способны разрушать аминокислоты, необходимые для роста клеток опухоли. Для лечения опухолей применяют аргиназу, аспаргиназу и некоторые другие ферменты. Эффективность такой терапии под вопросом, так как резистентность вырабатывается очень быстро: человеческая иммунная система начинает вырабатывать антитела к ним. Однако исследования показывают, что ферментотерапия значительно смягчает последствия химиотерапии.
При лечении рака большое внимание уделяется не только воздействию на саму опухоль, но и улучшению качества жизни пациента, в частности — борьбе с болью. Чаще всего боль вызывается ростом опухоли, но иногда болевой синдром — побочный эффект некоторых лекарств от рака.
Выбор обезболивающих препаратов зависит от стадии болезни. ВОЗ разработала трехступенчатую схему, которая предполагает переход ненаркотических анальгетиков к слабым опиатам, а затем — к сильным опиатам. Эта схема позволяет добиться заметного улучшения состояния у 9 из 10 пациентов.
- Адъювантные средства . Эти лекарства не являются обезболивающими в строгом смысле слова, однако они уменьшают побочные эффекты сильных опиоидов и усиливают их болеутоляющее действие (к примеру, клонидин). Определенный эффект дают и антидепрессанты.
- Ненарктотические анальгетики . Это первый шаг в снятии болевого синдрома при онкологических заболеваниях. Для этих целей применяются препараты на основе парацетамола, а также нестероидные противовоспалительные препараты (ибупрофен).
- Слабые опиаты . К этим средствам относятся кодеин, трамадол и некоторые другие. Это сильнодействующие препараты, которые тем не менее отличаются хорошей переносимостью. Они дают особенно заметный эффект в сочетании с ненаркотическими анальгетиками.
- Сильные опиаты . В случаях, когда боль становится слишком сильной и иные средства не помогают, врач назначает сильные опиаты на основе морфина, фентанила и т.д. Они воздействуют напрямую на ЦНС, подавляя нервные импульсы.
Онкологические заболевания распространены очень широко, количество больных раком увеличивается с каждым годом, причем врачи отмечают, что рак молодеет — все чаще этот диагноз ставится людям, не достигшим и 40 лет. Все это делает исследования в области разработки новых препаратов от рака приоритетом для международного фармацевтического сообщества. Исследования проводятся постоянно, и уже есть определенные результаты.
Возможно, уже через несколько лет подобные вакцины станут доступными, а таргетная терапия разовьется достаточно, чтобы полностью заменить химиотерапию. Однако пока эти направления являются экспериментальными.
Почему косметологи перестраховываются
Эти вопросы демонстрируют огромную нишу потребностей онкопациента, относящуюся к качеству жизни, ведь благодаря развитию медицинских технологий все больше людей после лечения могут не просто доживать, а полноценно жить.
Однако в своем большинстве косметологи не спешат разрешать процедуры ранее, чем через несколько лет после лечения.
Причин этому несколько:
- недостаток качественных исследований безопасности и эффективности подобных процедур у перенесших лечение,
- недостаток общих знаний по данной проблеме (который, впрочем, активно устраняется благодаря тому, что на специализированных конгрессах специалисты-онкологи, хирурги и косметологи междисциплинарно обсуждают свой опыт).
Качество жизни
Из-за успехов в выявлении и лечении около 70 % больных раком живут более пяти лет после постановки диагноза (в США), в России подобная статистика в целом несколько хуже, но варьирует в зависимости от диагноза. При своевременной диагностике и лечении рака груди, например, выживаемость составляет 80–90 %.
Исследования (Carver, Ganz, Gotay) показывают, что беспокойство о внешнем виде вызывает серьезную озабоченность у выживших после рака, влияющих на их качество жизни в физической, эмоциональной, социальной и сексуальной сферах.
Люди, победившие рак, считают финансовые проблемы и проблемы внешнего вида – главными.
Спрос на процедуры по омоложению лица, требующие применения инъекций, постепенно увеличивается благодаря безопасным и эффективным результатам. Из них ботулотоксины и филлеры на основе гиалуроновой кислоты чаще всего используются либо отдельно, либо в комбинации. Причем спрос на такие процедуры высок как в группах, получавших до лечения подобные процедуры, так и среди тех, кто такие процедуры не делал (Carruthers 2003).
В научных публикациях говорится, что омоложение лица приводит к значительному повышению самооценки и компонентов качества жизни у здоровых и условно здоровых пациентов. Кроме того, омоложение лица может способствовать улучшению физического здоровья, настроения, быта, общей удовлетворенности жизнью, внешним видом, самосознанием, восприятием собственного интеллекта, веса, привлекательности, чувства преуспевания, внешней самооценки, социальной самооценки и самооценки, связанной с производительностью (Dayan, Arkins).
Исследования
Это первое исследование безопасности и эффективности омоложения лица с помощью низкомолекулярной гиалуроновой кислоты с лидокаином и abobotulinumtoxin A у пациентов после химиотерапии 10 .
Безопасность и эффективность такого омоложения оценивали у девяти пациентов после химиотерапии. Эффективность измерялась в начале исследования, а также на 2-й и 8-й неделях с использованием оценки степени выраженности морщин. Безопасность и переносимость обоих продуктов проверяли на протяжении всего исследования путем мониторинга возникновения нежелательных явлений.
Пациенты получали среднее количество 2,4 мл гиалуроновой кислоты в носогубные складки и 57,8 единиц токсина А в область глабеллы на начальном этапе. Кроме того, на 2-й неделе для четырех пациентов вводили дополнительно среднее количество l,0 мл низкомолекулярной гиалуроновой кислоты с лидокаином.
Оценка серьезности морщин в среднем по исходному уровню составила 2,22, что указывало на умеренную степень тяжести. На 2-й и 8-й неделях наблюдались значительные улучшения по сравнению с исходным уровнем (р = 0,004). В целом гель на основе низкомолекулярной гиалуроновой кислоты с лидокаином хорошо переносился. Синяки, покраснение, отек, боль, зуд или другие нежелательные явления локализовались и разрешались в течение 1–2 дней.
Оба продукта хорошо переносились у пациентов после химиотерапии без значительных побочных эффектов. Отмечалось клинически и статистически значимое улучшение тяжести морщин на 2-й неделе после инъекций по сравнению с исходным уровнем. Это улучшение сохранялось у всех пациентов на 8-й неделе.
Цель исследования Dayan SH – установить, какие инъекции ботулотоксина типа А (BoNTА) для лечения лицевых морщин были связаны с качеством жизни (QOL) и самооценкой.
Сто участников получили лечение токсином или плацебо-солевым раствором в этом двойном слепом рандомизированном плацебо-контролируемом исследовании.
Статистически значимые улучшения (p 5) в местах хирургического вмешательства или лучевой терапии или в обоих случаях. Ботулотоксин (20–100 единиц) вводили в область очага боли (кожи или мышцы или в обе).
Пять из семи пациентов наблюдались через год (1,5–5 лет) с повторным лечением.
Все семь пациентов сообщили о значительном улучшении качества жизни и уменьшении признаков боли. Они описали свой ответ по шкале глобальной оценки пациентов как удовлетворительный (два пациента) или очень удовлетворительный (пять пациентов).
Шесть из семи пациентов отметили облегчение боли, связанное со значительным улучшением качества жизни. У одного пациента развилась слабость мышц челюсти после двусторонней инъекции, которая не наблюдалась во время второй инъекции (уменьшенная доза). Эффективность лечения сохранялась при повторных инъекциях при длительном наблюдении (пять пациентов).
Местное лечение ботулотоксином типа А может значительно уменьшить боль и улучшить качество жизни у больных раком, страдающих от боли в местах вмешательств, и хорошо переносится такими больными.
Международная команда ученых сделала удивительное открытие в лечении рака 13 .
В ходе своего исследования ученые из Норвегии, Японии, Германии и США изучали роль нервной системы при раке. Они обнаружили, что блуждающий нерв связан с ростом опухолей желудка, так как он высвобождает необходимые для них нейротрансмиттеры. Чтобы остановить рост рака желудка, команда протестировала несколько методов, направленных на прерывание нервных сигналов от блуждающего нерва к опухоли. Наиболее выраженными были эффекты локальной ваготомии и инъекций ботулотоксина. Исследователи считают, что это хороший метод лечения, поскольку он применяется локально и нацелен на раковые стволовые клетки. Еще одним плюсом инъекций ботулотоксина является безопасность.
В ходе эксперимента ученые обнаружили, что нейротрансмиттер ацетилхолин был основным медиатором роста опухолей, а ботулотоксин эффективно блокировал высвобождение ацетилхолина из нервных окончаний.
Ботулотоксин может рассматриваться как альтернативное лечение для пациентов, которые больше не отвечают на химиотерапию или не желают ее проходить.
Существует мало данных о распространенности использования пищевых добавок при раке, особенно в свете растущих доказательств того, что некоторые пищевые добавки могут иметь неблагоприятные взаимодействия с обычным лечением рака. Целью исследования Gupta D. явилось изучение применения БАД у больных раком взрослых. Его команда обследовала 227 взрослых онкологических больных, впервые поступивших на лечение в онкологические центры Америки в региональном медицинском центре среднего Запада в период с ноября 2001 по октябрь 2003 года. Пациенты заполнили опросник McCune, проверенный инструмент, который собирает информацию об использовании 56 пищевых добавок при раке, при поступлении в больницу.
Из 227 пациентов 73 % использовали ту или иную форму БАД в течение 30-дневного периода до проведения исследования. Применение БАД было достоверно выше (р = 0,04) у больных колоректальным (80 %) и раком молочной железы (75 %) по сравнению с больными раком легких (53 %). Пациенты со II (86 %) и III (76 %) стадиями заболевания на момент постановки диагноза чаще (р = 0,02) использовали пищевые добавки по сравнению с больными на I стадии (71 %) заболевания на момент постановки диагноза, а больные на IV стадии (61 %) на момент постановки диагноза были менее склонны использовать БАД.
Из 80 пациентов, получавших химиотерапию в течение последних 30 дней, 71 % также использовал пищевые добавки в течение этого периода, а 25 % проходили растительную терапию (травы), которая, как подозревают исследователи, может неблагоприятно взаимодействовать с химиотерапией. Из 57 пациентов, сочетающих химиотерапию с биодобавками, 52,6 % не проконсультировались с врачом.
В исследовании 25 % пациентов, получавших химиотерапию, одновременно использовали пищевые добавки (которые могли вступать в конфликт с химиотерапией), полагаясь на источники информации, отличные от мнения врачей.
Важно: учитывая распространенность этих препаратов, поставщики медицинских услуг должны систематически запрашивать информацию о них и учитывать потенциал взаимодействия между лекарственными и диетическими добавками при планировании лечения.
Мнения

Массаж не противопоказан для пациентов, перенесших радикальное лечение по поводу рака молочной железы. Важно помнить о том, что при возникновении болей в спине сначала надо исключить появление метастазов в кости, а не сразу приступать к массажу или тем более мануальной терапии (нередки случаи, когда при возникновении болей в пояснице пациентки обращались к мануальному терапевту, и в результате необдуманных действий во время сеанса возникал перелом позвоночника). Что же касается легкого массажа руки на стороне операции, то его надо проводить ежедневно с целью улучшения лимфообращения и профилактики лимфостаза.
Я считаю, что витамины принимать надо обязательно. Организм после лечения рака молочной железы всегда ослаблен. Оперативное вмешательство, лучевая терапия, химиотерапия никогда не проходят просто так, они всегда оказывают негативное влияние на организм. Витамины позволяют устранить это влияние.
Мнение по поводу того, что витамины являются стимуляторами роста опухолевых клеток, является ошибочным. Безусловно, витамины надо принимать в стандартных дозировках.
Дмитрий Андреевич Красножон, хирург-онколог

Онкологические заболевания – слишком обширная и разнообразная патология и по своей природе, и по локализации, и по распространенности. С другой стороны, и косметологические процедуры имеют разные точки приложения и механизмы воздействия. Как правило, в период активного лечения онкологического заболевания накладываются ограничения на проведение любых активных косметологических вмешательств, особенно с нарушением целостности кожного покрова. В то же время уходовые процедуры, мягкие УЗ-пилинги, расслабляющий массаж лица проводить можно (если, конечно, речь не идет об онкологическом заболевании в области шеи и головы). В период ремиссии можно рассматривать ботулинотерапию, а вот филлеры, лазерные и другие аппаратные процедуры противопоказаны в течение первых 5 лет после удаления опухоли. В дальнейшем можно проводить и контурную пластику, и лазерную эпиляцию. Следует избегать всех методик, усиливающих микроциркуляцию, применение составов, содержащих регуляторные молекулы (плацентарные препараты, биомиметические пептиды), а также аппаратные методики с глубокой проникающей способностью и прогревом (RF-терапия).
Более строгие ограничения, даже в отдаленном периоде, накладываются на участки кожи, находящиеся непосредственно в зоне локализации имевшейся опухоли. Например, область шеи при раке щитовидной железы. Осторожность следует проявлять при работе с пациентами после меланомы и других злокачественных новообразований кожи. Им противопоказаны процедуры с облучением УФ-спектра.
Отдельно, как мне кажется, стоит упомянуть применение препаратов на основе гидроксиапатита кальция. В литературе описано несколько случаев ложной диагностики метастазов опухолей различного происхождения (чаще всего речь идет о раке молочной железы) из-за того, что во время контрольного КТ-обследования в мягких тканях лица определялись частицы кальция. Известно, что кальцинаты – характерный признак метастазов опухоли. Пациенты не информировали врача-онколога, что им по эстетическим показаниям вводился филлер на основе гидроксиапатита кальция, что и привело к неправильной трактовке томограмм.
Алиса Александровна Шарова, к.м.н., врач-дерматовенеролог, косметолог

Реконструктивные пластические операции, где это возможно с точки зрения стадии, очень приветствуются – это в основном опухоли головы, шеи и молочной железы. Татуаж сосков, губ, тату на послеоперационные рубцы – это все замечательно. Бани, сауны и другие тепловые процедуры следует назначать с осторожностью и после окончания активного лечения, здесь нет единого рецепта – все зависит от вида заболевания. Например, после лучевой терапии хотя бы полгода надо выждать. Массажи тоже с осторожностью.
Абсалямов Руслан Ильдарович, онколог клиники доказательной медицины Рассвет

Эстетические процедуры для онкопациентов – в зоне мутного правового поля.
Состояние такого пациента может ухудшиться в любой момент, есть высокий риск, что ухудшение состояния пациент может связать с проведенной процедурой. Есть мировая практика в пластической хирургии корректировать хирургическим образом дефекты после онкологических операций, например, после радикальной мастэктомии сразу устанавливаются грудные имплантаты, и через некоторое время в техниках перманентного татуажа рисуется область соска и ареолы. В центры паллиативной медицины приезжают волонтеры-косметологи, которые проводят легкие эстетические уходы для пациентов. В остальном косметологи пока ограничены инструкциями к препаратам.
Зверькова Ольга Дмитриевна, врач-косметолог клиники доказательной медицины Рассвет

Моя практика связана с ботулинотерапией при спастичности и дистониях.
Онкологические заболевания, согласно официальной инструкции к препаратам БТА, не являются противопоказанием для инъекций. Каких-либо эффектов ослабления/усиления действия препаратов БТА после химиотерапии и др. видов лечения онкозаболеваний мной замечено не было. Об эффектах ботулинотерапии при коррекции морщин мнение такое же, хотя моя практика в этой сфере недостаточна.
Рафиз Каирович Шихкеримов, д.м.н., главный невролог ЮАО г. Москвы

- Трехступенчатая система коррекции болевого синдрома
- Как облегчить боль: описание этапов трехступенчатой схемы
- Как часто возникает боль при раке?
- В чем причина неудач в лечении боли?
- Технологии управления хроническими болевыми синдромами
- Обезболивающие при раке желудка
- Обезболивающие при раке легких
Зачастую первым и единственным симптомом онкологических заболеваний является боль. Она причиняет пациенту мучения, снижает качество жизни, приводит к депрессивным расстройствам, суицидальным намерениям и действиям.
Борьба с болевым синдромом — актуальная проблема в онкологии. Для того чтобы эффективно справиться с болью, врач должен правильно оценить ее причины, характер, интенсивность.
В Европейской клинике направление медицины боли развито очень хорошо. Наши врачи применяют все доступные методы, в том числе инновационные.
Трехступенчатая система коррекции болевого синдрома
Основным методом лечения боли в онкологии является медикаментозная терапия. В практике работы Европейской клиники используется трехступенчатая система обезболивания из ненаркотических и наркотических анальгетиков, которая позволяет эффективно купировать болевой синдром и держать его под контролем. Мы учитываем рекомендации Всемирного института боли (FIPP WIP, USA), Европейской Федерации Международной Ассоциации Изучения Боли (EF IASP).
Метод заключается в последовательном применении анальгетиков возрастающей силы действия в сочетании с адъювантной терапией по мере увеличения интенсивности боли. Важным принципом является начало фармакотерапии немедленно при появлении первых же признаков боли, пока не развилась сложная цепная реакция, которая приводит к хроническому болевому синдрому. Переход на более сильное обезболивающее производится, когда все препараты предыдущей ступени неэффективны в своих максимальных дозировках.
- На первой ступени при легкой боли эффективны нестероидные противовоспалительные средства (НПВСП).
- На второй ступени при умеренной боли применяются препараты, которые содержат комбинацию слабых опиатов и ненаркотических анальгетиков. К первым относят дионин, трамадол, промедол, проседол, трамал. Чаще всего применяется трамадол из-за высокой эффективности и удобства применения.
- На третьей ступени при сильной боли назначаются наркотические анальгетики: бупренорфин, морфин, фентанил, омнопон.
На любом этапе противоболевой терапии анальгетики необходимо принимать постоянно по часам. Доза корректируется с учетом вида и интенсивности болевых ощущений. Если препарат становится неэффективным, желательно заменить его на альтернативное средство аналогичной силы, но рекомендовать его пациенту, как более мощное.
В качестве анальгетиков часто применяют кортикостероиды — препараты гормонов коры надпочечников. Они оказывают мощное противовоспалительное действие, особенно важное при болях, вызванных компрессией нерва, при головной боли, обусловленной внутричерепной гипертензией, а также костных болях.
Анестезиолог-реаниматолог Вадим Сергеевич Соловьев об опиоидных анальгетиках:

Наши врачи следуют принципам терапии боли, провозглашенным ВОЗ:
Как облегчить боль: описание этапов трехступенчатой схемы
Пациенту назначают неопиоидные анальгетики: НПВС (Ибупрофен, Диклофенак, Кетопрофен и пр.), Парацетамол. При выборе препарата учитываются токсичность для печени и почек, присущие всем неопиоидным анальгетикам, а также токсичность для желудка неселективных НПВС, риски со стороны сердечно-сосудистой системы при применении селективных НПВС. Применение препаратов первой линии целесообразно сопровождать адъювантной и симптоматической терапией: блокаторы ионной помпы, кортикостероиды, спазмолитики, бензодиазепины, антигистаминные препараты и др.
Пероральный путь введения препаратов является предпочтительным, если пациент может принимать препараты через рот. Для пациентов со слабой или умеренно выраженной болью, у которых адекватный контроль боли не достигается регулярным пероральным приемом парацетамола или нестероидных противовоспалительных препаратов, добавление опиоидного анальгетика может обеспечить достижение эффективного обезболивания без неблагоприятных побочных эффектов. В качестве альтернативы возможно использование низких доз опиоидных анальгетиков (например, морфина, ТТС фентанила).
Как часто возникает боль при раке?
Боль возникает у 30% больных раком, которые получают лечение, и у 60–90% больных в связи с прогрессированием болезни. Основные источники возникновения боли при раке:
- собственно рак (45–90%);
- сопутствующие воспалительные реакции, приводящие к спазму гладкой мускулатуры (11–25%);
- боль в области послеоперационной ране после хирургического вмешательства (5–16%);
- сопутствующая патология, например, поражения суставов, артрит (6–11%), невралгия (5–15%).
Болевые синдромы при раке группируют:
- По происхождению болевого потока: висцеральные, соматические, невропатические, психогенные.
- По качественной субъективной оценке: жгучие, колющие, режущие, сверлящие, пульсирующие.
- По интенсивности: оценивают по специальным шкалам.
- По продолжительности: острые и хронические.
- По локализации: абдоминальные, кардиалгии, люмбалгии, мышечно-суставные и другие.
В связи со значительными различиями механизмов возникновения болевых ощущений, не существует универсального анальгетика для купирования всех видов болевых синдромов. Лечение всегда должно быть индивидуальным.
В чем причина неудач в лечении боли?
В силу отсутствия специальной подготовки по лечению боли даже у онкологов, а также в силу восприятия рака как инкурабельного заболевания, даже врачи-специалисты зачастую не осознают, что болью при раке можно управлять.
У 80–90% пациентов боль можно полностью ликвидировать, а у остальных ее интенсивность можно значительно ослабить. Для этого врачу необходимо учитывать каждый из источников и механизмов боли для подбора адекватной обезболивающей терапии при раке.
В клинической практике мы постоянно сталкиваемся с типичными ошибками при лечении болевого синдрома: неоправданно ранним назначением наркотических анальгетиков, применение чрезмерных дозировок препаратов, несоблюдение режима назначения анальгетиков.
Технологии управления хроническими болевыми синдромами
Европейская клиника оснащена всем необходимым оборудованием, включая индивидуальные носимые помпы, аппараты для дозированного введения. Клиника имеет требуемые законодательством Российской Федерации лицензии и разрешения. У нас функционирует хорошо оснащенное отделение терапии болевых синдромов, в нем работают врачи-специалисты в области медицины боли.
Воспользуйтесь быстрыми ссылками, чтобы узнать об интересующем вас методе обезболивания:
Обезболивание при раке 4 стадии позволяет значительно улучшить качество жизни пациента, уменьшить, а в большинстве случаев предотвратить страдания. Это помогает подарить неизлечимому больному дополнительное время, в течение которого он может активно общаться с родными и близкими, провести последние дни жизни без мучительных симптомов.
Это способ трансдермального введения препарата. Пластырь содержит четыре слоя: защитная полиэфирная пленка, резервуар с действующим веществом (например, с фентанилом), мембрана, корректирующая интенсивность выделения и липкий слой. Пластырь можно наклеить в любом месте. Фентанил высвобождается постепенно на протяжении 3 суток. Действие наступает уже через 12 часов, после удаления концентрация лекарственного вещества в крови медленно снижается. Дозировка может быть разная, ее подбирают индивидуально. Пластырь назначают, как правило, в самом начале третьей ступени обезболивания при онкологии.
Более щадящий по сравнению с предыдущим метод. Лекарство вводят в пространство, где формируются спинномозговые нервы. Препараты аналогичны спинальной анестезии. Эпидуральная анестезия используется, чтобы на долгое время снять боль, когда оральный и парентеральный методы введения уже не приносят результатов.
Катетеризационные методики позволяют обеспечивать длительное качественное обезболивание. Внедрение постановки порт-систем в эпидуральное и субарахноидальное пространство с применением местных, наркотических и адъювантных препаратов позволяют на продолжительное время избавится от болевого синдрома и снизить применение других анальгетиков, имеющих свои побочные эффекты.
Нейролизис (невролиз) — это процесс разрушения ноцицептивного (болевого) нервного пути.
Одним из наиболее эффективных методов является нейролизис чревного (солнечного) сплетения, которое располагается в забрюшинном пространстве в верхнем отделе живота и осуществляет иннервацию органов брюшной полости: желудка, печени, желчевыводящих путей, поджелудочной железы, селезенки, почек, надпочечников, толстого и тонкого кишечника до селезеночного изгиба.
Введение анальгетика происходит трансгастрально — через ЖКТ, точность обеспечивает эндоскопический ультразвуковой контроль. Такие методы местного обезболивания применяются, к примеру, при раке поджелудочной железы с эффективностью до 90%. Обезболивающий эффект способен сохраняться более нескольких месяцев, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.

Такой же качественный эффект обеспечивают фасциальные блокады и блокады нервов и сплетений.
Блокада нерва или нервного сплетения предусматривает введение препарата около нерва, который связан с пораженным органом и вызывает боль. Процедуры периферических блокад выполняются опытными специалистами при помощи ультразвуковой навигации, что позволяет более точно вводить анальгетический препарат в необходимое место, не затрагивая и не повреждая нервные структуры.
Использование в процессе блокады гормональных препаратов позволяет устранить боль на долгое время, а многократная блокада может убрать боль на несколько месяцев. В зависимости от вида анестетика, процедуру проводят раз в год, раз в полгода или каждую неделю. Еще один плюс — минимальное количество негативных последствий.
В основе этой технологии лежит выборочная термокоагуляция определенных нервов специальными электродами. Зона поражения аккуратно контролируется, позволяя воздействовать на очень небольшие участки, не повреждая расположенные рядом двигательные и чувствительные нервы. Восстановление после процедуры происходит очень быстро и почти без последствий, что позволяет пациенту вернуться к нормальной жизни.
Процедура может выполняться без госпитализации. Радиочастотное разрушение дает длительный эффект, который может длиться до года и более.
Частота развития осложнений и побочных эффектов очень мала. Если боль возобновляется, лечение может быть проведено повторно.
Пациенты с очевидными психическими нарушениями, с вторичными болями или наркотической зависимостью — это неподходящий контингент для нейродеструктивных манипуляций. Такие пациенты могут продолжать жаловаться на боли, даже если процедура проведена успешно. У пациента должен быть сформирован реалистический взгляд на исход лечения. Он должен понимать, что целью является уменьшение боли, а не полное ее устранение.
Перед нейродеструктивной процедурой обязательно проведение диагностической блокады. Хороший эффект от диагностической блокады может прогнозировать удовлетворительный результат нейродеструкции. Тем не менее, такую же диагностическую блокаду нужно повторить, по крайней мере, еще один раз, даже если ослабление боли было значительным, чтобы свести на нет эффект плацебо.
Если результат не совсем ясен, следует использовать дифференциальное блокирование. У пациентов с распространенной или мультилокальной болью результат лечения обычно не оправдывает ожидания. Пациент должен осознавать, что воздействие на один участок может не привести к достижению желаемого эффекта и, возможно, потребуется дополнительная деструкция для максимально возможного уменьшения боли.
Врачи Европейской клиники о радиочастотной абляции:

Следует избегать проведения процедуры на смешанных нервах, поскольку это может привести к потере кожной чувствительности и мышечной слабости. Деафферентационные боли могут усугубляться при деструкции поврежденного нерва. В том случае, когда боль имеет центральное происхождение (спинальная или выше), деструкция периферического нерва может вызывать увеличение болевой перцепции за счет элиминации входящего стимула. Лучшая альтернатива в этом случае — это нейроаугментация с TENS или стимуляция спинного мозга.
В ходе процедуры нейрохирург перерезает корешки спинномозговых или черепных нервов, по которым проходят нервные волокна. Тем самым мозг лишается возможности получать болевые сигналы. Разрезание корешков не приводит к утрате двигательной способности, однако может затруднить ее.
Этот вид обезболивания основан на простом правиле: пациент получает анальгетики тогда, когда он этого хочет. В основу схемы положено индивидуальное восприятие боли и необходимость приема анальгетиков. В европейских странах РСА принята в качестве стандарта постоперационного обезболивания. Метод прост и относительно безопасен. Однако пациентам необходимо проходить тщательный инструктаж.
PCA наиболее эффективна при использовании катетерных методов (эпидуральная, спинальная анестезия, блокада нервных сплетений с установкой катетера), а также порт-систем, как венозных, так и эпидуральных и интратекальных.
Лечением боли в нашей клинике занимаются сертифицированные специалисты анестезиологи, нейрохирурги, ангиохирурги и эндоскописты, предоставляется услуга обезболивания при 4 стадии рака.
Обезболивающие при раке желудка
Неприятные ощущения и боли испытывают примерно 70% пациентов, страдающих раком желудка. Как правило, боль локализуется в животе, но по мере прогрессирования опухоли может возникать и в других местах: в спине, ребрах, костях. В качестве симптома паранеопластического синдрома или побочного эффекта химиотерапии могут возникать нейропатические боли.
Помимо трехступенчатой системы, для борьбы с болью и дискомфортом при раке желудка применяют бензодиазепины, антидепрессанты, препараты гормонов коры надпочечников (преднизолон, дексаметазон), снотворные, антипсихотические средства. При болях в костях и патологических переломах назначают бисфосфонаты.
Врач может провести два вида нервных блокад:
- Блокада чревного сплетения помогает справиться с болью в верхней части живота. Блокируется проведение болевых импульсов по нервам желудка, печени, поджелудочной железы, желчного пузыря, кишечника, почек.
- Блокада подчревного сплетения помогает справиться с болью в нижней части живота. Во время нее блокируют нервы нижнего отдела кишечника, мочевого пузыря, яичек, пениса, предстательной железы, матки, яичников, влагалища.
Блокаду нервных сплетений можно проводить с помощью анестетиков и препаратов, которые временно повреждают нервы. При невролизе вводят препарат, который разрушает сплетение.
Обезболивающие при раке легких
Причиной боли в грудной клетке при раке легких может быть сама опухоль или перенесенное хирургическое вмешательство. Другие возможные причины:
- Метастазы в головном мозге приводят к головным болям.
- Метастазы органов брюшной полости приводят к болям в животе.
- Метастазы в костях приводят к костным болям, патологическим переломам.
- Паранеопластический синдром приводит к нейропатическим болям в разных частях тела.
- Боли — один из побочных эффектов химиотерапии.
Помимо обезболивающих уколов при онкологии легких с НПВС и наркотическими анальгетиками, помогают другие препараты, нервные блокады, лучевая терапия, паллиативные хирургические вмешательства.
Читайте также:

