Удаление опухоли с нижней полой вены
Пациентка 69 лет обратилась в поликлинику по месту жительства с жалобами на периодические боли в правой паховой области. При ультразвуковом исследовании органов брюшной полости в декабре 2014 года, в забрюшинном пространстве, выявлено объемное образование до 5см в диаметре. В нашей клинике диагноз забрюшинной опухоли подтвержден при помощи компьютерной томографии с внутривенным контрастированием.


Расположение опухоли в непосредственной близости от аорты на уровне L2-L3, сдавление нижней полой вены и результаты нижней кавографии позволили предположить первичную саркому нижней полой вены. Этот вариант опухоли встречается крайне редко и составляет 0.05% от всех злокачественных опухолей человека и 0.5% от всех сарком у взрослых.
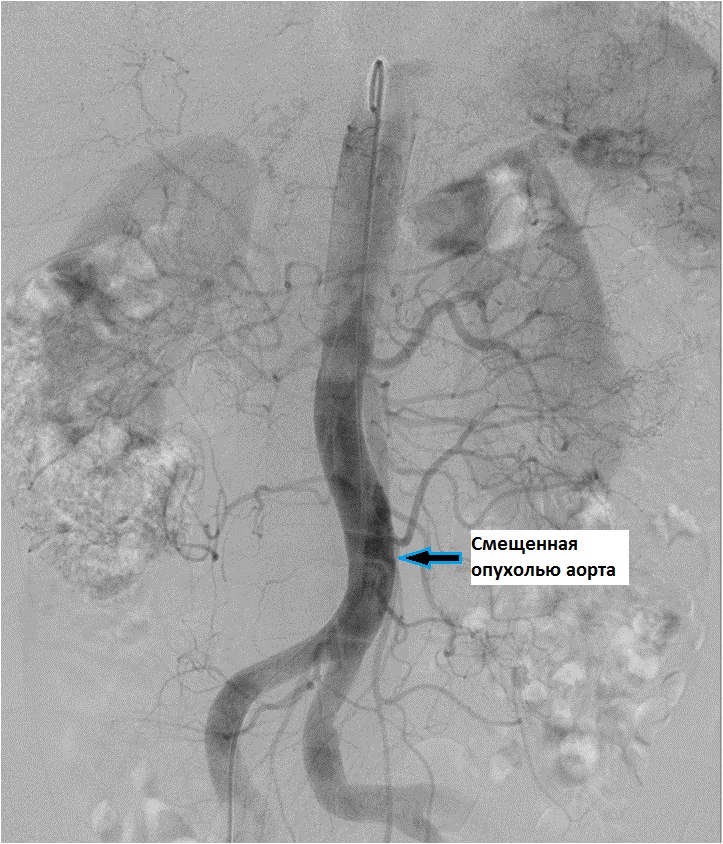

Опухоль имеет чрезвычайно низкую чувствительность к лучевой и химиотерапии, поэтому единственным вариантом лечения является радикальное удаление опухоли с последующим протезированием сосуда, при отсутствии хорошо развитых коллатералей. После предоперационной подготовки больная была оперирована. На операции выявлена плотная опухоль максимальными размерами 6.0х7.0см, исходящая из передней и левой стенок инфраренального отдела нижней полой вены. Пальпаторно в просвете сосуда определялся экзофитный компонент опухоли. Выполнено удаление опухоли с резекцией нижней полой вены на протяжении и реконструкцией линейным синтетическим протезом из политетрафторэтилена (PTFE). Время пережатия НПВ составило 33 минуты, общая кровопотеря – 200мл. Поскольку риск тромбоза венозных протезов значительно выше, чем при артериальных реконструкциях в раннем послеоперационном периоде пациентке проводилась суточная инфузия гепарина по протоколу с поддержанием целевых значений показателей коагулограммы. Через 5 дней пациентка была переведена на пероральный прием современных антикоагулянтов.


Больная выписана без осложнений на 9 сутки. При контрольной компьютерной томографии и ультразвуковой доплерографии проходимость протеза полностью сохранена, данных за тромбоз нет.
Комментарий главного хирурга, к.м.н., Павла Вячеславовича Кононца:
На современном этапе развития онкохирургии, при отсутствии отдаленного метастазирования вовлечение в опухолевый процесс сосудистых структур не является противопоказанием к радикальной операции.
Тем не менее, протезирование крупных сосудов при выполнении онкологических операций выполняется довольно редко. Это связано, как с техническими и организационными сложностями, так и с малым количеством больных которым возможно выполнение радикальной операции с реконструктивным сосудистым этапом.
При планировании подобных вмешательств следует помнить о тщательном соблюдении правил и технических приемов сосудистой хирургии, а также использовании современных протоколов ведения больных как в интра-, так и в послеоперационном периоде.
Терешин О.С., Зотов С.П., Зайков А.А.
Челябинский областной клинический онкологический диспансер, Челябинск, Россия
Аннотация. В статье рассмотрены результаты лечения опухолей забрюшинного пространства, тесно контактировавших с крупными сосудами.
Материалы и методы. Проведен ретроспективный анализ результатов лечения 26 пациентов с первичными и рецидивными опухолями забрюшинного пространства, 24 из которых проведена резекция опухоли en block c фрагментом магистрального сосуда или диссекция опухоли от сосуда в условиях сосудистой изоляции. Пациенты проходили лечение или контрольное обследование в Челябинском областном клиническом онкологическом диспансере.
Результаты. Возраст пациентов – от 15 до 75 лет (средний – 45,7 лет), 22 женщины и 4 мужчин. Неорганные забрюшинные опухоли – 21 больной (80,7%), из них у 5 – рецидивные опухоли и у 2 – лейомиосаркомы нижней полой вены (НПВ). У 1 пациентки – рак надпочечника с ростом в забрюшинную клетчатку. У 2 больных лапаротомия оказалась пробной. Радикально оперированы 24 пациента, они разделены на 2 группы. В 1 группе для удаления опухоли потребовалась резекция сосуда. Во 2 группе удалось осуществить отделение опухоли от сосуда путем тщательной диссекции, в ряде случаев субадвентициально. В 1 группе было 12 пациентов, средний возраст – 41,2 года. У 3 диагноз при выписке – нейрофиброма, у 2 – воспалительная псевдоопухоль забрюшинного пространства. При этом имелись признаки местно-агрессивного роста, требовавшие удаления сосуда en block с опухолью. В этой подгруппе результаты прослежены на протяжении 1.5, 2, 9, 15, 19 лет. Они расцениваются как хорошие. По поводу злокачественных опухолей оперированы 7 пациенток. Одна операция закончилась смертью пациентки от ДВС-синдрома и полиорганной недостаточности в раннем послеоперационном периоде после резекции лейомиосаркомы ретропеченочного сегмента нижней полой вены. Для других 6 пациенток при медиане наблюдения 22,5 мес. зарегистрированы 2 смерти от прогрессирования заболевания, 1 рецидив и ремиссия в 3 наблюдениях. В целом в 1 группе выполнены 10 резекций НПВ; 2 циркулярных резекции завершены пластикой синтетическим протезом, 2 резекции общей подвздошной артерии с протезированием, 1 боковая резекция аорты.
Во 2 группе было 12 пациентов, средний возраст – 48,1 лет. В одном наблюдении по данным гистологического исследования удаленного препарата опухоль оказалась доброкачественной. В группе из 11 пациентов со злокачественной патологией одна пациентка погибла через 1 мес. после обширной операции от полиорганной недостаточности. У других 10 при медиане наблюдения 21,2 мес. зарегистрированы 3 местных рецидива, 1 генерализация и 2 смерти от прогрессирования.
Выводы. Выполнение вмешательства на крупных сосудах забрюшинного пространства целесообразно при условии онкологической радикальности операции. Наиболее часто необходимость резекции сосудов забрюшинного пространства возникает при лечении неорганных забрюшинных опухолей, в том числе доброкачественных. Тесный контакт метастатической опухоли с крупным сосудом значительно усложняет оперативное вмешательство и является отрицательным прогностическим фактором Получение статистически достоверных выводов возможно при создании мультицентрового регистра пациентов.
Ключевые слова: злокачественные новообразования забрюшинного пространства, брюшная аорта, нижняя полая вена, резекция с протезированием.
Врастание в крупные сосуды остается одной из главных причин нерезектабельности опухолей забрюшинного пространства. Проведен ретроспективный анализ результатов лечения 26 пациентов с первичными и рецидивными опухолями забрюшинного пространства. Радикально оперированы 24 пациента, они разделены на 2 группы. В 1 группе для удаления опухоли потребовалась резекция сосуда. Во 2 группе удалось осуществить отделение опухоли от сосуда путем тщательной диссекции, в ряде случаев субадвентициально. В 1 группе выполнено 10 боковых резекций нижней полой вены (НПВ), 3 циркулярных резекции с пластикой, 2 резекции общей подвздошной артерии с протезированием (в одном случае в сочетании с боковой резекцией НПВ), 1 боковая резекция аорты. Для 6 пациенток этой группы со злокачественной патологией, благополучно перенесших операцию, при медиане наблюдения 22,5 мес. зарегистрированы 2 смерти от прогрессирования заболевания, 1 рецидив и 3 ремиссии. Для 10 перенесших операцию пациенток со злокачественными опухолями во 2 группе при медиане наблюдения 21,2 мес. зарегистрированы 3 местных рецидива, 1 генерализация и 2 смерти от прогрессирования. С учетом редкости обсуждаемой патологии получение статистически достоверных выводов возможно только при создании мультицентрового регистра пациентов.
Подавляющее большинство опухолей, возникающих в забрюшинном пространстве, имеют неорганное происхождение. Их диагностируют с частотой от 0,01% до 1% от общего числа новообразований, и в 60-80% они носят злокачественный характер. Резектабельность колеблется от 25% до 70% и достигает 94% в группах, включающих доброкачественные опухоли 1. Инвазия в крупные сосуды остается одной из главных причин нерезектабельности, несмотря на применение комбинированных вмешательств с резекцией и протезированием сосудов во многих специализированных клиниках [4, 5]. С учетом сравнительно невысокой частоты возникновения данной группы опухолей вообще и особенно подгруппы с тесным контактом с крупными сосудами лечебная тактика полностью не определена, что и послужило поводом для представления нашего опыта лечения этой редкой когорты пациентов.
Материалы и методы
Ретроспективное исследование проведено на материале Челябинского областного клинического онкологического диспансера (ЧОКОД). В исследование были включены пациенты с первичными/рецидивными опухолями забрюшинного пространства, имевшими тесный контакт или врастание в нижнюю полую вену (НПВ), брюшную аорту или их ветви в пределах забрюшинного пространства, и проходившие лечение и обследование в ЧОДОК. Метастатические опухоли не рассматривались. Все пациенты по данным дооперационного обследования имели признаки тесного контакта опухоли с сосудами и не имели однозначных признаков нерезектабельности или неоперабельности. Всего включено в анализ 26 пациентов, в том числе 5 мужчин, в возрасте от 15 до 75 лет (средний возраст − 45,7 лет). Подавляющее большинство (80,7%) составили неорганные забрюшинные опухоли – у 21 больного, из них у 5 – рецидивные и у 2 – лейомиосаркомы НПВ. У 1 пациента обнаружен рак надпочечника с ростом в забрюшинную клетчатку. У 6 больных процесс носил доброкачественный характер.
Операции проводили в условиях мобилизации сосудов выше и ниже опухоли. Далее предпринимали попытку диссекции опухоли от сосудов без их пережатия. Особенно настойчивыми попытки диссекции были в ходе операций, включавших резекции полых органов, или при невозможности окончательно оценить радикальность проводимой операции до сосудистого этапа. Решение о боковой или циркулярной резекции сосуда принимали при невозможности радикально удалить опухоль, отделив ее от сосуда. В 2 наблюдениях лапаротомия оказалась пробной (одна из пациенток погибла от прогрессирования через 3 мес., другая потеряна для наблюдения). Радикально оперированы 24 больных, разделенных на 2 группы. В 1 группе для удаления опухоли потребовалась резекция сосуда. Во 2 группе удалось осуществить отделение опухоли от сосуда путем тщательной диссекции, в ряде случаев субадвентициально.
В 1 группе (резекция) было 12 пациентов, 3 мужчины и 9 женщин, средний возраст − 41,2 года. Диагнозы, особенности операций, сроки и результаты наблюдения приведены в таблице 1. После гистологического исследования удаленного препарата у 3 больных диагностирована доброкачественная опухоль (нейрофиброма), у 2 – воспалительная псевдоопухоль забрюшинного пространства (в одном наблюдении − туберкулезной этиологии). При этом во время операции были отмечены признаки местно-агрессивного роста, вынудившие принять решение об удалении сосуда en block с опухолью. Для подгруппы пациентов с доброкачественными и воспалительными псевдоопухолями результаты прослежены на протяжении 1.5, 2, 9, 15, 19 лет и расцениваются как хорошие. Значимых ранних послеоперационных осложнений не было. Резвившийся у двух пациентов синдром нижней полой вены был выражен умеренно и хорошо контролировался терапией.
Таблица 1. Характеристика пациентов 1 группы с резекцией сосудов забрюшинного пространства.
| № | Пол, возр. | Диагноз | Размер опухоли | Операция | Срок наблю- дения | Результат |
|---|---|---|---|---|---|---|
| 1 | Ж, 55 л. | Липосаркома забрюшинного пространства T2bN0M0, G1, I ст. | 56 мм | Резекция 10 см сегмента НПВ без протезирования, нефрэктомия | 21 мес. | Смерть от прогрессирования |
| 2 | Ж, 74 г. | Злокачественная фиброзная гистиоцитома забрюшинного пространства справа T2bN0M0, G2, IIВ ст. | 60 мм | Боковая резекция, шов НПВ, лигирование ОПВ | 17 мес. | Рецидив |
| 3 | Ж, 39 л. | Нейрофиброма забрюшинного пространства | 39 мм | Резекция сегмента НПВ с пластикой протезом | 105 мес. | Ремиссия |
| 4 | Ж, 20 л. | Рак левого надпочечника T4N0M0, IV ст. с прорастанием в забрюшинную клетчатку, стенку НПВ | 128 мм | Нефрадреналэктомия, боковая резекция, шов НПВ | 18 мес. | Ремиссия |
| 5 | М, 44 г. | Нейрофиброма забрюшинного пространства | 100 мм | Резекция сегмента НПВ с протезированием, реимплантацией левой почечной вены, нефрэктомия справа | 15 лет | Ремиссия |
| 6 | Ж, 43 г. | Лейомиосаркома забрюшинного пространства T1bN0M0 G2 1А ст. | 50 мм | Боковая резекция, шов НПВ | 28 мес. | Смерть от прогрессирования |
| 7 | Ж, 29 л. | Лейомиосаркома нижней полой вены | 47 мм | Резекция супраренального сегмента НПВ с пластикой аортальным гомографтом | 25 мес. | Ремиссия |
| 8 | Ж, 47 л. | Лейомиосаркома нижней полой вены | 142 мм | Резекция супраренального сегмента НПВ с пластикой печеночной вены | 0 | Смерть от полиорганной недостаточности, ДВС-синдром |
| 9 | М, 38 л. | Злокачественный карциноид тонкого кишечника T3N1M0, III ст. Воспалительная псевдоопухоль брыжейки тонкой кишки и забрюшинного пространства | 40 мм | Резекция тонкой кишки, мочеточника, отделение от аорты, резекция ОПА с пластикой | 19 мес. | Ремиссия |
| 10 | Ж, 42 г. | Псевдоопухоль (туберкулез) забрюшинного пространства | 38 мм | Боковая резекция НПВ | 27 мес. | Ремиссия |
| 11 | Ж, 45 л. | Злокачественная гемангиоперицитома забрюшинного пространства T2bN0M0,Gx, IB ст. | 137 мм | Краевая резекция брюшной аорты в устье НБА с боковым швом, нефрэктомия слева | 26 мес. | Ремиссия |
| 12 | М, 19 л. | Рецидивная нейрофиброма забрюшинного пространства | 240 мм | Резекция НПВ, резекция правой ОПА с протезированием аутовеной | 19 лет | Ремиссия |
Сокращения:
НПВ – нижняя полая вена; ОПВ – общая подвздошная вена; ОПА – общая подвздошная артерия;
НБА – нижняя брыжеечная артерия, ДВС-синдром – синдром диссеминированного внутрисосудистого свертывания.
По поводу злокачественных опухолей оперировано 7 пациенток. Одна операция закончилась смертью от ДВС-синдрома и полиорганной недостаточности в раннем послеоперационном периоде после резекции лейомиосаркомы ретропеченочного сегмента нижней полой вены. Отмечены транзиторное повышение трансаминаз у одной пациентки и легкая анемия у двух в раннем послеоперационном периоде.
Для 6 пациенток, благополучно перенесших операцию, при медиане наблюдения 22,5 мес. зарегистрированы 2 смерти от прогрессирования заболевания, 1 рецидив и 3 ремиссии, что не позволяет назвать результаты удовлетворительными. В целом в 1 группе у 10 больных из 11 потребовались манипуляции с НПВ, у 2 циркулярные резекции завершены пластикой синтетическим протезом, у 1 – аортальным гомографтом. Выполнены также 2 резекции общей подвздошной артерии с протезированием (одна – в сочетании с боковой резекцией НПВ), 1 боковая резекция аорты.
Во 2 группе (диссекция) наблюдали 12 пациентов, из них 2 мужчин, средний возраст составил 48,1 лет. Диагнозы, особенности операций, сроки и результаты наблюдения приведены в таблице 2. У одного пациента опухоль оказалась доброкачественной. В группе из 11 пациентов со злокачественной патологией одна пациентка погибла через месяц после обширной операции от полиорганной недостаточности. В раннем послеоперационном периоде у 1 пациентки наблюдали повышение уровня креатинина и мочевины с последующей нормализацией, анемия с уровнем гемоглобина от 80 до 90 г/л отмечена у 3 пациенток. Для 10 больных, благополучно перенесших операцию, при медиане наблюдения 21,2 мес. зарегистрированы 3 местных рецидива, 1 генерализация и 2 смерти от прогрессирования.
Таблица 2. Характеристика пациенты 2 группы с диссекцией сосудов забрюшинного пространства.
Сокращения:
НПВ – нижняя полая вена; ОПА – общая подвздошная артерия; НПА – наружная подвздошная артерия;
НБА – нижняя брыжеечная артерия; ИОЛТ – интраоперационная лучевая терапия.
Несмотря на довольно значительное количество публикаций по обсуждаемой теме, сравнение результатов и формирование общих выводов затруднены разнородностью групп пациентов. Наиболее частым сосудистым компонентом при удалении забрюшинной опухоли являются резекции НПВ.
По данным И.С. Стилиди [6], вовлечение НПВ при забрюшинных опухолях правосторонней локализации встречается в 24%. В 44% это внеорганные саркомы, в 33,3% – адренокортикальный рак. Из 27 операций произведено 6 тромбэктомий, 5 протезирований НПВ, 7 циркулярных резекций без протезирования, 15 продольных резекций (2 с заплатой). Решение о протезировании НПВ принимали в зависимости от развития коллатерального русла. Вмешательство было радикальным у 21 пациента, послеоперационная летальность составила 18,6%. Прослежены отдаленные результаты у 18 больных. Медиана общей выживаемости не достигнута при средней продолжительности наблюдения 19,5 мес. Умерли 1 пациентка с первичной лейомиосаркомой НПВ, 5 больных после паллиативного вмешательства и 4 после радикального.
По данным А.А. Клименкова [7], частота вовлечения сосудов при неорганных забрюшинных опухолях составляет 10%, 5-летняя выживаемость − 12,6%. Как показывает наш опыт и анализ литературы, основным поводом для манипуляций на магистральных сосудах при удалении опухолей забрюшинного пространства служат саркомы.
В серии W. Quinones-Baldrich [11] из 47 пациентов с резекцией и реконструкцией НПВ при удалении забрюшинной опухоли при сроках наблюдения 1,5-216 мес. (в среднем – 42) 5-летняя выживаемость составила 45% при медиане наблюдения 5,8 лет. Отмечена значительная разница в медиане общей выживаемости после шва вены или применения заплаты (6,5 лет) по сравнению с циркулярной резекцией и протезированием (4,2 года; p<0,005).
По данным M. Schwarzbach [12], необходимость вмешательства на сосудах возникала в 18% операций при забрюшинной саркоме. В 64% вовлечена только вена, в 16% – артерия, в 20% – оба сосуда. Послеоперационные осложнения составили 36%, смертность – 4%, двухлетняя выживаемость после радикальных операций – 90%, 5-летняя – 66,7%, медиана общей выживаемости при позитивных краях резекции – 21 мес., при циторедуктивных операциях – 8 мес.
Выполнение вмешательства на крупных сосудах забрюшинного пространства целесообразно при условии онкологической радикальности операции. Наиболее часто необходимость резекции сосудов забрюшинного пространства возникает при лечении неорганных забрюшинных опухолей, в том числе доброкачественных. Тесный контакт метастатической опухоли с крупным сосудом значительно усложняет оперативное вмешательство и, как маркер местной распространенности процесса, является неблагоприятным прогностическим фактором.
- Кит О.И., Касаткин В.Ф., Максимов А.Ю. и др. Хирургическое лечение неорганных забрюшинных опухолей. Паллиативная медицина и реабилитация, 2012; 1: 27-9.
- Харченко В.П., Чхиквадзе В.Д., Сдвижков А.М. Диагностика и лечение забрюшинных липом и липосарком. Российский онкологический журнал, 2011; 3: 10-5.
- Чиссов В.И., Вашакмадзе Л.А., Бутенко А.А. и др. Современные подходы и факторы прогноза при хирургическом лечении первичных и рецидивных неорганных опухолей забрюшинного пространства. Российский онкологический журнал, 2011; 3: 4-10.
- Зотов С.П., Фокин А.А. Ангиохирургия в онкологии. Челябинск, 1999; 118.
- Файнштейн И.А., Нечушкин М.И., Горобец Е.С. и др. Резекция и протезирование брюшного отдела аорты при хирургических вмешательствах по поводу местнораспространенных забрюшинных опухолей. Хирургия (им. Н.Н. Пирогова), 2010; 6: 26-30.
- Стилиди И.С., Губина Г.И., Бохян В.Р. и др. Резекция и пластика нижней полой вены при опухолях забрюшинной локализации. Анналы хирургии, 2011; 6: 36-43.
- Клименков А.А., Губина Г.И. Неорганные забрюшинные опухоли: основные принципы диагностики и хирургической тактики. Практическая онкология, 2004; 5(4): 285-90.
- Антипов С.В., Калинин Е.В., Мирошниченко П.В. и др. Интеграционная хирургия заболеваний брюшной полости, забрюшинного пространства. Онкология, 2010; 12(4): 355-8.
- Song TK, Harris EJ Jr, Raghavan S, et al. Major blood vessel reconstruction during sarcoma surgery. Arch Surg, 2009; 144: 817-22.
- Tseng WW, Wang SC, Eichler CM, et al. Complete and safe resection of challenging retroperitoneal tumors: anticipation of multiorgan and major vascular resection and use of adjunct procedures. World J Surg Oncol, 2011; 9: 143.
- Quinones-Baldrich W, Alktaifi A, Eilber F. Inferior vena cava resection and reconstruction for retroperitoneal tumor excision. J Vasc Surg, 2012; 55(5): 1386-93.
- Schwarzbach MH, Hormann Y, Hinz U, et al. Clinical results of surgery for retroperitoneal sarcoma with major blood vessel involvement. J Vasc Surg, 2006; 44(1): 46-55.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Опухоль забрюшинного пространства с возможным прорастанием в нижнюю полую вену
Добрый вечер! Маме 57 лет. В апреле 2016 году была проведена операция ПДР по поводу рака 12 перстной кишки. Высокодифференцированная аденокарцинома. T3N1M0. В апреле 2017 году резекция сигмовидной кишки pT2N0M0. Высокодифференцированная аденокарцинома. В октябре 2017 году прогрессирование, метастаз коллректального рака в забрюшинное пространство, сдавливание правого мочеточника, гидронефроз правой почки. Лечение: холелитотомия, реконструкция гепатикоеюноанастамоза, правосторонняя нефрэктомия, циторедуктивная резекция опухоли забрюшинного пространства, электроэмболяция опухоли. Всю опухоль удалить не удалось (на тот момент по состоянию мамы). Опухоль плотно прилегала к передней полуокружности нижней полой вены ( данных за прорастание в вену нет). Оставшаяся опухоль маркирована танталовыми скрепками. В период декабрь 2017-сентябрь 2018 проведено 4 химиотерапии по схеме xelox (больше не смогла перенести), далее эрбитукс еженедельно в монорежиме (KRAS, NRAS, BRAF мутации не выявлены). В июне 2018 по результатам МРТ уменьшение размеров образования в забрюшинном пространстве ( та часть опухоли, что оставалась на нижней полой вене). В сентябре 2018 прогрессирование. 1. Прорастание опухоли в поясничную мышцу ( опухоль до 5 см в диаметре) 2. Появление рядом метастаза ( до 4 см в диаметре) Вторая забрюшинная опухоль (метастаз) пока под вопросом ( будем делать кт с болюсным контрастированием на следующей неделе). Посоветуйте, прошу. Куда обратиться? Какая больница, институт (Москва, Питер)? чтобы рассмотрели возможность проведения радикальной операции по удалению опухоли и метастаза в забрюшинном пространстве с резекцией и протезированием нижней полой вены? (понимаю, что прогрессирование и т.д., но последние 2,5 года жизни были прожиты как раз Благодаря радикальным операциям). Если же операцию будет сделать невозможно, может быть, у кого то из форумчан есть опыт применения РЧА, киберножа, томотерапии при забрюшинных опухолях? (доказательств, что опухоль проросла в НПВ на сегодняшний день нет) Линию химиотерпаии тоже,видимо, придется менять. Какие препараты могут быть следующей линией? Есть ли на форуме кто-то, кто делал или может прокомментировать по поводу анализа - жидкостная биопсия при онкологии (определение мутаций для дальнейшего выбора химиотерапевтического препарата). Спасибо огромное за помощь и комментарии! Понимаю, что вопросов задала много, но сейчас у нас снова наступил период жизни, когда надо что-то срочно делать и выбирать очередные способы борьбы.
Не врач, но долгое время лечил отца от РПЖ T3N1M1, рак с множественніми мтс в л/у, лёгкие, кости скелета, так папин уроонколог сразу не рекомендовал его оперировать, кроме как микрооперацию по кастрации, а показал проводить гормонотерапию, после химию и облучение, чтобы не сделать папу раньше времени "лежачим овощем".
И папа прожил на этой паллиативной терапии в более-менее приличном качестве жизни 4 года и ушёл от нас 10 дней назад, почти до последнего был в сознании, на ногах, здраво рассуждал, даже ездил читать лекции студентам раз в неделю. Перед уходом папа пролежал всего 38 часов, не особо мучаясь, в полубессознательном состоянии. Это я к тому, что прежде чем выбирать путь радикального оперативного вмешательства надо прикинуть, а не ухудшится ли качество жизни онкобольного после них, ведь мтс распространились в жизненно важные лимфоузлы и органы. И какой смысл человеку жить, прикованным к кровати с разваленным операциями организме. Насчёт КиберНожа, насколько я знаю на поздних стадиях он малоэффективен, при мтс его вроде не назначают.
Ну, где то так, может, ещё кто то подойдёт прокомментит, может, из врачей.

Методы хирургической коррекции синдрома нижней полой вены
В статье приведен опыт лечения пациентов с СНПВ, как одного из возможных вариантов КСС. Выделены типы поражения НПВ в соответствии с классификацией, разработанной и используемой на базе ИОНХ АМНУ. Описаны методики как паллиативного, так и радикального лечения пациентов с СНПВ, усовершенствованных на базе торакального отделения ИОНХ АМНУ.
Ключевые слова
Компрессионный синдром средостения, синдром нижней полой вены, эндокавальное стентирование.
Синдром нижней полой вены - симптомокомплекс, обусловленный нарушением кровообращения в бассейне нижней полой вены, который является одним из возможных вариантов клинического проявления компрессионного синдрома средостения.
Клиника данной компрессии зависит от объема опухолевой ткани и степени инвазии в нижнюю полую вену. К сожалению, большинство таких клинических случаев относятся к неоперабельным. В то же время начальные стадии заболевания позволяют выполнять паллиативные[1], а в ряде случаев радикальные операции.
По мере увеличения инвазии опухоли в НПВ нарастают клинические проявления, сходные с синдромом Бадда – Киари[2], однако с более выраженной сердечно – сосудистой недостаточностью. Отек нижней половины туловища, резистентный к диуретинам асцит, прогрессирующая печеночно – почечная и полиорганная недостаточность быстро приводит к декомпенсации пациентов и летальному исходу.
Материалы и методы
Исходя из классификации инвазии опухолей переднего средостения в нижнюю полую вену, выделяем следующие типы поражения (Рис.1): I тип – поражение НПВ в месте вхождения в правое предсердие; II тип – поражение НПВ правого сердца; III тип – поражение НПВ на уровне печеночных вен.

Рис.1
Инвазия в НПВ может быть представлена следующими вариантами:
I - сдавление и смещение нижней полой вены опухолью;
II - прорастание стенки нижней полой вены с пристеночным тромбозом или без него;
III - прорастание нижней полой вены с выходом опухолевой ткани в просвет нижней полой вены.
Для диагностики СНПВ целесообразны допплерографическое и ангиографическое исследования. Нижняя каваграфия на наш взгляд имела ряд несомненных преимуществ, так как позволяла выявить наличие внутрипросветных тромбов, что явилось противопоказанием для манипуляций со стороны нижней полой вены из-за опасности тромбоэмболии легочной артерии.
При сдавлении нижней полой вены опухолью либо смещении, особенно, при небольших новообразованиях и доброкачественном опухолевом росте, имелась возможность прецизионного удаления опухоли без повреждения НПВ. Хороший обзор и свободу манипуляций обеспечивал вертикальный стернотомный доступ.
В наших наблюдениях компрессия нижней полой вены имела место у 23 больных в период с 1998 г. по 2008 г. В табл.1 представлены данные о примененных методах лечения у больных основной группы и группы сравнения с СНПВ на базе ИОНХ АМНУ.
Табл.1 Выполненные оперативных вмешательства у больных основной группы и группы сравнения.
Группа сравнения
Основная группа
- Эксплоративные операции с биопсией
- обходные шунтирующие операции;
- резекция нижней полой вены.
Результаты и их обсуждения
Опасность массивного кровотечения при повреждении НПВ требовала бережного обращения к тканям, обязательного взятия НПВ на турникеты дистальнее опухолевого поражения (Рис. 2).

В некоторых случаях возникала необходимость наложения держалок на прокладках выше опухоли на правое предсердие. После удаления опухоли турникет снимали, держалки завязывали, проходимость по НПВ полностью восстанавливалась.
При отсутствии тромбоза НПВ выполняли кавадилятацию из феморального пункционного доступа (Рис.3).

Несмотря на кратковременность дилатационного эффекта, эта манипуляция существенно улучшала общее состояние больного, позволяла подготовить его более эффективно к операции и выполнить радикальную операцию в более выигрышных хирургических условиях. Как паллиативная операция, когда удаление опухоли было невозможно, возможно выполнение эндокавального стентирования. Применялись стенты зарубежного производства, которые устанавливали через бедренную вену[3]. Одними из возможных осложнений данной манипуляции является миграция стента в правое сердце, тромбоз стента. В связи с этим, нами разработан стент с наружным покрытием его фторопластовой эмульсией №4, содержащей фрагменты мелкодисперсной алмазной крошки (Рис.4).

Рис.4
За счет повышения трения между стентом-эндопртезом и внутренней поверхностью НПВ стент был практически не смещаем. Профилактика тромбоза стента эндопротеза достигалась назначением антикоагулянтов по общепринятым схемам. Стентирование нижней полой вены было возможно только при I и II типах поражения НПВ. III тип поражения с вовлечением печеночных вен для данной коррекции был противопоказанием. Радикальное удаление опухоли с вмешательством на нижней полой вене также было возможным только при I и II типе инвазии опухоли в НПВ. Операция выполняется с использованием искусственного кровообращения (Рис.5).

Рис.5
Канюляция аорты и верхней полой вены выполняется по общепринятой методике. НПВ канюлируется дистальнее опухолевой инвазии. После остановки кровообращения в условиях кардиоплегии правое предсердие вскрывали ближе к НПВ, осуществляли ревизию устья НПВ, при необходимости выполняли тромбэктомию эверсионным способом либо с использованием катетера Фогарти[4]. Убедившись в адекватности нижнего кавального кровотока, производили резекцию нижней полой вены с ее полным замещением протезом либо с вшиванием заплаты из перикарда либо синтетической ткани.
При отсутствии возможности радикального удаления опухоли, прорастающей в НПВ, применяли обходное аурикулокавальное шунтирование (Рис.6).

Рис.6
Для наложения анастомоза протеза с нижней полой вены нами разработана методика с применением временного эндокавального шунта – 1 (заявка № u2Рис.7 ).

Особенностью данной конструкции является наличие бокового отверстия(2) в конюле, которая устанавливается внутрикавально. Временный шунт укрепляется кисетным швом на нижней полой вене (3), а также турникетами (4,5-в зависимости от анатомических условиях может быть использован один турникет). Кровоток обеспечивается по эндокавальному шунту 2-6. На выключенном сигменте нижней полой вены (А↔Б) формировали анастомоз протеза – наружного шунта с НПВ. Во избежание тромбоза эндокавального шунта его канюлю (1) извлекали, завязывали кисет (3), наружный шунт пережимали и вшивали в ушко правого сердца, которое предварительно отжимали зажимом Сатинского. Наружный аурикулоковальный шунт включали в кровоток после заполнения протеза кровью и удаления пузырьков воздуха из него.
Следует подчеркнуть, что удаление опухолей переднего средостения с инвазией в нижнюю полую вену является чрезвычайно травматичным оперативным вмешательством, что требует тщательного отбора пациентов, учета степени операционного риска. Как альтернатива могут быть применены двухмоментные операции: первым этапом производится циторедуктивная операция удаления опухоли и формирования кавааурикулярного анастомоза; вторым – резекция нижней полой вены с остатком опухолевой ткани.
СНПВ, как один из вариантов КСС,- тяжелое состояние, методы коррекции которого должны решаться индивидуально в каждом конкретном клиническом случае.
Радикальное удаление опухолей средостения с вмешательством на нижней полой вене является чрезвычайно травматичным, требует применения искусственного кровообращения и должно осуществляться в специализированных клиниках высококвалифицированным персоналом.
Эндоваскулярные технологии могут быть единственно возможными в лечении пациентов с СНПВ, которые значительно улучшают состояние больных.
1. Tackes J., Antonucci F., Stuckmann G., et al. (1994) The palliative
treatment of venous stenoses in tumor patients with self-expanding vascular
prostheses. Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr 100: p.433-440.
2. J Ang Vasc Sugr Vol.6 1/2000; p.81
3. Venbrux A. C., Mitchell S. E., Savander SI., et al. (1994) Long-term results with the use of metallic stents in the inferior vena cava for treatment of Budd-Chiari syndrome. J Vasc inter Radiol 5: p.411-416.
5. Покровский ангиология -М.:Медицина,1979.-С.443-447.
Читайте также:

