Паллиативная операция при раке печени
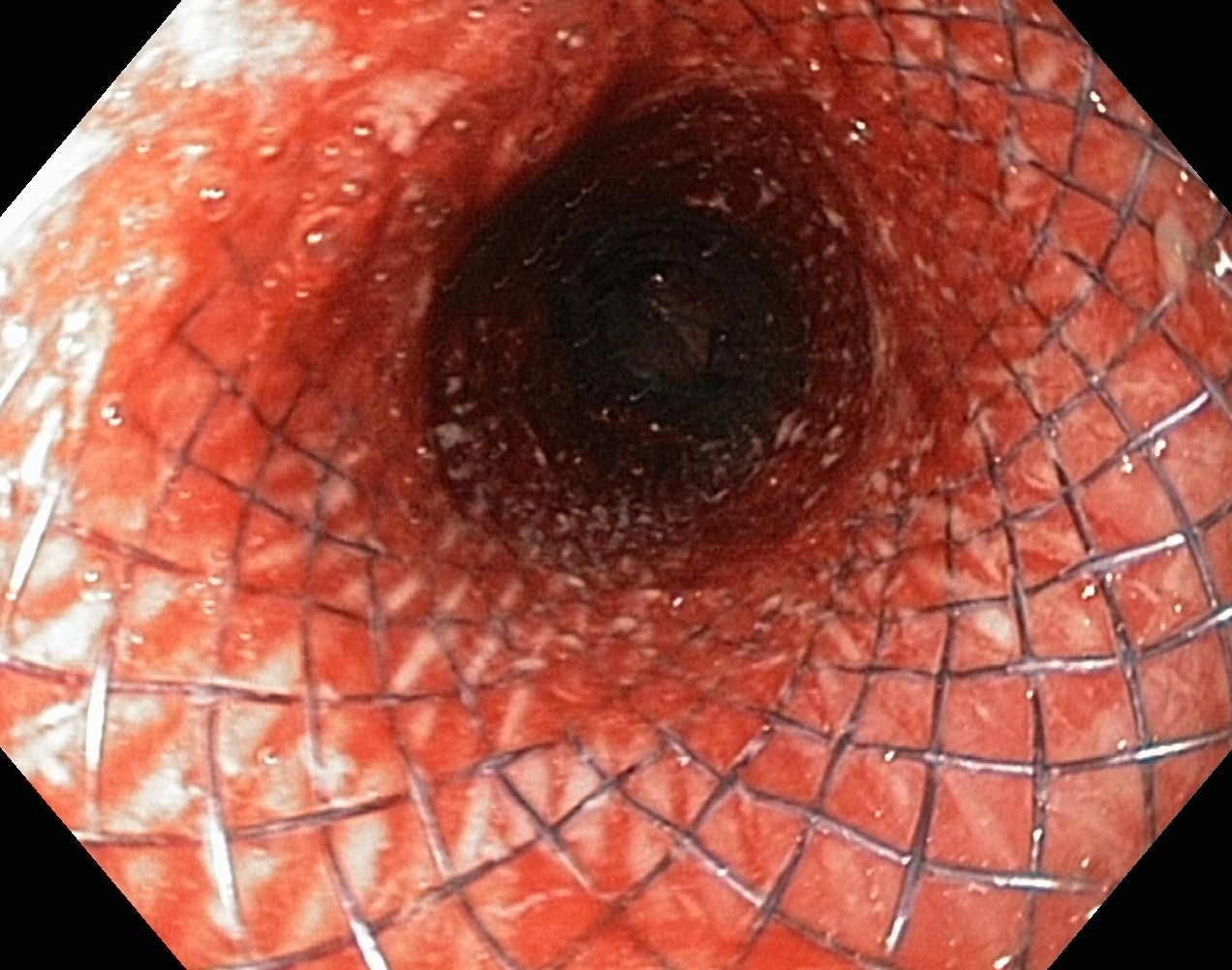
Спорим, вы не угадаете, что это? Это стент в просвете пищевода
Не каждый из тех, кто кашляет весной 2020 – болен COVID-19. Есть пациенты, кому еще хуже: они задыхаются, и им не помогут 2 недели в инфекционной больнице. У них рак. Рак легких, или молочной железы, или яичников, или, возможно, лимфома.
При многих опухолях частое осложнение – скопление жидкости в плевральной полости (вокруг легких). Ее бывает много, до нескольких литров (!) – и она сдавливает легкие, мешая им работать. Это называется гидроторакс.
Заметьте, хирург позволяет человеку жить дальше, хотя не действует на главную причину беды: злокачественную опухоль. Это один из примеров паллиативной хирургии.
Паллиативная хирургия – это такая, которая не устранит главную проблему – раковую опухоль, не вылечит человека полностью. Но паллиативная операция, вероятно, продлит ему жизнь и заметно повысит ее качество: он сохранит способность к самообслуживанию и социальную адекватность, сможет сам передвигаться, есть или ходить в туалет, перестанет мучиться от боли.
Почему бывает нельзя просто вырезать опухоль?
Хирургическое лечение в онкологии многие считают только радикальным: когда все очаги поражения можно просто иссечь. А иначе ведь – зачем и связываться с травматичными вмешательствами и вообще впустую размахивать скальпелем? Это распространенный стереотип.
Если, например, кроме опухоли в молочной железе у женщины метастазы в печени, легких и позвоночнике – придется удалять слишком много тканей из разных органов сразу, и риск умереть от такой операции у нее будет выше, чем от прогрессирования болезни.

Органы, куда чаще всего метастазирует рак молочной железы
Но это не значит, что таким людям ничем нельзя помочь! Паллиативная помощь может значительно облегчить состояние пациента и улучшить качество его жизни, а иногда и продлить ее – не прибегая к радикальному лечению.
Паллиативная медицина чаще всего использует химио- и лучевую терапию. К сожалению, это отложилось в головах у многих российских врачей слишком плотно: они не готовы применять хирургию, когда заранее понимают, что оставят опухоль или часть ее внутри пациента. Хотя в онкологических отделениях по миру до 20% всех операций – паллиативные.
И их становится больше. Показания к хирургическому лечению на любой стадии рака – даже при распространённом процессе – расширяются. Появляются новые малоинвазивные способы вмешательства – они снижают риски для пациента и после них легче восстановиться.
Паллиативная хирургия становится частью комплексного лечения. У нас этому очень помогает налаженное междисциплинарное взаимодействие. Когда хирург, онколог, химиотерапевт, врач лучевой терапии и реаниматолог собираются вместе, они не тянут одеяло на себя (как вы могли подумать), а находят оптимальную лечебную тактику, чтобы избавить пациента от мучительных симптомов максимально безопасно, и насколько возможно долго.
На сегодня успехи таковы. С помощью паллиативной операции можно:
- Уменьшить размер опухоли, чтобы появилась возможность действовать на нее химиотерапевтическими методами.
- Снизить опухолевую интоксикацию.
- Убрать тягостные симптомы.
- Остановить/предотвратить внутреннее кровотечение.
- Уменьшить боли.
- Реконструировать поврежденную часть тела и помочь реабилитации после радикальных методов лечения.
Не можем удалить – уменьшим. Циторедуктивные операции
а) продлить пациенту жизнь,
б) убрать тягостные симптомы,
в) предотвратить жизнеугрожающие состояния.
Часто опухолевые очаги нельзя удалить целиком. Например, опухоль слишком крупная – вместе с ней пришлось бы удалять жизненно важный орган или очень большой его участок. Или поражены слишком много систем организма – множественные отдаленные метастазы. Или очаги метастазирования мелкие, до микроскопического размера, зато их тысяча – как при канцероматозе брюшины.
Хотя в таких случаях часто есть возможность удалить не всю, но максимально возможную часть опухоли. Это уменьшит тяжелые симптомы, вызванные жизнедеятельностью раковых клеток. А главное – не остановит, но замедлит распространение злокачественного процесса, позволит пациенту выиграть время, даст больше шансов на то, что химио- и лучевая терапия подействуют – они работают тем эффективнее, чем меньше объем опухолевой ткани в организме.
Циторедуктивные операции становятся частью комплексного лечения. Мы уже рассказывали про HIPEC, гипертермическую внутрибрюшинную терапию, которая помогает пациентам на последних стадиях рака яичников, желудка, различных отделов кишечника, печени. Циторедуктивная операция занимает в процедуре HIPEC первое место: сначала хирург удалит все очаги, которые сможет найти, а затем брюшную полость пациента обработают горячим химиопрепаратом. После такой операции люди могут жить годы вместо месяцев, а в некоторых случаев – добиться ремиссии.
На этом видео можно посмотреть, как проходит циторедуктивная операция при канцероматозе брюшины. Осторожнее, если вы не любите заглядывать людям слишком глубоко внутрь!
Одна из наших пациенток, которой удаляли аденокарциному яичников, выполняет циторедуктивную операцию в сочетании с HIPEC уже 5-й раз подряд – и это 5 лет жизни.
Кроме рака яичников, циторедуктивные операции, как один из этапов лечения, показывают улучшение показателей по выживаемости при колоректальном раке, раке желудка, аденокарциноме аппендикса, саркомах мягких тканей – даже на тех стадиях, когда опухоль уже начала метастазировать.
Циторедуктивная операция нередко оказывается способом избежать худшего в ситуации, когда пациенту угрожают серьезные, опасные осложнения. Например, такое вмешательство помогает предотвратить перфорацию кишечника или сильное кровотечение из-за распада опухоли.
Эти меры, хотя и являются паллиативными – не дают пациенту уйти из жизни раньше времени.
Поэтому мы стараемся всегда найти максимум возможных вариантов лечения и следить за прогрессированием, даже когда невозможно выполнить радикальное вмешательство или опухоль плохо реагирует на химиотерапию.
Не можем удалить причину – режем следствия. Симптоматические операции
Симптоматические паллиативные хирургические вмешательства вообще не затрагивают опухоль, в отличие от циторедуктивных операций, но борются с опасными последствиями для пациента, которые вызывает рост злокачественного новообразования.
Например, про торакоцентез при скоплении жидкости в грудной клетке мы описали в самом начале статьи. Но не реже происходит скопление жидкости в брюшной полости – асцит. Это обычное осложнение при раке желудка, яичников, колоректальном раке и др.
При асците (скоплении жидкости в брюшной полости) объем жидкости может достигать 10 и более литров. Пациент чувствует себя очень плохо: одышка, нарушение в работе ЖКТ и внутренних органов. Чтобы облегчить это состояние, выполняют лапароцентез – прокол в стенке брюшной полости, чтобы вывести жидкость. Если жидкость скапливается быстро, устанавливают дренаж – он выводит излишки непрерывно.
Однако чаще всего симптоматические операции нужны, чтобы организм, по сути, продолжал производить с окружающей средой обмен, который всем нам так привычен и воспринимается здоровыми людьми как должное.
Для обеспечения функционирования пищеварительной системы
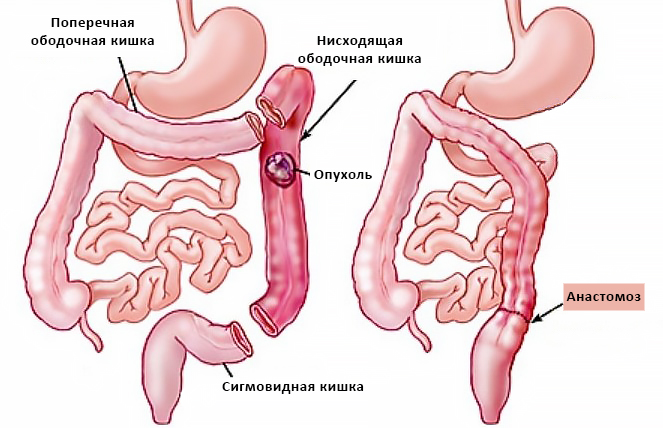
Удаление части ободочной кишки и формирование анастомоза
Однако, анастомоз наложить удается не всегда: например, пищевод или кишечник может быть слишком сильно поврежден опухолью. Существует еще ряд ситуаций, когда возникает необходимость создать прямое сообщение между полостью любого органа и окружающей средой.
На этот случай существуют стомы – отверстия, хирургическим путем сформированные на коже, к которым подшивают края нужной полости, в зависимости от локализации неоперабельной опухоли, которая закрывает просвет.
Например, гастростома – если не удается задействовать для питания пищевод: желудок подшивают к стенке брюшной полости и формируют отверстие на коже, через которое вводят полужидкую пищу.
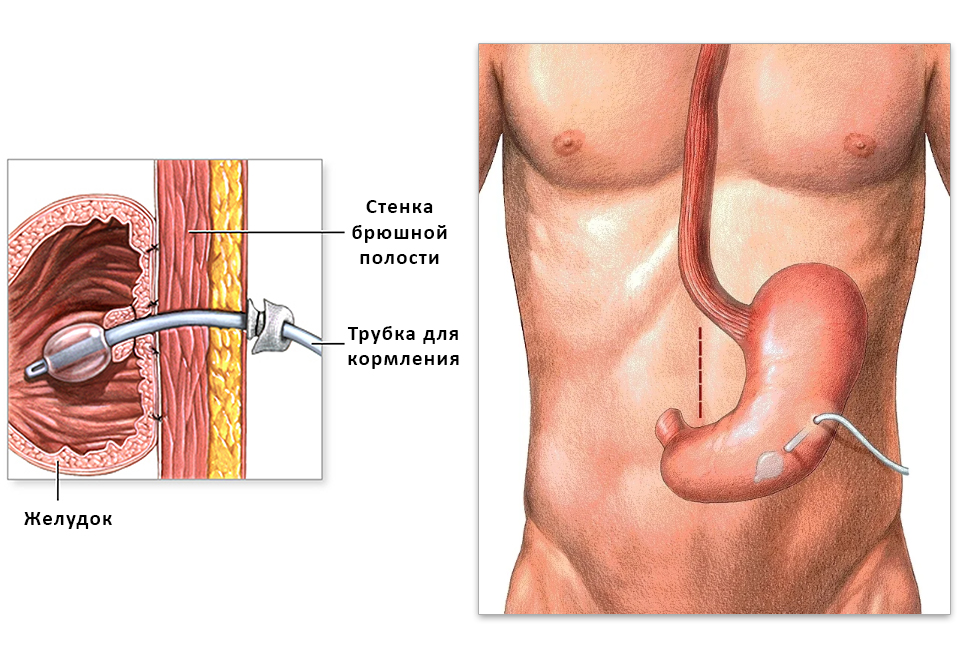
Устройство гастростомы
Колостома и илеостома. Если предыдущее отверстие было предназначено для питания пациента, то это – наоборот. При колостомии на кожу живота выводят отверстие из ободочной кишки, при илеостомии – подвздошной кишки. Через коло- или илеостому в специальный мешок-калоприемник отходят продукты жизнедеятельности.

Резекция толстой кишки с выведением колостомы
Обеспечение функции дыхания
Трахеостома. При опухолях гортани, чтобы не допустить удушья, проводят трахеостомию — на кожу выводят отверстие из трахеи, через которое человек может дышать.
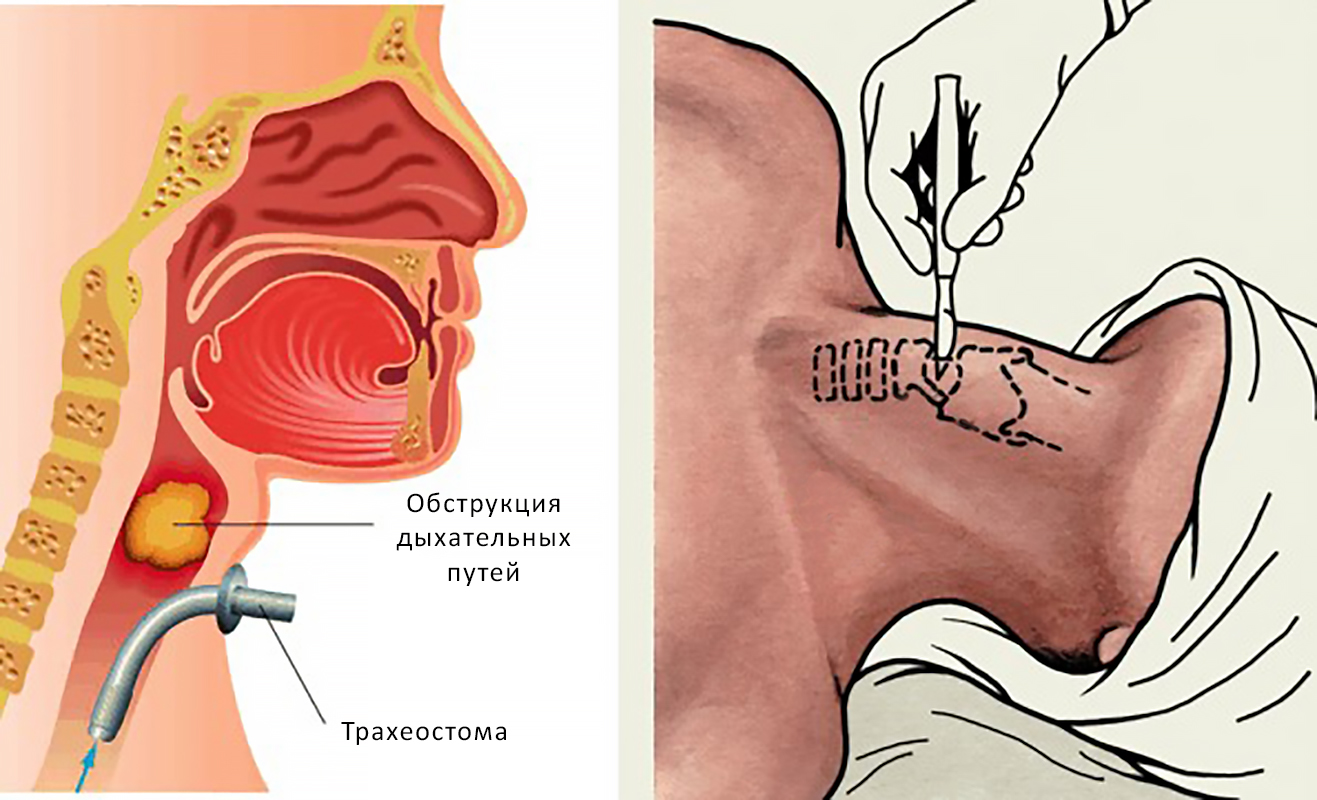
Трахеостома и проведение процедуры трахеостомии
Обеспечение мочевыделения
Нефростома – специальная полая трубка, которая выполняет функцию дренирования при нарушениях оттока мочи. Ее устанавливают в почечную лоханку через прокол на коже под контролем УЗИ.

Нефростома
Когда возможно – не режем, а используем эндоскоп
Когда опухоль разрастается и вовлекает какой-либо полый орган (пищевод, желудок, желчный проток, мочеточник, и т.д.), это может приводить к сдавливанию стенок органа, сужению просвета и полной непроходимости.
Зачастую в таких случаях есть возможность установить стент — металлический или полимерный сетчатый цилиндр-расширитель, который автоматически расправляется внутри полости органа и создает каркас, чтобы поддерживать достаточный просвет и проходимость.
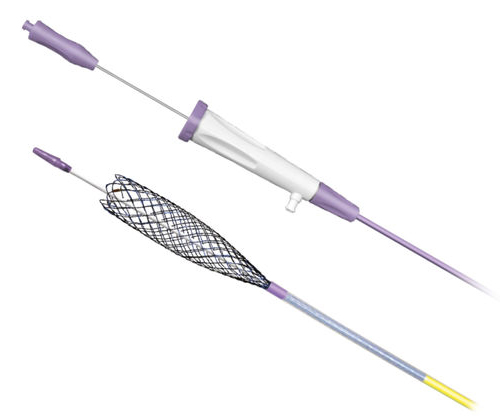
Билиарный стент (для желчного протока)
С помощью стентирования у нас получается сохранить физиологические функции многих органов даже на поздних стадиях опухолевого процесса.
Нормальное отведение желчи и лечение механической желтухи. Стентирование желчных протоков восстанавливает беспрепятственный отток желчи из печени в двенадцатиперстную кишку. Во-первых, пациент избавится от опасного состояния: механической желтухи. Она вызывается нарушением оттока желчи, провоцирует повышение уровня билирубина в крови и токсическое действие на ЦНС. Во-вторых, пациенту не придется ходить с выходящими наружу дренажами. В-третьих, естественный ток желчи сохранит нормальную работу кишечника. Так одна малоинвазивная операция делает очень много для сохранения качества жизни.

Стентирование желчного протока с помощью эндоскопа
Обеспечение работы пищевода и возможности самостоятельно питаться. Мы можем стентировать пищевод и желудок в случаях, когда опухоль находится в самом органе, или разрастается, придавливая его снаружи, или сужение просвета стало результатом более ранних вмешательств или иных повреждений (рубцов от химического ожога, например).
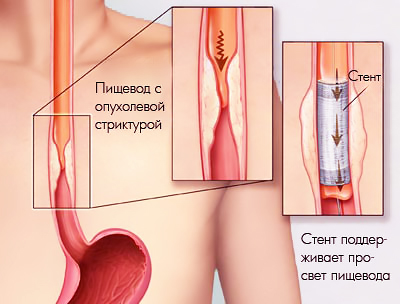
Работа стента в пищеводе, сдавленном опухолью
Судите сами: пациента привезли на реанимобиле с механической желтухой и стенозом пищевода, а выписали через 10 дней в состоянии, когда он может самостоятельно принимать пищу через рот и нормально ее переваривать.
Удалить всё и восстановить красоту. Санационные операции и реконструктивные
Когда опухоль не оперировали, и не слишком успешно лечили иными методами, она продолжает расти, а потом начинает распадаться. Эта опухолевая ткань может инфицироваться, вызывать массивные кровотечения, некрозы, оказывать токсическое действие на организм пациента, и сильно ухудшает его состояние.
Чтобы не допустить этого, нужно удалить как можно большее количество инфицированной опухолевой ткани. Такие паллиативные операции в онкологии называются санационными. Их выполняют, например, при раке молочной железы. Необходимость в таких операциях возникает у 30-40% женщин на III-IV стадиях. Также такие операции проводятся при угрозе распада и нагноения опухолей других органов: например, печени, ободочной кишки.
Часто после объемных оперативных вмешательств с полным удалением пораженного органа требуется последующая реконструкция. Например, молочной железы, частей лица или части кишечника, мочевого пузыря – для восстановления жизнедеятельности организма.
Это крайне важно и для психоэмоционального настроя пациента – чтобы он снова чувствовал себя нормальным человеком, с симметричными молочными железами и способностью ходить в туалет без дренажей и мочеприемников. От этого в большой мере зависит, будет ли человек находить радость в жизни и мотивацию для продолжения лечения.
Этой статьей мы хотим, во-первых, напомнить в нынешнее тревожное время, как счастливы те из нас, чей организм не нуждается в поддержке хирургов, чтобы есть или дышать.
А во-вторых, показать: даже в запущенных и тяжелых случаях все еще остается довольно много возможностей помочь онкологическому пациенту, продлить жизнь, убрать или облегчить мучительные симптомы. Даже если по прогнозам, жизни осталось совсем немного – есть очень большая разница в том, как ее прожить. В качестве, а не только в количестве. Паллиативная медицина – и паллиативная хирургия в частности, сегодня могут многое сделать для качества.
Хирургическое удаление опухоли — единственный радикальный метод лечения рака печени. Однако, операцию можно выполнить далеко не у всех пациентов. Зачастую очагов много, и они разбросаны по всему органу, опухоли оказываются слишком большими или успевают прорасти в кровеносные сосуды, желчевыводящие пути, соседние органы.
При раке печени проводят два вида хирургических вмешательств:
- резекция — удаление части органа;
- трансплантация.
Возможность радикального хирургического лечения определяют по данным КТ и МРТ с ангиографией. При неоперабельных опухолях прибегают к возможностям интервенционной хирургии.
Резекция печени
Такая операция может быть выполнена только при определенных условиях:
- Опухоль локализованная (находится в одном месте) и не прорастает в кровеносные сосуды.
- Очаг относительно небольшого размера.
- Нет метастазов в лимфатических узлах и других органах.
- Ткань печени не поражена циррозом и может нормально справляться со своими функциями.
К сожалению, возможность удалить злокачественную опухоль есть далеко не всегда. В зависимости от объема, резекция печени может быть долевой, сегментарной, атипичной.

Насколько большую часть печени можно удалить во время операции? Печень обладает высокой способностью к регенерации, поэтому во время резекции врач может удалить достаточно большую часть органа. Прежний размер восстанавливается примерно через 6 месяцев. Однако, хирург должен действовать предельно аккуратно. Нужно постараться полностью удалить опухоль, при этом оставить как можно больший объем здоровой ткани.
Если обнаружен цирроз — означает ли это, что врачи однозначно откажут в операции? В целом цирроз является противопоказанием к резекции. Даже если удалить небольшое количество ткани, есть риск, что оставшаяся часть печени не сможет адекватно справляться со своими функциями.
Но иногда, если функции печени нарушены не сильно, операция всё же возможна. Для того чтобы оценить функциональное состояние органа, пользуются пятью критериями Чайлда-Пью: уровень билирубина и альбумина в крови, протромбиновое время (показатель свертываемости крови), наличие асцита (скопления жидкости в брюшной полости), печеночной энцефалопатии (поражения мозга в результате нарушения функции печени).
Пациентов делят на три класса:
- Класс A — когда все пять показателей в норме. У таких больных резекция, скорее всего, возможна.
- Класс B — легкие отклонения от нормы. Вероятность того, что пациента возьмут на операцию, ниже.
- Класс C — тяжелые отклонения. Хирургическое лечение противопоказано.
Почему резекция печени считается сложным хирургическим вмешательством? Проведение операции требует от хирурга большого опыта, потому что:
В Европейской онкологической клинике работают опытные врачи-гепатоонкологи и функционирует превосходно оснащенная операционная. Мы выполняем операции любой сложности при раке печени и других органов пищеварительной системы.
Трансплантация печени
Для некоторых онкобольных с нерезектабельным раком альтернативой может стать трансплантация печени. Хирург удаляет пораженный опухолью орган и заменяет его на донорский. Трансплантация возможна, когда есть один очаг не более 5 см в диаметре или 2–3 очага, диаметр каждого из которых не превышает 3 см. При этом опухоль не должна прорастать в кровеносные сосуды, не должно быть метастазов.
Получить донорскую печень можно от трупа или от живого донора, в роли которого обычно выступает близкий родственник. В России, как и во всех странах мира, ситуация с донорскими органами напряженная. Пересадка печени бывает необходима не только при раке, но и при других заболеваниях: вирусных гепатитах, циррозе, болезни Вильсона-Коновалова.
Хирургическая тактика в зависимости от стадии
Резектабельная опухоль I–II стадии. К сожалению, такая ситуация встречается редко, но она позволяет провести радикальную операцию, удалить пораженную часть органа, и после этого может наступить ремиссия. Хирургическое лечение дополняют курсом неоадъювантной химиотерапии.
Нерезектабельная опухоль, когда не поражены регионарные (близлежащие) лимфатические узлы, нет метастазов. Проводят паллиативную терапию. Прибегают к методам интервенционной хирургии:
- Радиочастотная аблация — процедура, во время которой тонкий электрод в виде иглы вводят в опухоль и разрушают её током высокой частоты.
- Химиоэмболизация — введение в сосуд, питающий опухоль, особого эмболизирующего препарата в сочетании с химиопрепаратом. Эмболизирующий препарат состоит из микрочастиц, которые блокируют приток крови к опухолевой ткани, а химиопрепарат уничтожает раковые клетки.
- Интраартериальное введение химиопрепаратов. Лекарство вводят в печеночную артерию, благодаря чему оно оказывает более мощное локальное действие и не поступает в общий кровоток. Такое лечение пациенты переносят лучше, чем системную химиотерапию (внутривенное введение препаратов).

Иногда эти меры помогают уменьшить опухоль и сделать её резектабельной.
Небольшая опухоль, которая неоперабельна из-за другого заболевания. Бывают ситуации, когда операцию нельзя проводить из-за цирроза или других противопоказаний, не связанных с самим раком. В таких случаях применяют радиочастотную аблацию, химиоэмболизацию, химиотерапию, таргетную терапию.
Рак печени, который успел распространиться в лимфатические узлы и метастазировать. Такие опухоли имеют неблагоприятный прогноз. Но даже в запущенных случаях пациенту можно помочь, облегчить симптомы при помощи правильного паллиативного лечения.
Рецидивирующий рак печени. Если рецидив локальный, без распространения в лимфоузлы и метастазов, можно повторно провести резекцию. В других случаях лечение будет носить паллиативный характер.
Операции при метастазах рака в печень
Чаще всего раковые клетки метастазируют в печень из опухолей легких, кишечника, желудка. Если есть один или несколько мелких очагов, проводят резекцию. В других случаях применяют радиочастотную аблацию, химиоэмболизацию, назначают химиотерапию, таргетную терапию.
В Европейской онкологической клинике проводятся миниинвазивные вмешательства, которые помогают справиться с осложнениями рака: механической желтухой, асцитом.
Сколько живут после операции при раке печени?
Рак печени — злокачественная опухоль, с которой очень сложно бороться. Даже после резекции в течение 5 лет остается в живых не более 20% больных.
После радикальной операции в печени могут продолжаться патологические процессы, которые вызвали рак, со временем они приведут к рецидиву.
Лечение рака печени в последние годы претерпело существенные изменения за счёт внедрения инновационных подходов, существенно увеличивающих продолжительность жизни пациентов, но радикальный способ остался прежним — операция. Как и при большинстве злокачественных новообразований избавить от заболевания способна только адекватная хирургия, в помощь ей — химиотерапия, но с очень ограниченным спектром действенных лекарственных препаратов.

В каких случаях операция невозможна?
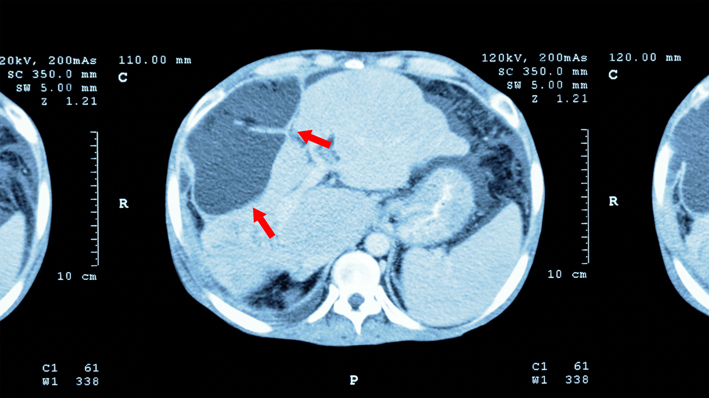
Радикальная операция при гепатоцеллюлярном раке печени возможна при небольшом и одиночном опухолевом узле или нескольких маленьких — до 3 см, но кучно располагающихся в одной доле печени. Печеночная ткань обладает редкой способностью к восстановлению, после удаления почти 70% органа через некоторое время объём печени полностью восстанавливается.
Восстановление утраченных в результате операции печёночных долек возможно только при здоровой печени, не страдающей хроническим гепатитом или циррозом и полностью выполняющей свои многообразные функции. Вопросы оперативного лечения рака зависят от состояния здоровья органа. Наличие выраженного цирроза может стать абсолютным противопоказанием для хирургии даже при небольшом злокачественном новообразовании.
Отдалённые метастазы печеночной карциномы в других органах, равно как и распространение ракового конгломерата на сосуды ворот печени или опухолевый тромб в воротной вене обозначены как абсолютное противопоказание к хирургическому лечению.
Невозможно оперативное лечение при асците — образовании в брюшной полости избыточного количества жидкости, и не важно, чем это вызвано: нарушением ли работы сердечно-сосудистой системы, тяжёлым циррозом или метастазами на выстилающей брюшную полость брюшине. Асцит свидетельствует о декомпенсации функциональных возможностей органа, в такой клинической ситуации прибегают к консервативной терапии с эвакуацией выпота.
Какие операции выполняются при раке печени?
Радикальных вмешательств при гепатоцеллюлярной карциноме только два:
- Удаление части печеночной ткани — резекция;
- Полное удаление печени с одномоментной трансплантацией донорского органа.
Резекция — щадящая по объёму удаляемых тканей операция, тем не менее, она невозможна при имеющемся у пациента циррозе или фиброзе печени, когда почти исключается возможность послеоперационного восстановления, к сожалению, существенную недостаточность печеночной функции пока не научились адекватно компенсировать.
Во всех случаях доступ к больному органу осуществляется через брюшную стенку в правом подреберье. Сегодня можно выполнить резекцию щадящим лапароскопическим доступом через несколько проколов брюшной стенки и под контролем оптического оборудования. Этой инновационной и технически сложной манипуляцией владеют немногие российские хирурги, но у специалистов нашей клиники достаточный опыт высокотехнологичной эндоскопической хирургии и онкохирургии.
Отзывы наших пациентов
Какие хирургические методики помогают бороться с опухолью печени?
В некоторых случаях возникают сомнения в возможности технического выполнения резекции печени, к примеру, при нескольких раковых узлах небольшого размера — до 3–5 см каждый. Стандарты лечения предлагают комбинировать резекцию органа с локальными методами уничтожения злокачественной ткани.
Технология локальной манипуляции заключается в подведении к новообразованию физического фактора, вызывающего гибель клеток с последующим замещением погибшей печеночной паренхимы соединительной тканью с формированием рубца.
мы обязательно вам перезвоним
Заключённые в микроскопические капсулы изотопы иттрия или химиопрепараты в составе жировой эмульсии тоже подводят к раковому конгломерату, но уже не просто в опухоль, а по вставленному в питающую рак крупную артерию катетеру, процесс называется трансартериальная радиоэмболизация (ТАРЭ) или химиоэмболизация (ТАХЭ).
При любом локальном воздействии для хорошего конечного результата может потребоваться несколько манипуляций.
В каких случаях можно использовать локальное воздействие на печень без операции?
Все локальные методики могут применяться совершенно самостоятельно при первичном раке печени менее 3 см, когда пациент по состоянию здоровья не способен перенести объёмную операцию, при рецидиве после резекции и метастазах в печени — IV стадии. Клинические исследования показали их хорошую переносимость и долговременный результат при приличном качестве жизни пациента.
Возможности лекарственного лечения — химиотерапии при раке печени ограничены, тем не менее, они могут потребоваться. Печень выполняет множество функций, её болезнь нарушает нормальную биохимию всех процессов жизнедеятельности, поэтому без регулярной реабилитационной поддержки и симптоматической терапии тяжелое противоопухолевое лечение невозможно провести без потерь.
В нашей клинике каждому пациенту предложат индивидуальную программу сопроводительной терапии, облегчающую противоопухолевое лечение, ориентированную на улучшение качества и максимальную продолжительность жизни.
- Щукина О. Е. Ультразвуковая диагностика рака печени // Саратовский научно-медицинский журнал. 2014. №1.
- Подымова С. Д. Болезни печени. М.: Медицина, 2006; 554 с.
- Терновой С. К., Васильев А. Ю., Синицын В. Е., Шехтер А. И. Лучевая диагностика и терапия. М.: Медицина, 2008.
- Мерабишвили В. М., Мерабишвили Э. Н., Чепик О. Ф. Эпидемиология рака печени // Российский онкологический журнал. 2014. №4.
Оперативные вмешательства при гепатоцеллюлярном раке
Основной метод радикального хирургического лечения гепатоцеллюлярного рака, позволяющий добиться значительного продления жизни, а в ряде случаев и полного излечения пациентов, - анатомическая резекция печени. Без лечения прогноз заболевания крайне неблагоприятный: медиана выживаемости составляет 2-6 мес.
Цирроз печени - основной фактор, препятствующий выполнению резекций печени при гепатоцеллюлярной карциноме из-за функциональной неполноценности паренхимы и её резко ограниченной способности к регенерации. Именно поэтому необходимым этапом предоперационного обследования служит тщательное изучение функциональных резервов печени и соизмерение операционного риска с возможностями хирургического вмешательства. Максимальное сохранение функционирующей печёночной паренхимы - один из основных принципов хирургического лечения больных с циррозом печени.
При гепатоцеллюлярной карциноме и отсутствии цирроза показано выполнение обширной анатомической резекции печени - правосторонней или левосторонней гемигепатэктомии, в том числе в расширенном варианте. Необходимость выполнения обширной резекции определяется как объёмом поражения, так и особенностями внутриорганного распространения опухоли, а также тем, что даже при малых размерах гепатоцеллюлярной карциномы в 25-30% случаев имеются сателлитные очаги, окружающие основную опухоль, а в 40% случаев - опухолевые тромбы в воротной вене.
При нормально функционирующей печёночной паренхиме рекомендуется резекция с удалением по меньшей мере 3 см здоровой паренхимы вокруг опухоли, при циррозе край непоражённой паренхимы может быть уменьшен до 1 см. У больных с циррозом выполнение обширной анатомической резекции печени возможно лишь в отдельных случаях при стадии А по Чайлду-Пью, высоких показателях дооперационных функциональных тестов и гипертрофии остающейся после резекции доли.
При гепатоцеллюлярной карциноме небольших размеров у больных с циррозом возможно выполнение сегментэктомии, субсегментэктомии или энуклеации (если цирроз выраженный, а опухоль представлена одним узлом). Хронический гепатит независимо от степени его активности не является противопоказанием для выполнения обширной резекции печени. Также не является абсолютным противопоказанием опухолевый тромбоз портальных вен, тромбоз печёночных вен или нижней полой вены.
Послеоперационная летальность после резекций печени по поводу гепатоцеллюлярной карциномы при отсутствии цирроза находится на приемлемом уровне и составляет, по данным разных авторов, 2-6%. Число осложнений и летальность после резекций печени у больных с циррозом составляют 20-50% и 10-20% соответственно.
Отдалённая выживаемость после резекций печени по поводу гепатоцеллюлярного рака определяется размерами опухоли, наличием или отсутствием капсулы, сосудистой инвазии, сателлитных опухолевых узлов, а также степенью дифференцировки опухоли. Преимущественно отдалённый прогноз определяет наличие цирроза печени: у больных без цирроза 5-летняя выживаемость достигает 50%, с циррозом в стадии В и С по Чайлду-Пью - менее 25%, что определяется частотой рецидива опухоли и прогрессированием цирроза и развитием его осложнений. Внутрипечёночный рецидив гепатоцеллюлярного рака после радикальных резекций печени развивается у 40-80% больных.
Рецидиву рака способствуют:
- размеры опухоли более 5 см;
- число узлов опухоли более 3;
- сосудистая инвазия;
- низкая степень дифференцировки опухоли.
- радикальная резекция печени при массивной анатомической форме рака;
- наличие высокодифференцированного гепатоцеллюлярного гистологического типа;
- отсутствие внутрипечёночных и отдалённых метастазов, поражения лимфатических узлов.
При выявлении локального внутрипечёночного рецидива показано выполнение повторной резекции (ререзекции) печени, которая может быть выполнена у 10-20% больных. Следует отметить значительную техническую сложность выполнения такого вмешательства из-за выраженных сращений и нарушения анатомических взаимоотношений после первичной операции. Однако у пациентов, перенёсших ререзекцию печени, отмечено значительное увеличение продолжительности жизни - 3- и 5-летняя выживаемость в этой группе больных составляет 35-70% и 20-40% соответственно.
В связи с тем что ререзекция печени возможна лишь при своевременном выявлении рецидива, всем больным, перенёсшим резекцию печени по поводу гепатоцеллюлярного рака, показано тщательное динамическое наблюдение и обследование после первичной операции не реже 1 раза в 3-6 мес.
Выделяют 3 основных способа локальной деструкции опухоли.
Внутриопухолевое введение этанола.
Процедура заключается в чрескожном внутриопухолевом введении 99,5% спирта под ультразвуковым контролем или непосредственно во время операции. Введение спирта в опухоль вызывает гибель опухолевых клеток вследствие клеточной дегидратации, развития микрососудистых тромбозов и коагуляционных некрозов с формированием последующего фиброза. Противопоказания для данного метода - размеры опухоли более 5 см в диаметре или наличие более 3 опухолевых узлов. Осложнения (разрыв опухоли, жёлчный перитонит, кровотечение, диссеминация опухоли по ходу пункционного канала) крайне редки. Однако эффективность метода достаточно низкая, поэтому в последние годы предпочтение отдаётся таким методам локальной деструкции опухоли, как крио- и радиочастотная абляция.
Криоабляция.
Эффект воздействия на опухолевую ткань основан на развитии некроза тканей, вызванного прямым воздействием холода, и образованием микрососудистых тромбозов. Криоаппликатор подводят непосредственно к опухоли, и замораживание происходит путём охлаждения аппликатора жидким азотом до температуры -180 °С. Помимо сочетанного с резекцией печени применения криоабляции, этот вариант может использоваться самостоятельно при лечении злокачественных опухолей на фоне выраженного цирроза печени, когда выполнение резекции непереносимо для больного.
Термоабляция.
Наибольшее распространение получила радиочастотная абляция. Локальное гипертермическое воздействие при температуре свыше 50 °С с помощью этого метода приводит к развитию коагуляционного некроза сферической формы с последующим замещением его соединительной тканью. Метод радиочастотной абляции может быть использован как интраоперационно, так и без операции - путём чрескожного доступа под контролем УЗИ (данный доступ предпочтителен в настоящее время). Частота полного некроза опухоли при использовании метода в случае гепатоцеллюлярного рака достигает 80%, при метастазах колоректального рака - 70% (в том случае, если размер опухолевого узла не превышает 4 см в диаметре). Если диаметр опухолевого узла превышает возможную зону некроза, применяют специальные методики перекрывающихся полей. Общая частота тяжёлых осложнений после радиочастотной абляции (внутрибрюшные кровотечения, гематомы, биломы, абсцессы печени, гемоторакс) составляет менее 4%, при этом летальность не превышает 0,3%.
Радиочастотная абляция в последние годы находит всё большее применение как самостоятельный метод лечения метастатического поражения печени, а также как метод лечения резектабельного гепатоцеллюлярного рака на фоне цирроза печени в стадии А и В по Чайлду-Пью. Годичная, 2- и 3-летняя выживаемость при этом составляет 95%, 86% и 80% соответственно.
Цель применения в предоперационном периоде регионарной химиотерапии - возможность уничтожения микрометастазов, а также уменьшение массы опухоли, что облегчает последующее выполнение резекции. Поскольку опухолевая ткань кровоснабжается в основном из печёночной артерии, целесообразным представляется внутриартериальный путь введения химиопрепаратов. Однако доказано, что предоперационная химиотерапия не улучшает отдалённые результаты. Поэтому при резектабельных опухолях печени этот вид лечения в настоящее время не считается необходимым ни в виде регионарной внутриартериальной, ни в виде системной химиотерапии.
Предоперационная химиотерапия в любом из вариантов показана лишь при неоперабельных опухолях печени в целях уменьшения их объёма и перевода в резектабельное состояние. Однозначного суждения о целесообразности послеоперационной химиотерапии при радикальной резекции печени по поводу гепатоцеллюлярного рака нет. Данный вопрос требует дальнейшего изучения.
Трансплантация печени выполняется при гепатоцеллюлярном раке на фоне выраженного цирроза и невозможности выполнить резекцию из-за низких функциональных резервов печени. При этом лучшие отдалённые результаты отмечены при фиброламеллярной форме опухоли (более 70% больных живут 3 года).
Читайте также:





