Операция по удалению опухоли на диафрагме
Рак диафрагмы встречается редко. Описаны опухоли из эмбриональных зачатков — дизэмбриомы, возможность развития которых объясняется сложным эмбриогенезом диафрагмы, формирующейся из нескольких зачатков в тесной связи с развитием прилежащих органов. Это органоидные тератомы, в частности аденома из ткани надпочечника и печени.
Чаще развиваются саркомы: фибросаркомы, фибромиосаркомы, миосаркомы (опухоль из миобластов), рабдомиосаркомы, круглоклеточные, эндотелиальные, недифференцированные саркомы. Описаны злокачественные фиброангиоэндотелиомы, гемангиоэндотелиомы, гемангиоперицитомы, мезотелиомы и синовиомы диафрагмы. Вторичные злокачественные опухоли имеют ту же гистологию, что и опухоли, из которых они исходят, и встречаются довольно часто.
Симптомы рака диафрагмы
Проявления опухолей диафрагмы зависят от размера и локализации, связаны со сдавлением прилежащих органов. При больших опухолях бывают выражены симптомы со стороны грудной клетки (смещение сердца, сдавление легкого). Больные отмечают тяжесть в грудной клетке, одышку (при больших опухолях — в покое), кашель. Симптомы вторичных злокачественных новообразований также зависят от локализации основного патологического процесса.
Все указанные симптомы не являются характерными именно для опухолей диафрагмы, которые удается диагностировать только при рентгенологическом исследовании.
Тень опухоли или кисты правого купола обычно сливается с печенью и средостением, поэтому необходимо установить, относится ли образование к диафрагме или же лишь расположено рядом с ней в грудной полости. Для дифференцирования с опухолями легкого определенное вспомогательное значение имеют бронхография, бронхоскопия, томография, ангиопульмонография; с аналогичными заболеваниями средостения — пневмомедиастинография; с дивертикулами и опухолями пищевода и кардии — контрастное исследование этих органов; с опухолями печени и селезенки — спленопортография; с опухолями почек — пиелография. Еще труднее диагностировать злокачественные опухоли, инфильтрирующие диафрагму. При этом видны лишь утолщение и легкая деформация купола, причем опухоль часто маскируется сопутствующим плевритом.
Таким образом, диагноз рака диафрагмы представляет значительные трудности и нередко устанавливается лишь на операции, а характер опухоли удается выяснить только после гистологического исследования.
Лечение рака диафрагмы
Оперировать рак диафрагмы следует под эндотрахеальным наркозом с применением миорелаксантов, через трансторакальный разрез в седьмом — девятом межреберье с пересечением ребер. Такой доступ не только позволяет радикально удалить опухоль диафрагмы, но и выполнить при ошибке в диагнозе операцию по поводу любого заболевания. Для подхода к переднему отделу диафрагмы удобнее оперировать через седьмое, к заднему — через восьмое — девятое межреберье.
Первичные опухоли удаляют либо по типу вылущения, либо, чаще, с резекцией прилежащей диафрагмы. Образующиеся дефекты ушивают отдельными швами. При особо злокачественных новообразованиях производят обширную резекцию. Ушить дефект диафрагмы не всегда удается и лучше применять аллопластические методы. Это позволяет более широко резецировать диафрагму, не боясь трудностей в закрытии образующегося дефекта, что повышает радикальность операции при раке диафрагмы. Для этой цели наиболее пригодны лоскуты из капрона или тефлона; применение губки из поливинилалкоголя (айвалона) менее целесообразно в связи с большой ее эластичностью и угрозой растяжения и даже разрыва. Специально выкроенный лоскут ткани из тефлона или капрона, пропитанный раствором антибиотиков, подшивают к диафрагме отдельными обычными или П-образными швами, чтобы края протеза заходили приблизительно на 1,5 см под край диафрагмы. Это повышает прочность соединения, обеспечивает плотное прилегание протеза и создает наиболее благоприятные условия для его приживления. Применение для закрытия больших дефектов сложных аутопластических методов — мышечных лоскутов на ножке, мышечно-надкостнично-плеврального или кожного лоскута на ножке — не оправдано из-за значительного увеличения травматичности операции у больного со злокачественным новообразованием. Большой дефект правого купола можно ликвидировать, подшивая к его краям печень.
При вторичных опухолях диафрагмы, переходящих на нее с грудной стенки (саркомы) и прилежащих органов (чаще при раке кардиального отдела желудка или опухоли легкого), резекцию диафрагмы производят по тем же правилам, дополняя ею основное вмешательство.
Опухоли диафрагмы – это группа доброкачественных и злокачественных новообразований первичного или метастатического характера, локализованных в области грудобрюшной преграды. Неоплазии небольшого размера протекают скрыто. При крупных опухолях появляются признаки сдавления лёгкого, смещения средостения, симптомы хронической гипоксии, абдоминальные боли. Заболевание обнаруживается с помощью методов лучевой диагностики, характер новообразования подтверждается гистологическим исследованием операционного материала. Неоплазия удаляется хирургическим путём. При необходимости выполняется последующая пластика диафрагмы.
МКБ-10
- Причины
- Патогенез
- Классификация
- Симптомы опухолей диафрагмы
- Осложнения
- Диагностика
- Лечение опухолей диафрагмы
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Первичные опухоли диафрагмы являются очень редкой патологией. На сегодняшний день в медицинской литературе описано не более 200 случаев заболевания. У 50-60% пациентов неоплазии имеют доброкачественный характер, чаще всего встречаются кисты или липомы. Злокачественные новообразования представлены преимущественно саркомами (рабдомиосаркома, фибросаркома). Среди больных отмечается незначительное преобладание женщин, возраст пациентов колеблется от 40 до 80 лет. Правый и левый купола диафрагмы поражаются одинаково часто. Приблизительно у 15% больных с доброкачественной патологией, у 11% пациентов со злокачественными образованиями клинические проявления отсутствуют. Метастатические поражения диафрагмы встречаются чаще первичных.

Причины
Новообразования грудобрюшной преграды могут быть первичными и вторичными (метастатическими). Метастатические опухоли возникают в результате гематогенного, лимфогенного или контактного распространения онкологической патологии органов брюшной и грудной полостей, строение таких опухолей определяется особенностями первичного процесса. Наиболее часто прорастают диафрагму или метастазируют в этот орган неоплазии лёгких, плевры, рёбер, грудной стенки, желудка. Иногда в области диафрагмы обнаруживаются эндометриомы.
Первичные опухоли развиваются непосредственно в грудобрюшной преграде. Причина их появления до конца не изучена. Определённую роль в неопластическом процессе играет ионизирующее излучение. В работах специалистов в сфере онкологии описаны случаи возникновения новообразований диафрагмы у пациентов, получавших лучевую терапию по иному поводу в детском возрасте. Другими предпосылками к опухолевому росту являются травмы с последующим образованием соединительнотканных рубцов, воздействие некоторых химических веществ.
Патогенез
Патогенез неопластического роста отражает этапы формирования опухоли любого органа или ткани. Канцероген взаимодействует с генами, контролирующими рост и деление клеток (протоонкогенами). Происходит изменение генома клетки – она приобретает способность к бесконечному делению. Под действием канцерогена подавляются функции белков, тормозящих пролиферацию изменённых клеток (онкосупрессоров). Клетка утрачивает способность к полному созреванию (дифференцировке), активно и бесконтрольно делится, образуется опухолевый узел.
Степень злокачественности неоплазии зависит от её зрелости. Низкодифференцированные новообразования ведут себя наиболее агрессивно. Они быстро растут, прорастают органы, разрушая нормальные окружающие ткани (инвазивный рост). От основного опухолевого узла отделяются изменённые клетки и с током крови или лимфы разносятся по организму (метастазирование). Бластома имплантационным способом распространяется на соседние органы. Доброкачественные опухоли представлены зрелыми высокодифференцированными клетками, неспособны к инвазивному росту и метастазированию, по мере увеличения в размерах могут сдавливать соседние органы.
Классификация
Опухоли диафрагмы делятся на первичные и вторичные, доброкачественные и злокачественные. В зависимости от тканей, из которых они исходят, различают мышечные, соединительнотканные, мезотелиальные, ангиогенные, неврогенные и смешанные новообразования. Среди доброкачественных неоплазий чаще выявляются липомы, фибромы и фибролипомы, реже лейомиомы, хондромы, лейомиофибромы, фибролимфангиомы, очень редко дизэмбриомы. Наиболее распространёнными злокачественными опухолями являются саркомы (миосаркома, хондросаркома, рабдомиосаркома, липосаркома).
Злокачественные неоплазии систематизируются по стандартной системе TNM, в которой отражается распространённость процесса в пределах органа (Т), метастазирование в регионарные лимфатические узлы (N) и отдалённые органы (М). По данной системе опухоли диафрагмы классифицируются дважды. Первый раз распространённость онкологической патологии оценивается по клиническим данным, во второй – по гистологическим (система рТNM). По результатам патоморфологического исследования резецированного материала определяется степень злокачественности новообразования. На основании данных системы TNM устанавливаются стадии онкологического процесса.
Симптомы опухолей диафрагмы
При локализации опухоли в левом куполе диафрагмы присутствуют проявления диспепсии. Пациента беспокоит тяжесть в эпигастрии, ощущение переполнения желудка. После еды возникают мучительные боли в животе, изжога, тошнота, рвота. При сдавлении пищевода отмечаются нарушения глотания. Для злокачественных поражений диафрагмы опухолевой природы характерна повышенная утомляемость, нарушение аппетита, прогрессирующее снижение массы тела и другие симптомы общей раковой интоксикации.
Осложнения
Диагностика
Неоплазии диафрагмы тяжело поддаются диагностике. Симптомы опухоли часто скрываются под маской лёгочной, сердечной патологии, заболеваний желудочно-кишечного тракта. Патогномоничные признаки неопроцесса отсутствуют. В диагностическом поиске принимают участие пульмонологи, кардиологи, гастроэнтерологи, окончательный диагноз устанавливается врачом-онкологом. Применяются следующие методы:
- Физикальное обследование. При осмотре пациента с запущенной формой онкологического процесса можно обнаружить акроцианоз или диффузную синюшность кожных покровов, расширение и избыточное ветвление подкожных вен груди. При прорастании плевры наблюдается отставание половины грудной клетки в акте дыхания. Выявляются перкуторные и аускультативные симптомы смещения средостения, притупление лёгочного звука, ослабление дыхания в нижних отделах на стороне поражения. У пациентов с небольшими бластомами и доброкачественными процессами объективные изменения отсутствуют.
- Лучевые исследования. Являются основными методами диагностики диафрагмальных опухолей. Выполняется рентгенография и КТ брюшной полости, грудной клетки. При необходимости применяется контрастирование. Методики позволяют визуализировать округлые или неправильной формы образования, связанные с контуром диафрагмы, определить их размеры, предположить доброкачественный или злокачественный характер процесса, определить признаки инвазии соседних органов и наличие метастазов в лимфатических узлах.
- Гистологическое исследование. На основании изучения полученного во время операции материала устанавливается окончательный диагноз. С помощью данного метода уточняется степень дифференцировки неопластических клеток, происхождение опухоли. При необходимости дополнительно назначаются молекулярно-генетические и иммуногистохимические исследования новообразования.
- Методы функциональной диагностики. Имеют второстепенное значение. На электрокардиограмме нередко обнаруживается отклонение сердечной оси, присутствуют нарушения ритма и проводимости. При исследовании функции внешнего дыхания выявляются рестриктивные нарушения вентиляционной способности – уменьшение жизненной ёмкости лёгких. Наличие подобных отклонений косвенно указывает на возможность неопластического процесса, но не позволяют верифицировать диагноз.
Опухоли диафрагмы необходимо дифференцировать с новообразованиями органов забрюшинного пространства, грудной и брюшной полостей. В ходе дифференциальной диагностики используются специальные методы лучевого исследования (пневмомедиастинография, бронхография, ангиопульмонография, спленопортография, пиелография). Для исключения бронхогенного рака выполняется бронхоскопия. В неясных случаях производится видеоторакоскопическое исследование.
Лечение опухолей диафрагмы
После установления диагноза выполняется хирургическое вмешательство трансторакальным доступом. Доброкачественные образования вылущивают, возникший дефект ушивают. При злокачественном неопроцессе осуществляют резекцию опухоли в пределах здоровых тканей. Для ликвидации дефекта прибегают к аллопластике диафрагмы лоскутами капрона или тефлона. После удаления опухоли правого купола края отверстия иногда подшивают к печени. Вопрос о назначении послеоперационной лучевой или химиотерапии решается с учетом результатов патоморфологического исследования новообразования.
Прогноз и профилактика
Прогноз при доброкачественных образованиях диафрагмы благоприятный. После удаления неоплазии функции подвергавшегося компрессии органа полностью восстанавливаются. Рецидивы встречаются редко. При злокачественной патологии исход зависит от стадии процесса, природы новообразования и степени дифференцировки опухоли. Выживаемость значительно повышается при выявлении онкологического заболевания на ранних стадиях. Метастазы в диафрагму протекают неблагоприятно. Профилактика включает здоровый образ жизни, использование индивидуальных средств защиты при работе с источниками радиации и химическими агентами, регулярные профилактические медицинские осмотры.
Первичные опухоли диафрагмы представляют исключительную редкость. Для диагностики кист и опухолей диафрагмы применяется торакоскопия, а также рентгенологическое исследование на фоне искусственного пневмоперито-неума и пневмоторакса. Уточнение диагноза, однако, как правило, производится во время опе-
ративного вмешательства. Это объясняется тем, что опухоль диафрагмы приходится дифференцировать от ряда заболеваний (грыжа диафрагмы, киста перикарда, опухоль легкого и т. д.). Следовательно, торакоТомия абсолютно показана.
Кисты идоброкачественные опухолимогут быть сравнительно легко удалены, так как они только рыхло связаны с диафрагмой. После удаления опухоли ее ложе в диафрагме должно быть ушито, так как это место обычно истончено и может произойти перфорация или релаксация патологически измененной части диафрагмы.Злокачественные опухолирезецируют в пределах здоровых тканей диафрагмы, а образовавшийся значительный дефект замещают, как это описано в соответствующем разделе, обычной пластикой синтетической тканью (см. стр. 292).
Особенности хирургии диафрагмы у новорожденных и грудных детей
У новорожденных и грудных детей имеется некоторое отличие в отношении тактики вмешательства при врожденных грыжах диафрагмы, выбора времени для операции и устранения этой аномалии в более позднем возрасте. Различия в отношении сроков вмешательства объясняются тем, что у новорожденных грыжи диафрагмы приводят к тяжелым нарушениям дыхания, в связи с чем возникает необходимость неотложного оперативного вмешательства.Устранение сопутствующих аномалий и репозиция проникших в грудную полость органов малой по объему брюшной полости у новорожденных и грудных детей производятся различно и отличаются от таковых у больных детского возраста и взрослых.
У новорожденных выпадениеорганов брюшной полости происходит обычнобез грыжевого мешка. Наличие грыжевого мешка встречается крайне редко. Выпадение внутренностей (грыжа) в 9/10 всех случаев локализуется на левой стороне. Значительно реже эта патология встречается справа, и еще более редко такую аномалию находят с двух сторон. Вследствие тяжелых нарушений дыхательной функции многие из новорожденных погибают еще до того, как принимается решение об оперативном вмешательстве.
При левостороннем выпадениивнутренностей заполненные газом петли кишки располагаются в большей части левой половины грудной клетки. Левое легкое сдавливается и может быть даже гипоплазировано. Оттесненные в правую половину груди сердце и средостение сдавливают и правое легкое.
Рентгенологическое исследование с пассажем контрастного вещества через желудок и кишечник производить не следует,так как оно значительно ухудшает и без того тяжелое состояние новорожденного. Из аномалий, сопутствующих
этой патологии, чаще всего встречаются различные перекруты (см. стр. 475).
У новорожденныхнеотложное вмешательство должно производиться при тяжелых расстройствах дыхания, связанных с левосторонним дефектом диафрагмы. Наиболее удобным для оперативного вмешательства доступом являетсяширокая парамедианная ила субкостальная лапаротомия. Левая доля печени отводится, что позволяет более удобно оперировать в области дефекта диафрагмы. Выпавшие в грудную полость органы низводят обратно вниз, в брюшную полость или кпереди, через операционный разрез. Тем самым становится более доступным дефект диафрагмы. Отверстие в диафрагме зашивается узловатыми матрацными швами. Перед завязыванием последнего шва через отверстие диафрагмы заводят дренаж, который выводят из брюшной полости через отдельный разрез в брюшной стенке. Дренаж присоединяют к отсосу. В тех случаях, когда дефект диафрагмы больших размеров или полностью отсутствует задняя часть диафрагмы, производят пластику лоскутом на ножке, который формируют из мышц брюшной стенки.
При операции по поводу грыжи диафрагмы у новорожденного может случиться, что низведенные из грудной клетки органы не вмещаются в брюшную полость. В таком случае приходится помещать органы брюшной полостив синтетический мешок, создавая искусственный грыжевой мешоки по возможности закрывая его мобилизованной кожей (см. стр. 337).Эта искусственно созданная грыжа передней стенки живота подлежит в последующем пластическому оперативному устранению.
Более редко встречающийсяправосторонний дефект диафрагмы уноворожденного обычно не сопровождается симптомами, первые признаки этой патологии появляются лишь в грудном возрасте. В подобных случаях оперативное вмешательство рекомендуется производить изторакального доступа,который позволяет легче достигнуть правой части диафрагмы, и разъединить уже сращенные кишку и легкие. Отверстие в диафрагме и при торакальном доступе закрывается матрацными швами.
Врожденная грыжа пищеводного отверстия диафрагмы у новорожденного не сопровождается тяжелыми симптомами. Может отмечаться более или менее выраженная рвота во время и после кормления. В таких случаях временно по-
казано консервативное лечение. Во время и после кормления новрожденного держат в вертикальном положении и дают противорвотные средства. Если такого рода консервативное лечение новорожденного безрезультатно и его состояние вследствие рефлюксного эзофагита ухудшается, может быть показано оперативное вмешательство. Это вмешательство, особенно если установлен брахиазофагус, легче производить из торакального доступа по Allison(см. стр. 295).
Релаксация диафраагмы уноворожденного может привести к рецидивирующим расстройствам дыхания и частым пневмониям, а также перегибу желудка. Оперативное вмешательство показано в тех случаях, когда эти осложнения начинают повторяться. Вмешательство производится из абдоминального или торакального доступа, при этом создается одинарная или двойнаядуплика-турадиафрагмы, состоящая из тонкой соединительной ткани (см. стр. 304).
Резекции париетально-диафрагмального типа можно отнести к периферическим, в отличии от остальных типов резекций внелегочных анатомических образований и органов грудной полости. Они включают резекции мягких тканей грудной стенки: париетальной плевры, мышц, внутригрудной фасции, а также ребер и диафрагмы.
В клинике резекции этого типа выполнены у 89 больных, что составило 14,7% от общего числа всех пациентов, которым производились комбинированные операции. В отличии от других типов резекций они чаще быват одиночными. Резекции париетально-диафрагмального типа выполняются в большинстве случаев при периферической форме рака легкого и чаще, чем при других типах комбинированных операций, могут быть выполнены в объеме расширенной комбинированной лобэктомии. Так, из 89 оперированных больных у 64 (71,9%) были выполнены пневмонэктомии, частичные резекции легких — 25 (28,1%). Резекции грудной стенки выполнены у 66 больных, из них у 32 — с фрагментами ребер, резекции участка стенки пищевода — у 23.
Прорастание периферической опухоли легкого в грудную стенку требует выполнения его расширенной резекции в комбинации с пораженными участками париетальной плевры, внутригрудной фасции и ребрами. Иногда у таких больных метастазов рака обнаружить не удается не только в лимфатических узлах средостения, но и в прикорневых узлах. Чаще всего опухоль прорастает задние отделы грудной клетки. Для того, чтобы операция была выполнена абластично, вовлеченный в опухолевый процесс участок грудной стенки, целесообразно иссекать вместе с легким единым блоком, без нарушения целостности самой опухоли. При выполнении комбинированной операции такого типа вначале необходимо обработать элементы корня легкого.
После пересечения сосудов и бронха легкое остается фиксированным лишь в той части, где опухоль прорастает в грудную стенку. Париетальную плевру, фасцию и мышцы грудной стенки отслаивают в пределах здоровых тканей и достигают поверхности соответствующих ребер. Если имеется их поражение опухолевой тканью, ребра последовательно пересекают кзади (у позвоночника) и кпереди от опухоли, на удалении 5—см от видимых границ ее роста. Для того, чтобы удалить опухоль в пределах здоровых тканей, следует резецировать помимо явно пораженных участков ребер, также и фрагменты соседних с ними: по одному выше и ниже. Как правило, приходится резецировать фрагменты 3— ребер.
При опухоли Пэнкоста быстрее всего прорастает ее боковая поверхность, т.е. область 1,2, иногда 3 ребер. Близость подключичных сосудов и образований плечевого нервного сплетения требует осторожной и тщательной их препаровки. К резекции верхних ребер можно приступать только после полной идентификации элементов сосудисто-нервного пучка.
Прорастание опухоли в купол плевры и в плечевое сплетение, в стенки подключичных сосудов, а также в боковые поверхности позвонков и в межпозвоночные пространства делают операцию технически невыполнимой.
Резекция диафрагмы при ограниченном прорастании в нее опухоли без поражения органов брюшной полости операция технически несложная. Значительная пластичность диафрагмы дает возможность иссекать большие ее участки до 10 х 15 см, закрывая образовавшийся дефект с помощью швов.
В пределах неизменных тканей мышечную часть диафрагмы прошивают двумя П-образными швами, подтягивают в плевральную полость и рассекают. Затем последовательно, в пределах здоровых тканей, иссекают пораженную часть диафрагмы. Края ее дефекта сводят с помощью провизорных швов-держалок и накладывают одно-двухрядный шов. При этом необходимо обязательно убедиться в полной герметичности вновь сформированной грудобрюшной преграды, в отсутствии дефекта для поступления плеврального экссудата в брюшную полость.
У больных после резекции значительных по размерам участков диафрагмы целесообразно укрепить ее швы каким-либо аллопластическим материалом. В клинике, с этой целью использовали болгарскую антибактериальную поликапромидную сетку "Ампоксен", вшивая ее поверх швов диафрагмы со стороны плевральной полости.
Бисенков Л.Н., Гришаков С.В., Шалаев С.А.
2-ая кафедра клинической хирургии
(заведующий - профессор Тимофей Павлович Макаренко)
института усовершенствования врачей на базе Центральной клинической больницы
МПС (начальник В. Н. Захарченко), Москва, Россия.
Публикация посвящена памяти Василия Дмитриевича Стоногина (1933-2005).
Больной К., 41 года, поступил в клинику 3/VII 1968 г. с жалобами на боли в правой половине грудной клетки, слабость, похудание, периодическое повышение температуры. Болен около 2 месяцев, когда возникли указанные выше явления. Был обследован по месту жительства, а затем направлен в клинику. Анамнез не отягощен. Родители живы, здоровы, опухолевыми заболеваниями в семье никто не болел.
При поступлении общее состояние больного удовлетворительное, питание резко понижено, при росте 180 см вес 58кг. Периферические лимфатические узлы не пальпируются. Перкуторно над обоими лёгкими звук ясный лёгочный. Аускультативно дыхание везикулярное, несколько ослабленное в задне-базальных отделах справа, хрипов нет. ЭКГ без отклонений от нормы. В крови: НЬ10,5%, эр3540000, цветной показатель 0,9; л. 11100, п4%, с65%, лимф27%, мон4%; СОЭ 70мм/час. В моче: белок 0,03%, эритроцитов 5-7 в поле зрения. В крови сахара 106мг%, белка 7,2г%, билирубина 0,360-0,200-0,160мг%, остаточного азота 17мг%, содержание электролитов (К, Са, Na) в плазме, эритроцитах и моче без отклонений от нормы.
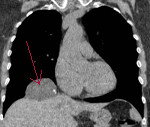
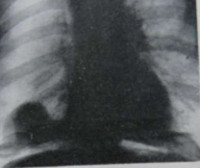
Рентгенологически в задне-базальном сегменте нижней доли правого легкого определяется шаровидное образование размером 3*3*3 см с неровными тяжистыми контурами, дистальнее этого образования над куполом диафрагмы уплотнение легочной ткани треугольной формы, обусловленное, по-видимому, ателектазом легочной ткани (рис. 1 и 2). Было высказано предположение о периферическом раке нижней доли с субсегментарным ателектазом. При бронхоскопии дополнительных данных не получено, кровоточивость слизистой оболочки бронхов повышена. После соответствующей подготовки 24.VII.1968г. произведена операция (профессор Т. П. Макаренко). В нижней доле правого легкого в задне-базальном сегменте имеется опухоль округлой формы, 3-4 см в диаметре. Нижняя доля в области опухоли интимно сращена с диафрагмой. После выделения нижней доли из сращений обнаружено, что опухоль лёгкого прорастает в диафрагму. В последней имеется опухолевый узел, превышающий по размерам опухоль в лёгком (примерно 9*7*7см), этот узел ограниченно подвижен. Верхняя и средняя доли не изменены, в корне лёгкого лимфатические узлы не определяются.

Рисунок 1 - Прямая рентгенограмма грудной клетки больного К. Справа в нижнем лёгочном поле видна дополнительная тень.

Рисунок 2 – Боковая рентгенограмма того же больного. Дистальнее шаровидного образования в лёгком над куполом диафрагмы имеется другая дополнительная тень, сливающаяся с первой.
Решено произвести удаление нижней доли легкого и иссечь опухоль диафрагмы в пределах здоровых тканей. Была выделена нижняя легочная вена, дважды перевязана, прошита и пересечена, аналогичным образом обработана нижнедолевая легочная артерия. На нижнедолевой бронх наложен аппарат УКЛ-40. Сделана плевризация культи бронха листками париетальной плевры.
Затем методически, в пределах здоровых тканей, иссечена опухоль в диафрагме. В области купола диафрагмы, на участке 4-5см, опухоль прорастала в капсулу печени, опухоль иссечена вместе с небольшим участком печени. После удаления всего опухолевого конгломерата в диафрагме образовался дефект размером 15*12 см, стянуть края которого не представлялось возможным. Был выкроен соответствующей формы и размеров лоскут лавсана (сеточки), подшит к краям диафрагмы. К дефекту в печени подведен биологический тампон, уложенный под лоскут из лавсана. В плевральную полость засыпано 1000 000ЕД пенициллина и 1г стрептомицина. В восьмое межреберье по среднеключичной и по задней подмышечной линии в плевральную полость введены резиновые дренажи.
Послеоперационный период протекал без осложнений. Дренажи удалены через 48 часов после операции. При последующих плевральных пункциях жидкость получить не удавалось. Со стороны брюшной полости осложнений не наблюдалось. 28.VIII.1968г. в удовлетворительном состоянии больной выписан па амбулаторное наблюдение по месту жительства.
Гистологическое заключение: в лёгком и в диафрагме картина рака солидного типа.
Больной осмотрен через б месяцев после операции. Чувствует себя вполне удовлетворительно, приступил к работе (диспетчер), прибавил в весе 12 кг.
Нам хотелось подчеркнуть следующие моменты: во-первых, возможность подобного рода операций в тех случаях, когда поражено не только лёгкое, но и диафрагма и печень; во-вторых, несмотря па отрицательное отношение большинства хирургов к существующим аллопластическим материалам, всё же в случаях безвыходного положения, какое создалось в нашем наблюдении, можно прибегнуть к ним для закрытия дефекта в диафрагме, если собственных тканей недостаточно, чтобы, стянув края, закрыть дефект, ибо сложные аутопластические методы вряд ли целесообразны в таких ситуациях.
Данные об авторе:

Василий Дмитриевич Стоногин – доцент 2-й кафедры клинической хирургии ЦОЛИУв, заведующий учебной частью кафедры, кандидат медицинских наук. E-mail: svas70@mail.ru
Восстановление текста, компьютерная графика - Сергей Васильевич Стоногин.
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Работа защищена Федеральным законом РФ о защите авторских прав.
Читайте также:

