Операция опухоли в грудной клетке
Доброкачественными опухолями называют такие новообразования, которые не имеют в своей структуре раковых клеток и не являются смертельными для человека. Тем не менее, всегда существует определенный риск развития доброкачественной опухоли в злокачественную. Чтобы избежать негативных последствий, врачи рекомендуют удалять опухоли, находящиеся в пределах доступа хирурга. Опухоли, расположенные в труднодоступных для резекции участках, должны постоянно наблюдаться с учетом динамики роста и возможного изменения структуры.
Средостение. Опухоли средостения, их локализация и причины
Средостение — это область груди, отделяющая легкие от остальных органов грудной клетки. Она окружена грудиной спереди и окружает легкие с передней стороны и со стороны позвоночника. Область средостения состоит из сердца, аорты, пищевода, трахеи и тимуса.
Опухоли средостения состоят в основном из половых клеток и развиваются чаще всего в тимусе, нервной, лимфатической и мезенхимальной ткани. Встречаются такие новообразования довольно редко, средний возраст пациентов составляет 30-50 лет, однако теоретически появиться такие опухоли могут в любом возрасте. Им подвержена любая ткань в пределах средостения или проходящая через грудную клетку.
Что вызывает опухоли средостения?
Опухоли средней части, например, бронхогенная киста, имеют доброкачественную структуру и респираторное происхождение, то есть формируются из клеток трахей, бронхов. Киста перикарда образуется при чрезмерном росте тканей перикарда, а трахеальные опухоли и сосудистые нарушения вызваны либо генетической предрасположенностью, либо неблагоприятными внешними условиями, неправильным питанием.
Симптомы, диагностика, лечение опухолей средостения
Около 40% людей с опухолями средостения не имеют никаких симптомов. Большинство новообразований часто обнаруживаются на рентгене грудной клетки, выполняемом по другой причине. Если симптомы всё же присутствуют, они вызваны сжатием окружающих органов и тканей, например спинного мозга, сердца или перикарда (внутренняя оболочка сердца).
- кашель, сбивчивое дыхание;
- боль в груди, лихорадка;
- озноб, ночная потливость;
- кашель с кровью;
- охриплость;
- необъяснимая потеря веса;
- лимфаденопатия (опухшие или чувствительные лимфатические узлы);
- стридор (частое, шумное дыхание, которое может быть признаком дыхательной обструкции, особенно в трахее или гортани).
Диагностика опухолей органов грудной клетки
Для выявления опухолей органов грудной клетки используют такие виды тестов:
- рентгенограмма грудной клетки;
- компьютерная томография (КТ) или КТ-управляемая биопсия;
- медиастиноскопия с биопсией (проводится под общим наркозом, через небольшой разрез под грудной костью вставляется трубка, далее берется образец ткани для определения того, есть ли раковые клетки). Медиастиноскопия с биопсией позволяет врачам точно диагностировать от 80 до 90% опухолей средней части средостения, и от 95 до 100% опухолей передней части.
Лечение опухолей средостения
Лечение опухолей средостения зависит от типа опухоли и ее расположения. Все злокачественные опухоли лечат при помощи облучения, химиотерапии и менее известных методов, например, торакоскопии, медиастиноскопии и торакотомии.
Доброкачественные опухоли должны наблюдаться с целью отслеживания их динамики роста и увеличения. По сравнению с пациентами, подвергающимися традиционной хирургической процедуре удаления опухоли, пациенты с минимально инвазивным вмешательством, таким как торакоскопия или медиастиноскопия, испытывают умеренные послеоперационные боли, меньше находятся в больнице, быстрее восстанавливаются и возвращаются к привычной жизни и работе.
Возможные осложнения малоинвазивного хирургического лечения:
- повреждение окружающих тканей, в том числе сердца, перикарда или спинного мозга;
- плевральной выпот (сбор жидкости между тонкими слоями ткани оболочки легких и стенки грудной полости, или плевры);
- послеоперационные инфекции или кровотечения.
Доброкачественные опухоли сердца – виды, симптомы
Первичные доброкачественные опухоли сердца встречаются крайне редко, примерно в 0,002-0,15% случаев всех опухолей грудной клетки. И хотя онкологической угрозы они не несут, большинство из них приводит к нарушению сердечной функции (например, застойной сердечной недостаточности).
Наиболее распространенной первичной доброкачественной опухолью является миксома.
Миксомы имеют размеры от 1 до 20 см, подавляющее большинство образуется в левом предсердии, а остальные – в правом.
Также распространены рабдомиомы, поражающие желудочки, фибромы, которые образуются на межжелудочковых перегородках или стенках сердца. В отличие от миксом, эмболизация рабдомиом происходит редко.
Рост опухоли может сместить митральный и аортальный клапан и привести к клапанной регургитации или стенозу. Миксомы являются наиболее распространенными опухолями у взрослых. А рабдомиома чаще встречается у детей (вторая по частоте доброкачественная опухоль сердца).
Симптомы доброкачественных опухолей сердца:
- аритмия;
- боли в сердце.
Опухоль может не причинять никакого беспокойства, прогноз благоприятен. После полного иссечения риск внезапной смерти или другое опасное состояние исключаются. Неполные резекции могут привести к повторному образованию опухоли.
Доброкачественные опухоли тимуса (вилочковой железы)
Самые распространенные новообразования тимуса, или вилочковой железы, — это кисты. Другие опухоли: тимомы, нейроэндокринные опухоли тимуса, вилочковая гиперплазия, тимолипома.
Тимомы образуются из коры или из мозговых эпителиальных клеток тимуса. Они считаются гистологически доброкачественными опухолями даже при клинически инвазивном поведении.
Карциномы тимуса образуются из коры или из мозговых эпителиальных клеток тимуса. Они считаются гистологически доброкачественными опухолями даже при клинически инвазивном поведении.
Карциномы тимуса имеют эпителиальное происхождение, встречаются редко и имеют низкий злокачественный потенциал. Первичные нейроэндокринные опухоли тимуса крайне редки. Считается, что они образуются из эндодермальной ткани.
Гиперплазия тимуса — это аномальный рост тканей вилочковой железы. Фолликулярная или лимфоидная гиперплазия тимуса часто встречается при аутоиммунных нарушениях, особенно у пациентов с миастенией. Обширная или идиопатическая гиперплазия характеризуется увеличением тимуса и доброкачественной пролиферацией. Гиперплазия может возникать у детей в ответ на прекращение химиотерапевтического лечения болезни Ходжкина или других злокачественных опухолей.
Кисты вилочковой железы могут быть врожденными и приобретенными. Врожденные кисты тонкостенны и появляются в основном на поверхностных слоях ткани железы. Приобретенные кисты могут появляться в тимусе в связи с тимомой или другими опухолевыми или воспалительными процессами переднего средостения.
Тимолипома — доброкачественное новообразование, состоящее из хорошо дифференцированной жировой ткани. Из-за большой доли жировой ткани в этих опухолях они иногда классифицируются как мезенхимальные опухоли.
Существует и ряд новообразований, имеющих отношение к тимусу, но появляющихся за ее пределами. Это гарматомная тимома, карцинома тимуса и эпителиальная опухоль.
Боль в животе, вздутие и рвота могут быть признаками предынфарктного состояния
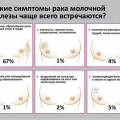
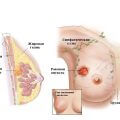
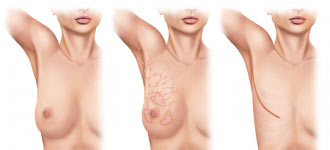
Опухоль молочной железы является одной из распространённых болезней среди женского населения. Но не стоит сразу поднимать панику. В первую очередь необходима консультация специалиста, который правильно поставит диагноз, определит степень развития заболевания и назначит адекватное лечение. Операция по удалению опухоли молочной железы – это метод лечения не только злокачественных, но и доброкачественных образований. Хирургическое вмешательство предполагает удаление жировых тканей с лимфоузлами, а в некоторых случаях и грудных мышц.
Операция по удалению опухоли молочной железы
На данный момент врачами используются два основных типа хирургического вмешательства:
- Органосохраняющая операция — предусматривает удаление опухоли молочной железы у женщин с небольшой частью здоровой ткани, при этом орган, в котором развивается опухоль, сохраняется. Как правило, пациентки затем назначается лучевая терапия.
- Мастэктомия – это операция, при которой с целью лечения рака удаляется весь пораженный орган. Различается полная (простая) и модифицированная радикальная мастэктомия. В первом случае удаляется весь орган вместе с соском. В этом случае риск перерождения клеток в раковые очень низок. Во втором случае удаляются также подмышечные лимфатические узлы и выстилку над грудными мышцами. Такое вмешательство необходимо, когда раковые клетки обнаружены более чем в одном участке, или когда опухоль очень велика относительно размера молочной железы.
При правильном подходе с точки зрения рисков возникновения рецидива и органосохраняющие операции с последующей лучевой терапией и мастэктомия не отличаются. Однако с косметической точки зрения первый тип хирургического вмешательства обладает явными преимуществами.
Только после проведения диагностики, которая включает в себя общие и биохимические анализы крови и мочи, УЗИ, ЭКГ, обязательную биопсию и маммографию, врач принимает решение о хирургическом вмешательстве. Большинство профессионалов настаивают на проведении операции, если существуют следующие осложнения:
- Есть воспаление;
- У женщины наблюдаются многочисленные опухоли;
- Есть гнойное поражение органа;
- Имеется множественное кисты;
- Прогрессирующий рак молочной железы и другое.
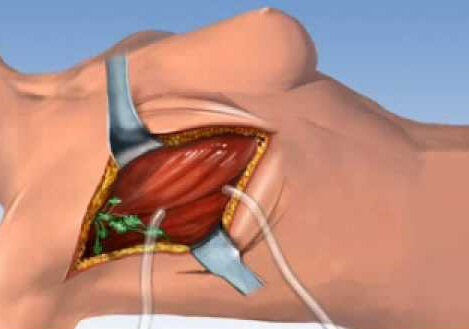
Подготовка начинается за две недели: обязательно нужно прекратить прием антикоагулянтов; антибиотики водятся в организм накануне вечером, за 12 часов не рекомендуется есть, и необходимо очистить кишечник. Пациенту вводят общий наркоз в специализированной палате. Хирург наносит на кожу разметку и делает надрезы скальпелем. Постепенно отслаивается кожа от молочной железы, а затем она отделяется от мышц. После завершения этапа удаления опухоли останавливается кровотечение, устанавливается дренажная трубка, накладывается стерильная повязка.
Реабилитационный период полностью зависит от состояния организма пациентки. Через полтора часа уже разрешается ходить, однако болевые ощущения остаются на протяжении нескольких дней. Противопоказаны физические нагрузки, резкие движения, а также нельзя поднимать руки вверх. Дренаж удаляется через примерно пять суток. В течение первых дней врач контролирует скопление крови и лимфатической жидкости, а также следит за общим состоянием организма. Швы снимают на 10-12 сутки. Затем вокруг грудной клетки накладывается плотная повязка, которую нужно носить в течение месяца. Через два месяца, если нет никаких осложнений, то женщина возвращается к привычному для нее ритму жизни.
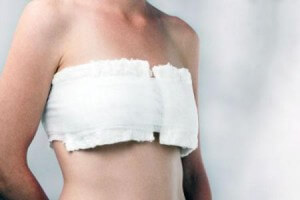
После операции по удалению опухоли молочной железы
В первые дни в области шеи и спины появляется чувство дискомфорта. Часто у пациенток наблюдается онемение рук, груди, плеч и подмышек. Но такие симптомы постепенно проходят через несколько дней. Помогает также избавиться от неприятных ощущений специальные лечебные упражнения.
В первую неделю может развиться нагноение раны, которое сопровождается покраснением кожи, отеком и повышением температуры тела. В такой ситуации необходимо сразу же известить врача, чтобы избежать дальнейших осложнений.
Если же лимфостаз образовался через несколько месяцев, то это может свидетельствовать о появление метастазов или о рецидиве. В этом случае назначается или лечение, или повторное вмешательство хирурга.
Проблемы психологического плана также встречаются у женщин в послеоперационный период: депрессия, развитие комплекса неполноценности и другое. Чтобы предотвратить такое состояние рекомендуется пройти психологическую подготовку. Седативные, антидепрессанты и психокоррекция назначаются специалистом в реабилитационный период.
![]()
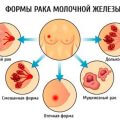
Рак молочной железы![]()
Лечение рака молочной железы![]()
Гормонотерапия при раке молочной железы![]()
Химиотерапия при раке молочной железы![]()
Опухоль молочной железы![]()
Рак молочной железы 1 стадия![]()
Рак молочной железы 2 стадии![]()
Рак молочной железы 3 стадии![]()
Рак молочной железы 4 стадии![]()
Симптомы рака молочной железы![]()
Народные методы лечения рака молочной железы
Ведущим методом лечения больных с первичными злокачественными опухолями ГС остается хирургический, иногда в комбинации с лучевой терапией. Объем резекции ГС зависит от распространенности и локализации опухоли, глубины поражения и вовлечения соседних органов и структур. Эти, и ряд других факторов (гистологическая структура, степень дифференцировки опухоли и др.), делают операции по поводу злокачественных опухолей грудной стенки нестандартными.
В большинстве публикаций освещены лишь хирургические аспекты этой проблемы, описаны различные методики оперативных вмешательств. Между тем хирургический метод лечения злокачественных опухолей ГС в сочетании с лучевой терапией до или после операции улучшает ближайшие и отдаленные результаты.
При опухолях мягких тканей ГС операция может носить изолированный характер и заключается в резекции кожи, подкожной клетчатки, соответствующих пораженных мышц, в пределах границ онкологического радикализма.
При опухолях ребер оперативное вмешательство подразумевает резекцию ГС единым блоком. Этот блок должен включать пораженные ребра с выше- и нижележащими непораженными ребрами, а также межреберные и поверхностные мышцы (рис. 4).
При опухолях рукоятки или тела грудины обычно выполняют ее резекцию, субтотальную резекцию с оставлением суставного конца, а по показаниям - стерноэктомию. Нередко в удаляемый блок тканей включают медиальные отделы одной или двух ключиц, хрящевые и костные фрагменты соответствующих ребер (рис. 5).
При опухолях лопатки выполняют ее краевую резекцию, скапулэктомию и резекцию тела лопатки с оставлением суставного конца. Эти операции производят при доброкачественной опухоли или вторичном ее вовлечении злокачественной опухолью мягких тканей (рис. 6). После краевых резекций и резекции половины тела лопатки ее функция обычно не нарушается.
Показанием к межлопаточно-грудной резекции (операция Тихова-Лимберга) служат злокачественные опухоли мягких тканей плечевого пояса с распространением в лопатку и плечевой сустав, а также опухоли лопатки с вовлечением ключицы и/или плечевого сустава (рис. 7). В блок удаляемых тканей включают лопатку, акромиальный конец ключицы, плечевой сустав с головкой плечевой кости, а также участки мышц плечевого пояса и/или их сухожилия (дельтовидная мышца, трапециевидная, широчайшая, малая грудная, короткая головка двуглавой мышцы плеча, большая и малая круглая, подостистая, поднимающая лопатку).
Если при злокачественной опухоли мягких тканей, лопатки или плеча в процесс вовлекаются отрезки ребер, выполняют радикальную межлопаточно-грудную ампутацию с резекцией ГС (рис. 8).
Дефекты кожи и мягких тканей ГС устраняют без специальных приемов пластики, так как окружающие ткани после широкой мобилизации позволяют с успехом устранить дефект и зашить рану.
Разработка новых методик формирования и перемещения пластического материала привела к интенсивному развитию современной пластической хирургии и применению единой терминологии и классификации.
В настоящее время для пластических операций на ГС наибольшее распространение в России получили силиконы, поли-2-гидроксиэтилмета-крилат, углеродные материалы и консервированная твердая мозговая оболочка. При характерном для злокачественных опухолей поражении нескольких слоев ГС с вовлечением костных (ключицы, ребер, грудины, лопатки) и прилежащих структур (плевры, перикарда, диафрагмы) необходимо использовать при закрытии образовавшегося дефекта комбинации различных полимерных материалов, местных, свободно пересаженных или перемещенных мягких тканей.
СТ. Зацепин, располагая многолетним опытом лечения около 5000 больных с костной патологией, приводит данные о 46 больных со злокачественной опухолью грудины (первичная - у 31 и метастатическая - у 15) и 48 с новообразованиями ребер. Для закрытия больших дефектов после резекции или удаления грудины автор использовал аутотрансплантаты из крыла подвздошной кости, пластины из нержавеющей стали, титана или фторопласта. Разработанная им методика укрепления трансплантата в пропил ребер и остатка грудины, а не просто прикрепления к ним, позволяет надежно фиксировать используемый материал, обеспечить его неподвижность, что в свою очередь уменьшает сроки активации больных и восстановления адекватного самостоятельного дыхания.
В качестве искусственного пластического материала для закрытия дефектов ГС, образующихся после удаления первичных злокачественных опухолей, зарубежные хирурги чаще используют марлекс, пролен, метил-метакрилат, полипролен, политетрафлюороэтилен, реже - сетку из дексона и викрила. Для восстановления дефекта мягких тканей и закрытия искусственного эндопротеза применяют местные или перемещенные мышцы.
Кожно-фасциальные лоскуты используют для ликвидации дефектов покровных тканей размером до 15 х 15 см в видимых зонах: надключичноподключичной, тела и рукоятки грудины, а мышечные трансплантаты - при пластике глубоких дефектов с обнажением сосудов и нервов подключичноподмышечной зоны, реберно-грудинного каркаса.
В случаях высокого риска гнойных осложнений при закрытии сквозных дефектов в плевральной полости и средостении применяют сальник, который перемещают в пределах сосудистой ножки или свободно.
С. Deschamps и соавт. за период с 1977 по 1992 г. провели реконструкцию каркаса ГС, применяя синтетические материалы (полипропилен, политетрафлюороэтилен), а также и пластику местными тканями у 81 (41,1%) больного, перемещенным мышечным лоскутом у 116 (58,9%), сальником у 3 (1,5%) из 197 больных, оперированных по поводу рецидивной (65) или первичной (62) злокачественной опухоли ГС, рака легкого или молочной железы с вовлечением ГС (58 больных), а также других заболеваний (12 больных).
Резекция грудины была выполнена у 46 (23,4%), ее полное удаление - у 7 (3,6%), резекция ключицы - у 8 (4,1 %), одного или более позвонков - у 4 (2,0%) больных, а у абсолютного большинства производили резекцию ребер. Среднее количество резецированных ребер - 3 (от 1 до 8). Дефекты ГС менее 5 см не восстанавливали. Аналогичная тактика использовалась и при дефектах до 10 см по задней поверхности ГС, поскольку каркасность ГС обеспечивала лопатка. Послеоперационные осложнения развились у 91 больного: дыхательные расстройства (24,4%), серома раны (7,1%), нагноение раны (4,6%), нарушение сердечного ритма (2,5%) и инфаркт миокарда (1,5%).
G.L. Walsh с соавт. приводят данные о 51 больном с первичной и рецидивной злокачественной опухолью ГС. Из них поражение грудины было у 11 , ребер - у 36, ребер и позвонков - у 4 пациентов. Комбинированное лечение проведено у 51% больных: предоперационная химиотерапия -у 22, лучевая - у 3 и химиолучевая - у 1 больного; послеоперационная химиотерапия - у 9 и химиолучевая - у 4 больных. При закрытии дефекта после резекции (у 5) или полного удаления (у 6) грудины у 10 из 11 больных были использованы синтетические протезы из метилметакрилата и пролена.
После резекции ребер у 39% больных использованы марлекс, пролен и политетрафлуороэтилен, у 22% - метилметакрилат. Для реконструкции и пластики использовали мышечные и кожно-мышечные трансплантаты с включением большой грудной, прямой мышцы живота, широчайшей мышцы спины. Среди всех оперированных только у 3 больных отмечено нагноение раны, причем у 2 из них потребовалось удаление синтетического материала. Общая 5-летняя выживаемость составила 64%.
МНИОИ им. П.А.Герцена располагает опытом хирургического и комбинированного лечения 127 больных с первичными (67) и рецидивными (60) саркомами ГС: хондро- и остеосаркома (31,5%), ангиосаркома (24,5%), нейросаркома (9,5%), фибросаркома (8,4%), миосаркома (7,5%), липосаркома (6,3%), синовиальная (6,3%) и неклассифицированная (6,3%) саркома.
А.А. Вишневский, С.С. Рудаков, Н.О. Миланов

- Удаление опухоли в молочной железе
- Нужно ли избегать или стараться отложить операцию при раке груди?
- Секторальная резекция молочной железы
- Центральная резекция молочной железы
- Резекция соска
- Мастэктомия
- Радикальные мастэктомии
- Паллиативная мастэктомия
- Оценка онкологического риска операций, включающих первичную реконструкцию
- Органосохраняющие операции при раке молочной железы
- Лампэктомия
- Онкопластические резекции
- После операции по удалению рака груди: питание, прогноз, риск рецидива
- Сколько живут после операции по поводу рака молочной железы?
- Правильное питание после операции по поводу рака молочной железы
Удаление опухоли в молочной железе

Нужно ли избегать или стараться отложить операцию при раке груди?
Хирургическое лечение рака молочной железы, несомненно, является основным методом комплексного лечения. Его эффективность существенно возрастает при сочетании с химиотерапией, гормональной терапией и лучевой терапией.
Одним из основных принципов лечения рака молочной железы в Европейской онкологической клинике является проведение в основном органосохраняющих операций, так и операций полного удаления молочной железы (мастэктомия), с учетом индивидуальных показаний.
Суть органосохраняющей операции при раке молочной железы заключается в удалении только очага опухоли молочной железы с небольшим количеством окружающей здоровой ткани (лампэктомия и квадрантектомия). После такой операции обычно следует курс лучевой терапии на область оставшихся тканей молочной железы и регионарных зон.
Важно знать, что при инвазивном раке обе эти операции сочетаются с обязательным удалением подмышечных лимфатических узлов — лимфаденэктомией. При неинвазивных формах рака в настоящее время полного трехуровнего удаления лимфоузлов не производится, поскольку это резко ухудшает качество жизни пациенток — развивается отёк верхней конечности (лимфедема), нарушения подвижности в плечевом суставе, а также хронические боли.
Секторальная резекция молочной железы
Такую операцию делают при узловой мастопатии (сборный диагноз, включающий и ситуации с уплотнением в молочной железе неизвестной природы). Кожный разрез производят либо над уплотнением, либо по краю ареолы, либо по субмаммарной складке. Удаляется уплотнение, образовавшийся дефект ткани железы ушивается, накладывается внутрикожный шов.
Особая техника секторальной резекции применяется при внутрипротоковой папилломе (обычно это маленькая опухоль, расположенная в протоке и проявляющаяся выделениями из соска). В проток вводится красящее вещество. Кожный разрез делается по краю ареолы, за соском находят прокрашенный проток, в этом месте его пересекают, выделяют к периферии от соска с тем, чтобы была удалена папиллома. Ушивается ткань железы и кожа внутрикожным швом.

В Европейской онкологической клинике ведёт консультативный приём и выполняет операции известный российский хирург-маммолог, доктор медицинских наук Сергей Михайлович Портной (автор более 300 печатных работ, член правления Российского общества онкомаммологов, автор трех патентов на изобретения).
Сергей Михайлович выполняет весь объем оперативных вмешательств на молочной железе, включая органосохраняющие и реконструктивные пластические операции.
Центральная резекция молочной железы
Применяется при внутрипротоковой папилломе, когда её не удаётся локализовать, при множественных внутрипротоковых папилломах, располагающихся в центральных отделах протоков. Операция приемлема в тех случаях, когда не предвидится кормление грудью. После кожного разреза, выполненного по краю ареолы, за соском пересекают все протоки. Ткань железы с центральными отделами протоков выделяют на 2–3 см и удаляют. Дефект ткани железы ушивается, накладывается внутрикожный шов.
Резекция соска
Используется при аденоме соска, — редкой доброкачественной опухоли или как диагностический этап для морфологической диагностики рака Педжета. Клиновидно резецируется сосок, накладываются узловые швы тонким шовным материалом. Часть протоков при этом пересекаются, что может осложнить последующую лактацию.
Мастэктомия

Радикальные мастэктомии
К недостаткам операции относится деформация грудной стенки. В настоящее время показаниями к радикальной мастэктомии по W. S. Halsted являются прорастание первичной опухолью большой грудной мышцы и поражение лимфатических узлов Роттера, а также выполнение паллиативных операций.
D. H. Patey и W. H. Dysonв 1948 г. предложили модифицированную методику радикальной мастэктомии, отличающуюся от операции W. S. Halsted сохранением большой грудной мышцы. В блок удаляемых тканей включается молочная железа, малая грудная мышца и лимфатические узлы 1–3 уровней. Операция в большинстве случаев не уступает по эффективности операции Холстеда, её преимуществом является меньшая травматичность и меньшая деформация грудной стенки. В то же время, не всё просто с остающейся большой грудной мышцей. При удалении малой грудной мышцы неизбежно пересекается 1–2 мелких нервных веточек (латеральный пекторальный нерв и ветвь медиального пекторального нерва), иннервирующих наружную часть большой грудной мышцы. Впоследствии, конечно, это приводит к атрофии наружной части большой грудной мышцы.
Модификация радикальной мастэктомии по J.L Madden предполагает сохранение обеих грудных мышц и удаление клетчатки I и II уровней.
Является вариантом модифицированной радикальной мастэктомии, разработанным в ФГБУ РОНЦ им. Н. Н. Блохина РАМН. Подразумевает удаление молочной железы, удаление клетчатки I–III уровней без удаления малой грудной мышцы в отличие от операции Patey & Dyson. Преимуществом операции является полное удаление клетчатки и сохранение мышц, и их иннервации.
Паллиативная мастэктомия
Оценка онкологического риска операций, включающих первичную реконструкцию
В нашей клинике выполняется широкая панель онкологических операций, включающих одновременную реконструкцию молочной железы. Возникает вопрос: это безопасно? Не провоцирует ли дополнительная операция быстрое развитие метастазов?
Для ответа на эти вопросы нами были проанализированы сведения о 503 больных РМЖ I — III стадий, получавших лечение в ФГБУ РОНЦ им. Н. Н. Блохина РАМН в 1992—2002 гг. В основную группу вошли 124 больные, средний возраст 41,5 года (24–67). Женщины были оперированы в объеме радикальной мастэктомии с сохранением грудных мышц в сочетании с первичной реконструкцией молочной железы: экспандером (n=14) или кожно-жировым лоскутом на широчайшей мышце спины с использованием эндопротеза (n=18), или поперечным ректоабдоминальным лоскутом на мышечной ножке (n=92). Контрольную группу составили 379 больных, средний возраст 40,1 года (26–79). 145 больным выполнены органосохраняющие операции, 234 — радикальная мастэктомия с сохранением грудных мышц. Группы были сопоставимы по основным факторам, оказывающим влияние на прогноз (стадия, возраст, проводимое лечение). Лекарственное и лучевое лечение проводились по общим принципам. Медиана длительности прослеженности 63,7 (20,4–140,5) месяца.
Частота местных рецидивов составила:
- в молочной железе после органосохраняющих операций — 4,1%;
- после модифицированной радикальной мастэктомии — 1,7%;
- после модифицированной радикальной мастэктомии с первичной реконструкцией — 1,6% (p>0,05).
За весь срок наблюдений рецидив болезни (то есть не только местно, а в любых органах и тканях) наблюдался в 18,6±3,5% в группе с реконструкцией молочной железы (у 23 больных) и в 18,2±2,0% в контрольной группе (у 69 больных, p>0,05). Кривые безрецидивной выживаемости и общей выживаемости в сравниваемых группах статистически не различаются.
По данным многофакторного анализа факт выполнения первичной реконструкции молочной железы не влияет на развитие рецидива болезни. Анализ факторов, влияющих на рецидив болезни, показывает преобладающее влияние таких известных факторов, как критерии T, N, возраст, проведение химиотерапии. Факт проведения первичной реконструкции не оказывал статистически значимого влияния на процесс рецидивирования опухоли. Таким образом, первичная реконструкция молочной железы может безопасно выполняться больным РМЖ.
Однако, чем больше объем операций, тем вероятнее осложнения их заживления, особенно у пациенток при сопутствующем сахарном диабете, ожирении и длительном курении. У них длительное заживление раны может отсрочить проведение адъювантной лучевой терапии, химиотерапии. Поэтому для больных с планируемой адъювантной химиотерапией или лучевой терапией, имеющих перечисленные факторы, ухудшающие заживление раны, предпочтительнее отказаться от первичной реконструкции.
Органосохраняющие операции при раке молочной железы
История развития органосохраняющих операций при раке молочной железы относительно коротка. Такие операции стали возможны благодаря сочетанию трёх основных факторов: 1) более раннему выявлению болезни; 2) осознанию того, что расширение объёма операции при ранних формах рака не приводит к улучшению выживаемости больных; 3) применению лучевого воздействия на сохранённую молочную железу как мощного средства снижения вероятности местного рецидива.
G.Crile Jr. в 1975 г. представил10-летние результаты рандомизированного исследования, сравнивающего органосохраняющую операцию частичную мастэктомию (partial mastectomy) с тотальной мастэктомией. В группах сравнения было по 42 больных первично операбельным раком. Смертность от рака за 10 лет составила 34% и 38% соответственно.
Лампэктомия

Минимальное по объёму удаляемой ткани молочной железы хирургическое вмешательство — лампэктомия (lump — глыба, кусок, комок), было разработано в ходе исследований Национального проекта дополнения операций на молочной железе и кишечнике (США, NSABBP).
В исследование входили больные с величиной опухоли не более 4 см. Сравнивались группы больных с разными видами лечения: лампэктомией (1-я группа), лампэктомией с лучевой терапией (2-я группа), модифицированной радикальной мастэктомией (3-я группа).
При 12-летнем наблюдении местный рецидив в молочной железе развился у больных 1-й группы в 35%, 2-й группы — в 10%. Достоверные различия общей выживаемости и выживаемости без отдалённых метастазов между сравниваемыми группами отсутствовали. Общий вывод о равной эффективности органосохраняющего лечения и радикальной мастэктомии подтвержден и при 20-летнем наблюдении. Частота местного рецидива после лампэктомии составила 39,2%, после лампэктомии с облучением — 14,3%.
Обретя собственный опыт в выполнении лампэктомии, мы пришли к необходимости её модифицировать. Модификация касается двух моментов: опухоль удаляется обязательно с запасом здоровых тканей вокруг неё, обязательно производится ушивание ткани железы. Для опухолей небольшого размера (до 1–2 см) лампэктомия остаётся лучшей операцией: нетравматичной и элегантной.
При больших размерах опухоли или при её центральной локализации для сохранения формы железы возникает необходимость в привлечении дополнительных усилий по перемещению тканей, и / или вмешательства на контралатеральной железе для сохранения симметрии, то есть необходимость в выполнении онкопластических резекций.
Онкопластические резекции
В настоящее время вариантов онкопластических резекций очень много, можно сказать, что их столько, сколько пациенток. Техника и ход операции диктуется онкологической ситуацией, формой молочных желёз, особенностями состояния тканей, излюбленными приёмами хирурга.
Органосохраняющие операции не являются автоматически адекватным видом лечения. Необходимо тщательное обследование пациенток, которым планируется такая операция. Лучше сделать мастэктомию, чем несоответствующую онкологическим критериям органосохраняющую операцию.
После операции по удалению рака груди: питание, прогноз, риск рецидива
Хирургия — наиболее радикальный метод лечения онкологических заболеваний. Но, даже если опухоль полностью удалена, и врач констатировал ремиссию, в будущем сохраняется риск рецидива. Каждая женщина, успешно прошедшая лечение, должна находиться под наблюдением у врача.
Посещать маммолога придется раз в несколько месяцев. Со временем врач будет приглашать на осмотры все реже, спустя 5 лет — примерно раз в год (если в течение этого времени не возникало рецидивов). Спустя 6–12 месяцев после хирургического вмешательства врач назначит маммографию, затем ее нужно будет проходить ежегодно. По отдельным показаниям назначают регулярные осмотры гинеколога, определение плотности костей и другие исследования.
Сколько живут после операции по поводу рака молочной железы?
Средняя продолжительность жизни после операции по удалению рака молочной железы оценивается по показателю пятилетней выживаемости. Он обозначает процент пациентов, которые остаются живы в течение пяти лет с того момента, когда был установлен диагноз. Пятилетняя выживаемость при раке молочной железы в первую очередь зависит от стадии, на которой начато лечение:
- I стадия — практически 100%.
- II стадия — 93%.
- III стадия — 72%.
- IV стадия — 22%.
Помимо стадии, играют роль и такие факторы, как возраст, общее состояние здоровья женщины, тип опухоли, образ жизни. Специальных рекомендаций, которые помогли бы существенно улучшить прогноз выживаемости после операции по поводу рака молочной железы, не существует. Нужно в целом вести здоровый образ жизни: правильно питаться, поддерживать физическую активность, следить за массой тела, избегать курения и алкоголя.
Правильное питание после операции по поводу рака молочной железы
После лечения организм восстанавливается, поэтому он должен получать достаточное количество белка. В ближайшее время после операции не стоит переживать о лишних калориях, даже если у вас есть избыточная масса тела. Сейчас важно восстановиться. Сбросить вес можно потом.

Некоторые вещества, которые содержатся в растительных продуктах, помогают укрепить здоровье и снизить риск рецидива:
- Фитоэстрогены, которые содержатся в сое, согласно результатам некоторых исследований, помогают снизить риск рецидива эстроген-позитивного рака. В ходе других исследований не было обнаружено такого эффекта.
- Антиоксиданты содержатся во многих фруктах и овощах, особенно много их в брокколи, чернике, моркови, манго. Они помогают защитить клетки от повреждения.
- Ликопин — один из антиоксидантов, который придает красный цвет томатам и розовый — грейпфруту.
- Бета-каротин придает оранжевый цвет моркови, абрикосам. Есть некоторые данные в пользу того, что он помогает предотвращать рак.
Стоит ли принимать биологически активные добавки? Диетологи считают, что рацион, богатый разнообразными свежими продуктами, намного лучше, чем БАДы.
Читайте также: