Лазерное удаление опухоли в мочевом пузыре
Рак мочевого пузыря занимает второе место среди злокачественных новообразований органов мочеполовой системы. У 70% пациентов выявляется немышечноинвазивная опухоль.
На сегодняшний день, общепризнанным стандартом хирургического лечения немышечноинвазивного рака мочевого пузыря является трансуретральная монополярная электрорезекция стенки мочевого пузыря с опухолью.
Однако, стандартная электрорезекция опухоли мочевого пузыря подразумевает поэтапное удаление образования, при котором его фрагменты свободно флотируют в полости мочевого пузыря.
В связи с этим, многими авторами неоднократно высказывалось предположение, что рецидив опухоли мочевого пузыря может возникать вследствие имплантации флотирующих опухолевых клеток.
Данная теория подтверждается также и значительным снижением числа рецидивов при использовании местной химиотерапии в ближайшем послеоперационном периоде.
Высокая частота рецидивов после трансуретральной электрорезекции, составляющая по разным данным от 16% до 71%, послужила поводом для поиска новых подходов в лечении немышечноинвазивного рака мочевого пузыря.
В 1997 году Кавада и соавторами была предложена техника монополярной энблок-резекции стенки мочевого пузыря с опухолью. Главными целями, преследуемыми при выполнении энблок-резекции являются:
- улучшение качества морфологического исследования;
- уменьшение свободного флотирования опухолевых клеток;
- снижение частоты рецидивов заболевания и опухолевой прогрессии.
При этом производится отсечение опухоли от стенки мочевого пузыря, отступя от ее основания, в пределах здоровых тканей при помощи специального электрода и извлечение опухоли целиком из полости мочевого пузыря.
Однако, использование электрохирургии при расположении опухоли на боковой стенке мочевого пузыря сопряжено с риском развития так называемого обтураторного синдрома и, как следствие этого, повреждением стенки мочевого пузыря и кровотечением.
В последние годы все большее распространение находят различные виды энблок-резекции с применением лазеров (тулиевого, зелёного, гольмиевого), что позволяет исключить развитие обтураторного синдрома.
Одной из наиболее распространенных методик с использованием лазера является гольмиевая энблок-резекция стенки мочевого пузыря с опухолью.
В клинике урологии Первого МГМУ имени Ивана Михайловича Сеченова начата работа по оценке эффективности и безопасности выполнения гольмиевой энблок-резекции стенки мочевого пузыря с опухолью. На сегодняшний день выполнено двенадцать операций при размерах опухоли от 0,8 до 4,5 см.
Согласно существующей методике, выполняется резекция стенки мочевого пузыря с отступом от основания опухоли. При этом хорошо виден мышечный слой.
Гольмиевое излучение позволяет также выполнять качественную коагуляцию зоны резекции. Удаленная ткань извлекается из полости мочевого пузыря при помощи петли резектоскопа единым блоком. На макропрепарате отмечается зона основания опухоли.
При больших размерах опухоли возможно отсечение экзофитной части опухоли и удаление ее из полости мочевого пузыря при помощи морцеллятора, что существенно сокращает время операции и не препятствует получению достаточного материала для гистологического исследования.
В дальнейшем возможно выполнение электро- или лазерной резекции основания опухоли.
Давать оценку онкологическим результатам данного метода преждевременно, ввиду небольшого числа пациентов и срока наблюдения, но, по нашему мнению, неоспоримым преимуществом энблок-резекции является возможность удаления опухоли с основанием, что позволяет уменьшить вероятность ошибки в стадировании процесса, а это, в свою очередь, является крайне важным для определения дальнейшей тактики лечения.
Таким образом, лазерная энблок-резекция является эффективным и безопасным способом хирургического лечения пациентов с немышечноинвазивным раком мочевого пузыря и, в отличие от трансуретральной электрорезекции, не вызывает повреждения мочевого пузыря вследствие отсутствия обтураторного синдрома и обладает возможностью лучшего морфологического исследования и правильного стадирования опухолевого процесса.
Клиника урологии Сеченовского университета единственная в стране выполняет эту высокотехнологичную операцию
Энблок лазерная энуклеация показана пациентам с мышечно-неинвазивным раком, то есть не затронут мышечный слой стенки мочевого пузыря. Если опухоль проросла в глубокие ткани, выполняют радикальную цистэктомию – удаление мочевого пузыря.
Опухоль извлекаем целиком, без полостного разреза, под щадящей анестезией
В отличие от трансуретральной резекции (ТУР), когда раковое образование срезают послойно электропетлей, энблок методом опухоль отсекают разом у основания. В результате нет кровотечения, которое во время ТУР может затруднить обзор настолько, что операцию прекращают и проводят кровоостанавливающие мероприятия.
Лазер аккуратно прижигает сосуды и обладает настолько хорошим гемостатическим эффектом, что накануне операции можно не отменять разжижижающие кровь препараты больным, которым ранее назначили специальную терапию для профилактики инфаркта или инсульта.
Операция лазером имеет меньшую вероятность рецидива
В зависимости от стадии рака, вероятность рецидива после ТУР мочевого пузыря составляет от 16% до 71%. Отсеченные фрагменты некоторое время свободно плавают в мочевом пузыре, могут всасываться слизистой, что приводит к образованию новых очагов. Для лазерной резекции процент осложнений еще не посчитан, но первые исследования показывают – риск существенно ниже.
Лазер исключает травму вследствие обтураторного синдрома
Обтураторный синдром – это непроизвольное движение ноги, когда электропетля затрагивает запирательный (обтураторный) нерв. Из-за неожиданного резкого движения инструмент может сильно повредить стенку мочевого пузыря или привести к разрыву. В последнем случае необходима срочная лапаротомия – вскрытие брюшной полости для ушивания стенки пузыря.
Энблок операция помогает оценить опухолевый процесс, что критически важно для правильного лечения
Преимущества энблок операции перед ТУР мочевого пузыря кратко:
• Лучше качество морфологического исследования
• Меньше кровотечение и риск травмы в ходе операциии
• Ниже вероятность рецидива и опухолевой прогрессии
Операцию выполняем новым тулиевым лазером без вреда здоровым тканям
Волокно лазера отделяет опухолевую ткань подобно ножу, но благодаря своим размерам и физическим свойствам делает это более деликатно. Технология новая, в мире проведены единицы таких операций. Наши врачи много работали, чтобы выбрать правильные режимы и выработать методику. Сегодня мы обладаем этой уникальной технологией.
Технически лазерная операция похожа на ТУР. Инструмент диаметром со стержень шариковой ручки заводим через мочеиспускательный канал под щадящей спинальной анестезией. После отсечения извлекаем опухоль специальными щипцами по просвету эндоскопического инструмента. Катетер, который устанавливаем в завершении операции для отвода мочи, удаляем через сутки. Время в стационаре – три дня.
Удаление рака простаты лазером – стоимость энблок операции
Операция входит в перечень высокотехнологичной медицинской помощи – российским гражданам выполняем бесплатно. Наши врачи помогут оформить необходимые документы. Стоимость по каналу платных медицинских услуг, в том числе для иностранных граждан, без учёта пребывания в стационаре, от 90 тыс. рублей.

Лазерная резекция стенки мочевого пузыря с опухолью
Что включает в себя лазерное удаление опухоли мочевого пузыря?
Данная операция является малоинвазивным методом лечения мышечно-неинвазивного рака мочевого пузыря. С помощью лазера происходит резекция стенки мочевого пузыря с опухолью.



Кому показана данная операция?
Лазерная резекция опухоли показана пациентам с мышечно-неинвазивным раком мочевого пузыря. Для мышечно-инвазивного показана радикальная цисэктомия.
Подготовка к операции
Перед операцией каждого пациента консультирует врач-анестезиолог для выявления противопоказаний к лекарственным препаратам, используемым во время анестезии, аллергических реакциях на лекарства. Кроме этого выясняется список лекарств, которые применяет пациент, так как некоторые средства могут вызвать осложнения во время операции. В отличие от обычной трансуретральной резекции мочевого пузыря, при которой антикоагулянты обязательно отменяются за 5-7 дней до операции, лазерное удаление опухоли не требует отмены кроверазжижающих препаратов, что делает данное пособие наиболее предпочтительным у пациентов с высоким риском геморрагических осложнений. Кроме анестезиолога с пациентом беседуют терапевт и уролог. Пациент должен сообщить о всех имеющихся у него заболеваниях. Перед операцией проводят тщательную подготовку кишечника, назначают антимикробные препараты широкого спектра действия для предотвращения инфекционных осложнений в послеоперационном периоде.
Как выполняется лазерная резекция опухоли мочевого пузыря?
Одной из наиболее распространенных методик с использованием лазера является лазерная (гольмиевая или тулиевая) энблок-резекция стенки мочевого пузыря с опухолью. Операция выполняется под спинномозговой или внутривенной анестезий в положении больного на спине с разведенными в сторону нижними конечностями (так называемое литотомическое положение). Согласно существующей методике выполняется резекция стенки мочевого пузыря отступя от основания опухоли. При этом хорошо виден мышечный слой. Гольмиевое излучение позволяет также выполнять качественную коагуляцию зоны резекции. Удаленная ткань извлекается из полости мочевого пузыря при помощи петли резектоскопа единым блоком для гистологического исследования.


Возможные осложнения
Большинство манипуляций имеют риск развития тех или иных побочных явлений. Несмотря на то, что возможность возникновения этих побочные явлений общепризнанные, очень немногие пациенты в действительности сталкиваются с ними после урологических вмешательств.
В раннем послеоперационном периоде может отмечаться:
- примесь крови в моче
- учащение мочеиспускания
- инфекции мочевого пузыря, яичек или почек, требующие антибактериального лечения
- временное недержание мочи, особенно выраженное в течение 6 недель после операции, может быть сведено к минимуму с помощью тренировок мышц тазового дна
- часть фрагментов опухоли может остаться в мочевом пузыре, и для их удаления проводится повторная эндоскопическая процедура
- в чрезвычайно редких случаях возможна перфорация мочевого пузыря, которая потребует временной установки мочевого катетера, либо хирургическое ушивание стенки мочевого пузыря
Чего ждать после операции?
Сразу после вмешательства возможно незначительное кровотечение. В большинстве случаев, гематурия прекращается в течение 12 часов, но у некоторых пациентов может продолжаться несколько дольше. Потребность в переливании крови после лазерной операции возникает крайне редко.
Рекомендовано обильное питье в течение 12 после операции, так как оно способствует более раннему разрешению гематурии. Иногда катетер промывают жидкостью, чтобы очистить мочу от примеси крови. Вы сможете пить и принимать пищу в день операции, как только почувствуете себя в состоянии.
Катетер будет извлечен на следующий день или через день после операции. Первое время мочеиспускание может быть болезненным и учащенным. Любые неприятные ощущения могут быть купированы приемом таблетированных препаратов, либо инъекций.
Небольшое урежение частоты мочеиспускания наступит спустя несколько дней после операции. Некоторые из симптомов, особенно, учащенное мочеиспускание, императивные позывы, и никтурия могут сохраняться в течение нескольких месяцев, так как они связаны преимущественно не с увеличением простаты, а с гиперактивностью мочевого пузыря (разрешение которой займет некоторое время после операции).
В течение 24-48 часов после удаления катетера, в моче может быть обнаружена кровь. Иногда кровь различима в моче на протяжении нескольких недель, и в большинстве случаев не представляет опасности.
Опухоль мочевого пузыря – новообразование, которое возникает в полости или на стенке органа. Болезнь может протекать как с яркими симптомами, так и без особых признаков, что часто приводит к поздней диагностике. По основной классификации опухоли бывают доброкачественными и злокачественными. Именно тип образования, его размеры и место определяют схему лечения опухоли мочевого пузыря и прогноз выздоровления.
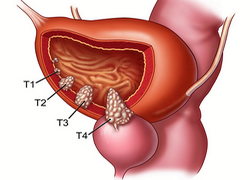
Причины появления опухоли
Механизм развития опухолей заключается в активном делении клеток. Такие процессы могут быть запущены разными факторами, которые провоцируют мутацию генетического клеточного материала. В случае с мочевым пузырем особенно опасны курение, неблагоприятная экология и работа, связанная с химическими веществами. Эти факторы могут вызывать разные виды опухолей мочевого пузыря:
- Доброкачественные: полипы, папилломы, миомы, гемангиомы, фибромы.
- Злокачественные: солидный, переходноклеточный, папиллярный и плоскоклеточный рак, аденокарцинома, а также поверхностный (неинвазивный) и инвазивный рак.
Доброкачественные опухоли часто диагностируются у рабочих, занятых в лакокрасочной, бумажной, химической и резиновой промышленности. Провоцировать заболевание может застой мочи. Чем выше ее концентрация и чем дольше она задерживается в пузыре, тем более сильным оказывается опухолегенное действие веществ в ее составе. У мужчин причинами опухолей выступают заболевания мочеполового тракта:
- аденома простаты;
- простатит;
- камни в органах мочевыделительной системы;
- стриктуры и дивертикулы мочеиспускательного канала.
Ввиду особенностей анатомического строения мужчины больше подвержены риску возникновения новообразований. Злокачественные опухоли мочевого пузыря могут развиваться по тем же причинам:
- из-за работы на вредном производстве;
- паразитарных инфекций;
- длительной задержки мочи;
- инфекций и воспаления урогенитального тракта.
Симптомы опухолевых заболеваний
Рассматривая симптомы опухоли мочевого пузыря, стоит отметить, что на раннем этапе она никак себя не проявляет. Признаки возникают, когда новообразование достигает таких размеров, при которых оно может раздражать стенки органа. В такой ситуации у человека могут быть следующие жалобы:
- изменение цвета мочи;
- спазмы и боль внизу живота;
- ощущение не полностью опорожненного мочевого пузыря;
- выделение мочи небольшими порциями;
- частые позывы к мочеиспусканию;
- нарушение менструального цикла и выделения из половых путей (у женщин);
- отечность в ногах, области промежности;
- нарушения работы органов пищеварения.
Методы диагностики опухоли мочевого пузыря
Поскольку опухоль может носить доброкачественный или злокачественный характер, особое значение приобретает дифференциальная диагностика. Она направлена на то, чтобы определить тип новообразования, поскольку от этого зависит схема лечения. Исходя из этого, в инструментальную и лабораторную диагностику опухоли мочевого пузыря включают:
- Ультразвуковое исследование (УЗИ) органов малого таза.
- Магнитно-резонансную или компьютерную томографию (МРТ или КТ) малого таза.
- Цистоскопию с биопсией новообразования для определения его типа.
- Экскреторную урографию и цистографию.
- Цитологическое тестирование мочи.

Для выполнения данной операции мы используем самые эффективные и безопасные лазеры: тулиевый и гольмиевый.
Преимущества лазерной En-bloc резекции стенки мочевого пузыря с опухолью перед трансуретральной электрорезекции стенки мочевого пузыря с опухолью:
Показания для лазерной En-bloc резекции стенки мочевого пузыря с опухолью:
- Наличие единичных поверхностных опухолей мочевого пузыря небольших размеров по данным МСКТ или МРТ с контрастированием.
Противопоказания:
- Тяжелое состояние пациента, не позволяющее выполнить тот или иной метод обезболевания (спинномозговая анестезия, наркоз).
- Острые инфекционно-воспалительные заболевания.
- Техническая невозможность проведения инструмента по уретре в мочевой пузырь, связанная с заболеванием тазобедренных суставов или протяженной стриктурой уретры.
Предоперационный период
На данном этапе в амбулаторных условиях проводится полное обследование пациента:
- Анализы крови и мочи, включая исследование атипических клеток в моче.
- Полипозиционная рентгенография органов грудной клетки, ЭКГ.
- Консультация терапевтом и смежными специалистами при необходимости.
- УЗИ органов мочевой системы, МСКТ органов мочевой системы с контрастированием.
- После полного обследования Вы госпитализируетесь в отделение накануне операции.
- Осмотр и консультация врачом-анестезиологом накануне оперативного вмешательства.
Важно! Если Вы принимаете кроверазжижающие препараты, после предварительной консультации с терапевтом необходимо отменить их приём за 7 дней до назначенной операции.

Техника выполнения лазерной En-bloc резекции стенки мочевого пузыря с опухолью.
- Проведение резектоскопа по уретре в мочевой пузырь.
- Осмотр стенок мочевого пузыря, определение устьев мочеточников, выявление опухоли.
- Выполнение при помощи тулиевого или гольмиевого лазера резекции стенки мочевого пузыря с опухолью единым блоком вместе с мышечным слоем, отступя от края опухоли.
- Окончательный гемостаз (остановка кровотечения).
- Удаление опухоли из полости мочевого пузыря.
- Установка уретрального катетера в мочевой пузырь.
Послеоперационный период
- Проведение комплексной консервативной, в том числе внутрипузырной терапии.
- Удаление уретрального катетера на 1-е сутки после операции.
- Выписка пациента на 1-е или 2-е сутки после операции.
После лазерной En—bloc резекции стенки мочевого пузыря с опухолью пациенты могут столкнуться с временными побочными явлениями, к которым относятся:
- Примесь крови в моче.
- Жжение и резь в уретре.
В течение месяца после операции рекомендуется соблюдение охранительного режима.
Официальный сайт уролога

Доброкачественные или злокачественные новообразования могут наблюдаться вне зависимости от пола. Из-за гормональных сбоев в работе организма мужчин старше 40 лет, такое явление, как рак мочевого пузыря, возникает чаще у такой группы людей. Развитию опухоли мочевого пузыря способствует застой мочи вследствие аденомы простаты, а также хронические заболевания слизистой оболочки этого органа. Хронические язвы, цистит, другие заболевания мочевого пузыря при халатном лечении и запущенного течения болезни могут рано или поздно привести к опухоли.
Выбор способа лечения опухоли мочевого пузыря зависит от нескольких факторов. Важна сама морфология опухоли, ее структура, область распространения, запущенность заболевания, стадия рака, наличие метастаз. Немаловажную роль играет и возраст больного.
Основным способом лечения опухоли мочевого пузыря является хирургическое вмешательство. Для полноценной жизни очень важно нормальное функционирование мочеполовой системы, поэтому приоритетным в лечении опухоли является сохранение органа. Сохранить орган отчасти удается потому, что симптомы опухоли проявляются довольно быстро, и диагностика заболевания происходит вовремя.
Как выполняется лазерная резекция опухоли мочевого пузыря?
В современном мире чаще всего удаление опухоли мочевого пузыря проводят путем применения лазера: проводят резекцию стенки с новообразованием. В ходе выполнения операции пациент лежит на спине с разведенными ногами (литотомическое положение). Применяется спинальная или внутривенная анестезия. Согласно методике выполнения данной операции лазером, резекция стенки пузыря выполняется отступя от самого основания новообразования (хорошо виден мышечный слой). Преимущество лазера также заключается в возможности качественно коагулировать ткани в месте резекции. Удаленная опухоль извлекается из полости органа для дальнейшего гистологического исследования.


Возможные осложнения лазерного удаления опухоли мочевого пузыря
В течение некоторого времени после хирургического вмешательства пациент может наблюдать кровь в моче, мочеиспускание может участиться. Небольшое кровотечение не должно пугать больного: после лазерной операции оно незначительно. Также после операции увеличивается риск развития инфекций мочевого пузыря. Временное недержание мочи – еще один послеоперационный синдром (лечится тренировками мышц тазового дна).
Лазерное удаление опухоли мочевого пузыря в Махачкале проводит врач высшей категории, член Европейской ассоциации урологов Алибеков Магомедали Магомедрасулович. Проконсультироваться с врачом и записаться на прием можно по телефону 8 928 513 91 11 или через официальный сайт.












Лазерное удаление опухоли мочевого пузыря единым блоком
В России показатель заболеваемости раком мочевого пузыря (РМП) находится на третьем месте среди онкоурологических заболеваний после рака предстательной железы и рака почки. По данным систематического ежегодного анализа, заболеваемость РМП в России в 2016 г. составила 71,3 на 100 тыс. населения против 47,8 на 100 тыс. в 2006 г.
Удельный вес пациентов с диагнозом, подтвержденным морфологически, среди больных с впервые установленным диагнозом РМП на 2016 г. составил 92,4%, из них 46,7% приходится на рак стадии Т1 и 2,8% – на неустановленную стадию [1]. Летальность в течение первого года с момента постановки диагноза (из числа больных, впервые взятых на учет в предыдущем году) на 2016 г. составила 16,6%, в то время как в 2006 г. данный показатель был равен 23,1%. Своевременная диагностика, адекватное лечение и контроль за пациентом, которому проводится лечение по поводу РМП, – актуальные задачи современной урологии.
Основные цели ТУР МП: удаление видимой патологически измененной ткани МП, определение гистологического типа опухоли, оценка глубины инвазии и степени злокачественности [4]. Несмотря на постоянное совершенствование технологического обеспечения, наличие возможностей наиболее достоверной верификации диагноза и не прекращаемые поиски новых методов визуализации опухоли МП на самых ранних стадиях, частота рецидива после проведения стандартной ТУР остается достаточно высокой [5, 6]. Высокая вероятность рецидивирования опухоли после первичной ТУР, отсутствие мышечного слоя в гистологических образцах при проведении резекции не в полном объеме, а также выявление низкодифференцированной опухоли требуют проведения повторной ТУР МП [3]. Так, согласно исследованию D. A. Lazica et al. [7], частота развития рецидива опухоли после первичной ТУР, диагностируемого при повторной ТУР МП, составляет 41,4%, причем cреди женщин, несмотря на более низкую заболеваемость, чем среди мужчин, риск рецидивирования опухоли выше [8]. Данный факт можно связать с несоответствием стандартной ТУР МП как полноценной самостоятельной операции, критериями радикальности в подходах к лечению онкологических заболеваний. В том числе из-за вероятности опухолевой имплантации при обсеменении МП и уретры опухолевыми клетками при фрагментации опухоли в ходе проведения стандартной ТУР [9, 10]. Невозможность проведения резекции в полном объеме из-за большого размера опухоли, неудобного ее расположения, а также при недостаточном опыте хирурга и боязни осложнений в виде перфорации стенки МП увеличивает риск оставления остаточной опухоли в зоне резекции [11]. Так, при повторной ТУР остаточная опухоль стадии рT1 выявляется в 25% случаев [12]. Кроме вышеперечисленного недостатком стандартной ТУР МП является нерепрезентативность гистологического материала, взятого в ходе резекции, в связи с чем патоморфолог не всегда может дать достоверное заключение [13–17]. Отсутствие мышечного слоя в препарате, термическое повреждение ткани в ходе ТУР и нарушение микроархитектоники ткани из-за фрагментации опухоли затрудняют оценку качества проведенной резекции, как следствие – постановку точного диагноза, что служит показанием к проведению повторной резекции [18–21]. Такие осложнения, как инфекция мочеполовых путей, встречающаяся в 23% случаев, перфорация стенки МП (5%) и кровотечение, требующее трансфузионной терапии (13%) [22], катетер-ассоциированная боль [23] и задержка мочеиспускания [24], увеличивают продолжительность нахождения пациента в стационаре, следовательно, увеличивают расходы ЛПУ [22]. Появление опухолевых клеток в общем кровотоке [25], стимуляция запирательного нерва при резекции МП и как следствие – неконтролируемая перфорация стенки МП с последующей экстравезикальной диссеминацией опухолевых клеток [26, 27] исключают радикальность проведенной операции [28]. Таким образом, ТУР МП является не только лечебным мероприятием, но и диагностической процедурой, а качество и полнота ее проведения прямо коррелируют с наличием периоперационных осложнений. Оптимизация методики резекции необходима как для предотвращения возможных осложнений, так и для увеличения показателя безрецидивной выживаемости пациентов и повышения их качества жизни.

2. Woldu S.L., Bagrodia A., Lotan Y. Guideline of guidelines: non-muscle-invasive bladder cancer. BJU Int. 2017;119(3):371–380. Doi: 10.1111/bju.13760.
3. EAU Guidelines on Non-Muscle-invasive Urothelial Carcinoma of the Bladder. Update 2016.
4. Qie Y., Hu H., Tian D., Zhang Y., Xie L., Xu Y., Wu C. The value of extensive transurethral resection in the diagnosis and treatment of nonmuscle invasive bladder cancer with respect to recurrence at the first follow-up cystoscopy. Onco Targets Ther. 2016;9:2019–2025. Doi: 10.2147/OTT.S103703.
5. Zainfeld D., Daneshmand S. Transurethral Resection of Bladder Tumors: Improving Quality Through New Techniques and Technologies. Curr Urol Rep. 2017;18(5):34. Doi: 10.1007/s11934-017-0680-0.
6. Sureka S.K., Agarwal V., Agnihotri S., Kapoor R., Srivastava A., Mandhani A. Is en-bloc transurethral resection of bladder tumor for non-muscle invasive bladder carcinoma better than conventional technique in terms of recurrence and progression?: A prospective study. Indian Journal of Urology : IJU : Journal of the Urological Society of India. 2014;30(2):144–149. Doi:10.4103/0970-1591.126887.
7. Lazica D.A., Roth S., Brandt A.S., Böttcher S., Mathers M.J., Ubrig B. Second Transurethral Resection after Ta High-Grade Bladder Tumor: A 4.5-Year Period at a Single University Center. Urol Int. 2014;92:131–135. Doi: 10.1159/000353089.
8. Uhlig A., Strauss A., Seif Amir Hosseini A., Lotz J., Trojan L., Schmid M., Uhlig J. Gender-specific Differences in Recurrence of Non–muscle-invasive Bladder Cancer: A Systematic Review and Meta-analysis. Eur Urol Focus. 2017 Sep 6. Doi: 10.1016/j.euf.2017.08.007.
9. Malmström P.U., Agrawal S., Bläckberg M., Boström P.J., Malavaud B., Zaak D., Hermann G.G. Non-muscle-invasive bladder cancer: a vision for the future Scand J Urol. 2017;51(2):87–94. Doi: 10.1080/21681805.2017.1283359.
10. Martov A.G., Ergakov D.V., Andronov A.S. Recurrence of muscular-non-invasive bladder cancer: possible endoscopic ways to solve the problem. Onkourologiya 2010;6(1):6–13. Doi:10.17650/1726-9776-2010-6-1-6-13. Russian (Мартов А.Г., Ергаков Д.В., Андронов А.С. Рецидивирование мышечно-неинвазивного рака мочевого пузыря: возможные эндоскопические пути решения проблемы. Онкоурология 2010;6(1):6–13. Doi:10.17650/1726-9776-2010-6-1-6-13).
11. Mariappan P., Zachou A., Grigor K.M. Detrusor, Muscle in the First, Apparently Complete Transurethral Resection of Bladder Tumour Specimen Is a Surrogate Marker of Resection Quality, Predicts Risk of Early Recurrence, and Is Dependent on Operator Experience. Eur Urol. 2010;57(5):843–849. Doi: 10.1016/j.eururo.2009.05.047.
12. Herr H.W., Donat S.M. Quality control in transurethral resection of bladder tumours. BJU Int. 2008;102(9 Pt B):1242–1246. Doi: 10.1111/j.1464-410X.2008.07966.x.
13. Liem E.I., de Reijke T.M. Can we improve transurethral resection of the bladder tumour for nonmuscle invasive bladder cancer? Curr Opin Urol. 2017;27(2):149–155. Doi: 10.1097/MOU.0000000000000370.
14. Upadhyay R., Kapoor R., Srivastava A., Krishnani N., Mandhani A. Does En-bloc transurethral resection of bladder tumor give a better yield in terms of presence of detrusor muscle in the biopsy specimen? Indian J Urol. 2012;28(3):275–279. Doi: 10.4103/0970-1591.102700.
15. Saito S. Transurethral en bloc resection of bladder tumors, saito, seiichi. The Journal of Urology. 2001;166(6):2148–2150.
16. Ukai R., Kawashita E., Ikeda H. A new technique for transurethral resection of superficial bladder tumor in 1 piece. J Urol. 2000;163(3):878–879.
17. Kawada T., Ebihara K., Suzuki T., Imai K., Yamanaka H. A new technique for transurethral resection of bladder tumors: rotational tumor resection using a new arched electrode. J. Urol. 1997;157(6):2225–2226.
18. Balci M., Tuncel A., Keten T., Guzel O., Lokman U., Koseoglu E., Aslan Y., Atan A. Comparison of Monopolar and Bipolar Transurethral Resection of Non-Muscle Invasive Bladder Cancer. Urol Int. 2018;100(1):100–104.
19. Bolat D., Gunlusoy B., Degirmenci T., Ceylan Y., Polat S., Aydin E., Aydogdu O., Kozacioglu Z. Comparing the short-term outcomes and complications of monopolar and bipolar transurethral resection of non-muscle invasive bladder cancers: A prospective, randomized, controlled study. Arch Esp Urol. 2016;69(5):225–233.
20. Yang S.J., Song P.H., Kim H.T. Comparison of Deep Biopsy Tissue Damage from Transurethral Resection of Bladder Tumors between Bipolar and Monopolar Devices. Korean Journal of Urology. 2011;52(6):379–383. Doi:10.4111/kju.2011.52.6.379.
21. Babjuk M. Transurethral Resection of Non–muscle-invasive Bladder Cancer. Eur Urol. Supplements. 8(7):542–548.
22. Nieder A.M., Meinbach D.S., Kim S.S., Soloway M.S. Transurethral bladder tumor resection: Intraoperative and postoperative complications in a residency setting. J Urol. 2005;174:2307–2379.
23. Guo N., Su D. Incidence and Prediction of Catheter-related Bladder Discomfort after Transurethral Bladder Tumor Resection. West Indian Medical Journal. Doi:10.7727/wimj.2015.601.
24. Gregg J.R., McCormick B., Wang L., Cohen P., Sun D., Penson D.F., Smith J.A., Clark P.E., Cookson M.S., Barocas D.A., Resnick M.J., Moses K.A., Chang S.S. Short term complications from transurethral resection of bladder tumor. Can J Urol. 2016;23(2):8198–81203.
25. Engilbertsson H., Aaltonen K.E., Björnsson S., Kristmundsson T., Patschan O., Rydén L., Gudjonsson S. Transurethral bladder tumor resection can cause seeding of cancer cells into the bloodstream. J Urol. 2015;193(1):53–57. Doi: 10.1016/j.juro.2014.06.083.
26. Shah N.F., Sofi K.P., Nengroo S.H. Obturator Nerve Block in Transurethral Resection of Bladder Tumor: A Comparison of Ultrasound-guided Technique versus Ultrasound with Nerve Stimulation Technique. Anesth Essays Res. 2017;11(2):411–415. Doi: 10.4103/0259-1162.194580.
27. Bolat D., Aydogdu O., Tekgul Z.T., Polat S., Yonguc T., Bozkurt I.H., Sen V., Okur O. Impact of nerve stimulator-guided obturator nerve block on the short-term outcomes and complications of transurethral resection of bladder tumour: A prospective randomized controlled study. Can Urol Assoc J. 2015;9(11–12):E780–784. Doi: 10.5489/cuaj.3149.
28. Wilby D., Thomas K., Ray E., Chappell B., O’Brien T. Bladder cancer: new TUR techniques. World J Urol. 2009;27(3):309–312. Doi: 10.1007/s00345-009-0398-9.
29. Lodde M., Lusuardi L., Palermo S., Signorello D., Maier K., Hohenfellner R., Pycha A. En bloc transurethral resection of bladder tumors: use and limits. Urology. 2003;62(6):1089–1091.
30. Martov A.G., Ergakov D.V., Baikov N.A. Transurethral holmium resection of the bladder with the use of a single unit technique. Meditsinskii vestnik Bashkortostana. 2015;10(3). Russian (Мартов А.Г., Ергаков Д.В., Байков Н.А. Трансуретральная гольмиевая резекция мочевого пузыря с применением техники единого блока. Медицинский вестник Башкортостана. 2015;10(3)).
31. Naselli A., Introini C., Germinale F., Spina B., Puppo P. Surgery illustrated – Focus on details en bloc transurethral resection of bladder lesions: A trick to retrieve specimens up to 4.5 cm. BJU Int. 2012;109(6):960–963. Doi: 10.1111/j.1464-410X.2012.10982.x.
32. Kramer M.W., Rassweiler J.J., Klein J., Martov A., Baykov N., Lusuardi L., Janetschek G., Hurle R., Wolters M., Abbas M., von Klot C.A., Leitenberger A., Riedl M., Nagele U., Merseburger A.S., Kuczyk M.A., Babjuk M., Herrmann T.R. En bloc resection of urothelium carcinoma of the bladder (EBRUC): a European multicenter study to compare safety, efficacy, and outcome of laser and electrical en bloc transurethral resection of bladder tumor. World J Urol. 2015;33(12):1937–1943. Doi: 10.1007/s00345-015-1568-6.
33. Tan W.S., Rodney S., Lamb B., Feneley M., Kelly J. Management of non-muscle invasive bladder cancer: A comprehensive analysis of guidelines from the United States, Europe and Asia. Cancer Treat Rev. 2016;47:22–31. Doi: 10.1016/j.ctrv.2016.05.002.
34. Ukai R., Hashimoto K., Iwasa T., Nakayama H. Transurethral resection in one piece (TURBO) is an accurate tool for pathological staging of bladder tumor. Int J Urol. 2010;17(8):708–14. Doi: 10.1111/j.1442-2042.2010.02571.x.
35. Maurice M.J., Vricella G.J., MacLennan G., Buehner P., Ponsky L.E. Endoscopic snare resection of bladder tumors: evaluation of an alternative technique for bladder tumor resection. J Endourol. 2012;26(6):614–617. Doi: 10.1089/end.2011.0587.
36. Naselli A., Puppo P. En Bloc Transurethral Resection of Bladder Tumors: A New Standard? J Endourol. 2017;31(S1):20–24. Doi: 10.1089/end.2016.0534.
37. Kramer M.W., Wolters M., Herrmann T.R. En Bloc Resection of Bladder Tumors: Ready for Prime Time? Eur Urol. 2016;69(5):967–968. Doi: 10.1016/j.eururo.2016.01.004.
38. D’Souza N., Verma A. Holmium laser transurethral resection of bladder tumor: Our experience. Urol Ann. 2016;8(4):439–443. Doi: 10.4103/0974-7796.190815.
39. Nagele U., Kugler M., Nicklas A., Merseburger A.S., Walcher U., Mikuz G., Herrmann T.R. Waterjet hydrodissection: first experiences and short-term outcomes of a novel approach to bladder tumor resection. World J Urol. 2011;29(4):423–427. Doi: 10.1007/s00345-011-0653-8.
40. Resektion von Blasentumoren mit dem HybridKnife unter Verwendung des Fluoreszenzmarkers Hexvix. DRKS-ID der Studie: DRKS00004414.
41. Morizane S., Sejima T., Iwamoto H., Masago T., Honda M., Ikebuchi Y., Matsumoto K., Ueki M., Takenaka A. Transurethral En Bloc Resection of Bladder Tumor Using an Endoscopic Submucosal Dissection Technique: Preliminary Results in an Animal Model. Yonago Acta Med. 2016;59(2):143–148.
42. Migliari R., Buffardi A., Ghabin H. Thulium Laser Endoscopic En Bloc Enucleation of Nonmuscle-Invasive Bladder Cancer. J Endourol. 2015;29(11):1258–1262. Doi: 10.1089/end.2015.0336.
43. Zhang Z., Zeng S., Zhao J., Lu X., Xu W., Ma C., Wang Y., Chen X., Jia G., Zhou T., Sun Y., Xu C. A pilot study of Vela laser for en bloc resection of papillary bladder cancer. Clin Genitourin Cancer. 2017;15(3):311–314. Doi: 10.1016/j.clgc.2016.06.004.
44. Zhang K.Y., Xing J.C., Li W., Wu Z., Chen B., Bai D.Y. A novel transurethral resection technique for superficial bladder tumor: retrograde en bloc resection. World J Surg Oncol. 2017;15(1):125. Doi: 10.1186/s12957-017-1192-6.
45. Gontero P., Sylvester R., Pisano F., Joniau S., Oderda M., Serretta V., Larré S., Di Stasi S., Van Rhijn B., Witjes A.J., Grotenhuis A.J., Colombo R., Briganti A., Babjuk M., Soukup V., Malmström P.U., Irani J., Malats N., Baniel J., Mano R., Cai T., Cha E.K., Ardelt P., Vakarakis J., Bartoletti R., Dalbagni G., Shariat S.F., Xylinas E., Karnes R.J., Palou J. The impact of re-transurethral resection on clinical outcomes in a large multicentre cohort of patients with T1 high-grade/Grade 3 bladder cancer treated with bacille Calmette–Guérin. BJU Int. 2016;118(1):44–52. Doi: 10.1111/bju.13354.
46. Patschan O., Holmäng S., Hosseini A., Jancke G., Liedberg F., Ljungberg B., Malmström P.U., Rosell J., Jahnson S. Second-look resection for primary stage T1 bladder cancer: a population-based study. Scand J Urol. 2017;51(4):301–307. Doi: 10.1080/21681805.2017.1303846.
48. Hafner C., Knuechel R., Zanardo L., Dietmaier W., Blaszyk H., Cheville J., Hofstaedter F., Hartmann A. Evidence for oligoclonality and tumour spread by intraluminal seeding in multifocal urothelial carcinomas of the upper and lower urinary tract. Oncogene. 2001;20(35):4910–4915.
49. Huncharek M., McGarry R., Kupelnick B. Impact of intravesical chemotherapy on recurrence rate of recurrent superficial transitional cell carcinoma of the bladder: results of a meta-analysis. Anticancer Res. 2001;21(1B):765–769.
50. Sylvester R.J., Oosterlinck W., van der Meijden A.P. A single immediate postoperative instillation of chemotherapy decreases the risk of recurrence in patients with stage Ta T1 bladder cancer: a meta-analysis of published results of randomized clinical trials. J Urol. 2004;171(6 Pt 1):2186–2190.
51. Sylvester R.J., Oosterlinck W., Holmang S., Sydes M.R., Birtle A., Gudjonsson S., De Nunzio C., Okamura K., Kaasinen E., Solsona E., Ali-El-Dein B., Tatar C.A., Inman B.A., N’Dow J., Oddens J.R., Babjuk M. Systematic Review and Individual Patient Data Meta-analysis of Randomized Trials Comparing a Single Immediate Instillation of Chemotherapy After Transurethral Resection with Transurethral Resection Alone in Patients with Stage pTa-pT1 Urothelial Carcinoma of the Bladder: Which Patients Benefit from the Instillation? Eur Urol. 2016;69(2):231–244. Doi: 10.1016/j.eururo.2015.05.050.
52. Yang H., Wang N., Han S., Male M., Zhao C., Yao D., Chen Z. Comparison of the efficacy and feasibility of laser enucleation of bladder tumor versus transurethral resection of bladder tumor: a meta-analysis. Lasers Med Sci. 2017;32(9):2005–2012. Doi: 10.1007/s10103-017-2308-5.
Читайте также:

