Гистология после удаления опухоли почки
Гистология - одно из самых эффективных обследований на сегодняшний день, которое помогает своевременно выявить все опасные клетки и злокачественные новообразования. С помощью гистологического обследования можно детально изучить все ткани и внутренние органы человека. Главное достоинство этого метода в том, что с его помощью можно получить максимально точный результат. Для того чтобы изучить строение почки, гистология также является одним из наиболее эффективных обследований.
Что такое гистология?

Гистология - это изучение человеческого тканевого материала под микроскопом. Благодаря такому методу специалист выявляет все болезнетворные клетки или же новообразования, которые присутствуют у человека. Стоит отметить, что такой способ изучения - самый эффективный и точный на данный момент. Гистология опухоли почки является одним из наиболее эффективных методов диагностики.
Методика проведения забора материала для гистологии
Как было описано выше, гистология - это изучение образца человеческого материала под микроскопом.
Чтобы изучить тканевый материал гистологическим методом, проводят следующие манипуляции.
Когда исследуется почка (гистология), препарат обязательно указывается под определенным номером.
В целом процесс подготовки образца к проведению гистологии требует не только повышенного внимания, но и высокого профессионализма от всех специалистов лаборатории. Стоит отметить, что проведение такого исследования требует неделю времени.
В некоторых случаях, когда ситуация носит экстренный характер и требуется срочная гистология почки человека, лаборанты могут прибегнуть к экспресс-тесту. В таком случае забранный материал предварительно замораживают перед выполнением нарезки образца. Минус от такой манипуляции в том, что полученные результаты будут менее точными. Подходит экспресс-тест только для выявления опухолевых клеток. При этом количество и стадийность недуга необходимо изучать отдельно.
Способы забора анализа для проведения гистологии
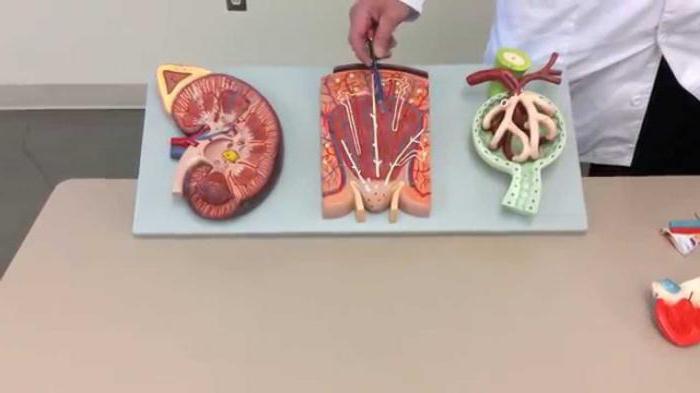
Как производится срез почки (гистология)?
Игла вводится через кожу под строгим контролем приборов. Открытый метод - почечный материал забирается во время проведения оперативного вмешательства. К примеру, во время удаления опухоли либо же когда у человека работает только одна почка. Уретроскопия - такой метод используют для детей или беременных женщин. Проведение забора материала с помощью уретроскопии показано в случаях, если в почечной лоханке имеются камни.
Транс яремная методика используется в случаях, если человек страдает нарушениями свертываемости крови, при избыточном весе, при дыхательной недостаточности или при врожденных дефектах почек (киста почки). Гистология производится различными способами. Каждый случай рассматривается специалистом индивидуально, согласно особенностям человеческого организма. Более детальную информацию о проведении такой манипуляции может дать только квалифицированный врач. При этом стоит отметить, что обращаться следует только к опытным врачам, не стоит забывать тот факт, что данная манипуляция достаточно опасна. Врач без опыта может принести много вреда.
Как проводится процедура забора материала на проведение гистологии почек?

Что именно делают?
Гистология почек проводится следующим образом. Человек укладывается на больничную кушетку лицом вниз, при этом подкладывают под живот специальный валик. Если почка была ранее пересажена у больного, то человек должен лечь на спину. При проведении гистологии специалист на протяжении всей манипуляции контролирует пульс и давление у больного. Доктор, проводящий данную процедуру, обрабатывает место, куда планируется введение иглы, затем вводит обезболивание. Стоит отметить, что в целом при проведении такой манипуляции болезненные ощущения сведены к минимуму. Как правило, проявление боли во многом зависит от общего состояния человека, а также от того, насколько правильно и профессионально была выполнена гистология почек. Поскольку практически все возможные риски развития осложнений связаны только с профессионализмом врача.
Когда игла проникает под кожный покров к почке, у человека может появиться ощущение давления. А когда непосредственно происходит забор образца ткани, то человек может услышать небольшой щелчок. Все дело в том, что такая процедура производится пружинным методом, поэтому данные ощущения не должны пугать человека.
Стоит отметить, что в некоторых случаях в вену пациента могу ввести определенное вещество, которое будет показывать все важнейшие кровеносные сосуды и непосредственно саму почку.
Гистология почек в редких случаях может проводиться в два или даже три прокола, если забранного образца будет недостаточно. Ну а когда тканевый материал взят в необходимом количестве, доктор выводит иглу, а на место, где проводилась манипуляция, накладывают повязку.
В каких случаях могут назначить проведение гистологии почек?
- если выявлены острые или хронические дефекты неясного происхождения;
- при сложных инфекционных заболеваниях мочевыводящих путей;
- при обнаружении крови в моче;
- при повышенной мочевой кислоте;
- для уточнения дефектного состояния почек;
- при нестабильной работе почки, которая была ранее пересажена;
- для установления степени тяжести заболевания или повреждения;
- если есть подозрение на кисту в почке;
- при подозрении на злокачественное новообразование в почке (рак почки) гистология обязательна.
Важно понимать, что гистология - это самый достоверный способ выявления всех патологий почек. С помощью образцов ткани можно установить точный диагноз и выявить степень тяжести заболевания. Благодаря такому методу специалист сможет подобрать наиболее эффективное лечение и предупредить все возможные осложнения. Особенно это касается тех случаев, когда первичные результаты указывают на появившиеся новообразования в данном органе.
Какие могут быть осложнения при взятии материала на исследование?
- Возможное кровотечение. В этом случае необходимо срочное переливание крови. В редких случаях потребуется оперативное вмешательство с дальнейшим удалением поврежденного органа.
- Возможен разрыв нижнего полюса почки.
- В некоторых случаях гнойное воспаление жировой оболочки вокруг самого органа.
- Кровотечение из мышцы.
- При попадании воздуха может развиться пневмоторакс.
- Заражение инфекционного характера.
Стоит отметить, что данные осложнения происходят крайне редко. Как правило, единственный негативный симптом - это небольшое повышение температуры после проведенной биопсии. В любом случае, если возникла необходимость в такой процедуре, то лучше обратиться к квалифицированному специалисту, у которого достаточно опыта в проведении такой манипуляции.
Как проходит послеоперационный период?
Людям, которым предстоит пройти данную манипуляцию, следует знать несколько простых правил послеоперационного периода. Следует точно следовать рекомендациям врача.
Что должен знать и выполнять больной после процедуры гистологии?

Стоит отметить, что небольшое количество крови в моче может присутствовать на протяжении суток после забора биопсии. В этом ничего страшного нет, поэтому кровяная примесь не должна пугать человека. Важно понимать, что альтернативы гистологии почек нет. Любой другой способ диагностики не дает таких точных и развернутых данных.
В каких случаях забор материала на гистологическое обследование выполнять не рекомендуется?
Противопоказаний для забора материала на исследования несколько, а именно:
- если у человека только одна почка;
- при нарушении свертываемости крови;
- если у человека есть аллергия на новокаин;
- если в почке была обнаружена опухоль;
- при тромбозе почечных вен;
- при почечной недостаточности.
Если человек страдает хоть одним из вышеперечисленных недугов, то забор материала на гистологическое исследование из почек категорически запрещен. Поскольку данный метод обладает определенными рисками развития серьезнейших осложнений.
Заключение
Современная медицина не стоит на месте, она постоянно развивается и дарит людям все новые открытия, которые помогают спасти человеческую жизнь. К таким открытиям можно отнести и гистологическое исследование, оно является самым эффективным на сегодняшний день для выявления многих заболеваний, в том числе и раковых опухолей.
Основной метод лечения рака почки (РП) любой стадии – это его хирургическое удаление. Вследствие того, что этот вид злокачественной опухоли почти нечувствителен к химиотерапии и облучению, онкологи примерно в половине случаев наблюдают его послеоперационное распространение.
Чаще встречаются отдаленные метастазы. Местные рецидивы — явление редкое, но почти всегда ассоциирующиеся с неблагоприятным прогнозом.
Лечение возобновления злокачественного процесса не стандартизировано. Основная надежда возлагается на повторную операцию, другие методы лечения не доказали свою эффективность.
Рецидив – это повтор, возвращение. Это состояние, когда на месте удаленной опухоли вновь наблюдается рост карциномы с той же гистологической структурой.

При лечении почечноклеточного рака применяются следующие основные виды операций:
- Радикальная нефрэктомия – орган удаляется полностью вместе с окружающей ее клетчаткой, надпочечником и регионарными лимфоузлами.
- Нефрэктомия – удаляется только почка, без надпочечника и лимфоузлов.
- Резекция. Это органосохраняющая операция, при которой иссекается часть почки вместе с опухолью.
- Малоинвазивные методики уничтожения злокачественных очагов – криодеструкция, радиочастотная аблация, эмболизация. Для каждой из этих операций существуют свои показания, и зависят они от размеров опухоли и стадии процесса.
Вероятность рецидива рака почки существует как после радикальных, так и органосохраняющих операций. Несколько большая частота их после резекции почки совсем не означает, что от таких операций нужно отказываться.
Статистика
Данные литературы, касающиеся местных рецидивов, очень скудны, единых рекомендаций и алгоритма нет. Опубликованы несколько исследований различных крупных клиник, описывающих собственный опыт наблюдений за пациентами, прооперированными по поводу рака почки. Из них можно сделать выводы:
- Частота развития этого события после радикальной нефрэктомии – от 2 до 4% (некоторые авторы указывают цифру до 14%).
- Рецидив рака почки после резекции встречается немного чаще, от 4 до 10%.
- Сроки повторного разрастания опухоли – от нескольких месяцев до нескольких лет в послеоперационном периоде (около 80% их возникает в первые 3 года).
- В половине случаев местное распространение сочетается с отдаленными метастазами.
Основные причины возвращения заболевания:
- Не полностью удаленная опухолевая ткань.
- Неадекватное иссечение регионарных лимфоузлов.
- Периоперационная имплантация злокачественных клеток (попадание клеток рака на окружающие ткани непосредственно во время операции).
- Отсутствие адъювантной (послеоперационной) терапии вследствие химио- и радиорезистентности почечноклеточного рака.
Факторы риска развития рецидивов
Большинство авторов выделяет следующие критерии, при которых риск повторного появления новообразования увеличивается:
- Гистологический тип опухоли. В 95% случаев рецидивирует светлоклеточный рак (однако он является и самым распространенным).
- Низкая степень дифференцировки по градации Фурмана.
- Наличие метастазов в лимфоузлах.
- Размеры (чем больше опухоль, тем выше риск).
- Осложнение в виде венозного тромбоза.
- Наличие отдаленных метастазов.
- Рецидивы выявляются чаще у больных, имевших клинические признаки первичной опухоли, чем у бессимптомных пациентов.
- Нерадикальность операции.
- Внебрюшинный доступ (люмботомия) сопряжен с большим процентом рецидивов, чем лапаротомический.
Виды рецидивов
Возможно возникновение местного рецидива в оперированной почке или надпочечнике после резекции опухоли и локорегионарного – после радикальной нефрэктомии.
Локорегионарные рецидивы возникают в ложе удаленной почки, в забрюшинных лимфоузлах, в послеоперационном рубце.
Возврат заболевания может быть представлен одним опухолевым узлом или несколькими.
Повторные новообразования отличаются агрессивным инвазивным ростом, в половине случаев прорастают в соседние органы – печень, поджелудочную железу, селезенку, нижнюю полую вену, аорту, поясничную мышцу, толстый или тонкий кишечник.
Клиническая картина
В 40% случаев рецидивы протекают бессимптомно и обнаруживаются только во время очередного динамического наблюдения. Появление жалоб и клинических признаков считается плохим прогностическим критерием.
Местный рецидив после резекции почки будет вести себя так же, как и первичная опухоль. Она может проявляться болями, гематурией, общими и неопластическими признаками.
При локорегионарном росте почечных симптомов не будет, так как сама почка удалена. Клинические признаки возможны при прорастании опухоли в окружающие ткани, генерализации процесса (рецидив может метастазировать так же, как и первичная опухоль). Возврат заболевания проявлятся паранеопластическими симптомами.
При каких признаках можно заподозрить рецидив рака почки:
В оперированном органе.
- Гематурия (появление крови в моче).
- Боли в поясничной области или подреберье ноющего характера, иногда по типу почечной колики.
- Немотивированная артериальная гипертензия.
- Слабость, потеря аппетита.
- Повышение температуры тела.
- Отеки ног.
- Варикоцеле у мужчин.
Локорегионарный рецидив на месте удаленного органа.
- Появление болей в спине при инвазии поясничной мышцы, нервных рецепторов.
- При прорастании в органы панкреатодуоденальной зоны боли локализуются в животе или подреберьях, имитируют панкреатит, холецистит, возможно развитие желтухи.
- Так же, как и первичная опухоль, рецидив сопряжен с риском развития тромбоза нижней полой вены, что проявится отеками ног, тромбофлебитами, расширением вен мошонки у мужчин.
- Инвазия в селезенку проявляется болями и тяжестью в левой половине живота.
- Прорастание кишечной стенки может спровоцировать примесь крови в кале или кровотечение, вызвать непроходимость кишки.
- Паранеопластические синдромы – слабость, утомляемость, субфебрильная температура, похудание, онемение конечностей.
Диагностика
Пациенты, оперированные по поводу рака почки, находятся под диспансерным наблюдением. Самое частое и доступное обследование – это анализы. Даже при отсутствии симптомов следует обращать внимание на:
- Снижение гемоглобина (анемия).
- Увеличение СОЭ.
- Повышение креатинина, мочевины, щелочной фосфатазы, ЛДГ, печеночных трансаминаз, билирубина, кальция.
- Микрогематурия (эритроциты в моче).
Любой отклонение этих показателей – повод для дальнейшего обследования. Специфических онкологических маркеров для рака почки не выявлено.
- Ультразвуковая диагностика. УЗИ – скрининговый метод, в 80-90% позволяет выявить опухоль более 1 см и увеличение лимфоузлов.
- КТ – компьютерная томография. Стандарт для диагностики как первичных опухолей, так и рецидивов. С точностью до 100% оценивает размеры, распространенность, прорастание в соседние органы, поражение лимфоузлов.
- МРТ – назначается иногда как уточняющее обследование при подозрении на опухолевый тромбоз, а также при аллергии на контраст.

- Ангиография проводится при планировании операции.
Лечение
Единых стандартов лечения рецидивов рака почки нет. Имеющиеся наблюдения и анализ различных методов показывает, что наиболее оправдано оперативное удаление опухолевой ткани. Предпринимаются попытки лечить его как рак четвертой стадии – иммунными и таргетными препаратами, однако эффективность такой терапии очень низкая.
Операция дает 51% трехлетней выживаемости (против 18% при консервативной терапии).
Всегда нужно стремиться к радикальному удалению всех очагов опухоли.
При возобновлении ракового роста в оперированной почке после резекции проводится обычно радикальная нефрэктомия с удалением лимфоузлов и надпочечника. Эффективность такой операции высокая, если вторая почка в удовлетворительном состоянии.
При локорегионарном рецидиве проводится иссечение опухолевой ткани в ложе удаленной почки. При прорастании новообразования в окружающие органы и проводятся комбинированные операции, если это технически возможно. Оправдана максимально агрессивная, направленная на радикальность, хирургическая тактика.
Вместе с иссечением рецидивной раковой опухоли может быть выполнена:
- Спленэктомия (удаление селезенки).
- Панкреатодуоденальная резекция.
- Резекция нижней полой вены.
- Иссечение поясничной мышцы.
- Резекция печени.
- Гемиколэктомия.
- Тромбэктомия из нижней полой вены.
Подобные расширенные и комбинированные операции сопряжены с высоким риском осложнений (до 30%) и летальности (до 15%). Однако отсутствие других альтернативных методов лечения не оставляет врачам и пациентам выбора.
Если проведение радикальной операции технически невыполнимо, проводится симптоматическое лечение. Консервативная терапия считается нецелесообразной.
Прогноз
Появление рецидива резко ухудшает прогноз пациентов с раком почки. 3-х летняя выживаемость таких больных – не более 30%. Хирургическое удаление опухоли повышает эту цифру до 50%. Применение таргетных и иммунопрепаратов никак не влияет на выживаемость, поэтому не оправдано.
Основные факторы, ухудшающие прогноз при рецидивах:
- Сроки возникновения (чем меньше времени прошло после первичной операции, тем хуже прогноз).
- Наличие жалоб у пациента. Бессимптомное течение расценивается как благоприятное течение.
- Распространение карциномы на лимфоузлы.
- Наличие более чем одного опухолевого узла.
- Врастание в соседние органы.
- Выявление отдаленных метастазов.
- Нерадикальность хирургического вмешательства.
Рекомендации по наблюдению
Пациенты после оперативного удаления рака почки должны находиться под диспансерным патронажем. Частота обследований зависит от стадии заболевания.
| Размер первичной опухоли | Частота наблюдения | Обследования |
| Т1, Т2 (опухоль до 7см. в пределах почки). | Каждые 6 месяцев в течение 3-х лет; ежегодно до 5 лет. | Гемоглобин, креатинин, щелочная фосфатаза. УЗИ органов брюшной полости и забрюшинного пространства, рентгенография грудной клетки. |
| Т3 (прорастание в крупные вены и окружающие ткани); Т4 (прорастание в фасцию Героты и надпочечник). | Первый осмотр через 3 месяца. Каждые 6 месяцев в течение 3-х лет. Ежегодно в течение 3-10 лет. | Общеклинические анализы УЗИ или КТ брюшной полости и забрюшинного пространства, КТ легких. |
Повторные рецидивы после их хирургического удаления возникают у 47% пациентов, прогноз при этом значительно ухудшается.
Светлоклеточный рак почки — злокачественная опухоль, которая развивается из эпителия проксимальных канальцев или собирательных трубочек — участков, где образуется моча. Новообразование характеризуется появлением бесконтрольно делящихся клеток, которые постепенно разрушают орган. Как и любая другая злокачественная опухоль, данное новообразование склонно к метастазированию. В настоящее время наблюдается рост заболеваемости светлоклеточным раком почки. Мужчины болеют практически в два раза чаще женщин.
- Факторы риска
- Клиническая картина
- Диагностика
- Классификация
- Метастазирование
- Лечение
- Диспансерное наблюдение
Факторы риска
Специалисты выделяют ряд состояний, которые могут увеличивать риск развития светлоклеточного рака почки. К ним относятся:
- Наследственная предрасположенность (наличие рака почки у родителей или кровных родственников).
- Синдром фон Гиппеля-Линдау — генетическое заболевание, проявлением которого являются опухоли различных внутренних органов, в том числе и почек.
- Приобретенные факторы — курение, ожирение, сахарный диабет, артериальная гипертензия и др.
Кроме того, имеются научные данные, доказывающие, что заболевание может развиваться при длительном приеме некоторых мочегонных средств.
Клиническая картина
Ранняя стадия светлоклеточного рака почки протекает бессимптомно. Часто новообразование является случайной находкой при выполнении инструментальных методов диагностики. По мере развития опухоли могут присоединяться следующие симптомы поражения ткани почек:
- Гематурия — появление эритроцитов в моче. При большом их количестве моча приобретает красноватый оттенок (цвет мясных помоев). Небольшое количество эритроцитов не изменяет внешний вид мочи и выявляется только лабораторными методами.
- Болевой синдром в области поясницы или подреберья.
- Пальпируемое образование в области подреберья. Соответствует запущенной форме рака почки, когда опухоль достигает больших размеров.
К экстраренальным (внепочечным) симптомам опухоли относят:
- Варикоцеле (расширение вен) яичка. Является редким признаком новообразования почки и встречается всего у 3% больных. Наличие данного симптома у пациентов с другими признаками рака почки или при наличии факторов риска врач должен проявить настороженность и назначить дополнительное обследование.
- Синдром сдавления нижней полой вены. Возникает у 50% больных. Характеризуется отеком обеих ног, двусторонним варикоцеле, появлением венозной сети в области живота, тромбозом глубоких вен нижних конечностей.
- Симптоматическая гипертензия. Почки участвуют в поддержании нормального артериального давления. Нарушение их функции вызывает гипертензию.
К общим симптомам, характерным для любой злокачественной опухоли, относится слабость, недомогание, потеря массы тела и лихорадка.
Диагностика
Диагностика светлоклеточного рака почки начинается со сбора анамнеза, осмотра и пальпации. Врач проводит опрос больного, уточняет наличие жалоб и факторов риска. При осмотре особое внимание уделяется признакам сдавления нижней полой вены, варикоцеле, исследованию лимфатических узлов, которые могут быть поражены метастазами.
Инструментальные способы включают в себя следующие мероприятия по диагностике рака:
- Ультразвуковое исследование органов забрюшинного пространства. Позволяет узнать точное расположение и распространенность рака, метастазы в близлежащих лимфатических узлах, опухолевое поражение нижней полой вены.
- Компьютерная томография с контрастированием. Чувствительность метода превышает 95%. Позволяет визуализировать опухоль и метастатические поражения органов и лимфатических узлов.
- Магнитно-резонансная томография области почек. Отличается высокой информативностью и безопасностью, не оказывает лучевой нагрузки на организм.
- Биопсия почки. Наиболее часто применяются чрескожные методы. Врач осуществляет пункцию почки и затем отправляет материал на микроскопическое исследование.
Классификация
Рак почки насчитывает несколько классификаций. С помощью гистологического исследования специалист устанавливает морфологическую форму и степень злокачественности (дифференцировки) опухоли. Светлоклеточный рак встречается в 70-85% случаев злокачественных новообразований почки. По степени злокачественности выделяют четыре градации:
- G1. Клетки содержат одинаковые, ровные ядра. Эта стадия рака обнаруживается у 10-15% всех больных.
- G2. Ядра крупные, имеют неправильную форму. Диагностируется чаще всего — у 35-50% больных.
- G3. Ядра крупные, неправильной формы. Наблюдается у 25-35% больных.
- G4. Клетки содержат несколько крупных ядер, неправильной причудливой формы. Диагностируется у 5-15% больных.
Классификация по TNM насчитывает четыре стадии рака. Они формируются на основании размера опухоли, поражения внутренних органов (кости, легкие и другие) и лимфатических узлов. Стадия рака почки по TNM определяет тактику лечения и прогноз.
Метастазирование
Метастазы — это вторичные опухолевые очаги, которые образуются в результате распространения опухолевых клеток по организму из первичного образования. Светлоклеточный рак почки может метастазировать гематогенным и лимфогенным путями. В первом случае опухолевые клетки распространяются с током крови во внутренние органы. Наиболее часто поражаются легкие, головной мозг, кости. Также метастазы рака могут распространяться по лимфатическим сосудам и образовывать вторичные очаги в лимфоузлах. В первую очередь поражаются сторожевые узлы — первые на пути оттока лимфы.
Лечение
Главным способом лечения является оперативный метод. Различают следующие его разновидности:
- Резекция почки. Представляет собой удаление светлоклеточной опухоли. Является органосохраняющей операцией. Показаниям является наличие рака единственной почки, небольшие размеры опухоли.
- Нефрэктомия — удаление почки целиком. Дополнительно удаляется околопочечная клетчатка и региональные лимфатические узлы. В случае распространения опухолевого процесса на надпочечник, он удаляется вместе с почкой. Показаниями к удалению органа являются: большой размер опухоли, распространение рака на нижнюю полую вену или почечную артерию.
Оперативное лечение рака может быть выполнено открытым и лапароскопическим способом. Альтернативой вышеописанному лечению является радиочастотная абляция и криоабляция.
Радиочастотная абляция (РЧА) — это локальное уничтожение опухоли. Суть метода заключается в подведении к раку почки электрода, который испускает радиочастотные волны на опухолевые ткани. Это приводит к их нагреву и разрушению. Основной задачей РЧА является создание температуры 50-100 оС в области новообразования. В этом случае гибель раковых клеток происходит в течение 4-6 минут. Показанием к выполнению РЧА является маленькая опухоль размером не более 4 см, расположенная на периферии почки. Часто РЧА выполняют пожилым людям с высоким операционным риском.
Криоабляция также является точечным методом удаления опухолевых тканей и имеет такие же показания, как и РЧА. Метод позволяет разрушить светлоклеточный рак почки путем подведения к ним специальных криозондов и последовательной заморозки патологических тканей. Криоабляция может быть выполнена тремя способами:
- Открытый. Криоабляция осуществляется в процессе оперативного вмешательства. Преимуществами являются высокая точность в уничтожении рака и низкая вероятность повреждения здоровых тканей, нервных волокон и сосудов.
- Чрескожный. Выполняется под контролем УЗИ. Является операцией с малой травматичностью.
- Лапароскопический — является эффективным оперативным вмешательством по лечению рака. Позволяет с высокой точностью расположить криозонды, при этом обладает меньшей травматичностью в сравнении с открытым способом.
Лекарственная терапия, как правило, используется при диссеминированных формах рака почки. Преимущественно применяются таргетные препараты. Они ингибируют белки и ферменты, которые контролируют процесс роста светлоклеточного рака почки. Используются ингибиторы тирозинкиназы, моноклональные антитела, ингибиторы мишени рапамицина млекопитающих.
Лучевая терапия используется при метастатическом поражении костной ткани и головного мозга. Данные методы не позволяют добиться радикального лечения метастазов светлоклеточного рака почки, но позволяют уменьшить симптомы и улучшить качество жизни больного.
Диспансерное наблюдение
Регулярное медицинское наблюдение позволяет своевременно выявить рецидивы светлоклеточного рака, метастазы и оценить работоспособность почек. Диспансерный надзор осуществляется с помощью УЗИ или КТ и длится не менее 5 лет. Для оценки работы почки используют лабораторные методы исследования — определение уровня креатинина, электролитный состав, скорость клубочковой фильтрации.
Детальный анализ 427 препаратов, полученных в NWTS-1, показал, что при опухолях, имевших анапластический или саркоматозный характер, отдаленные результаты были намного хуже. Опухоли с так называемым неблагоприятным гистологическим строением включали 25 случаев анапластического поражения и 24 — саркоматозного.
Хотя эти неблагоприятные варианты наблюдались лишь у 11,5% пациентов в NWTS-1, однако на их долю приходилось 52% летальных исходов. Летальность среди детей с неблагоприятным гистологическим видом опухоли составила 57%, что очень резко контрастирует с 7%-й летальностью среди 378 пациентов с гистологически благоприятными вариантами опухоли. Подобные данные позволяют утверждать, что гистологический характер опухоли является единственным достоверным фактором, определяющим прогноз для детей с опухолью Вильмса.
Последующее изучение опухоли Вильмса внесло некоторые изменения в наши представления об этой патологии. Саркоматозные виды (светлоклеточная саркома и рабдоидные опухоли) не считаются в настоящее время вариантами опухоли Вильмса. Они не включаются в классификации злокачественных опухолей почек и обсуждаются отдельно в данной главе ниже (табл. 63-2).
Анапластические опухоли продолжают рассматриваться как неблагоприятный гистологический вариант нефробластомы. Анаплазия характеризуется наличием существенно увеличенных и необычайно мультиполярных митотических фигур, увеличены в три раза по сравнению с прилежащими клетками подобного типа и ядра, для которых свойственна гиперхромазия.
Выявление всех трех перечисленных признаков позволяет диагностировать анаплазию. Описанные изменения могут быть диффузными или локализованными. Средняя частота анапластической опухоли Вильмса составляет, по совокупным данным NWTS-2 и NWTS-3, 5,6%.
Нефробластоматоз. Хотя этиология нефробластоматоза не известна, однако существует несомненная связь между ним и опухолью Вильмса. Большинство исследователей считает это состояние предопухолевым. По мнению Беквита, наиболее важно с практической точки зрения то, что нефробластоматоз сопровождается повышенным риском последующего развития опухоли в контралатеральной почке.
Гистологически нефробластоматоз характеризуется персистированием метанефральной ткани в почке после 36-й недели гестации. Микроскопические очаги перилобарного нефробластоматоза в почках обнаруживаются у 1 % грудных детей при посмертном исследовании. У детей с опухолью Вильмса они отмечаются в 20—45% наблюдений. В зависимости от анатомической локализации нефрогенной ткани нефробластоматоз может быть отнесен к группе низкого или высокого риска. В NWTS-2 метахронная двусторонняя опухоль развилась у 5% детей с перилобарным нефробластоматозом и у 16%-с интралобарным поражением.
Рекомендации относительно лечения детей с гистологически очевидным нефробластоматозом должны основываться на анализе степени риска. Если нефробластоматоз выявляется случайно у ребенка, не имеющего опухоли Вильмса, то риск последующего развития нефробластомы оценивается в 1%, поэтому в подобной ситуации не рекомендуются ни лечение, ни интенсивное наблюдение, ни периодические диагностические мероприятия.
Если у пациента с односторонней опухолью Вильмса обнаруживаются множественные очаги ипсилатерального нефробластоматоза, то необходимо наблюдение с ежеквартальным УЗИ оставшейся почки, поскольку риск развития метахронной опухоли составляет от 5% до 16%. Если при резекции односторонней опухоли Вильмса обнаружены небольшие узелки нефробластоматоза в контралатеральной почке, то рекомендуется произвести обьгчную или эксцизионную биопсию, если это, конечно не ставит под угрозу сохранность почечной ткани.
Следует избегать любых манипуляций и вмешательств, которые угрожают жизнеспособности почки. Достаточно благоприятный опыт лечения двусторонней опухоли Вильмса в последние два десятилетия заставляет умерить энтузиазм хирургов в отношении удаления всех на вид аномальных тканей. Цель хирургического лечения пациентов с нефробластоматозом — сохранить как можно больше нормальной почечной ткани.
Лучевая и химиотерапия. Лечебная тактика при опухоли Вильмса у детей находится в состоянии постоянного изменения и развития, а сотрудничество многих специалистов позволяет наиболее рационально эту тактику определять. В 1969 году, благодаря совместным усилиям Acute Leukemia Group-B, Children's Cancer Study Group и Southwest Oncology Group было положено начало NWTS-1, под эгидой которого в течение последних 20 лет проведены три большие серии клинических исследований и начата четвертая.
National Wilms' Tumor Study-1. Начальная серия NWTS включала 606 больных с октября 1969 года по декабрь 1973 года. Был сделан ряд очень важных наблюдений. Послеоперационная лучевая терапия не повышала выживаемости детей с опухолью I стадии. Полихимиотерапия, при которой использовалась комбинация актиномицина D и винкристина, способствовала улучшению результатов у пациентов с более запущенными локальными формами опухоли (стадии II и III). Хотя при дооперационном лечении винкристином размеры опухоли у пациентов IV стадии (легочные метастазы) уменьшались, однако прогноз не улучшался.
Было изучено естественное течение опухоли Вильмса, при этом выделен ряд факторов, имеющих отрицательное влияние на исход заболевания. Неблагоприятный гистологический тип опухоли, метастазы в региональные лимфоузлы, масса опухоли более 250 г, длительность существования опухоли более 2 лет и применение одного препарата при химиотерапии — вот те факторы, которые сопровождались повышенным риском метастазов и высокой летальностью. К параметрам, не имевшим статистически достоверной корреляции с выживаемостью, были отнесены: сторона поражения, прорастание капсулы почки, сосудистая инвазия, прямое региональное распространение опухоли и интраоперационное обсеменение.
Частота дооперационных диагностических ошибок составляла 5%. Десять больных в NWTS-1 умерли в результате интоксикации и/или инфекции (3%). Самым важным научным вкладом NWTS-1, несомненно, было выделение гистологически неблагоприятных видов опухоли, что ознаменовало собой важную веху в понимании биологии опухоли Вильмса.
National Wilms' Tumor Study-2. Перед NWTS-2 были поставлены следующие цели: выяснить, какой должна быть продолжительность химиотерапии у детей с опухолью I стадии и изучить эффективность и токсичность доксорубицина, используемого в качестве третьего химиотерапевтического препарата у детей с опухолью II, III и IV стадий. С октября 1974 по июль 1978 года во второй серии клинических исследований NWTS зарегистрировано 755 детей.
Количество пациентов с неблагоприятным гистологическим типом (11,9%), двусторонней опухолью (4,6%) и мезобластной нефромой (1,5%) было таким же, как и в NWTS-1, что подтверждает сходность групп пациентов в этих сериях и сопоставимость результатов исследований. Среди пациентов с I стадией, получавших комбинацию актиномицина D и винкристина, частота рецидивов и выживаемость не зависели от продолжительности лечения (6 или 15 месяцев).
Безрецидивная 2-летняя выживаемость детей со II—III стадиями и благоприятным типом опухоли при проведении химиотерапии тремя препаратами (актиномицин D, винкристин и доксорубицин) была выше, чем при использовании двух препаратов (90% и 75% соответственно). Однако показатели общей 2-летней выживаемости не отличались.
Исходы у пациентов, имевших метастазы при первичной диагностике (стадия IV), были неутешительными. Среди пациентов с IV стадией не отмечено существенной разницы в отношении безрецидивной выживаемости в зависимости от того, два или три препарата применялись для химиотерапии (43% и 59% соответственно). Как и в NWTS-1, исходы при неблагоприятном гистологическом типе опухоли были намного хуже, чем при благоприятном типе (2-летняя выживаемость 54% и 90% соответственно).
Ухудшался прогноз и при вовлечении региональных лимфоузлов (2-летняя выживаемость 54% против 82%). Риск летальных исходов, связанных с лечением (как результат токсичности препаратов и инфекции), оставался вполне приемлемым (2%). Частота дооперационных диагностических ошибок снизилась до 1,6%.
National Wilms* Tumor Study-З. В третьей серии NWTS была сделана попытка уменьшить интенсивность и продолжительность терапии у детей из группы низкого риска и разработать более эффективные программы химиотерапии для пациентов из групп высокого риска. С мая 1979 года по ноябрь 1985 года 1439 детей были зарегистрированы в NWTS-3. Частота неблагоприятных гистологических типов опухоли (10,4%), двусторонней опухоли (6,5%) и ошибок до-операционной диагностики (2,3%) была такой же, как и в предыдущих сериях.
У пациентов из группы низкого риска применение менее агрессивных лечебных протоколов не сопровождалось ухудшением результатов. У детей с 1 стадией гистологически благоприятной (FH — favorable histology) опухоли при лечении актиномицином D и винкристином частота рецидивов и выживаемости не зависела от продолжительности химиотерапии (10 недель или 6 мес). Добавление доксорубицина при стадии II-FH не улучшало результаты.
У детей со стадией III-FH отмечалось некоторое улучшение результатов при лечении тремя препаратами. При опухоли IV-FH стадии добавление циклофосфамида к стандартному протоколу из трех препаратов не повышало показателей двух- и 4-летней выживаемости, так же, как и не снижало частоты рецидивов. Лучевая терапия (2000 сГр) не приводила к улучшению результатов лечения детей с поражением II-FH, У пациентов с III стадией, получавших 1000 или 2000 сГр, частота рецидивов и выживаемость не зависела от облучения.
Полученные в результате исследования данные подтвердили, что 4-компонентная химиотерапия может быть эффективна у пациентов с IV стадией заболевания и с анапластическими опухолями. Исходы заболевания у детей с I-FH стадией были сравнимы с этим показателем у пациентов с гистологически благоприятными опухолями.
Показатель летальности, связанной с токсичностью препаратов и/или с инфекцией, составил 1,5%. Это позволяет говорить о том, что улучшение результатов достигнуто не ценой повышения частоты осложнений самого лечения.
Основной целью, поставленной перед NWTS-4, было улучшение перспектив для детей с опухолью Вильмса путем упрощения, укорочения и дальнейшей разработки различных лечебных протоколов и таким образом уменьшения социально-экономических последствий терапии для ребенка, семьи и общества. NWTS-4 было начато в 1985 году, и в настоящее время продолжается накопление материала. Последние, наиболее современные рекомендации по лечению пациентов с опухолью Вильмса представлены в таблице 63-3.
Читайте также:

