Гист опухоль тонкого кишечника при удалении развалилась
Гастроинтестинальные стромальные опухоли (GIST - Gastrointestinal Stromal Tumors) - наиболее распространенные мезенхимальные опухоли ЖКТ, которые происходят из клеток кишечных пейсмейкеров, т.н. интестинальных клеток Кахаля.
Отличием от других мезенхимальных опухолей ЖКТ (например, лейомиомы, шванномы и т.д.) является наличие специфических маркеров GIST с экспрессией, равной наблюдаемой в интерстициальных клетках Кахаля, и выявляемых при иммуногистохимическом анализе:
• CD117 (KIT): генный продукт c-kit протоонкогена рецептора фактора роста стволовой клетки.
• CD34: антиген гемопоэтических клеток-предшественников.
• PDGF альфа-рецептор (PDGFRA): альтернативный с c-kit механизм онкогенеза.
Злокачественный потенциал GIST сложен для оценки:
• Благоприятные факторы прогноза: локализация в желудке, диаметр 10 см, митотический индекс > 10 митозов на 10 полей зрения при большом увеличении, инвазия в соседние органы, признаки отсевов по брюшине или отдаленные метастазы.
Гастроинтестинальные стромальные опухоли (GIST) высокорезистентны к обычной химиотерапии. Лечение в основном хирургическое: резекция локализованной GIST, если опухоль резектабельна.
При рецидивных или местнораспространенных опухолях, а также при метастазах в последнее время как с паллиативной целью, так и с целью адъювантной и неоадъювантной терапии все чаще применяют иматиниб (Gleevec). Ответ опухоли на иматиниб (Gleevec) - ингибитор активности КГГ-киназы - коррелирует с экспрессией CD117.
а) Эпидемиология:
• Составляют 0,1-3% от всех опухолей ЖКТ. Ожидаемая ежегодная заболеваемость: 10-15 новых случаев на 1 миллион населения, т.е. в США регистрируется 3000-5000 новых случаев каждый год. Средний возраст: 50-60 лет, с одинаковой частотой для обоих полов.
• Локализация GIST: желудок - 50-60%, тонкая кишка - 25-30%, ободочная/прямая кишка и ректовагинальная перегородка - 2-10%, пищевод - 9% случаев. Другие локализации: забрюшинное пространство, поджелудочная железа и т.д. На момент постановки диагноза приблизительно 50% GIST имеют мультифокальный рост или метастазы.
б) Симптомы. Неспецифические симптомы: боль, обструкция, кровотечение или видимая/пальпируемая опухоль. Случайные находки при обследовании с помощью методов лучевой визуализации, эндоскопии.
в) Дифференциальный диагноз:
• Другие доброкачественные мезенхимальные опухоли: лейомиома, липома, нейрофиброма (шваннома).
• Другие злокачественные мезенхимальные опухоли: лейомиосаркома, нейрофибросаркома и т.д.
• Эпителиальные опухоли.
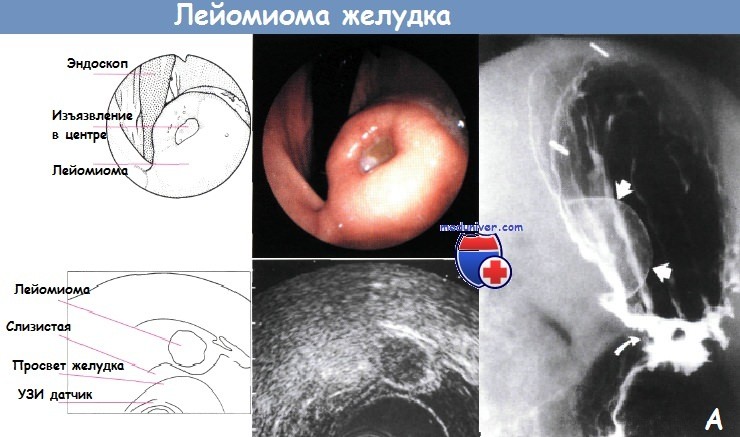
А - Рентгенологическое исследование желудка с двойным контрастированием.
Обнаружена лейомиома — гладкое образование в подслизистом слое (прямые стрелки) в области дна желудка.
Можно заметить гастроеюноанастомоз (изогнутая стрелка) у этого пациента после резекции желудка по Бильрот II.
г) Патоморфология гастроинтерстициальных стромальных опухолей
Макроскопическое исследование:
• Солидная или с кистозными участками опухоль различного размера: 1-20 см.
• Геморрагии.
• Очаговый некроз.
• Пути диссеминации: вовлечение лимфатических узлов относительно редко (менее 25% случаев); метастазирование в печень, по брюшине, реже - в легкие и кости.
Микроскопическое исследование:
• Веретеновидноклеточные, эпителиоидные или плеоморфные (смешанные) опухоли => ультраструктурные и иммуногистохимические отличия от лейомиомы, лейомиосаркомы или шванномы.
Иммуногистохимическое исследование:
• CD117 (KIT): 75-80% (цитоплазма).
• CD34 (антиген гемопоэтических клеток-предшественников): 60-70%.
• PDGFRA: 5-10%.
Обычные прогностические параметры:
1) размер опухоли;
2) митотический индекс (митозы/число полей зрения при большом увеличении). Выраженность KIT коррелирует с ответом на иматиниб.
д) Обследование при гастроинтерстициальной стромальной опухоли
Необходимый минимальный стандарт:
• Полное обследование толстой кишки (предпочтительно колоноскопия) в обязательном порядке при плановых операциях для выявления мультифокальных опухолей, синхронных раковых опухолей или полипов, а также сопутствующих заболеваний толстой кишки.
• Методы лучевой визуализации: КТ, ПЭТ, МРТ для оценки местной распространенности и выявления отдаленных метастазов.
Дополнительные исследования (необязательные):
• Такие же, как при КРР.
• ЭГДС.
е) Классификация:
• Иммуногистохимическая: KIT-положительные (GIST 85-95%) или KIT-отрицательные (GIST 5-15%).
• Характер опухоли: доброкачественные GIST/злокачественные GIST.
• Операбельные/неоперабельные или мультифокальные/метастатические GIST.
ж) Лечение без операции гастроинтерстициальной стромальной опухоли (GIST) зависит от степени распространенности опухоли:
• Возможная адъювантная химиотерапия во всех случаях?
• (Нео-)адъювантная терапия иматинибом (Gleevec, ингибитор тирозинкиназы) при условно резектабельных GIST.
• Рецидивные, местнораспространенные, нерезектабельные или метастатические GIST: 45-80% первичного ответа на паллиативное лечение Gleevec.
• Роль лучевой терапии не определена.
з) Операця при гастроинтерстициальной стромальной опухоли (GIST)
Показания:
• Любая локализованная форма GIST, при которой возможно полное удаление опухоли без инвалидизации, за исключением случаев абсолютных противопоказаний или множественных метастазов.
• Мультифокальные GIST, только у тщательно отобранных больных (после нео-адъювантной терапии иматинибом).
Хирургический подход. Резекция органа, пораженного опухолью, en-block интактной псевдокапсулой; радикальная лимфаденэктомия показана не во всех случаях.
и) Результаты гастроинтерстициальной стромальной опухоли (GIST):
• Локализованные GIST: выживаемость без признаков заболевания в течение одного года составляет 80-90%, пятилетняя выживаемость после полного хирургического удаления в среднем составляет 50%.
• Метастатические GIST: средняя выживаемость по данным литературы составляет около 20 месяцев, однако 80% больных при назначении иматиниба имеют преимущество в выживаемости.
к) Наблюдение:
• Общее клиническое наблюдение в настоящее время четко не определено.
• Методы лучевой визуализации: КТ, ПЭТ с обычными интервалами.
• Эндоскопия (колоноскопия/ЭГДС), по крайней мере, через каждые 6-12 месяцев.
• В зависимости от локализации: эндоректальная ультрасонография.
- Вернуться в оглавление раздела "Хирургия"

Гастроинтестинальные стромальные опухоли (ГИСО, ГИСТ) появились чуть больше 20 лет назад, когда усовершенствовали электронный микроскоп, их выделили из компании разнообразных лейомиом. ГИСТ — русскоязычная аббревиатура с английского. Это опухоли зрелого возраста, до 40 лет они встречаются очень редко, преобладают мужчины в середине седьмого десятка жизни. Предполагается, что заболеваемость не растет, просто диагностика стала лучше.

Причина стромальных опухолей
Диагностика ГИСО
В диагностике ГИСО возможности клиники определяют всё - нет возможностей — нет такого заболевания. Идеально сочетание эндоскопии с УЗИ — эндосонография, которая позволяет видеть внутри и за пределами желудка — состояние рядом находящихся структур и всю толщину желудочной стенки.
Главный диагностический критерий — иммуногистохимическое выделение в опухолевых клетках онкобелка KIT (CD117). Этот онкобелок синтезируют мелкоклеточный рак легкого и глиобластома, лейкоз из тучных клеток, метастазы меланомы и сосудистые образования, то есть возможен ложноположительный ответ при не гастроинтестинальной стромальной опухоли, к примеру, при поражении желудка или кишки лейкозом.
Дикими называют стромальные опухоли без с-KIT, таких пять на сотню всех гастроинтестинальных новообразований, внешне они ничем не отличаются от положительных по с-KIT, но течение и реакция на лекарственные препараты у них другая. Поскольку при диагностике с-KIT определяется только в двух экзонах из четырех, но в двух не исследуемых он может быть. В диких опухолях возможна мутация альфа-PDGFR или рецептора инсулинового фактора роста (IGF1R). Когда вообще не находят ни единого маркера, то выполняется молекулярно-генетический анализ, он способен выделить стромальную опухоль, негативную по всем известным критериям диагностики.
ГИСО растет под неизмененной слизистой, заметить маленький узел может только специалист с большим опытом наблюдения стромальных образований.
Симптомы стромальных опухолей желудка
Каждую пятую опухоль обнаруживают случайно при обследовании по другому поводу, узел же может постигать трети метра, ничем серьезным себя не проявляя. Причина частого бессимптомного течения — подслизистый рост, когда опухоль распластывается в стенке и выбухает наружу — в брюшную полость. К моменту обнаружения стромального образования у каждого третьего уже выявляются метастазы, преимущественно в печень, часто — канцероматоз брюшины, а вот легочная ткань поражается нечасто.
Никаких специфических проявлений нет, такие же симптомы возникают при других заболеваниях желудочно-кишечного тракта. В среднем от появления первых признаков неблагополучия до выявления патологического образования проходит почти полгода.
Что характерно только для ГИСТ?
Это не клинические симптомы, а сочетание стромальной опухоли с другими новообразованиями у девочек и молодых женщин. Синдром проявляется в сочетании ГИСО с параганглиомой, как правило, на шее или в животе, и доброкачественными гамартомами легких. Называется триада Карнея, сегодня таких пациентов чуть больше сотни. Гамартомы никак себя не проявляют, их обнаруживают при рентгеновском обследовании, а гормонально активная параганглиома вызывает повышение давления. Составляющие триаду процессы появляются с интервалом в несколько лет.
Когда гастроинтестинальное стромальное образование сопровождается множественными параганглиомами, то это синдром Карнея-Стратакиса, он генетически наследуется и вызван недостатком одного фермента, опять-таки поражает женщин. От врачей зависит своевременность выявления возможных метастазов, когда они хорошо лечатся. В Европейской онкологической клинике кумулирован опыт клинического наблюдения,что помогает изменить прогноз заболевания на благоприятный.
Лечение и химиотерапия

При любой злокачественной опухоли радикально лечит только удаление, и при ГИСТ ведущий метод — хирургический. При поражении желудка выполняются резекция или удаление всего органа — гастрэктомия, всё зависит от объема поражения. Лапароскопические операции следует делать только в специализированных учреждениях, поскольку имеется опасность разрыва неплотной псевдокапсулы с выбросом опухолевых клеток в брюшную полость.
Химиотерапия иматинибом имеет хорошую перспективу при наличии мутации гена с-KIT, применяется при метастатической стадии или рецидиве после операции, перед хирургическим этапом для уменьшения размера образования и объема операции. Доза иматиниба зависит от расположения мутации гена KIT, так она увеличивается двукратно при мутации в 9 экзоне. При прогрессировании на фоне химиотерапии используют лекарства второй линии: сунитиниб и дазатиниб. Их используют и при устойчивости ГИСО к иматинибу. В качестве третьей линии лечения применяется регорафениб.
Все ГИСТ активные химиопрепараты относятся к таргетным средствам — точно нацеленным, что не исключает токсические реакции на них. Химиотерапия не обязательно должна сопровождаться плохим качеством жизни, у специалистов Европейской онкологической клиники есть возможности минимизации побочных реакций. А при метастазах ГИСО в печени в клинике выполняется методика радиочастотной аблации, которой владеют единицы российских специалистов.
Опухоли тонкого кишечника – группа доброкачественных либо злокачественных новообразований, поражающих двенадцатиперстную, подвздошную и тощую кишку. Опухоль, локализованная в тонкой кишке, прижизненно диагностируется крайне редко, так как не имеет яркой симптоматики и успешно маскируется под другие заболевания. Несмотря на то, что тонкая кишка представляет собой 3/4 всей длины пищеварительного тракта и более 90% его площади, опухоли этой части ЖКТ встречаются лишь в 0,5-3,5% случаев. Злокачественные опухоли тонкой кишки диагностируются еще реже и составляют 0,01% всей онкопатологии тонкого кишечника.
В большинстве случаев рак тонкого кишечника развивается на фоне хронических ферментативных или воспалительных заболеваний ЖКТ или эпителиальных доброкачественных опухолей кишечника. Преобладающее поражение 12-перстной кишки объясняется раздражающим действием желчи и сока поджелудочной железы на начальный отдел тонкого кишечника, а также его активным контактом с канцерогенами, поступающими в пищеварительный тракт с пищей.
Факторы риска
Случаи спорадического или семейного аденоматозного полипоза являются факторами повышенного риска развития рака тонкого кишечника. Вероятность возникновения рака тонкого кишечника выше у:
- Курильщиков;
- Лиц, подвергшихся радиационному облучению;
- Страдающих алкогольной зависимостью;
- Людей, в чьем рационе преобладают животные жиры, консервированные продукты, жареная пища.
По характеру роста опухолевой ткани различают экзофитный и эндофитный рак тонкого кишечника.
- Экзофитные опухоли растут в просвет кишки, вызывая ее сужение и развитие кишечной непроходимости; макроскопически могут напоминать полип или цветную капусту;
- Эндофитные формы рака инфильтрируют стенку тонкого кишечника в глубину, сопровождаясь кишечным кровотечением, перфорацией и перитонитом.
По гистологической структуре злокачественные опухоли тонкого кишечника чаще представлены аденокарциномой, реже в онкологической практике встречаются саркомы, карциноид, лимфома кишечника.
В Юсуповской больнице успешно лечат пациентов с диагнозом рак тонкой кишки. Здесь вас проконсультируют высококвалифицированные врачи, проведут диагностику на современном оборудовании. Своевременное обращение в больницу и выявление рака тонкой кишки на ранней стадии, гарантирует максимальный эффект от лечения.
Симптомы
Коварство новообразований в том, что они длительное время никак не проявляются, либо в клинической картине преобладают симптомы, характерные для других заболеваний (язвенной болезни желудка и двенадцатиперстной кишки, холецистита, аднексита и др.). У 75% пациентов опухоли тонкого кишечника обнаруживаются только после смерти, в остальных случаях новообразование обычно диагностируется на запущенной стадии, когда перекрывается просвет кишечника и возникает клиника кишечной непроходимости.
Первым проявлением рака тонкого кишечника и двенадцатиперстной кишки может быть боль. Пациенты описывают боли как неопределенные, локализованные в области пупка или слева от него, в подвздошной области. Боль обычно возникает при прорастании новообразования в стенки кишечника и распространении процесса на брюшину и другие органы;
Кроме того, больного могут беспокоить:
- Отрыжка;
- Метеоризм;
- Нестабильность стула;
- Потеря аппетита;
- Исхудание;
- Умеренное повышение температуры тела.
Злокачественные опухоли могут иметь как общие проявления (истощение, интоксикация, бледность кожи и слизистых), так и местные симптомы, которые зависят от локализации и размеров опухоли.
Пациент предъявляет жалобы на:
- Тошноту;
- Рвоту;
- Изнуряющую изжогу.
На начальных стадиях злокачественной опухоли поносы чередуются с запорами, в терминальном периоде развивается клиника непроходимости кишечника, перфорации полого органа (связанной с распадом опухоли).
Все новообразования кишечника сопровождаются кахексией, анемией, интоксикацией. Анемия связана не только с постоянными кровотечениями, но и с нарушением всасывания питательных веществ в пораженном кишечнике, необходимых для нормального кроветворения. Обычно выраженная клиника указывает не только на запущенную стадию болезни, но и на метастазирование опухоли в лимфоузлы и другие органы.
В Юсуповской больнице работают ведущие онкологи России. Уже на протяжении нескольких десятков лет здесь применяются новейшие методики диагностики и лечения различных видов онкологических заболеваний. Разумеется, чем раньше выявляется злокачественное заболевание, тем больше шансов на полное выздоровление пациента. Как показывает мировая практика, до 90% пациентов, у которых был диагностирован рак на первичной стадии, смогли побороть недуг.
Диагностика
Диагностический алгоритм в Юсуповской больнице при раке тонкого кишечника различной локализации имеет свои особенности. Так, в распознавании опухолей 12-перстной кишки ведущую роль играет эзофагогастродуаденоскопия и контрастная рентгеноскопия.
Для диагностики опухолей терминального отдела подвздошной кишки информативными могут быть колоноскопия и ирригоскопия.
Важную роль в диагностике рака тонкого кишечника играет рентгенография пассажа бария, позволяющая выявить препятствия на пути продвижения контрастного препарата, участки стенозов и супрастенотического расширения кишки.
Ценность эндоскопических исследований заключается в возможности проведения биопсии для последующей морфологической верификации диагноза.
Определенный диагностический интерес может представлять проведение селективной ангиографии брюшной полости.
Онкологи Юсуповской больницы с целью выявления метастазов и прорастания рака тонкого кишечника в органы брюшной полости выполняют:
- Ультразвуковое исследование (печени, поджелудочной железы, почек, надпочечников);
- Мультиспиральную компьютерную томографию брюшной полости;
- Рентгенографию грудной клетки;
- Сцинтиграфию костей;
- В неясных случаях целесообразно проведение диагностической лапароскопии.
Рак тонкого кишечника необходимо дифференцировать от туберкулеза кишечника, окклюзии мезентериальных сосудов, доброкачественных опухолей тонкого кишечника, болезни Крона, дистопии почки, забрюшинных опухолей, у женщин – от опухолей придатков и матки.
Лечение
При операбельности рака тонкого кишечника наиболее эффективно проведение широкой резекции пораженного участка кишки и лимфоузлов, иссечение брыжейки. Протяженность тонкого кишечника позволяет выполнять радикальное удаление опухоли в границах здоровых тканей.
Целостность желудочно-кишечного тракта восстанавливается путем наложения энтероэнтероанастомоза (тонкой кишки в тонкую) или энтероколоанастомоза (тонкой кишки в толстую).
При раке 12-перстной кишки показана дуоденэктомия, иногда с дистальной резекцией желудка или резекцией поджелудочной железы (панкреатодуоденальная резекция).
При запущенном раке тонкого кишечника, не позволяющем осуществить радикальную резекцию, производится наложение обходного анастомоза между непораженными петлями кишки.
Хирургический этап лечения рака тонкого кишечника дополняется химиотерапией, этот же метод может являться единственным способом лечения неоперабельных опухолей.
Термин рак тонкого кишечника объединяет в себе несколько типов злокачественных новообразований.
Злокачественные новообразования тонкой кишки — одни из самых редких видов рака пищеварительной системы. На их долю приходится не более 1-2% всех случаев рака ЖКТ.
98% опухолей тонкой кишки это — аденокарциномы, карциноидные опухоли, лимфомы, саркомы (чаще всего лейомиосаркомы и реже ангиосаркомы или липосаркомы) и желудочно-кишечные стромальные опухоли (GIST). Каждый из этих подтипов опухоли имеет свое собственное клиническое поведение и, следовательно, диктует свой подход к лечению.

Причины рака тонкого кишечника
У пациентов с семейным аденоматозным полипозом развиваются множественные аденомы по всей тонкой кишке, которые могут привести к аденокарциноме. После толстой кишки двенадцатиперстная кишка является наиболее распространенным местом аденокарциномы.
Помимо колоректальной карциномы, у пациентов с наследственным неполипозным колоректальным раком также развиваются рак эндометрия, желудка, тонкой кишки, верхних мочевых путей и яичников.
Пожизненный риск развития аденокарциномы тонкой кишки у пациентов с наследственным неполипозным колоректальным раком составляет 1-4%, что более чем в 100 раз превышает риск в общей популяции.
Исследование Лоуэнфелса и Сонни, проведенное в 1977 году, показало, что потребление жира у животных коррелирует с раком тонкой кишки. В другом исследовании, проведенном в 1993 году, сообщалось, что потребление красного мяса и соленой или копченой пищи повышало риск развития рака тонкой кишки в 2-3 раза.
Исследования, проведенные Ченом и соавторами в 1994 году, обнаружили связь между курением и аденокарциномой тонкой кишки, а также между потреблением алкоголя и аденокарциномой тонкой кишки, но это не было подтверждено в других исследованиях.

Относительный риск развития аденокарциномы тонкой кишки у пациентов с болезнью Крона составляет от 15 до более 100 . В отличие от большинства аденокарцином тонкой кишки, связанные с Кроном опухоли обычно возникают в подвздошной кишке, отражая распределение болезни Крона.
Риск развития аденокарциномы не начинается, по крайней мере, через 10 лет после начала болезни Крона, а аденокарцинома обычно возникает спустя более 20 лет.
У пациентов с целиакией повышенный риск развития лимфомы тонкой кишки и аденокарциномы.
По всей видимости, аденокарциномы тонкой кишки, связанные с глютеновой болезнью, имеют более высокую частоту репарации дефектных ДНК по сравнению с таковыми, не связанными с глютеновой болезнью, а также связаны с более ранней стадией диагностики и лучшим прогнозом.
Сообщается также о примерно 18-кратном увеличении риска рака ЖКТ у пациентов с синдромом Петса-Джегерса.
Виды и типы
Тонкая кишка состоит из множества разных типов клеток, поэтому здесь могут развиться 4 основных типа онкопатологий.
- Аденокарциномы начинаются в клетках желез, которые выстилают внутреннюю часть кишечника. На их долю приходится примерно 1 из 3 случаев рака тонкой кишки.
- Карциноидные опухоли — тип нейроэндокринной опухоли и имеют тенденцию к медленному росту.
- Лимфомы — опухоли, развивающиеся в иммунных клетках лимфатических узлов. Вокруг тонкого кишечника сосредоточено очень много лимфоузлов. Лимфомы могут начаться практически в любом месте тела. В кишечнике обычно развиваются неходжкинские лимфомы.
- Саркомы — злокачественные опухоли соединительной ткани, например, в мышцах. Наиболее распространенные саркомы в кишечнике известны как желудочно-кишечные стромальные опухоли (GIST) .

Злокачественные опухоли тонкого кишечника (особенно аденокарциномы) чаще всего развиваются в двенадцатиперстной кишке. Рак, развивающийся в двенадцатиперстной кишке, часто обнаруживается в Фатеровом сосочке.
Симптомы и проявления
Признаки рака тонкого кишечника на ранних стадиях отсутствуют. При такой болезни как рак тонкой кишки симптомы на ранних стадиях либо невыраженные, либо совершенно неспецифичные.
Появление же характерных симптомов, к сожалению, отражает уже запущенную болезнь. Из-за неспецифического характера симптомов часто возникает значительная задержка между появлением симптомов и постановкой диагноза, в среднем 6-8 месяцев.
Тошнота, рвота и кишечная непроходимость — самые распространенные симптомы. Половина этих пациентов подвергается экстренной операции по поводу кишечной непроходимости. Боль в животе и потеря веса осложняют клиническую картину; кровотечение встречается реже.
Обычно, определенные симптомы не могут использоваться в качестве обобщений для выявления отдельных подтипов онкопатологии.
Тем не менее, похоже, что аденокарциномы чаще связаны с болью и обструкцией по сравнению с саркомами и карциноидами. Желудочно-кишечные стромальные опухоли (GIST) чаще проявляются в виде острого желудочно-кишечного кровотечения.

Стадии
Стадии рака тонкой кишки представлены на примере аденокарциномы. Для стромальной опухоли ЖКТ или карциноидов может применяться другая система стадирования.
Стадия
Группировка по TNM
Описание
0
Tis
N0
M0
Новообразование только в эпителии (верхний слой клеток слизистой оболочки). Оно не переросло в более глубокие слои ткани (Tis).
Нет распространения на регионарные лимфатические узлы (N0) или отдаленные части тела (M0).
I
Т1 или Т2
N0
M0
Новообразование переросло в более глубокие слои (lamina propria или submucosa) (T1), или через подслизистую оболочку в muscularis propria (T2).
Нет распространения на регионарные лимфатические узлы (N0) или отдаленные части тела (M0).
IIA
T3
N0
M0
Новообразование выросло через собственную мышечную оболочку в субсерозную.
Нет прорастания в любые соседние органы или структуры (T3).
Нет распространения на регионарные лимфатические узлы (N0) или отдаленные части тела (M0).
IIB
T4
N0
M0
Новообразование выросло через наружный слой ткани, покрывающей кишку (серозную или висцеральную брюшину) или в соседние органы или структуры (T4).
Нет распространения на регионарные лимфатические узлы (N0) или отдаленные части тела (M0).
IIIA
Любой Т
N1
M0
Новообразование проросло в любые слои стенки кишки (Any T). Есть распространение на 1 или 2 регионарных лимфатических узла (N1), но не на отдаленные части тела (M0).
IIIB
Любой Т
N2
M0
Новообразование могло перерасти в любые слои стенки кишки (Any T). Оно распространилось на 3 или более регионарных лимфатических узла (N2), но не на отдаленные части тела (M0).
IV
Любой Т
Любой N
M1
Новообразование может прорасти в любые слои стенки кишки (Any T).
Может быть или не быть распространение на соседние лимфатические узлы (Любой N).
Распространение на отдаленные лимфатические узлы или органы, такие как печень или брюшина (внутренняя оболочка живота) (M1).

Диагностика
Первичная диагностика рака тонкого кишечника проводится обычно с использованием методов медицинской визуализации.
Онкопатологии двенадцатиперстной кишки могут быть выявлены при проведении эзофагогастродуоденоскопии. С опухолями тощей и подвздошной кишок все обстоит сложнее.
За рубежом, в Европе, обычно используются методы мультиспиральной компьютерной томографии МСКТ и МРТ с разными видами контрастных веществ.
В странах СНГ пока, чаще всего используется менее информативный метод ренгеноскопии с использованием сульфата бария.
В Бельгии большое распространение получила методика видеокапсульной кишечной эндоскопии, которая позволяет провести предварительную оценку состояния слизистой тонкого кишечника. А при обоснованном подозрении на злокачественный процесс уже проводятся более сложные и дорогие диагностические процедуры — МСКТ и МРТ с контрастом.
Лечение
Основой лечения аденокарциномы и лейомиосаркомы является радикальная хирургическая резекция. Если поражение неоперабельное, лечение рака тонкого кишечника проводится с помощью хирургического шунтирования и паллиативной лучевой терапии.
Исследование показало, что пациенты с неоперабельной стадией IV, которые получали химиотерапию, достигли продолжительности жизни более 11 месяцев. Напротив, общая выживаемость без химиотерапии составила 3,3 месяца.
Однако не существует стандартной эффективной химиотерапии для пациентов с рецидивирующей метастатической аденокарциномой или лейомиосаркомой тонкой кишки.
Эти пациенты должны рассматриваться в качестве кандидатов для клинических испытаний, оценивающих использование новых противоопухолевых препаратов или биологических препаратов в фазах I и II.

Для локально рецидивирующего заболевания варианты включают:
- хирургическое вмешательство;
- паллиативную лучевую терапию;
- паллиативную химиотерапию;
- экспериментальные варианты лечения, оценивающие способы улучшения местного контроля, такие как использование лучевой терапии с радиосенсибилизаторами и системной химиотерапией.
Комбинации лекарств, которые были использованы при распространенном раке тонкой кишки.
- Капецитабин и оксалиплатин (КАПОКС)
- Капокс и бевацизумаб.
- 5-FU и лейковорин с оксалиплатином (ФОЛЬФОКС).
- 5-ФУ и лейковорин с иринотеканом (ФОЛЬФИРИ).
В онкологических центрах Бельгии накоплен положительный опыт использования таргетных препаратов при некоторых видах рака тонкого кишечника.
Пациенты с запущенным заболеванием могут лечиться в Бельгии с помощью препарата Гливек® (иматиниб) из группы ингибиторов тирозинкиназы.
Также хорошие результаты по увеличению общей и безрецидивной выживаемости показал препарат Сутент® (сунитиниб).
Это современный ингибитор мультикиназы, который нацелен на несколько ферментов, участвующих в опухолевом росте, патологическом ангиогенезе и метастазировании.
Он ингибирует рецепторы тромбоцитарного фактора роста (PDGFR-альфа, PDGFR-бета), рецепторы фактора роста эндотелия сосудов (VEGFR1, VEGFR2, VEGFR3), рецептор фактора стволовых клеток (KIT), Fms-подобную тирозинкиназу-3 (FLT3), рецептор колониестимулирующего фактора типа 1 (CSF-1R) и рецептор нейротрофического фактора (RET), полученный из глиальной клеточной линии.

Прогноз и профилактика
При такой болезни как рак тонкой кишки, прогноз общей пятилетней выживаемости при резектабельной аденокарциноме составляет 20%.
Пятилетняя выживаемость при аденокарциноме тонкой кишки по стадиям выглядит следующим образом:
- I этап - 70%
- Этап II - 55%
- III этап - 30%
- Стадия IV - 5-10%
Исследование, сравнивающее результаты для 2123 пациентов с аденокарциномой тонкой кишки и 248 862 пациентов с колоректальным раком, показало, что прогноз для аденокарциномы тонкой кишки хуже, чем для колоректального рака, и только хирургическое вмешательство улучшает выживаемость.
Пятилетняя выживаемость при резектабельной лейомиосаркоме, самой распространенной первичной саркоме , составляет приблизительно 50%. При такой болезни как саркоматозная опухоль тонкого кишечника, прогноз улучшается, если при операции отмечаются отрицательные хирургические поля.

В настоящее время не существует известного способа предотвращения аденокарцином тонкой кишки.
Существуют некоторые факторы, которые могут увеличить риск развития этих видов рака, такие как курение, употребление алкоголя и диета с высоким содержанием красного мяса, поэтому принятие более здорового решения в отношении этих факторов риска может снизить риск.
Для людей с высоким риском развития рака из-за определенных наследственных синдромов вариантом снижения риска может стать превентивное хирургическое вмешательство.
Например, люди с семейным аденоматозным полипозом (FAP) имеют очень высокий риск развития рака тонкой кишки, начиная с двенадцатиперстной . И если у человека много полипов кишечника, врачи могут предложить операцию по удалению двенадцатиперстной кишки до того, как может развиться рак.
Получите больше информации о лечении рака тонкой кишки в онкологических центрах Бельгии. Напишите нам или закажите обратный звонок. Наши специалисты предоставят вам всю нужную информацию.
Читайте также:

