Атлас операции по онкологии
В 2012 году раком заболели 14 миллионов человек, а 8,2 миллиона умерли. На заре исследований онкозаболеваний врачи выделяли несколько типов рака в зависимости от пораженного органа, а сейчас в Международной классификации онкологических заболеваний насчитывается несколько тысяч типов злокачественных новообразований. У большинства из них своя схема лечения, которая не подходит для других типов. Поэтому важно правильно поставить диагноз. Этим занимаются врачи-патоморфологи.
На первом этапе нужно понять, есть ли у человека новообразование. Для этого проводят скрининг — профилактическое обследование пациента, у которого нет симптомов онкозаболевания. Как правило, программы скрининга назначают по наиболее часто встречающимся типам рака. Например, рак шейки матки — второе по частоте онкозаболевание у женщин — можно выявить при визуальной проверке или тестировании на вирус папилломы человека. А один из самых частых видов онкологии у обоих полов — рак желудка — при помощи гастроскопии.

Окрашенные срезы ткани желудка в увеличении микроскопа. Фото: Unim
Когда человек жалуется на первичные симптомы рака, проводят раннюю диагностику. Симптомами могут быть слабая боль, высокая температура, быстрая потеря веса. В зависимости от жалоб пациенту назначают рентгенографию, которая может выявить рак кишечника и легких, компьютерную томографию, эндоскопию или ряд других исследований. Например, анализ крови и выделений может показать количество онкомаркеров — веществ-индикаторов развития опухоли. Если результаты положительные, нужно установить, доброкачественная опухоль или злокачественная.
Доброкачественная опухоль, в отличие от злокачественной, растет медленно, у нее нет склонности к появлению метастаз — вторичных очагов заболевания. Разрастаясь, доброкачественная опухоль может сдавить прилегающие органы, но не проникнет в них. Как правило, доброкачественные новообразования лечатся хирургическим вмешательством — их удаляют.
Чтобы установить, к какой группе относится новообразование, пациенту делают биопсию — берут кусочек ткани из опухоли и проводят гистологические исследования.

Между двух прямоугольных стекол помещают срез ткани толщиной 2-4 микрона, чтобы врач видел один слой клеток. Слишком толстый или тонкий, кривой срез не даст достоверной информации: если слой будет толще, патоморфолог увидит только неинформативное нагромождение клеток.
После этого срез окрашивают антителами. Эта делают вручную или автоматически — на гистостейнере.

Гистостейнер — автомат для окраски гистологических срезов. Фото: Unim
Когда препарат готов, он попадает в лабораторию, где врач-патоморфолог определяет тип опухоли. Для этого врачи пользуются специальными гистологическими атласами с фотографиями стекол и описаниями соответствующих онкозаболеваний. Эти справочники регулярно обновляются и дополняются, но они есть не у всех. Кроме того, даже профессионал с многолетним стажем может упустить детали и неправильно типировать опухоль.
Сократить число таких ошибок хотят разработчики сервиса Pathology Assistant — программы, которая помогает врачу верно определить тип онкологического заболевания по гистологическому срезу.

Окрашенные срезы ткани кожи в увеличении микроскопа. Фото: Unim
Врач вводит подробную информацию о пациенте, программа сравнивает ее с базой данных и предлагает несколько подходящих типов онкологических заболеваний. В итоге врач ставит более точный диагноз и экономит свое время — ему не нужно перечитывать справочник.
Пока у разработчиков готов раздел, посвященный костным опухолям. В нем 500 оцифрованных препаратов, что сопоставимо с количеством иллюстраций в гистологическом атласе костной патологии. Раздел помогали составлять заведующий патологоанатомическим отделением Российской детской клинической больницы Дмитрий Рогожин и американский патоморфолог Майкл Кляйн.

Онкология - Ганцев Ш. X. - Учебник
Описание: Учебник отличается от аналогов по ряду позиций. Во-первых — строгим соответствием учебной программе. Во-вторых — использованием опыта ведущих клиник и ученых России в рамках единой образовательной концепции. В-третьих — впервые в отечественной педагогической практике медицинских вузов изложены стандарты диагностики и лечения в онкологии. Студент, обучающийся на кафедрах, получит первоначальные знания о стандартизации лечебно-диагностического процесса, что на сегодняшний день очень важно. Можно и дальше перечислять плюсы учебника, но мне представляется, что главным экспертом издания является студент. Учебник создан для него, и он его по достоинству оценит.

Онкология - В.И. Чиссов, С. Л. Дарьялова - Учебник с компакт-диском
Описание: В учебнике представлена современная информация об этиологии, патогенезе, клинической картине, диагностике, лечении, профилактике и прогнозе онкологических заболеваний. В самостоятельных разделах приводятся сведения по общим вопросам онкологии, а также по особенностям онкологических заболеваний у детей. Учебник включает приложение на компакт-диске, содержащее тестовый экзамен, дополнительные иллюстрации и разнообразные справочные материалы.
Учебник подготовлен в соответствии с действующей программой по онкологии и предназначен для студентов медицинских вузов.

Молекулярная онкология: клинические аспекты - Имянитов Е.Н., Хансон К.П.
Описание: Бурное развитие молекулярной генетики, в частности открытие онкогенов и антионкогенов, кардинально видоизменило представления о механизмах возникновения новообразований. Тем не менее принято считать, что прогресс в теоретической области практически не отразился на состоянии дел в клинической онкологии. Содержание настоящего издания призвано продемонстрировать несостоятельность подобных утверждений.
Действительно, если 70-е и 80-е гг. XX века характеризовались прогрессом преимущественно в экспериментальной области, символом последнего десятилетия стали именно практические достижения молекулярной онкологии. К настоящему моменту молекулярно-генетические подходы рутинно используются на всех этапах онкологической помощи, т. е. в профилактике, диагностике, лечении и мониторинге пациентов. Наиболее заметные успехи отмечены в развитии лабораторных методов выявления групп онкологического риска, поиске диагностических и прогностических маркеров новообразований, разработке патогенетически обоснованных подходов к химиопрофилактике и химиотерапии неоплазм и, наконец, в генотерапии рака.

Лечение хронической боли онкологического генеза - Г.А. Новиков - Учебное пособие
Более 10 лет назад ученые начали большую работу, которая недавно завершилась созданием нового атласа онкологических заболеваний под названием PanCancer. Он поможет исследователям и врачам лучше ориентироваться в злокачественных опухолях с учетом их геномных и молекулярных характеристик.
Атлас PanCancer основан более чем на двух десятках научных работ. Над ним работали более 150 ученых из более чем двух десятков научно-исследовательских учреждений США. На проведение работы было потрачено 300 миллионов долларов.
Взгляд на онкологические заболевания под другим углом
Раком называют заболевание, при котором в ДНК клеток происходят мутации, и они начинают бесконтрольно размножаться. Традиционно злокачественные опухоли принято классифицировать в зависимости от органа, из которого они происходят: например, рак молочной железы, желудка, предстательной железы.
Но в последние годы учеными были замечены некоторые интересные особенности злокачественных опухолей, которые заставили усомниться в универсальности традиционной системы классификации.
Одна из этих особенностей состоит о том, что опухоли, происходящие из разных органов, могут иметь одинаковые молекулярно-генетические особенности. При этом две опухоли, которые происходят из одного и того же органа, могут иметь совершенно разные молекулярно-генетические особенности, то есть разные геномные профили.
Эти наблюдения привели к выводам о том, что большое влияние на течение болезни оказывают особенности ДНК раковых клеток. От этого зависит выбор оптимальных методов лечения и прогноз.
Создание атласа PanCancer — это попытка улучшить диагностику, лечение и профилактику разных
типов рака.
Простой пример. Есть злокачественная опухоль, с которой врач не сталкивался прежде и не до конца понимает, как ее лечить. Но известны молекулярно-генетические особенности этой опухоли. Можно сравнить их с молекулярно-генетическими характеристиками других опухолей и найти похожие среди тех, для которых уже существуют эффективные лечебные схемы.
Если рассматривать опухоли с молекулярно-генетической точки зрения, можно выявить противоопухолевую активность препаратов, которые применяются при других заболеваниях, но действуют на те же молекулярные сигнальные пути.
Конкретный пример — молекулярный путь JAK/Stat, который активируется при ревматоидном артрите. В настоящее время известно, что этот путь также активен при некоторых злокачественных опухолях.
Структура атласа PanCancer
Вторая часть атласа описывает онкогенные процессы, определяет приоритетные направления, в которых должны осуществляться поиск и изучение новых противоопухолевых препаратов. Здесь представлена следующая информация:
- Наследственные и приобретенные мутации.
- Влияние генома опухоли и эпигенетических факторов на экспрессию генов и белков.
- Взаимодействия между опухолевыми клетками и клетками иммунной системы. В третьей части описываются изменения в сигнальных путях, которые регулируют клеточный цикл, размножение и гибель клеток.

В атласе представлены самые последние достижения в области лечения, профилактики рака, а также статистика и распространение онкозаболеваний во всем мире.
В издании можно найти результаты исследований научных коллективов из 184 стран, а также Международного Агентства по изучению рака.
Информация, которая содержится в атласе, будет полезна не только врачам и пациентам, но и широкому кругу читателей, которые заботятся о своем здоровье. Большой раздел издания посвящен вопросам профилактики и скрининга (раннего выявления онкозаболеваний), а это два основных фактора, которые позволяют заметно снизить заболеваемость.
Согласно данным, приведенным в атласе, курение является причиной более 20% всех смертей от рака в мире. А вероятность развития рака легкого у курильщика в 15-30 раз выше, чем у остальных. С этой пагубной привычкой связаны не менее 16 типов рака, кроме рака легкого, это рак пищевода, ротовой полости, глотки и гортани. По прогнозам, к 2030 году от употребления табака будут ежегодно умирать 8 миллионов человек.
Другой серьезный фактор риска – это инфекции. Известно, что с инфицированием бактерией Helicobacter pylori связано почти 90% случаев рака желудка. Вирус папилломы человека (ВПЧ) (высокоонкогенные типы 16 и 18) является причиной почти всех случаев рака шейки матки и ряда других злокачественных новообразований. Вирус гепатита В и С является причиной более 75% случаев рака печени.
К счастью, с этими инфекциями можно бороться. Инфекция Helicobacter pylori лечится, а против гепатита В и вируса папилломы человека существуют вакцины.
Но это пока лишь те инфекции, которые, как мы знаем, повышают риск развития онкозаболеваний. Вполне возможно, что будущие исследования выявят и другие вирусы или бактерии, вызывающие рак.
Среди факторов риска онкозаболеваний, о которых говорится в атласе, – неправильное питание, избыточная масса тела и малоподвижный образ жизни.
Вот какие рекомендации дает Всемирный фонд исследования рака (WCRF): необходимо стараться поддерживать себя в форме, но при этом не допускать недостаточной массы тела, как минимум 30 минут в день уделять физическим тренировкам, не употреблять сахаросодержащие напитки, включить в рацион овощи, фрукты, цельные зерна, бобовые и фасоль, а также ограничить употребление красного мяса, алкогольных напитков и соленой пищи.
Среди других факторов, увеличивающих риск онкозаболеваний, – загрязнение окружающей среды канцерогенными веществами. К таким веществам относится газ радон (образуется в результате радиоактивного распада урана), мышьяк, дымовые выбросы от сгорания угля внутри помещений, мелкие взвешенные частицы, асбест, который до сих пор продолжает использоваться в строительстве, и тяжелые металлы.
Серьезная дилемма стоит в целесообразности проведения скрининга рака простаты (РПЖ). Например, спорным является вопрос о проведении ПСА-теста. Дело в том, что этот анализ часто выявляет латентный, клинически незначимый рак, который не дает никаких симптомов, не прогрессирует и никак не влияет на продолжительность и качество жизни. Но при лечении этой формы рака состояние пациента может ухудшаться.
Как говорят врачи, если РПЖ обнаружить на I стадии, то излечение практически гарантировано. К сожалению, в России, более половины всех случаев заболевания выявляются на III, IV стадиях, что приводит к высокой смертности.
В атласе также затрагивается один из самых острых вопросов в онкологии – вопрос обезболивания и доступа пациентов к опиоидным анальгетикам.
Проблема доступности обезболивающих препаратов для онкологических больных – одна из самых острых в российской онкологии, не устают повторять эксперты.
Завершаем цикл статей об онкологических заболеваниях.
Сегодня Атлас подробно расскажет, что такое молекулярное тестирование и как оно влияет на постановку диагноза.
Молекулярные процессы в опухоли
Каждая здоровая клетка содержит молекулу ДНК, из которой она считывает информацию, какую форму и специальность получить, какие белки и ферменты производить, а главное, когда делиться и умирать. Подробнее о том, как это происходит почитайте в нашем первом материале.
Мутации в протоонкогенах и генах-супрессорах, отвечающие за деление и смерть клетки, приводят к тому, что клетка перестает следовать инструкции и синтезирует белки и ферменты неправильно. Молекулярные процессы выходят из-под контроля: клетка постоянно делится, отказывается умирать и копит генетические и эпигенетические мутации. Поэтому злокачественные новообразования часто называют болезнью генома.
Драйверные мутации создают различные популяции клеток, что обеспечивает разнообразие опухоли. Эти популяции или клоны по-разному реагируют на лечение: некоторые из них устойчивы и приводят к рецидиву. К тому же разная чувствительность клонов к терапии может привести к радикальному изменению молекулярного профиля в ходе лечения: даже незначительные в начале популяции клетки могут получить преимущество и стать доминирующими в конце лечения, что приведет к устойчивости и развитию опухоли.

Источник: Cell.
Иллюстрации: Майкл Ковальски.
Молекулярная диагностика
Драйверные мутации, изменения в количестве или структуре белков используют в качестве биомаркеров — мишеней, по которым подбирают лечение. Чем больше мишеней известно, тем более точным может быть выбор из потенциально эффективных схем лечения.
Отделить драйверные мутации от остальных и определить молекулярный профиль опухоли непросто. Для этого применяется технология секвенирования, флуоресцентной гибридизации in situ (FISH), микросателлитного анализа и иммуногистохимии.
Методы секвенирования нового поколения позволяют выявить драйверные мутации, включая те, что делают опухоль чувствительной к таргетной терапии.
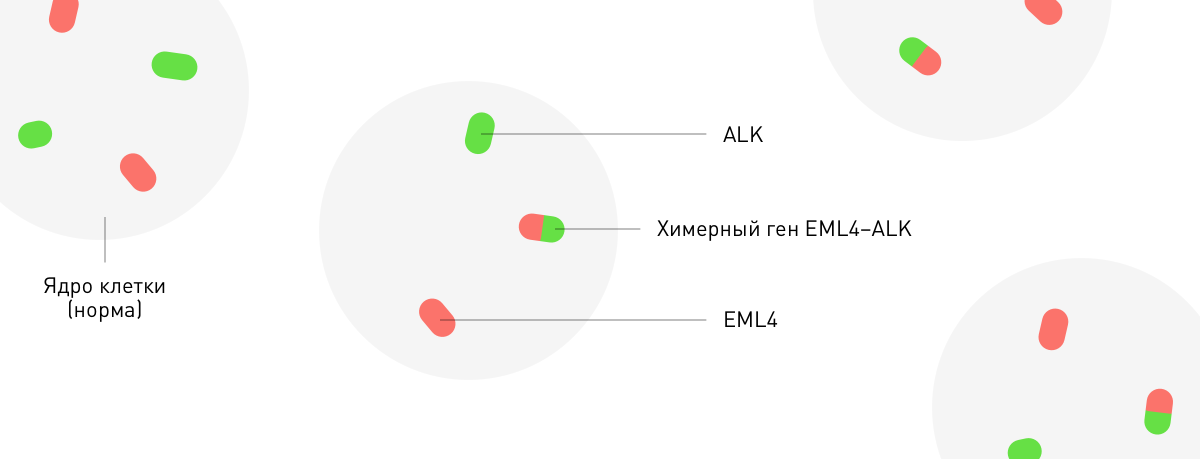
Флуоресцентная гибридизация in situ (FISH).
Микросателлитный анализ показывает степень нарушения системы репарации ДНК, а иммуногистохимия — белковые биомаркеры, расположенные на поверхности, в цитоплазме и ядрах опухолевых клеток.
Специалисты Solo исследуют до 450 генов и биомаркеров, чтобы оценить, как опухоль может ответить на применение более таргетных препаратов для лечения онкологических заболеваний. Для некоторых из них анализ биомаркера продиктован производителем. Для других используют данные клинических исследований и рекомендации международных сообществ онкологов.
Помимо выбора мишеней для таргетной терапии, молекулярное профилирование помогает обнаружить мутации, которые напротив, делают опухоль устойчивой к определенному лечению, или генетические особенности, которые связаны с повышенной токсичностью и требуют индивидуального подбора дозы лекарства.
Для исследований используется материал биопсии или парафинизированные блоки послеоперационного материала.
Молекулярное профилирование дает дополнительную информацию о заболевании, но она не всегда применима для выбора лечения. Например, в ситуациях, когда стандартная терапия обладает достаточной эффективностью или показано хирургическое лечение. Можно определить клинические ситуации когда такое исследование может быть наиболее полезно:
- Редкий вид опухоли;
- Опухоли с неустановленным первичным очагом (неизвестно, где изначально появилась опухоль, давшая метастазы);
- Тех случаев, когда требуется выбор из нескольких вариантов применения таргетной терапии;
- Исчерпаны возможности стандартной терапиии требуется экспериментальное лечение или включение пациента в клинические исследования.
Специалисты проекта Solo консультируют онкологов или пациентов и подсказывают, нужен ли тест в данном случае.
Результат диагностики также включает рекомендации по клиническим исследованиям с подходящим тестируемым препаратом. У пациента есть возможность принять в них участие.
Прецизионная медицина и клинические исследования
Обычно в медицинской практике применяют общие стратегии для лечения пациентов с определенным диагнозом. Для мелкоклеточного рака легкого используется одна стратегия, для немелкоклеточного — другая. Для онкологических заболеваний этот метод подходит не всегда. Из-за различий на молекулярном уровне даже при одном и том же типе опухоли пациенты могут получить неэффективное или лишнее лечение.
С увеличением исследований и изобретением таргетных препаратов, подход к лечению онкологических заболеваний начал меняться. Чтобы увеличить безрецидивный период и продолжительность жизни пациента, нужно учитывать молекулярный профиль опухоли, ответ организма на лекарственные препараты и химиотерапию (фармакогеномика), знать главные биомаркеры.

Прецизионная медицина позволяет существенно улучшить прогноз конкретного пациента, избежать серьезных побочных эффектов онкологических препаратов и значительно повысить качество жизни больного. Но и у этого метода существуют недостатки.
Таргетных препаратов становится все больше, и они имеют два основных ограничения: большинство молекулярно-направленных агентов обеспечивают лишь частичное подавление сигнальных путей и многие из них слишком токсичны для использования в комбинации.
Представьте, что вы архитектор Москвы. Перед вами стоит непростая задача — решить проблему с пробками в час пик, построив один мост. Молекулярные механизмы можно сравнить с движением машин, а мост — главный препарат, который должен решить основную проблему. Кажется, что несколько лекарств (серия мостов), направленные на главные молекулярные нарушения, могут решить эту проблему. Но токсичность препаратов при этом увеличивается и может быть непредсказуемой.
Мы стали лучше понимать молекулярные процессы злокачественных опухолей, но текущие методы внедрения точной онкологии в клиническую практику сильно отстают. Чтобы ускорить изучение таргетной терапии, ученые разработали два новых подхода — Basket и Umbrella.

Суть метода Basket в том, что для исследования выбирают пациентов с определенным биомаркером, независимо от расположения и названия опухоли. В мае 2017 года FDA одобрила такой метод лечения для биомаркера под названием высокая микросаттелитная нестабильность (MSI-H) или дефект восстановления несоответствия (dMMR).
Молекулярные нарушения отличаются не только у разных пациентов, но и в пределах одной опухоли. Гетерогенность — большая проблема в онкологии, для решения которой был разработан дизайн исследования Umbrella. Для метода Umbrella пациентов сначала отбирают по типу злокачественных новообразований, а потом учитывают генетические мутации.
Такие исследования помогают не только собрать информацию о действии таргетных препаратов — иногда это единственная возможность для пациентов, которые не отвечают на стандартное лечение зарегистрированными препаратами.
Клинический пример
Мы решили привести наглядный пример, как может выглядеть использование расширенного молекулярного профилирования.
Пациент с меланомой кожи и метастазами в печени обратился к онкологу. Врач и пациент приняли решение сделать молекулярное профилирование, чтобы получить более полную информацию о заболевании. Пациенту провели биопсию и отправили образцы ткани на исследование. В результате диагностики в опухоли обнаружили несколько важных генетических нарушений:
Ориентируясь на результаты клинических исследований и рекомендации можно прийти к следующим выводам:
- Потенциально эффективными могут быть препараты класса BRAF-ингибиторов (Вемурафениб), более того, наличие мутации NRAS может служить дополнительным основанием для назначения двойной блокады сигнального каскада — комбинацией с MEK-ингибиторами (Траметиниб).
- Несмотря на то что нет одобренной терапии, направленной непосредственно на онкоген NRAS, известно, что мутации в нем повышают вероятность успешного лечения при назначении иммунотерапии (Ипилимумаб и Пембролизумаб).
- Наследственный генетический вариант в гене TPMT указывает на повышенную индивидуальную токсичность Цисплатина, что требует коррекции дозы при назначении платиносодержащих режимов терапии.
Таким образом, врач получает возможность ориентироваться среди возможных вариантов лечения отталкиваясь не только от клинических параметров пациента, но и учитывая молекулярные особенности опухоли.
Молекулярная диагностика — это не панацея для всех онкологических заболеваний. Но это важный инструмент для онколога, который позволяет подойти к лечению злокачественных опухолей с новой стороны.
Спасибо, что читали и комментировали наши материалы об онкологии. Вот полный список статей:
Атлас операций на молочной железе.
Разделы: Анатомо-физиологические данные. - Хирургия пороков развития молочной железы и соска.
- Хирургия дисгормональных заболеваний. - Хирургия воспалительных заболеваний.
- Хирургия новообразований. 166 цветных и тоновых иллюстраций.

Атлас Операций при Злокачественных Опухолях Органов Мочеполовой Системы

Атлас Операций при Злокачественных Опухолях Молочной Железы

Атлас Операций при Злокачественных Опухолях Женских половых Органов

Атлас Операций при Злокачественных Опухолях пищевода и Желудка

Атлас Операций при Злокачественных Опухолях легкого, трахеи и Средостения

Атлас Видеоэндоскопических Внутрипросветных Операций В клинической Онкологии

Атлас Операций при Злокачественных Опухолях печени и поджелудочной Железы

Атлас операций при злокачественных опухолях органов мочеполовой системы (Алексеев)
Заболеваемость опухолями органов мочеполовой системы ежегодно возрастает, что делает проблему лечения больных данной патологией актуальной. Золотым стандартом лечения больных с локализованными, а в ряде случаев и с местнораспространенными, опухолями почек, мочевого пузыря, предстательной железы остается хирургическое вмешательство.
Принципами хирургического лечения больных злокачественными новообразованиями различных локализаций, в том числе и органов мочеполовой системы, являются аблястичность, удаление опухолевого узла единым блоком с пораженным органом в пределах здоровых тканей, удаление регионарных лимфатических узлов. Атлас операций при злокачественных опухолях органов мочеполовой системы содержит современную и актуальную информацию о показаниях к хирургическому лечению, подробное описание этапов операций, применяющихся для лечения больных раком предстательной железы, почки, мочевого пузыря, яичка, полового члена, цветные иллюстрации и интраоперационные фотографии.
Данное издание атласа значительно переработано и существенно дополнено. Добавлены новые иллюстрации и интраоперационные фотографии.
Текст содержит более подробную информацию об основных этапах хирургических операций, классификацию злокачественных новообразований органов мочеполовой системы, соответствующую современным требованиям. Для онкоурологов, хирургов, онкологов, урологов, клинических интернов и ординаторов, аспирантов.

Атлас операций при злокачественных опухолях пищевода и желудка (Чиссов)
Первое и второе издания Атласа онкологических операций , вышедшие в 1987 и 2008 гг., стали поистине настольными книгами для широкого круга специалистов нашей страны и стран ближнего зарубежья.
Предлагаемый читателю Атлас операции при злокачественных опухолях пищевода и желудка основан на многолетнем клиническом опыте специалистов МНИОИ им. П.
А Герцена и посвящен одному из самых сложных разделов полостной онкохирургии. В настоящем издании авторы учли современные тенденции развития хирургической онкологии, базирующиеся на принципах доказательной медицины.
Атлас состоит из двух разделов, посвященных операциям при злокачественных опухолях пищевода и желудка. В каждом разделе представлена глава по регионарному метастазированию и объемам лимфодиссекции.
Отдельная глава отведена современным классификациям злокачественных опухолей пищевода и желудка, включая Международную гистологическую и по системе TNM (7-го пересмотра, 2009 г.).
Заключительные главы посвящены технике типовых онкологических операций на пищеводе и желудке, пошаговому детальному описанию хода операций, а также оригинальным техническим приемам, которые облегчают работу хирурга и позволяют минимизировать частоту послеоперационных осложнений. По сравнению с предыдущим изданиями существенно дополнен иллюстративный материал.
Наряду с рисунками отдельных этапов оперативных вмешательств (доступы, мобилизация, лимфаденэктомия, реконструкция, анастомозы) впервые представлены фотографии онкологических операций. Атлас предназначен для хирургов-онкологов, научных сотрудников, ординаторов и аспирантов онкологических и неонкологических учреждений, проводящих хирургическое лечение больных с новообразованиями желудка и пищевода.

Атлас операций при злокачественных опухолях женских половых органов (Новикова)
Особое внимание уделено стандартизации распространенности опухолевого процесса согласно Международной классификации TNM (7-й пересмотр). Подробно описаны как классические радикальные хирургические вмешательства, так и новые органосохраняющие и реконструктивно-пластические операции.
Отдельная глава посвящена методическим и практическим аспектам применения видеоэндоскопических технологий при гинекологических опухолях. Для онкологов, гинекологов, специалистов смежных хирургических специальностей.
Читайте также:

