Современные препараты для лечения лимфомы



Лимфома – один из основных перспективных видов рака, для которых разрабатываются и тестируются новые виды иммунотерапии.
Лимфома – общее название группы раковых заболеваний крови, развивающихся в некоторых иммунных клетках. Существуют два основных вида лимфомы – лимфома Ходжкина (ЛХ) и неходжкинская лимфома (НХЛ). Около 90% случаев лимфомы приходится на НХЛ, только 10% составляют случаи ЛХ.
Лимфома Ходжкина имеет отличительные черты, включающие в себя наличие клеток Рид-Штернберга. Это крупные, опухолевые клетки с выраженными внешними характеристиками, названные по фамилиям открывших их ученых. Лимфома Ходжкина – одна из форм рака, наиболее хорошо поддающихся лечению в Израиле методом химиотерапии и иммунотерапии.
Неходжкинская Лимфома представляет собой разнообразную группу заболеваний, каждое из которых характеризуется наличием определенного вида клеток. Большинство людей с неходжкинской лимфомой имеют в составе опухоли клетки B-типа (около 85%). У других преобладают T-клетки или К-клетки (естественные киллеры). Некоторые случаи быстрорастущей неходжкинской лимфомы поддаются исцелению в самые короткие сроки. В случаях медленно прогрессирующей НХЛ лечение поможет контролировать заболевание на протяжении многих лет.

Пациенты с неходжкинской лимфомой в Израле проходят курс лечения препаратом Rituximab (моноклональное антитело) в комбинации с химиотерапией. Радиотерапия используется реже и, как правило, в случаях локализованного заболевания.
Другие типы иммунотерапии - моноклональные антитела, направленные на разрушение раковых клеток, используются для некоторых типов неходжинской лимфомы, также как и антитела, связанные с радиоактивным атомом.
Как дополнительное средство используются новые молекулярные препараты, нацеленные на важные пути клеток НХЛ. Если болезнь не отступает или рецидивирует после первичного лечения, возможно использование химиотерапии высокими дозами с последующей трансплантацией стволовых клеток.
При лимфоме Ходжкина, первым этапом лечения в Израиле как правило, назначается химиотерапия, радиотерапия или их комбинация в зависимости от стадии заболевания и типа преобладающих клеток.
Как вариант дополнительного лечения в случае неэффективности методов первой линии рассматривается трансплантация стволовых клеток. Таргетная терапия моноклональными антителами мАТ - препарат brentuximab vedotin (Adcetris) одобрена к использованию при лимфоме Ходжкина у пациентов, не отреагировавших на другие методы лечения. Препарат проходит клиническое тестирование как возможное средство для включения в терапию первой линии.
2020. Gilead заплатила $4.9 млрд за перспективный иммуно-онкологический препарат
Компания Gilead Sciences купила за $4.9 млрд стартап Forty Seven, чьим основным активом является препарат Magrolimab - антитело против раковых клеток. Оно нацелено на рецептор CD47, который позволяет раковым клеткам избежать нападения иммунной системы. В данный момент Magrolimab проходит клинические испытания сразу по нескольким типам рака: неходжкинская лимфома, В-клеточная лимфома, колоректальный рак, рак яичек и мочевого пузыря. Говорят, препарат действительно показывает многообещающие результаты и такая огромная сумма, заплаченная за него - это серьезное подтверждение.
2019. Новая иммунотерапия дает надежду на излечение лимфомы

Исследователи из Центра Маунт-Синай (в Нью-Йорке) под руководством доктора Джошуа Броди (на фото) разработали новый метод иммунотерапии, помогающий остановить развитие особо агрессивного и трудноизлечимого рака крови - неходжкинской лимфомы. Они создали вакцину, которая заставляет иммунные клетки организма (а именно, дендритные клетки) мигрировать к опухолям и помечать их маркерами для других иммунных клеток-убийц (Т-лимфоцитов). Броди говорит, что они вводят вакцину в одну опухоль, а остальные исчезают сами собой. Разработчики испытали вакцину на 11 пациентов с тяжелой формой лимфомы, и у 3 из них произошла значительная ремиссия.
2017. CAR-T иммунотерапия показала высокую эффективность для лечения неходжкинской лимфомы
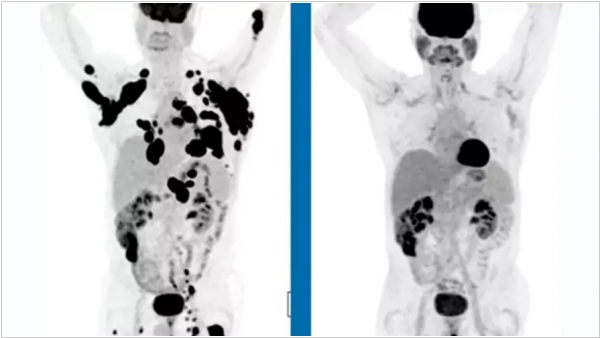
Фармацевтическая компания Kite Pharma обнародовала первые результаты клинических испытаний новой CAR-T иммунотерапии YESCARTA для лечения неходжкинской лимфомы. Новая технология позволяет перепрограммировать собственные иммунные клетки больного лимфомой человека за пределами его организма. Ученые модифицировают клетки, так, чтобы на своей поверхности они несли так называемые химерные антигенные рецепторы. Получившиеся модифицированные клетки начинают сами охотиться на раковые клетки и эффективно разрушать опухоли. В исследовании принимал участие 101 пациент с тремя различными формами лимфомы, причем в тяжелой, терминальной стадии заболевания, когда никакие способы лечения уже не действовали. В отчете говорится, что у трети таких пациентов спустя шесть месяцев наблюдалась полная ремиссия. На фоне успеха клинических испытаний акции компании выросли сразу на 25%. Конкуренты Kite Pharma - Juno Therapeutics и Novartis тоже проводят клинические испытания подобных препаратов.
2015. Ученые разработали гель для лечения лимфомы кожи

Первая фаза клинических исследований продемонстрировала безопасность и эффективность применения геля с резиквимодом (resiquimod) в терапии ранней стадии Т-клеточной лимфомы кожи. Результаты КИ были опубликованы в журнале Blood. В испытаниях экспериментального геля приняли участие 12 пациентов с Т-клеточной лимфомой кожи стадии IA-IIA. В течение 16 недель пациенты использовали гель с резиквимодом (0,03% и 0,06%) для обработки пораженных участков кожи. Согласно полученным результатам, состояние кожного покрова улучшилось у 75% пациентов, а у 30% полностью прошли поражения кожи. Ученые констатировали, что новый гель обладает позитивным профилем безопасности. Резиквимод (R-848) относится к группе имидозолинов и является модулятором иммунного ответа. Препарат обладает противоопухолевой и противовирусной активностью.
2015. В Китае разработали лекарство от лимфомы

Спустя 14 лет с начала разработок в китайская компания ChipScreen Biosciences начала продажи препарата Epidaza, предназначенного для лечения лимфомы – злокачественного новообразования лимфатических узлов. Epidaza стала первым в Китае и четвертым во всем мире препаратом класса селективных ингибиторов для пациентов с Т-клеточной лимфомой. На его исследование и разработку было потрачено $70 млн. ChipScreen Biosciences объявила, что месячный курс лечения Epidaza в Китае будет стоить 26 500 юаней ($4 275), что гораздо меньше стоимости ряда новых онкопрепаратов в США.
2012. Adcetris - первый в мире сертифицированный препарат для лечения лимфомы
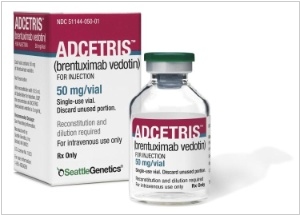
Компания Seattle Genetics получила сертификацию FDA на свой препарат Adcetris, предназначенный для лечения злокачественных опухолей – лимфомы Ходжкина и анапластической крупноклеточной лимфомы. Препарат показан к применению взрослым пациентам с рецидивирующей формой этих заболеваний, а также пациентам, которым не помогают традиционные виды лечения. Adcetris направлен на уничтожение раковых клеток, однако, в отличие от стандартной химиотерапии, лекарство не уничтожает здоровые клетки и ткани организма. Adcetris – первый фармакологический препарат для лечения лимфогранулематоза, одобренный FDA с 1977, и вообще первый препарат, непосредственно рекомендованный для лечения анапластической крупноклеточной лимфомы.


Химиотерапия при лимфоме — это спасение жизни, которую иными способами сохранить не удастся. Конечно лекарства не обещают 100% радикальности, как операция при раке, но вместе с облучением это единственно возможное и эффективное лечение. Проблема в том, что лимфомы способны изменяться, что обещает рецидивы и независимость от терапии.
- Как проходит химиотерапия при лимфоме
- Химиотерапия при лимфоме Ходжкина
- Химиотерапия при неходжкинских лимфомах
- Возможные осложнения после химиотерапии при лимфоме
- Методы химиотерапии при лимфоме
- Противопоказания к применению химиотерапии при лимфоме
- Препараты, применяемые при химиотерапии
- Рацион и диета при химиотерапии при лимфоме
- Прогнозы для пациентов
Как проходит химиотерапия при лимфоме
При подавляющем большинстве злокачественных лимфом или лимфосарком химиотерапия подаётся на первое-второе и на третье, при некоторых клеточных вариантах после первой линии дополняется лучевой терапией в скромных, по сравнению с раковыми заболеваниями, дозах.
Роль облучения — поддержка достигнутого результата и дополнение его позитивом. Сегодня полностью отошли от радикальной программы лучевой терапии, несколько десятилетий доминировавшей при лимфоме Ходжкина, отказавшись от профилактического облучения не поражённых опухоль лимфоколлекторов. Из профилактического — только введение цитостатиков в спинномозговую жидкость, уменьшающее вероятность злокачественного поражения головного мозга и его оболочек.
Сегодняшнее противоопухолевое лечение лимфом отобрало самые результативные комбинации, учитывающие иммуногистохимические характеристики злокачественных клеток. Для каждого прогностического варианта определено оптимальное число циклов, возраст больного и его хронические болезни уже не противопоказание для активного лечения, потому что созданы лекарственные комбинации на все случаи болезни, тем не менее, ограничения по применению цитостатиков включены в стандарты.
Химиотерапия используется всегда, когда в ней есть необходимость и нет абсолютных противопоказаний. На выборе схемы лечения сказываются не только клеточный вариант и прогностические характеристики лимфомы, распространённость болезни по данным ПЭТ-КТ, но и исходное состояние здоровья пациента.
Химиотерапия при лимфоме Ходжкина
Лимфома Ходжкина (или по-старому лимфогранулематоз) — одно из самых благоприятно текущих заболеваний лимфоидной ткани. Ходжкинская лимфома входит в ограниченное число болезней, излечиваемых только одной химиотерапией, но важная ремарка: диагностированная на ранней стадии и с признаками благоприятного течения. Прогноз ожидается малооблачным при небольшом поражении — не более двух групп лимфоузлов в верхней или нижней половине тела — по одну сторону диафрагмы, лучше без вовлечения лимфоузлов средостения и с исходными нормальными клиническими и биохимическими анализами крови.
Каждого пациента после первичного обследования относят к трём основным группам, по стандартам которых будет проводится противоопухолевое лечение, во всех случаях на первом этапе проводится химиотерапия, затем результат закрепляется трёхнедельным облучением зон поражения.
Число курсов зависит от исходного поражения и прогноза, в лучшем случае при лимфоме I-II стадии предложат от 2 до 4 циклов четырёхкомпонентной схемы. При том же объёме поражения, но худших прогностических факторах, потребуется 4-6 курсов. Для повышения результативности первых два цикла у сохранных молодых пациентов заменяют на 6-компонентную схему, затем проводят 2 стандартных ABVD и можно уходить на облучение.
Распространенные стадии не обещают хорошего прогноза, поэтому химиотерапия длительная и многокомпонентная. Причём сколько циклов потребуется — 6 или 8, определят по результатам первых 4 циклов: если опухоль полностью ушла и ПЭТ это покажет — предложат пройти только два цикла, затем назначается трёх-четырёхнедельное облучение. При незначительном эффекте — 8 циклов и лучевая терапия на пораженные лимфоузлы.
У пожилых пациентов, в популяции это каждый третий больной, лечение выбирается с учетом хронической патологии. Так у курильщиков и страдающих болезнями легких в комбинацию не включают блеомицетин, накапливающийся в легочной ткани и вызывающий специфическое воспаление. При сердечной патологии кардиотоксичные антрациклины заменяют на другие противоопухолевые антибиотики.
Лимфома Ходжкина чувствительна к множеству цитостатиков, что позволяет найти оптимальную комбинацию, вплоть до применения одного-единственного цитостатика.
Химиотерапия при неходжкинских лимфомах
Неходжкинские лимфомы представлены множеством морфологических видов, каждый с особенностями течения и лечения. Разберём самые частые варианты заболевания.
Самая благоприятная по течению фолликулярная лимфома встречается в каждом пятом случае злокачественных лимфом у взрослых. В самом начале процесса без явных признаков активности не всегда требуется безотлагательная химиотерапия, у некоторых пациентов прогноз настолько неплох, что можно ограничиться облучением лимфомы либо длительным наблюдением с тщательным мониторингом анализов и регулярным обследованием каждые 3 месяца.
Сразу ХТ начинается только при вовлечении в злокачественный процесс любых органов или при поражении не менее трёх лимфатических зон с размером узлов более 3 сантиметров, или при лихорадке с потливостью, или при плохих показателях крови.
Оптимальный режим — R-CHOP, сочетающий сравнительно мягкие в плане осложнений алкилирующие цитостатики с иммунным препаратом ритуксимабом. Это моноклональное антитело при начальном и прогностически благоприятном процессе используют без ХТ — в монорежиме внутривенно, подкожно каждые 8 недель в течение двух лет применяют для поддержания позитивного результата после завершения циклов.
Вопрос о высокодозной химиотерапии с пересадкой костного мозга ставится при рецидиве или переходе фолликулярной лимфомы в более агрессивную, вероятность чего возрастает с течением времени, так через 10 лет переход в диффузную В-крупноклеточную лимфому отмечается у каждого шестого, а через 15 лет — у каждого второго. По истечении полутора десятилетий после первичного лечения частота рецидивов лимфомы сходит на нет.
У каждого третьего первичного пациента с лимфомой выявляют диффузную крупноклеточную В-клеточную лимфому (ДВКЛ), ежегодно её диагностируют только у пяти из каждых ста тысяч россиян.

Стандарт химиотерапии при неагрессивном варианте ДВКЛ, позволяющий 80% больных прожить дольше пятилетки — 6 циклов комбинации CHOP с ритуксимабом. При полном уничтожении новообразований в результате лекарственного воздействия, возможно подключение лучевой терапии в обычной для лимфом дозе 30-36 грей, а при остаточных опухолевых очагах дозу облучения доводят до 36-40 Грей.
Аналогичная комбинация цитостатиков с иммунным препаратом неважно работает при агрессивном варианте и большом распространении, поэтому химиотерапию усугубляют уменьшением интервалов между циклами R-CHOP или переводят на многокомпонентные комбинации.
При неблагоприятном прогнозе всем пациентам уже на первой линии проводится профилактика поражения головного мозга — введение высоких дох метотрексата и цитарабина в спинномозговую жидкость.
После завершения основной программы поддерживающая химиотерапия не проводится из-за не столь хорошей чувствительности опухолевых клеток к лекарствам. При рецидиве крупноклеточной лимфомы прибегают к комбинациям 2-й линии и трансплантации стволовых клеток крови после высокодозной ХТ.
Периферическая Т-клеточная лимфома — каждый четвёртый случай злокачественного поражения Т-клеточного ростка кроветворения или каждая шестая лимфома. Морфологически группа представлена разнообразными клеточными вариантами. Агрессивно текущее заболевание, как правило, вовлекает не только лимфатические узлы, но и другие органы.
В первой линии используют традиционный CHOP, но в редких случаях удается отказаться от ВДХТ с аутологичной трансплантацией клеток костного мозга. Некоторые виды лимфом благоприятного течения отзываются на облучение и L-аспарагиназу. При отсутствии эффекта лечение подбирается индивидуально.
Лимфомы одного названия предполагают множество различных морфологических вариантов заболевания, внутри групп клетки различаются ИГХ-характеристиками, предполагающими возможности индивидуального подбора противоопухолевого лечения, поэтому специалисты нашей Клиники могут предложить не один-два стандарта, а десятки комбинаций ХТ.
Возможные осложнения после химиотерапии при лимфоме
Тошноту и рвоту уменьшает включение в схемы глюкокортикоидных гормонов. Многокомпонентные комбинации обязательно предваряются введением антиэметиков , приём которых продолжается после завершения терапии.
Для профилактики нейтропении через сутки после цитостатика вводят стимулятор КСФ, что помогает не снижать следующую дозу и не увеличивать интервал без лечения.
Повреждение миокарда характерно для антрациклинов, облучение средостения дополнительно увеличивает кардиотоксичность. Осложнение может проявиться через несколько лет, профилактика не разработана, поэтому у страдающих сердечно-сосудистыми болезнями из схемы исключают антрациклины.
При чувствительности к ХТ и большом распространении лимфомы возможно развитие синдрома лизиса опухоли (СЛО), когда вышедшие из погибшие опухолевых клеток вещества отравляют организм, приводя к почечной недостаточности и гиперкалиемии с фатальной аритмией. Индуцированный лекарствами распад опухоли научились предотвращать.
При пересадке донорского костного мозга высока вероятность отторжения — реакция трансплантат-против-хозяина. При высокодозной терапии отдается предпочтение пересадке собственных клеток даже при угрозе рецидива лимфомы. Рецидив можно вылечить, отторжение трансплантата фатально для пациента.
Методы химиотерапии при лимфоме
Пациент получает лечение всеми способами, кроме внутримышечных инъекций из-за раздражающего действия цитостатиков и опасности осложнений со стороны мягких тканей.
Большинство цитостатиков вводится внутривенно струйно — болюсно или капельно.
Частый компонент схем — преднизолон принимается в таблетках, цитостатик прокарбазин — в капсулах.

Ритуксимаб применяется внутривенно и подкожно, подкожные инъекции удобны для поддержки.
Профилактика нейролейкемии проводится интратекально — введением препарата в спинномозговой канал, потому что организм специальным гематоэнцефалическим барьером защищает головной мозг от проникновения лекарства в крови.
Противопоказания к применению химиотерапии при лимфоме
Абсолютные противопоказания к ХТ при лимфомах — только декомпенсация других хронических заболеваний с существенным снижением функции органов.
Препараты, применяемые при химиотерапии
При лимфомах применяется почти два с половиной десятка противоопухолевых препаратов, из которых составляют несколько десятков схем. Можно пересчитать по пальцам цитостатики, не используемые при лимфосаркомах.
Рацион и диета при химиотерапии при лимфоме
Прогнозы для пациентов
Эффективность лечения оценивают в середине программы и по её окончании, причём оптимально ПЭТ-КТ обследование.
На прогнозе сказывается очень много факторов, для каждого заболевания разработан свой прогностический индекс, поэтому и в диагнозе обязательно указывают прогностическую группу.
В конечном итоге перспективы на дальнейшую жизнь определяет результат химиотерапии и скорость развития рецидива.
Каждому хочется знать — что ждёт впереди, при злокачественном процессе важнее — как лечат и где лечат, потому что без современного обследования невозможно подобрать оптимальную терапию. В Европейской клинике всё проходит на очень высоком уровне, вы можете лично убедиться в этом.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
К концу ХХ века 10–летняя безрецидивная выживаемость больных лимфомой Ходжкина, по данным крупных исследовательских центров, при ранних стадиях достигла 90%: EORTC (Европейская организация по исследованию и лечению рака), 1993 г. – 92%, Stanford, 1997 г. – 93%, Harvard, 1999 г. – 96%, РОНЦ, 1988 г. – 89%. При распространенных стадиях 5–летняя выживаемость при этом заболевании, по данным NCI (Национальный раковый институт, США), 1999 г. достигает 60% [1,5]. В течение двух последних десятилетий прошлого века проводились многочисленные клинические исследования – велся целенаправленный поиск наилучшей комбинации химиотерапии и оптимального сочетания лучевой и химиотерапии при лечении больных лимфомой Ходжкина (название употребляется в соответствии с классификацией лимфом, принятой ВОЗ в 2001 г.). Анализ этих исследований позволил предложить новую комбинацию факторов риска и иное разделение больных по прогностическим группам при выборе программы лечения. Появились и новая стратегия лечения, и новые терапевтические программы.
В конце 70–х годов на смену радикальной лучевой терапии при I–III А стадиях лимфомы Ходжкина приходит комбинированное химио–лучевое лечение. К этому времени по результатам радикальной лучевой терапии определены прогностические факторы для I–II стадий лимфомы Ходжкина [6,9]. Набор прогностических факторов несколько варьировал у различных исследовательских групп, но в целом к неблагоприятным прогностическим факторам для I и II стадий были отнесены следующие факторы: возраст старше 40 (или 50) лет, поражение 3 и более лимфатических областей (или 4 и более), СОЭ выше 30 мм/час при наличии симптомов интоксикации и выше 50 мм/час при их отсутствии, гистологические варианты смешанноклеточный и лимфоидное истощение, а также массивное (медиастинально–торокальный индекс (МТИ) более 0,33) поражение медиастинальных лимфатических узлов. Эти прогностические факторы разделяли только больных с I и II стадиями лимфомы Ходжкина на две группы, нуждающиеся в различном объеме лечения.
Во второй половине 90–х годов EORTC и Германской группой по изучению лимфомы Ходжкина (GHDG) был проведен многофакторный анализ прогностических факторов. В исследование было включено более 14000 больных [5]. Этот анализ показал, что для всех больных лимфомой Ходжкина при использовании химиотерапии и комбинированного лечения, кроме стадии заболевания и симптомов интоксикации, прогностически значимыми являются только следующие факторы:
1. Массивное поражение средостения (МТИ >0,33).
2. Массивное поражение селезенки (наличие 5 и более очагов или увеличение органа с его диффузной инфильтрацией).
4. Поражение трех или более областей лимфоузлов.
5. Увеличение СОЭ>30 мм/час при стадии Б и >50 мм/час при стадии А [2,3,5].
Эти факторы в совокупности со стадией заболевания и симптомами интоксикации позволили исследователям из GHDG разделить больных лимфомой Ходжкина на прогностические группы. В соответствии с объемом опухолевой массы были выделены три прогностические группы – с благоприятным, промежуточным и неблагоприятным прогнозом (табл. 1), и тем самым выбор программы лечения был поставлен в прямую зависимость от объема опухолевой массы.
Адекватные дозы лучевой терапии на каждое лучевое поле для лимфомы Ходжкина были разработаны H. Kaplan в 60–х годах. Именно он показал, что при дозе облучения в 30 Гр риск рецидива в облученном поле составляет всего 11%, а в интервале доз от 35 до 40 Гр снижается лишь до 4,4%, но 100–процентная эффективность все равно не достигается при дальнейшем повышении дозы облучения. Еще трижды, в середине 70–х годов Fletcher G.H. и Shukovsky L.G., в начале 90–х годов Brincker H. и Bentzen S.M. и в конце 90–х годов M.Loeffler с соавторами проводили анализ эффективности различных доз лучевой терапии для больных с лимфомой Ходжкина [2,3,5,6]. Все три исследования на большом клиническом материале подтвердили выводы, сделанные H. Kaplan, о достижении максимальной тумороцидной дозы в интервале между 30 и 40 Гр и нецелесообразности превышения дозы локального облучения выше 40 Гр, в том числе и на большие опухолевые массы. Brincker H. и Bentzen S.M. при анализе всех опубликованных исследований с 1960 по 1990 гг. показали, что при проведении только радикальной лучевой терапии 95% контроль за лимфомой Ходжкина достигается для лимфатических узлов размером менее 6,0 см при дозе 26,5 Гр, а для лимфатических узлов более 6,0 см при дозе 32,5 Гр [6]. Эти данные были подтверждены клиническим исследованием M.Loeffler с соавторами (1997 г.), которое показало, что при использовании 20 Гр, 30 Гр и 40 Гр на зоны исходно пораженных лимфатических узлов (на большие массивы доза облучения всегда достигала 40 Гр) в рамках комбинированной химио–лучевой терапии не выявлено различия в результатах лечения: 4–летняя выживаемость, свободная от неудач лечения, составила 86%, 80% и 90% соответственно, а общая выживаемость – 93%, 94% и 88% (р=0,5) [5].
До настоящего времени при лечении первичных больных лимфомой Ходжкина использовались две основные схемы полихимиотерапии – схема МОРР (и ее аналоги) и схема ABVD. Длительный, 30–летний спор о преимуществе одной из схем был решен в последнее десятилетие в пользу программы ABVD. В конце 80–х – начале 90–х годов три крупные исследовательские группы опубликовали результаты больших рандомизированных исследований. Эти исследования показали статистически значимое преимущество комбинированных программ, в которых использовалась полихимиотерапия по схеме ABVD, по сравнению с программами со схемой МОРР. В исследовании EORTC (1997 г.) при одинаковой 10–летней общей выживаемости (больные с I–II стадиями лимфомы Ходжкина и неблагоприятным прогнозом, 6 циклов полихимиотерапии и лучевая терапия) риск неудачи лечения к 10 годам составил 24% для больных, получавших химиотерапию МОРР, и 12% для больных, получавших химиотерапию ABVD (p 2 , блеомицин 10 мг/м 2 , винбластин 6 мг/м 2 , дакарбазин 375 мг/м 2 , все препараты вводятся в 1 и 15–й дни с интервалом в 2 недели) была признана приоритетной для первичных больных с лимфомой Ходжкина.
В последние десятилетия комбинированное химио–лучевое лечение прочно заняло лидирующее положение в лечении всех первичных больных лимфомой Ходжкина.
Лечение больных с благоприятным прогнозом
Эта группа больных малочисленна и требует небольшого объема лечения. Во всех исследованиях длительная (10–летняя и более) выживаемость в этой группе достигает 96–100%. За последние два десятилетия в этой группе больных несколькими крупными рандомизированными исследованиями было доказано преимущество комбинированной терапии. В исследовании EORTC 6–летняя выживаемость, свободная от неудач лечения, составила в группе комбинированного лечения 90%, в то время как в группе, получавшей радикальную лучевую терапию, лишь 81% – p 2 1–й и 8–й дни, адрибластин 35 мг/м 2 1–й и 15–й дни, преднизолон 50 мг внутрь с 1–го по 28 день ежедневно, этопозид 100 мг/м 2 в/в с 15–го по 19 день ежедневно, блеомицин 10 мг/м 2 1–й и 8–й дни). После двухнедельного интервала следует лучевая терапия на зоны исходного поражения. Вся программа выполняется за 10 недель [5]. В 1978–88 гг. в РОНЦ им. Н.Н. Блохина РАМН также проводилось рандомизированное исследование по лечению этой группы больных (85 человек). Сравнивалась комбинированная терапия (4 цикла CVPP + облучение зон исходного поражения) и радикальная лучевая терапия. Шестилетняя выживаемость, свободная от неудач лечения, составила 88% и 63% соответственно – p
Лечение больных промежуточной прогностической группы
Эта группа больных лимфомой Ходжкина наиболее многочисленна, и принципиальное преимущество комбинированной терапии для этой группы больных было доказано еще к началу 90–х годов. В рандомизированном исследовании EORTC (1977–1982 гг.) 15–летняя общая выживаемость оказалась одинаковой – 69%, но риск рецидива на этот срок в группе больных, получавших радикальную лучевую терапию, составил 35% по сравнению с 16% в группе комбинированного лечения – p
Лечение больных неблагоприятной прогностической группы
Для лечения этой группы больных всегда использовалась полихимиотерапия. Непосредственная эффективность лечения достигала 60–80% полных ремиссий, но 5–летняя выживаемость редко превышала 60%, а выживаемость, свободная от неудач лечения, достигла лишь 40% [2,3,5]. В начале 80–х годов две группы исследователей (из Ванкувера и из Милана) предложили объединить в одной программе обе схемы полихимиотерапии первой линии (MOPP и ABVD) для повышения эффективности терапии. В 80–х – начале 90–х годов 9 крупных исследовательских групп провели многоцентровые рандомизированные исследования, пытаясь доказать преимущество 7–8–компонентной полихимиотерапии перед 4–компонентной. Только в 3 из 9 исследований было показано незначительное преимущество многокомпонентной химиотерапии перед 4–компонентной по безрецидивной выживаемости, однако остальные 6 исследований не выявили никаких различий [4,5].
В начале 90–х годов две группы исследователей – из Стэнфорда и из Германии (GHSG) – независимо друг от друга предложили новую концепцию для лечения этих больных. Проанализировав предшествовавшие программы лечения в большой группе больных (более 700 человек в группе GHSG), эти исследователи предложили иные принципы интенсификации лечения. Кроме объединения в одной схеме основных препаратов первой линии и эскалации доз, был сокращен интервал между циклами химиотерапии, чем достигалась более высокая еженедельная дозная нагрузка в течение всей программы лечения. Широкое внедрение в лечебную практику гранулоцитарных и макрофагальных колониестимулирующих факторов (граноцит, нейпоген, лейкомакс) позволило проводить всю программу лечения в оптимальном режиме без удлинения интервалов.
Стэнфордская группа предложила программу Stanford V, а GHSG – схемы ВЕАСОРР–базовый и ВЕАСОРР–эскалированный с добавлением лучевой терапии в дозе 30–36 Гр на зоны исходно больших массивов и/или остаточные опухолевые массы. Программа Stanford V состоит из 12–недельной беспрерывной полихимиотерапии и последующей лучевой терапии у больных, не достигших полной ремиссии. Лечение получили 126 больных и при 4,5–летней медиане наблюдения прогнозируемая 8–летняя общая выживаемость составила 96%, а выживаемость, свободная от неудач лечения – 89% [5]. GHSG предложила программу, состоящую из 8 циклов полихимиотерапии ВЕАСОРР базового или эскалированного уровня с последующим облучением. Эта исследовательская группа представила наиболее убедительные доказательства преимущества нового принципа лечения в рандомизированном многоцентровом исследовании. Было проведено сравнение 8 циклов ВЕАСОРР базового (циклофосфамид 650 мг/м 2 в 1–й день, адрибластин 25 мг/м 2 в 1–й день, вепезид 100 мг/м 2 1–3–й дни, прокарбазин 100 мг/м 2 1–7 дни, преднизолон 40 мг/м 2 1–8 дни, блеомицин 10 мг/м 2 в 8–й день и винкристин 1,4 мг/м 2 в 8–й день, курс возобновляется на 21–й день) и эскалированного (по дозам адрибластина, вепезида и циклофосфамида) уровней, со стандартной полихимиотерапией СОРР/ABVD (4 двойных цикла). Облучение зон исходно больших массивов и/или остаточных опухолевых масс проводилось во всех трех сравниваемых программах. Всего в исследование было включено 689 больных. Частота полных ремиссий составила 83%, 88% и 95% в группах больных, получавших полихимиотерапию СОРР/ABVD, ВЕАСОРР–базовый и ВЕАСОРР–эскалированный. Статистически значимо больше было больных с прогрессированием заболевания в группе, получавшей СОРР/ABVD – 13% по сравнению с 9% и 2% соответственно в группах, получавших ВЕАСОРР–базовый и ВЕАСОРР–эскалированный, что и обеспечило лучшую 2–летнюю выживаемость, свободную от неудач лечения в группах, получавших ВЕАСОРР: 72%, 81%, 89% соответственно, р Заключение
Таким образом, прошедшее столетие показало возможность излечения большинства больных лимфомой Ходжкина, а на рубеже столетий были сформулированы новые концепции лечения этих больных. Ушли в прошлое радикальная лучевая терапия и широкопольное облучение. Лучевая терапия стала применяться для всех больных только в сочетании с химиотерапией, исключительно на зоны поражения и в дозах не выше 30–40 Гр. Четко определилась тенденция к дальнейшему снижению суммарных очаговых доз облучения.
Основным лечебным принципом стало соответствие объема терапии объему опухолевой массы. Разделение больных на прогностические группы в соответствии с объемом опухолевой массы позволило более адекватно выбирать программу лечения. Так, для благоприятной прогностической группы с минимальным объемом поражения показан минимальный объем лечения – 2–4 цикла химиотерапии + облучение только исходно пораженных лимфатических коллекторов; для промежуточной прогностической группы – 4–6 циклов полихимиотерапии + облучение только исходно пораженных зон; для неблагоприятной прогностической группы с большим объемом опухоли максимальный объем лечения – 8 циклов полихимиотерапии + облучение зон исходно больших массивов и/или зон с остаточными лимфатическими узлами.
1. Клиническая онкогематология.// Ред. Волкова М.А. // Москва, Медицина, 2001.
2. Bailliere’s Clinical Haematology. International Practice and Research. Hodgkin’s Disease. // Guest editor V. Diehl. – 1996.
3. Cancer. Principles & Practice of Oncology. 4th Edition. // Ed. by V.T.DeVita, S. Hellman, S.A. Rosenberg // Philadelphia. – 1993. – V 2. – Р. 1819–1858.
4. Diehl V., Franklin J., Hansenclever D. et al. // Ann. of Oncol. – 1998. – V 9. (Suppl 5). – P. 68 – 71.
5. Hodgkin’s disease. // Ed. by Mauch P.V., Armitage J.O., Diehl V. et al // Philadelphia. – 1999.
6. Brincker H., Bentzen S.M.//Radiotherapy & Oncology, 30 (1994), 227–230.
7. Ruffer J–U., Sieber M., Pfistner B., et al.// Leukemia & Lymphoma –2001. – V 42 (Suppl. 2). – Abstr. P–095.– P.54
8. Zittoun R., Audebert A., Hoerni B. Et al.// J. Clin/ Oncol. – 1985. – V 3. – P. 203–214.
Читайте также:

