Результаты лечения лимфомы ходжкина у подростков
Эта онкологическая патология получила свое название по фамилии доктора, который впервые описал ее еще в 19 веке, — Томаса Ходжкина.
Прогноз в отношении опухолей данного типа достаточно благоприятный: исходя из стадии, на которой обнаружена онкопатология и начато лечение, он колеблется от 45 до 95%. В целом эксперты говорят о 80% пятилетней выживаемости пациентов.
Симптомы лимфомы Ходжкина
Манифест ЛХ практически всегда начинается с увеличения лимфатических узлов в размерах. При этом они остаются безболезненными при пальпации и не возвращаются к нормальным размерам даже после нескольких курсов терапии антибактериальными препаратами.
На начальных стадиях в процесс вовлекаются лимфоузлы, расположенные выше диафрагмы – шейные, надключичные, реже – подмышечные, а также расположенные в области средостения. В исключительных случаях лимфогранулематоз может начинаться в нижней части тела – лимфоузлах брюшной полости или паха.
Помимо увеличенных лимфатических узлов пациента могут беспокоить следующие нетипичные и типичные симптомы лимфомы Ходжкина:
- общее ухудшение самочувствия, выражающееся в вялости, упадке сил, выраженной повышенной утомляемости и сонливости, головных болях, головокружении, тошноте;
- периодическое повышение базальной температуры тела до субфебрильных значений и выше, сменяющиеся периодами, когда температура остается в пределах нормальных показателей;
- ночные проливные поты;
- потеря или уменьшение аппетита, и, как следствие, значительная утрата массы тела за короткий период;
- повышенная восприимчивость к простудам, вирусам и инфекциям;
- при поражении лимфоузлов в области средостения – одышка, непродуктивный кашель, сложности вдоха, при локализации в зоне пищевода – затрудненное глотание, при развитии онкопроцесса в паховых лимфоузлах – кожные изъязвления;
- обширный кожный зуд, раздражение и сухость кожи;
- редко – боли в пораженных лимфоузлах на фоне приема алкоголя.
По мере развития заболевания больной может испытывать достаточно интенсивные боли в измененных лимфоузлах или внутренних органах.
Стадии лимфомы Ходжкина
Прежде, чем перейти к стадированию, следует кратко остановиться на видах лимфогранулематоза. В современной медицинской классификации, исходя из преобладания в пораженной области тех или иных атопичных клеток, выделяют четыре гистологических разновидности данной онкопатологии:
- нодулярный склероз – классическая лимфома Ходжкина, диагностируемая примерно у половины пациентов с лимфогранулематозом;
- смешанно-клеточная лимфома (распространенность в общей массе порядка 35%)
- лимфоидное истощение (распространенность до 10%);
- лимфоидное преобладание – наиболее редкий вид лимфогранулематоза, выявляемый примерно у 3-5% пациентов.
Независимо от вида, все злокачественные образования ходжкинской группы классифицируют на стадии. В зависимости от запущенности патологии и объема вовлеченности в процесс органов и узлов выделяют четыре стадии лимфомы Ходжкина.
- Стадия I: определяется как распространение заболевания на одну группу лимфоузлов либо один нелимфатический орган.
- Стадия II: диагностируется при вовлечении в онкопроцесс двух и более групп лимфоузлов, находящихся по одну сторону диафрагмы, либо одного органа, не относящегося к лимфатической системе, и одной группы узлов, при условии, что они находятся только выше или только ниже диафрагмы.
- Стадия III: о ней есть предпосылки говорить, когда лимфогранулематоз поражает лимфоузлы по обе стороны диафрагмы, а также селезенку либо нелимфатический внутренний орган.
- Стадия IV: на этой стадии у больного наблюдается генерализованный злокачественный патологический процесс, охватывающий несколько групп лимфоузлов и несколько органов, находящихся в разных частях организма.
Успешность лечения напрямую зависит от стадии, на которой было обнаружено заболевание. Наиболее охотно поддающимися терапии являются первая и вторая стадии. На последней стадии вероятность излечения сводится к половине диагностированных случаев. Тем не менее, при грамотно разработанной тактике лечения и ответственном отношении к терапии самого пациента это вполне возможно.
Причины лимфомы Ходжкина
Несмотря на более чем двухсотлетнюю историю изучения этой онкологической болезни, на сегодняшний день точно ответить на вопрос, почему возникает лимфогранулематоз, невозможно.
Известно, что значимым фактором риска является наследственная предрасположенность и генные мутации клеток, из которых состоит лимфатическая система человека. Кроме того, в качестве вероятных предпосылок называют:
- наличие вируса Эпштейна-Барр либо Т-лимфотропного вируса человека;
- сбои в работе иммунной системы, частью которой является лимфатическая. Иммунодефицит может быть как врожденным, так и приобретенным. К подобным состояниям приводят аутоиммунные заболевания, ВИЧ и ряд других;
- проживание на протяжении длительного времени на радиоактивно загрязненных территориях;
- регулярный контакт с химическими веществами, являющимися потенциальными канцерогенами;
- избыточное облучение ультрафиолетом – чрезмерное пребывание на постоянной основе под прямыми солнечными лучами.
- прием некоторых медицинских препаратов.
Также определенное влияние на вероятность возникновения и развития лимфомы Ходжкина оказывает неправильный образ жизни, малая подвижность, несбалансированное питание, ожирение 2 и выше степени, злоупотребление алкоголем и никотином.
Диагностика лимфомы Ходжкина
Определяющим методом в диагностике лимфогранулематоза является взятие ткани из пораженного лимфоузла либо нелимфатического органа для проведения гистологического и цитогенетического исследований. Биопсия проводится пункционным, лапароскопическим либо хирургическим способом – в зависимости от локализации опухоли. Если поражена селезенка – ее, как правило, удаляют для проведения дальнейших исследований.
Кроме того, пациента опрашивает и осматривает специалист-онкогематолог, собирая личный и семейный анамнез, после чего могут назначаться:
- гемограмма (общеклинический анализ крови, позволяющей определить отклонение от референсных значений показателей гемоглобина, лейкоцитов и СОЭ);
- другие анализы сыворотки крови: биохимический, иммунологический, на онкомаркеры;
- инструментально-аппаратные исследования: рентгенография, КТ, МРТ, УЗИ, ПЭТ-сканирование с радиоактивной глюкозой, сцинтиграфия с контрастным реагентом, пункция костного мозга и другие.
Лечение лимфомы Ходжкина
Лечение злокачественных новообразований подбирается исходя из нескольких факторов: вида и стадии лимфогранулематоза, возраста и состояния здоровья пациента, наличия или отсутствия хронических заболеваний. Действующими протоколами предусмотрено назначение химиотерапии и радиотерапии.
Химиотерапия может быть стандартной либо высокоагрессивной – если в первом случае необходимый эффект не был достигнут. Она проводится с использованием больших доз препаратов-цитостатиков. Как правило, после окончания лечения высокодозной химиотерапией пациент нуждается в аутотрансплантации костного мозга. Иногда для облегчения протекания воспалительных процессов и снижения иммунного отклика организма в схему добавляются препараты-стероиды.
Лучевая терапия как самостоятельный метод лечения лимфомы Ходжкина применяется очень ограниченно: на первых стадиях, когда локализация опухолевого процесса охватывает одну группу лимфоузлов либо один нелимфатический орган, целенаправленное облучение способно дать позитивный эффект. На четвертой стадии лимфомы Ходжкина радиочастотное воздействие назначается в тех случаях, когда пациент по состоянию здоровья не способен перенести химиотерапию. В этом случае главная цель врачей – замедлить рост опухоли и продлить жизнь больного, по максимуму сохранив ее качество.
Наиболее выраженный положительный результат дает комбинированное химиолучевое лечение. В этом случае основная задача по уничтожению аномальных клеток возлагается на цитостатики, а лучевая терапия служит для закрепления эффекта.
Хирургическое вмешательство как лечебный подход при лимфогранулематозе используется крайне редко – преимущественно на самых ранних стадиях, когда зона поражения минимальна и локализована.
Пациентам с запущенной болезнью, не получившим ожидаемого результата от химиолучевой терапии, предлагается паллиативное лечение, направленное, в основном, на эффективное обезболивание и максимально возможное поддержание жизнедеятельности внутренних органов.
Прогноз в отношении лимфомы Ходжкина является достаточно благоприятным. В большинстве случаев болезнь хорошо поддается лечению, поэтому при своевременном установлении диагноза и назначении терапии длительная (пятилетняя) ремиссия, приравниваемая к полному выздоровлению, наблюдается у 95% детей и подростков.
У взрослых картина несколько менее позитивная: однолетняя выживаемость составляет 93%, пятилетняя – 82%, 10-летняя – 73%, 15-летняя – 63% (статистические данные США).
Чем на более поздней стадии обратился за помощью больной, тем менее благоприятным будет прогноз, который, к тому же, осложняется в случае неудовлетворительного общего состояния здоровья.
Рекомендации, касающиеся профилактики ЛХ, аналогичны рекомендациям в отношении любого онкологического заболевания. Это ограничение пребывания под прямыми солнечными лучами, контакта с радиацией, химическими-веществами-канцерогенами, а также здоровый образ жизни – сбалансированное, максимально чистое питание, достаточная физическая активность и отказ от вредных привычек.
Информация для родителей
Лимфома Ходжкина (болезнь Ходжкина или лимфогранулематоз) – злокачественное заболевание лимфатической системы.
Причины развития
Лимфома Ходжкина (ЛХ) возникает из-за злокачественного изменения (мутации) В-лимфоцитов. В-лимфоциты — это белые кровяные клетки крови, которые находятся в основном в лимфатической ткани. Поэтому лимфома Ходжкина может развиваться везде, где есть лимфатическая ткань, также она может поражать и другие органы (печень, костный мозг, лёгкие и/или селезёнку).
Распространенность
- Лимфома Ходжкина занимает 5-е место в структуре заболеваемости у детей и подростков и состаляет 5-7%.
- Заболеваемость лимфогранулематозом в России составляет 0,8 на 100 тыс. детского населения.
- Наиболее часто болеют дети и подростки старше 11 лет.
- В детском и подростковом возрасте мальчики болеют немного чаще, чем девочки, соотношение по полу составляет 1,6 : 1 (мальчики : девочки).
Формы
Морфологическим субстратом опухоли являются клетки Березовского-Штенберга-Рид, однако, их количество в опухолевой ткани редко превышает 10%. Второй вариант клеток – клетки Ходжкина, которые являются провариантом клетки Березовского-Штенберга-Рид. В зависимости от того, как выглядит ткань опухоли под микроскопом, выделяют пять форм лимфомы Ходжкина.
- Вариант болезни Ходжкина с лимфоцитарным преобладанием составляет 5-6% от всех случаев ЛХ. Клеток Березовского-Штенберга-Рид очень мало.
- Смешанно-клеточный вариант диагностируется у трех четвертей пациентов. Клетки Березовского-Штенберга-Рид и клетки Ходжкина встречаются в достаточном количестве.
- Лимфоцитарное истощение – наиболее редко встречающийся морфологический вариант опухоли (менее 1%).
- Наиболее часто встречается вариант лимфомы Ходжкина с нодулярным склерозом.
- При нодулярном лимфоидном преобладании ткань лимфатического узла полностью или частично замещена инфильтратом нодулярного строения, часто сочетающегося с зонами диффузного роста.
Клинические стадии
Клиническая стадия определяется согласно классификации Ann Arbor (1971), дополненной рекомендациями, принятыми в Котсвольде (1989):
I стадия — поражение одной или двух группы лимфатических узлов (I) или одного нелимфатического органа (или ткани) — (IE);
II стадия — поражение двух или более лимфатических областей по одну сторону диафрагмы (II) или вовлечение одного нелимфатического органа (или ткани) и одной (или более) лимфатических областей по одну сторону диафрагмы (IIE), поражение селезенки (IIS);
III стадия — поражение лимфатической системы по обе стороны диафрагмы (III), которое может сочетаться с локализованным вовлечением одного нелимфатического органа или ткани (IIIE), или с вовлечением селезенки (IIIS), или поражением того и другого (IIIES);
IV стадия — распространенное поражение одного и более нелимфатических органов (легких, плевры, перикарда, костного мозга, костей и проч.) в сочетании или без вовлечения лимфатических узлов.
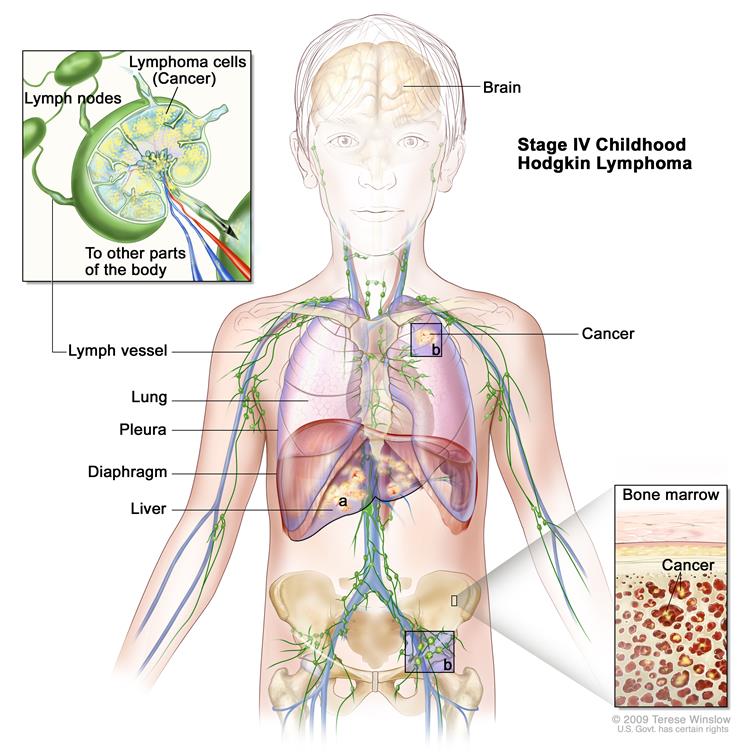
На рис. 1 представлены зоны поражения при лимфоме Ходжкина.
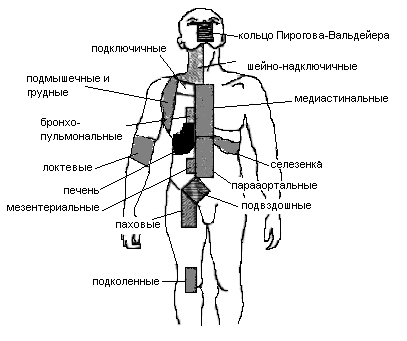
Рис. 1. Зоны поражения при болезни Ходжкина
Симптомы
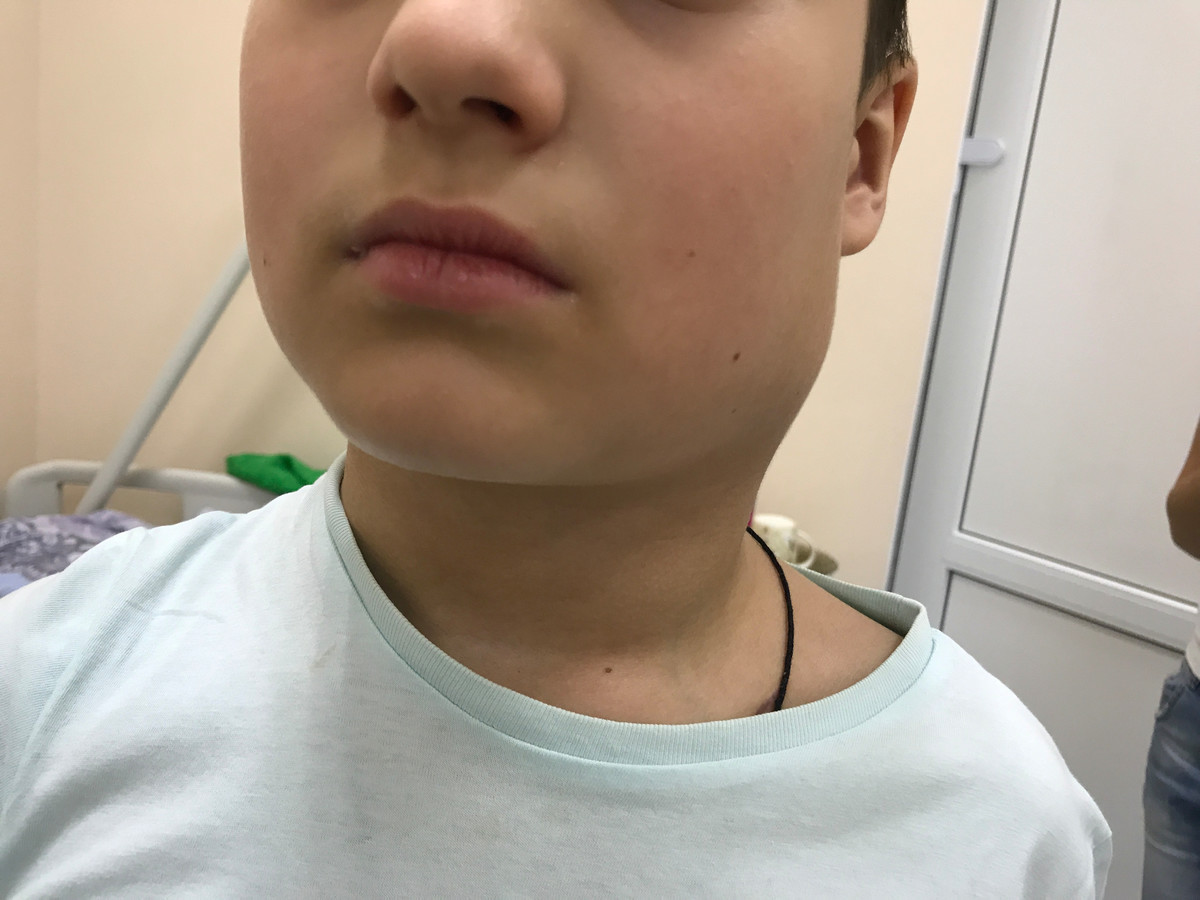
Рис. 2. Поражение шейных лимфатических узлов при лимфоме Ходжкина.
Если увеличенные лимфоузлы находятся в грудной клетке (средостении) (рис. 3), могут появляться приступы кашля или одышка.
Иногда увеличиваются печень и селезенка (в медицинской практике это называется гепатомегалия и спленомегалия).
Поражение ЦНС может развиться в далеко зашедших случаях лимфомы Ходжкина.
Поражение костей: чаще поражаются позвонки, тазобедренные суставы.
Вовлечение костного мозга встречается в 5-10% случаев болезни Ходжкина.
Для стадирования необходимо учитывать биологическую активность заболевания. Определяется она на основании двух и более следующих показателей: СОЭ ≥ 30 мм/час; фибриноген ≥ 4 г/л; альбумин ≤ 40 %; СРБ (++ и более); число лейкоцитов ≥ 12х10 /л; альфа-2-глобулин ≥ 12%
Диагностика
Если после тщательного осмотра педиатр находит признаки лимфомы Ходжкина, то он дает направление в специализированный стационар (клинику детской онкологии и гематологии).
В стационаре проводятся:
- Исследование пораженной ткани. Основным методом диагностики лимфомы является биопсия (оперативное удаление пораженного лимфатического узла или ткани и изучение материала под микроскопом). По результатам исследования образца ткани можно точно определить, болен ребенок лимфомой Ходжкина, и если да, то каким именно ее видом.
- Анализ распространенности болезни в организме. После установления диагноза необходимо выяснить, насколько болезнь успела распространиться по организму и какие органы она успела поразить. С этой целью выполняют ПЭТ-КТ всего тела с глюкозой. По показаниям проводят исследование костного мозга (трепан–биопсия костного мозга у больных с IВ, IIB-IV стадиями), остеосцинтиграфию, МРТ при костных поражениях.
- Если в анамнезе имеется сердечно-сосудистая патология, выслушивается сердечный шум, выполняется ФВЛЖ (функция выброса левого желудочка).
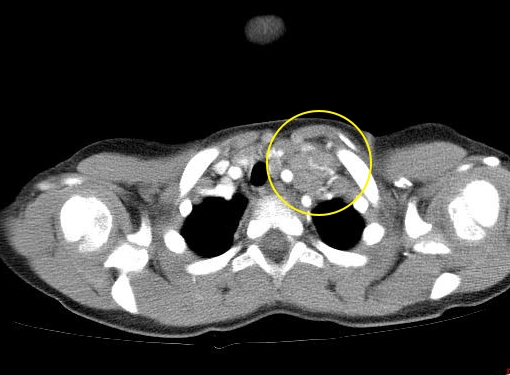
Рис. 3. Поражение внутригрудных лимфатических узлов при лимфоме Ходжкина
Современные подходы к лечению
Основное место в лечении лимфомы Ходжкина занимает химиотерапия.
Химиотерапия – это лечение лекарственными препаратами (цитостатиками), которые блокируют деление или убивают опухолевые клетки. Максимального эффекта можно добиться используя комбинации цитостатиков (полихимиотерапия — ПХТ), которые по-разному действуют на клетки.
Полихимиотерапия проводится в соответствии с группой риска, в которую отнесен больной при первичном стадировании, в специализированном стационаре.
Первый цикл ПХТ начинается сразу же после подтверждения диагноза и установления стадии, в случае проведения оперативного лечения полихимиотерапия начинается через 5 дней после операции.
После химиотерапии проводится лучевая терапия (облучение) пораженных зон. Лучевая терапия должна начинаться в течение 14 дней от окончания химиотерапии при нормальных показателях крови.
В России сегодня используются две основные программы лечения лимфомы Ходжкина: DAL-HD и СПбЛХ. Оба протокола включают в себя полихимиотерпию и завершающую лучевую терапию. Количество циклов ПХТ зависит от стадии болезни и от выбора терапевтической группы, по которой лечат пациента. Больные обычно получают следующую программу: при благоприятных вариантах (1-я группа риска) – 2 цикла химиотерапии, при промежуточном прогнозе (2-я группа риска) – 4 цикла химиотерапии, при неблагоприятных вариантах (3-я группа риска) – 6 циклов химиотерапии. Разделение больных на группы риска имеет некоторые отличия в зависимости от применяемого протокола.
В программе DAL-HD используются схемы OPPA/OEPA и COPP. В протоколе СПбЛХ – схемы VBVP и ABVD.
Лучевая терапия
Завершающим этапом лечения лимфомы Ходжкина является облучение всех пораженных зон лимфатических узлов. Как правило, лучевую терапию начинают через 2 недели после окончания лекарственной терапии при нормализации показателей крови.
Доза облучения зависит от полноты ремиссии после лекарственной терапии: при достижении полной ремиссии (исчезновение всех клинических и радиологических признаков заболевания) в лимфатической зоне по данным ПЭТ-КТ доза облучения составляет 20 Гр. Если размер опухоли после полихимиотерапии уменьшился на 75% и более от первоначальной опухоли и/или отмечается снижение гиперфиксации РФП по ПЭТ-КТ до 2-3 по Deauville, то доза облучения составляет 25 Гр. При уменьшении опухолевых образований менее чем на 75% и/или сохранении гиперфиксации РФП по ПЭТ-КТ 4-5 по Deauville, то дозу облучения увеличивают до 30 Гр.
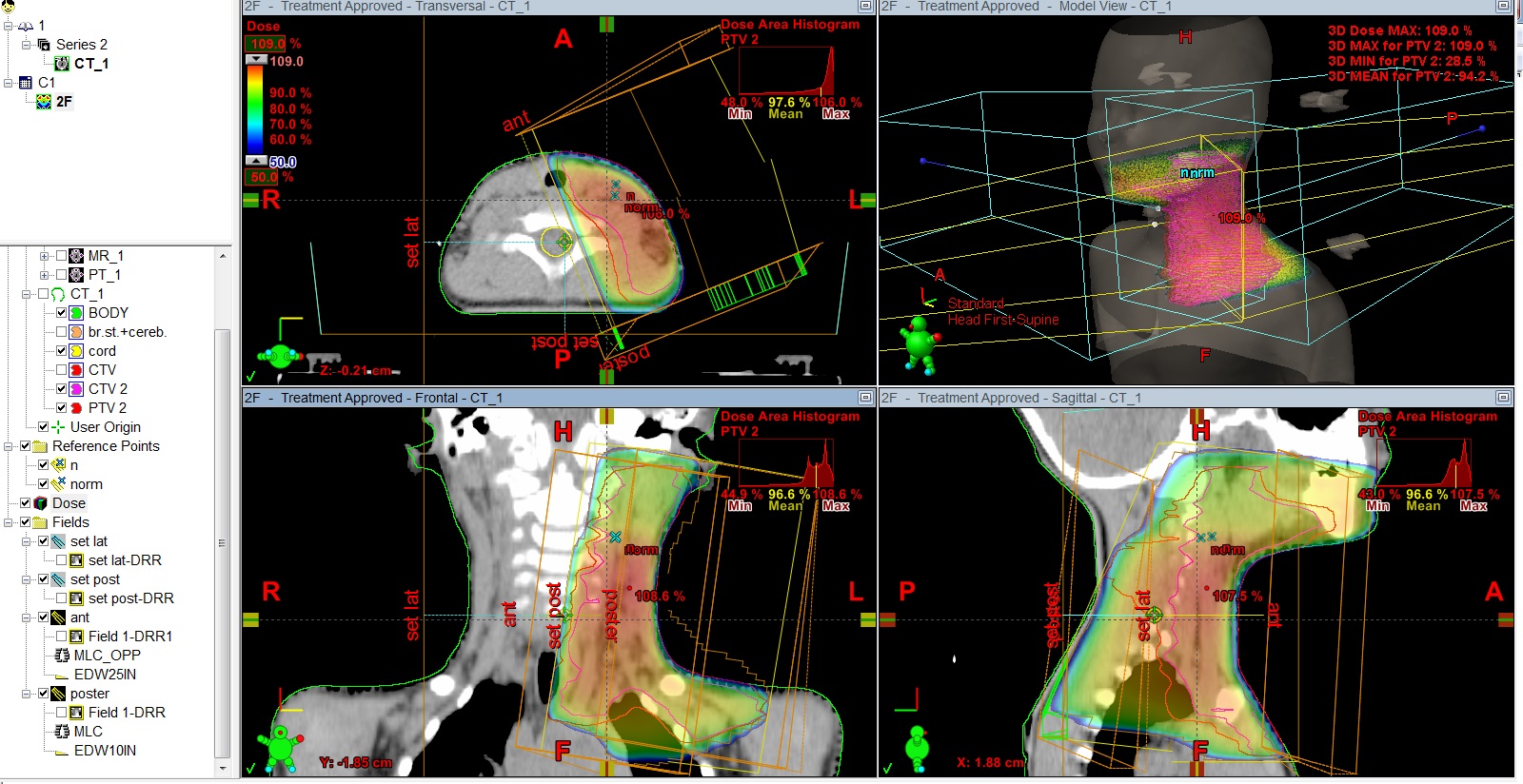
Рис.5 План лучевого лечения. Пациент И., 4 года 6 мес. Лимфома Ходжкина IIст. с поражением шейных, надключичных, подключичных л/у слева, вилочковой железы, носоглотки. Состояние после 4 курсов курсов ПХТ, ремиссия. Облучение шейно-над-подключичных л/у слева с консолидирующей целью, СОД 20 Гр.
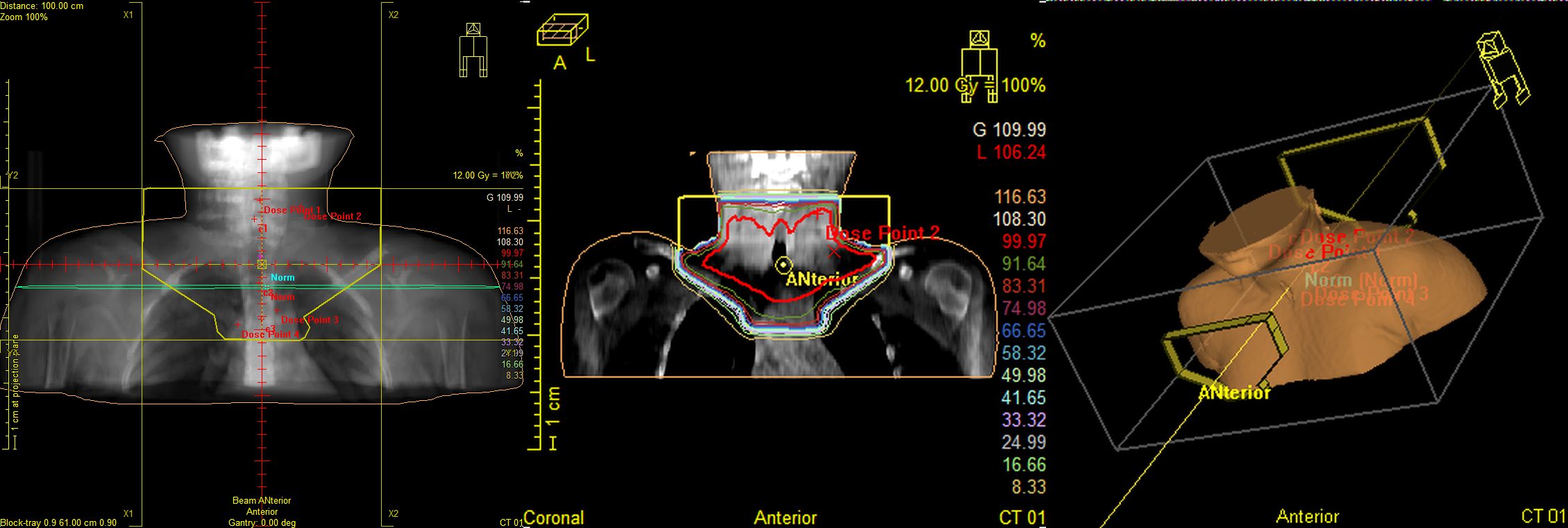
Рис.6 Пациентка М., 11лет. Лимфома Ходжкина II ст. с поражением мягких тканей шеи, лимфатических узлов шеи. Состояние после 2 курсов ПХТ. По данным контрольного ПЭТ/КТ метаболически значимых очагов не выявлено, ремиссия. Проведение лучевой терапии первично вовлеченных зон в суммарной очаговой дозе 20,0Гр с целью консолидации.
Критерии оценки полноты ремиссии
Критерии оценки ремиссии нужны врачу для определения необходимости продолжения лечения или интенсификации программ терапии, либо перевода пациента под динамическое наблюдение.
- Полная ремиссия — полный регресс всех признаков заболевания (клинических, гематологических и других проявлений болезни) по данным визуализирующих методов обследования, определяемая дважды с интервалом не менее 4 недель.
- Частичная ремиссия — уменьшение размеров опухолевых образований не менее, чем на 50% на срок от 4 недель при отсутствии новых очагов поражения.
- Стабилизация заболевания – уменьшение размеров опухолевых образований менее, чем на 50% или увеличение их не более, чем на 25% от первоначального объема при отсутствии новых очагов поражения.
- Прогрессирование — появление в процессе лечения новых очагов поражения или увеличение ранее имевшихся более, чем на 25%, а также появление симптомов интоксикации.
- Рецидив — появление новых очагов поражения после достижения полной ремиссии.
Диспансерное наблюдение
Наблюдение детей и подростков с лимфомой Ходжкина проводится в течение не менее 3-х лет после завершения лечебной программы.
В первом квартале пациент обследуется каждый месяц, в последующие 9 месяцев – каждый квартал и в последующие годы – раз в полгода.
Лимфома Ходжкина относится к числу наиболее излечиваемых онкологических заболеваний и около 80% пациентов живут более 10 лет после окончания лечения.

Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лимфома Ходжкина у детей (болезнь Ходжкина, лимфогранулематоз) - злокачественная опухоль лимфоидной ткани, имеющая специфическую гранулематозную гистологическую структуру. Заболевание встречается во всех возрастных группах, за исключением детей первого года жизни; в возрасте до 5 лет встречается редко. Среди всех лимфом у детей болезнь Ходжкина составляет около 40%. В возрастной группе до 12 лет чаще болеют мальчики, у подростков соотношение заболевших мальчиков и девочек приблизительно одинаково. Заболеваемость детей лимфогранулематозом, по данным Международных регистров, составляет 0,7-0,9 случаев на 100 000 детей. Риск развития лимфомы Ходжкина выше у детей с первичным иммунодефицитом (атаксия-телеангиэктазия, агамма-глобулинемия), ревматоидным артритом и системной красной волчанкой. В Украине корректной статистики заболеваемости лимфогранулематозом нет.

[1], [2], [3], [4], [5], [6], [7]
Код по МКБ-10
Причины лимфомы Ходжкина у детей
Причина лимфомы Ходжкина у детей неизвестна. Обсуждается роль вируса Эпстайна-Барр, выявленного в опухолевых клетках при лимфогранулематозе (чаще всего при смешанноклеточном варианте у детей младшей возрастной группы). Предложена гипотеза патогенеза лимфомы Ходжкина, согласно которой в основе неконтролируемой пролиферации опухолевых клеток, образовавшихся в лимфатическом узле в результате мутации герминогенных В-лимфоцитов, лежит блок запрограммированной смерти, апоптоза.

[8], [9], [10], [11]
Симптомы лимфомы Ходжкина у детей
Основной симптом лимфомы Ходжкина у ребенка - увеличение лимфатических узлов (лимфаденопатия).
Среди экстранодулярных локализаций следует отметить (до четверти случаев) поражение селезёнки, нередко в процесс вовлекаются плевра и лёгкие. Возможно поражение любых органов - костей, кожи, печени, костного мозга. Крайне редко наблюдают прорастание опухоли в спинной мозг, специфическую инфильтрацию почек и щитовидной железы.
Что беспокоит?
Диагностика лимфогранулематоза у детей
В клиническом анализе крови при лимфоме Ходжкина обнаруживают умеренный нейтрофилёз и лимфопению, практически у всех больных выявляют повышение СОЭ. Возможны умеренная эозинофилия и тромбоцитоз (эти изменения не имеют прямого диагностического значения).
В биохимическом анализе крови специфических изменений нет. Активность лактатдегидрогеназы не повышена или повышена не более чем в 2 раза по сравнению с нормальными значениями (большее повышение активности возможно при гемолизе). Увеличение концентрации ферритина, церулоплазмина и фибриногена не имеет диагностического значения, но в некоторых клиниках эти показатели учитывают в качестве прогностических факторов.

[12], [13], [14], [15]
Среди первичных больных лимфомой Ходжкина (ЛХ) дети до 16 лет составляют от 10 до 23 %, в среднем 18%.
Стандартизованный показатель заболеваемости в России составляет 1,9 случая на 100 000 детского населения, и в последние годы это заболевание среди гемобластозов у детей занимает 3-е место после лейкозов и неходжкинской лимфомы (НХЛ).
В возрасте до года ЛХ не встречается, к 4-6 годам наблюдается первый пик заболеваемости, а к 12-14 годам — второй.
Мальчики до 7 лет болеют в 3 раза чаще девочек, но к 15-16 годам это соотношение выравнивается.
Возраст обусловливает некоторые клинические особенности течения заболевания. Так, в раннем детском возрасте до 6 лет отсутствует первичное поражение средостения, а вовлечение медиастинальных лимфоузлов — следствие дальнейшего распространения процесса. Чаще наблюдается выраженность конгломератов лимфоузлов типичной локализации (в шейной области).
В препубертатный и пубертатный периоды первичное поражение средостения составляет до 30% случаев, нередко отмечается устойчивость к проводимой терапии и склонность к рецидивам заболевания, что снижает выживаемость больных и требует более интенсивных режимов лечения.
Клинические проявления, диагностика, морфологические варианты и стадирование процесса у детей не отличаются оттаковыху взрослых больных лимфомой Ходжкина.
Современные программы лечения ЛХ у детей позволяют достичь высоких результатов. Общая выживаемость более 10 лет отмечена более чему 90% больных, безрецидивная выживаемость — у 80%. Однако с увеличением продолжительности жизни больных стали проявляться последствия интенсивного лечения в виде нарушений органов и систем: задержка роста, деформации, гипотрофии, эндокринные нарушения, патология со стороны сердечно-сосудистой, легочной систем, проявления вторичного иммунодефицита.
Отмечаются проблемы в воспроизводстве, особенно у мужской популяции больных, которые связаны с кумулятивными дозами прокарбазина и алкилирующих препаратов. Существенную угрозу жизни представляют вторые опухоли, риск развития которых возрастает с каждым прожитым десятилетием от окончания лечения, обусловленные мутагенным эффектом из-за кумулятивных доз применяемых противоопухолевых препаратов, особенно алкилирующих агентов, в сочетании с облучением. Особенно чувствительными к облучению органами являются щитовидная, молочная железы, центральная нервная система (ЦНС) и некоторые другие. При этом важен возраст больного, в котором проводится облучение, а также суммарная очаговая доза (СОД).
Проблемы лечения лимфомы Ходжкина у детей сходны с таковыми у взрослых больных, но имеют ряд особенностей из-за чувствительности детского организма к лучевому воздействию, особенно в сочетании с химиотерапией (XT).
В лечении ЛХ у детей ведущим методом служит XT. Лучевая терапия утратила свои позиции, используется только в сочетании с химиотерапией в программе комплексного лечения при исходно большой массе опухоли и наличии остаточной опухоли после применения индукционной XT. Для снижения поздних побочных эффектов химиотерапии и лучевого лечения применяется комбинация невысоких кумулятивных доз химиопрепаратов, сниженных СОД лучевой терапии и уменьшения количества полей облучения.
У детей наиболее эффективны схемы МОРР, ABVD, ОРРА, затем по убыванию эффективности идут CVPP и СОРР. Включение в схемы CVPP и СОРР противоопухолевого антибиотика антрациклинового ряда — доксорубицина, эпирубицина (Фарморубицин), идарубицина — повышает результативность лечения и показано больным с факторами риска (см. ниже).
Важно соблюдение режимов терапии, т.к. введение неполных курсовых доз препаратов и удлинение интервалов между циклами значительно снижают эффективность проводимой XT. В связи с этим показана профилактика гематологической токсичности и инфекционных осложнений как основных причин нарушения режимов XT в виде своевременного назначения соответствующих симптоматических средств во время перерывов между циклами.
Циклы химиотерапии большинства применяемых режимов проводятся в течение 2 нед. с 2-недельными интервалами. Каждый последующий цикл проводится при удовлетворительном состоянии больного и отсутствии признаков гипоплазии костного мозга: число лейкоцитов более 2000/мкл, гранулоцитов более 500/мкл, тромбоцитов более 100 000/мкл.
Лечение прерывается и не проводится при развитии интеркуррентных инфекций (пневмония, сепсис, ветряная оспа и др.) с лихорадкой выше 38,5 °С. Режимы XT при ЛХ у детей приведены в табл. 12.3.
Таблица 12.3. Режимы химиотерапии, используемые при лимфоме Ходжкина у детей

Примечение:
* При включении в схемы CVPP, СОРР антрациклинового антибиотика суточная доза преднизолона увеличивается до 40 мг/м2. Применение преднизолона не является обязательным компонентом, и при многоцикловом (6 циклоб лечении возможно исключение его из схемы, особенно у детей пубертатного возраста.
** Разовая доза Натулана рассчитывается путем определения курсовой дозы (1400 мг/м2) и распределения этой дозы кратно 50 в течение 14 дней с постепенным увеличением дозы от 1-го к 14-му дню (50,100,150,200 мг) до достижения рассчитанной курсовой дозы.
При лечении лимфомы Ходжкина у детей, как и у взрослых, встает задача по возможности сократить интенсивность терапии. В то же время небольшая часть больных, напротив, нуждается в интенсификации лечения в связи с развитием резистентности к стандартным программам и непрерывным рецидивированием процесса. Уменьшение риска поздних осложнений при сохранении высокой эффективности терапии ЛХ у детей возможно только при дифференцированном подходе к лечению с учетом прогностических факторов.
В большинстве лечебных протоколов стратификация основывается на стадии ЛХ и наличии или отсутствии симптомов интоксикации. Ряд протоколов учитывает и другие прогностические факторы: наличие экстранодальных локализаций лимфомы Ходжкина, выраженность массы опухоли, особенно в средостении по медиастинально-торакальному индексу (МТИ), размер периферических лимфоузлов (различной градации в разных протоколах — более 5, 7 и 10 см по наибольшему размеру конгломерата) и др.
При планировании лечения ЛХ у детей учитывается морфологический вариант заболевания. Вариант нодулярного склероза, особенно 11 типа, считается неблагоприятным прогностическим фактором и определяет применение более интенсивных программ лечения с использованием схем, включающих алкилирующие препараты, прокарбазин, при выраженности массы опухоли в средостении — антрациклиновые антибиотики. Неблагоприятные прогностические факторы: изначальные поддиафрагмальные локализации ЛХ, поражение лимфоузлов ниже бифуркации брюшной аорты, подвздошных, паховых и бедренных лимфоузлов, увеличение скорости оседания эритроцитов (СОЭ) > 30 мм/ч.
Наличие факторов неблагоприятного прогноза определяет необходимость более интенсивного лечения.
В планировании лечения ЛХ у детей немаловажное значение имеет скорость достижения положительного эффекта. Оценка эффективности терапии после 2 и 4 индукционных циклов XT определяет дальнейший прогноз заболевания и тактику лечения. Введено понятие полной и неуверенной (почти полной) ремиссии. Сокращение опухолевых образований менее 70 % от исходного размера характеризует частичный эффект с необходимостью интенсификации лечения, изменения применяемой схемы, проведения облучения.
Для оценки эффекта проводимой терапии важно использовать комплекс диагностических методов с обязательным включением при первичной диагностике и в контроле компьютерной томографии (КТ) с двойным контрастированием. В последние годы для правильной оценки первичной стадии заболевания и резидуальной опухоли при проведении программного лечения стало важным включение в диагностический комплекс радионуклидных методов исследования (особенно позитронно-эмиссионной томографии (ПЭТ)).
Большинство современных программ лечения лимфомы Ходжкина у детей выделяет три группы риска.
1-я группа — благоприятного прогноза
1-я группа — благоприятного прогноза, к которой относят больных с локализованными формами заболевания (I-IIA стадия) и отсутствием неблагоприятных прогностических факторов: поражения средостения, первичного поражения ниже диафрагмы, экстранодального поражения, отсутствия выраженности массы опухоли по размеру конгломератов лимфоузлов. В некоторых протоколах также исключаются больные с морфологическим вариантом нодулярного склероза II типа ЛХ, с выраженной эозинофильной инфильтрацией опухоли.
В этой группе проводят наиболее щадящее лечение с использованием схем неинтенсивной химиотерапией в объеме 2-4 циклов в зависимости от скорости достижения полного эффекта и планируемой лучевой терапии.
В последние годы все больше исследователей склоняются к мнению о необходимости исключить алкилирующие препараты и антрациклины из схем XT при лечении нераспространенных стадий ЛХ, предлагая схему VBVP (винбластин, блеомицин, этопозид, прокарбазин) и дополняя ее при необходимости локальным облучением в низких дозах (20-26 Гр).
Преднизолон — 40 мг/м2 внутрь ежедневно в 1-8-й день.
Повторение цикла на 21-й день, считая с 1-го дня предыдущего цикла. Для случаев локализованных стадий лимфомы Ходжкина возможно использование менее токсичных схем: CVPP — циклофосфамид, винбластин, прокарбазин, преднизолон; СОРР — циклофосфамид, винкристин (Онковин), прокарбазин, преднизолон; АВОР — доксорубицин, блеомицин, винкристин (Онковин), преднизолон (отличающийся от режима ABVD отсутствием в схеме дакарбазина и включением преднизолона в дозе 40 мг/м2 ежедневно внутрь в 1-15-й день).
Высокоэффективен у этой группы больных режим ABVE.
2-я группа — промежуточного риска
2-я группа — промежуточного риска, включает в себя больных с локализованной стадией ЛХ (1-ИА), имеющих поражение средостения, выраженные конгломераты периферических лимфоузлов, при наличии симптомов интоксикации (I-IIB стадии) и больных с III стадией ЛХ без симптомов интоксикации (IIIА стадия).
Условием отнесения к этой группе является отсутствие выраженной массы опухоли в средостении (медиастинально-торакальный индекс менее 0,33), экстранодальных локализаций, первичного поражения лимфоузлов, расположенных ниже диафрагмы, поражения лимфоузлов ниже бифуркации брюшной аорты при IIIA стадии лимфомы Ходжкина.
Лечение этой группы больных основано на использовании более эффективных схем XT, к которым относятся ABVD и ее модификации, МОРР (режим аналогичен применяемому у взрослых больных), ОРРА, АСОРР (СОРР + антрациклиновый антибиотик). По непосредственной эффективности эти схемы равнозначны, но значительно различаются по токсичности, особенно поздней. Наиболее токсична схема МОРР. и ее применение у детей должно быть ограничено.
Токсичность МОРР определяет прежде всего развитие вторых опухолей и, особенно, лейкозов, нарушения со стороны щитовидной железы, герминогенной функции. Схема ABVD менее токсична, г при ограничении общего числа циклов до 3 не давала легочной и кардиотоксично-сти. В некоторых протоколах применяют сочетание режимов МОРР и ABVD, добиваясь высоких результатов при снижении токсичности.
В последние годы у больных, относящихся к промежуточной группе риска, стала использоваться схема ВЕАСОРР-14. В большинстве протоколов для получения высоких лечебных результатов в группе промежуточного риска проводится от 4 до 6 циклов химиотерапии в сочетании с последующей лучевой терапией со снижением СОД (до 20-25 Гр по эффекту) и полей облучения (только зоны первичного поражения).
Оценивается эффективность каждых 2 циклов проводимой XT. При недостаточноу эффекте (сокращение опухоли менее 70% от исходного размера) целесообразно интенсифицировать лечение. При использовании схемы ВЕАСОРР-14 дальнейшее лечение проводят по схеме ВЕАСОРР-интенсифицированная (как в группе высокого риска).
Если после 2 циклов по схеме ВЕАСОРР-интенсифицированная эффект не нарастает (сокращение опухоли менее 70% или стабилизация процесса), возможно полное изменение режима с переходом на схемы второй линии, применяемые при развитии резистентности и рецидивах заболевания, аналогичные режимам у взрослых больных. Это схемы В-МОРР, CCVPP, МАВОР, ABDIC, B-CAVe, CEVD, Dexa-BEAM, BEAM, CBV и др.
У детей эффективны следующие комбинации второй линии.
Ифосфамид — 2 г/м2/сут в/в постоянная инфузия в 1-5-й день + Месна (Уромитексан).
Цисплатин — 20 мг/м2/сутв/в 30-минутная инфузия в 1-5-й день.
Преднизолон — 100 мг/м2/сут внутрь в 1-5-й день.
При полном эффекте у больных с выраженной исходной массой опухоли, особенно при морфологическом варианте нодулярного склероза, показано применение консолидирующей лучевой терапии в дозе 20-22 Гр.
При выраженном, но неполном эффекте с сокращением опухоли более 70% от первоначального размера важны данные по активности процесса по результатам радионуклидного исследования. При неполной регрессии опухоли после окончания XT, особенно при большом исходном размере опухоли и морфологическом варианте ЛХ — нодулярном склерозе, целесообразно применение облучения с подведением дозы к очагу до 26-30 Гр.
3-я группа — высокого риска
К ней относят больных с неблагоприятными прогностическими факторами: первичная локализация поражения ниже диафрагмы, выраженная масса опухоли в средостении, экстранодальные локализации, поражение ниже бифуркации брюшной аорты у больных с IIIA, IIIВ и IV стадиями ЛХ.
В группе высокого риска результаты большинства лечебных протоколов на 20-40% хуже, чем в группах промежуточного риска, и в этой группе больных проводится наиболее интенсивная терапия с увеличением количества применяемых циклов до 8 и более. Используются интенсифицированные режимы ПХТ — схема ВЕАСОРР (интенсифицированная). Интенсификация заключается в повышении доз циклофосфамида, этопозида и винкристина, сокращении интервала между циклами.
Блеомицин — 10 мг/м2 в/в в 8-й день.
Этопозид — 200 мг/м2 в/в в 1-3-й день.
Доксорубицин — 35 мг/м2 в/в в 1-й день.
Циклофосфамид — 1200 мг/м2 в/в в 1 -й день.
Винкристин — 2 мг/м2 (не более 2 мг) в/в в 8-й день.
Прокарбазин (Натулан) — 100 мг/м2 внутрь в 1-7-й день.
Преднизолон — 20 мг/м2 внутрь в 1-14-й день.
Повторение цикла на 21-й день, считая от 1-го дня предыдущего цикла.
При лейкопении на 8-10-й день цикла используют гранулоцитарный колониестимулирующий фактор (Г-КСФ) в дозе 5 мкг/кг/сут.
После 4 циклов химиотерапии по схеме ВЕАСОРР-интенсифицированная оценивают эффект. При полном или выраженном эффекте (сокращение опухоли более 70%) девочкам проводят 4 цикла по схеме COPP/ABV, а мальчикам — 2 цикла по схеме ABVD и облучение зон первичного поражения (СОД 20 Гр).
При сокращении опухоли менее 70%, независимо от пола, проводится еще 4 цикла по схеме ВЕАСОРР-интенсифицированная и облучение зон первичного поражения (СОД 30-35 Гр на остаточную опухоль). При прогрессировании процесса переходят на режимы полихимиотерапии (ПХТ) второй-третьей линии.
Циклофосфамид — 600 мг/м2 в/в 30-минутная инфузия в 1-й день.
Винкристин — 1,4 мг/м2 (не более 2 мг) в/в в 1-й день.
Прокарбазин — 100 мг/м2 внутрь в 1-7-й день.
Преднизолон — 20 мг/м2 внутрь в 1-14-й день.
Доксорубицин — 35 мг/м2 в/в 30-минутная инфузия в 8-й день.
Блеомицин — 10 мг/м2 в/в струйно 10-минутная инфузия в 8-й день.
Винбластин — 6 мг/м2 (не более 10 мг) в/в в 8-й день.
В последние годы поднимается вопрос о выделении группы больных очень неблагоприятного прогноза с необходимостью проведения им высокодозной XT в ранние сроки, что повысит ее эффективность и снизит токсичность, т.к. токсичность высокодозной XT напрямую зависит от числа циклов и интенсивности предшествующей ей химиотерапии и облучения. Группа эта малочисленна, четких критериев ее выделения до настоящего времени нет. Эту группу формируют больные с поражением костной ткани, замедленным достижением полного или выраженного частичного ответа.
Эффективной в лечении лимфомы Ходжкина у детей является модифицированная программа БФМ — DAL-HD-98 с использованием схем ОРРА (у девочек) и ОЕРА (у мальчиков):
• больным 1-й группы риска (I-IIA стадия ЛХ) проводят 2 цикла ОРРА (ОЕРА) и локальное облучение зон первичного поражения в дозе 25 Гр;
• больным 2-й группы риска (IIB-IIIA стадия ЛХ) 2 цикла ОРРА (ОЕРА) дополняют 2 циклами СОРР и проводят локальное облучение зон первичного поражения в дозе 20 Гр;
• больным 3-й группы риска (IIIB-IV стадия лимфомы Ходжкина, экстранодальные поражения при любой стадии) 2 цикла ОРРА (ОЕРА) дополняют 4 циклами СОРР с последующим локальным облучением зон первичного поражения в дозе 20 Гр.
Проводимое лечение позволяет получить 5-летнюю безрецидивную выживаемость у 90-93 % детей.
При рецидиве ЛХ используют различные программы лечения в зависимости от характера и времени возникновения рецидива с возможностью использования при поздних рецидивах ранее применявшихся и эффективных для данного больного схем ПХТ или применения режимов ПХТ второй-третьей линии. При непрерывно рецидивирующем течении используются высокие дозы химиопрепаратов (циклофосфамид, этопозид, кармустин и др.) с пересадкой аутологичного костного мозга или периферических стволовых клеток (ПСК).
В последние годы начаты попытки применения препаратов на основе МКА в группах больных с неблагоприятным прогнозом течения лимфомы Ходжкина (первично-резистентные и с ранними рецидивами заболевания).
Читайте также:

