Регресс опухоли после лучевой терапии
Рецидив после лучевой терапии
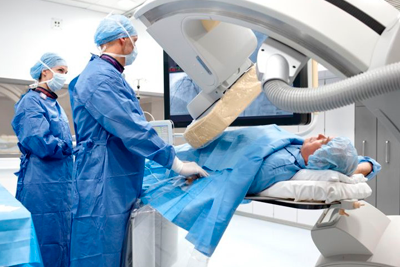
Хирургические и терапевтические методы лечения онкологических заболеваний не обладают абсолютной эффективностью, поэтому даже после проведения всех необходимых манипуляций возможно возвращение болезни. Рецидив после лучевой терапии может быть результатом неполного лечения или естественным осложнением патологии. Зачастую ионизирующее облучение назначают после оперативного вмешательства, однако такой метод не уничтожает всех злокачественных клеток. Врачебная консультация поможет пациенту узнать больше о такой процедуре, как лучевая терапия: рецидивы, способы проведения, эффективность, осложнения и другие аспекты.
Лучевую терапию также называют радиационной или ионизирующей терапией. Это один из самых эффективных методов лечения онкологических заболеваний, подразумевающий воздействие радиации на пораженные ткани. Результатом применения такой процедуры является предотвращение дальнейшего роста и распространения злокачественной опухоли. Иногда лучевая терапия также позволяет добиться уменьшения размера патологического очага. В зависимости от показаний радиация применяется в качестве главного метода лечения или адъювантной терапии. Рецидив после лучевой терапии возможен, однако при корректном применении риск такого исхода минимален.
В радиационной терапии применяются разные типы воздействия, включая корпускулярное и волновое излучение. При этом независимо от вида терапии основной механизм воздействия связан с поражением генетической информации клеток. Благодаря влиянию ионизирующего излучения в злокачественных клетках формируются молекулы, разрывающие связи в ДНК. Результатом такого воздействия является неспособность аномальных клеток к дальнейшему делению и выполнению функций. Метод не обладает абсолютной селективностью, однако основное действие приходится именно на злокачественные ткани из-за особенностей их метаболизма.
Лучевая терапия редко является основным методом лечения. Обычно первой назначаемой процедурой является операция, во время которой врач удаляет патологический очаг. Уже после хирургии проводится терапевтическое лечение, что включает и радиационную терапию. В этом случае процедура помогает уничтожить рассеянные в организме злокачественные клетки и предотвратить повторный рост опухоли. Тем не менее иногда лучевая терапия применяется в качестве первичного метода. В частности, неоадъювантная лучевая терапия может быть показана при неоперабельной опухоли или поздней стадии онкологического заболевания.
Главным недостатком ионизирующего облучения опухолевой ткани является высокий риск возникновения побочных эффектов. Негативные последствия связаны с воздействием радиации на здоровые ткани. Облучение может не только нарушить функции органов, но и спровоцировать возникновение генетических мутаций в клетках. Врачам также известно, что проведение лучевой терапии является фактором риска возникновения нового онкологического заболевания. Современные точечные способы применения радиации значительно уменьшают риск возникновения осложнений, однако процедура все еще считается достаточно опасной.
Основным показанием к прохождению лучевой терапии является наличие злокачественной опухоли в любой ткани. В зависимости от размера, формы и стадии патологии онколог может назначить терапию как основное средство лечение или в качестве вспомогательной процедуры.
Возможные цели назначения:
- Первичное лечение неоперабельных и крупных злокачественных новообразований, включая рак терминальной стадии.
- Метод подготовки к оперативному вмешательству, заключающийся в попытке уменьшения размера опухоли.
- Уничтожение оставшихся в организме аномальных клеток после операции.
- Часть комплексной терапии онкологии, включающей медикаментозное противоопухолевое лечение.
- Часть паллиативной терапии на поздних стадиях, необходимой для облегчения симптомов болезни.
Относительные и абсолютные противопоказания:
- Выраженная онкологическая кахексия, не позволяющая провести лечение.
- Туберкулез.
- Тяжелые расстройства деятельности сердечно-сосудистой системы, почек и печени.
Несмотря на то, что рецидивы рака после лучевой терапии всегда возможны, без этой процедуры редко обходится лечение злокачественных новообразований. Так, например, врачи нередко обнаруживают рецидив рака гортани после лучевой терапии, однако проведение дополнительного лечения помогает устранить опухоль.
Радиационная терапия классифицируется по виду излучения, дозировке и методу воздействия. Наиболее важным критерием является область применения ионизирующего излучения, от которой зависит риск возникновения осложнений.
- Контактная терапия, подразумевающая непосредственное воздействие радиации на злокачественную опухоль. Такая процедура может быть проведена во время оперативного вмешательства или при поверхностных новообразованиях. Риск осложнений значительно ниже, чем при других видах процедуры.
- Дистанционная терапия, при которой радиация преодолевает здоровые ткани. Это основной способ воздействия при злокачественных опухолях внутренних органов. Точечное применение помогает уменьшить нагрузку на здоровые ткани.
- Радионуклидная терапия – селективное воздействие радиации в патологическом очаге.
Рецидив после лучевой терапии является не единственным возможным негативным последствием процедуры. Непосредственно во время облучения в организме происходят патологические процессы, обуславливающие возникновение побочных эффектов. Важно понимать, что быстрое деление злокачественных клеток делает их более приемлемой мишенью для радиации, однако невозможно полностью избежать повреждения здоровых клеток.
Распространенные побочные эффекты:
- Выпадение волос, раздражение кожи и ломкость ногтей.
- Усталость и слабость.
- Сухость во рту и выделение вязкой слюны.
- Нарушение глотания.
- Боль в горле и изменение вкуса пищи.
- Тошнота и рвота.
- Кашель и одышка.
- Диарея или запор.
- Раздражение мочевого пузыря, частое мочеиспускание.
- Эректильная дисфункция.
- Нарушение работы иммунитета и частое возникновение инфекционных заболеваний.
Многие осложнения сохраняются в течение нескольких месяцев и даже лет после проведения терапии.
Онкологическими заболеваниями называют злокачественные опухоли, образующиеся в определенных тканях и органах. Сами по себе опухоли являются патологическими структурами клеточного строения, отличающимися особенностями обмена веществ и деления от близлежащих тканей. Опухоли быстро увеличиваются в размере, повреждают органы и распространяются в другие области. На поздних стадиях злокачественные клетки проникают в кровоток и лимфу, что приводит к формированию вторичных новообразований в отдаленных органах.
В отличие от хирургического лечения, необходимого для полного уничтожения опухоли, терапия имеет более сложный механизм воздействия. Большинство применяемых процедур направлено уничтожение определенных клеток в организме, отличающихся от здоровых тканей. Химиотерапия поражает ДНК и вызывает клеточную смерть, а лучевая терапия останавливает распространение новообразований. Тем не менее даже при стойкой ремиссии на фоне лечения возможно возвращение заболевания.
Чаще всего рецидив после лучевой терапии обусловлен сохранением отдельных злокачественных клеток в лимфатической системе или тканях, не подвергшихся воздействую ионизирующего излучения. На 3 стадии онкологического процесса аномальные клетки часто проникают в лимфоузлы, в результате чего возникает риск распространения болезни. На поздних стадиях даже при полном удалении очага болезни и облучении сохраняется риск рецидива. Решением такой проблемы может быть регулярная диагностика после проведения лечения и профилактика роста новых опухолей.
Перед назначением лучевой терапии пациенту требуется консультация врача и диагностика. На приеме онколог спрашивает больного о жалобах, изучает анамнестические данные и проводит физикальное обследование. Следующим этапом диагностики является назначение инструментальной и лабораторной диагностики. Результаты тестов помогут врачу определить форму и стадии онкологического процесса, что очень важно для подбора метода радиационной терапии.
- Анализ крови на онкологические маркеры, биохимию и общие показатели.
- Ультразвуковое обследование – визуализация внутренних органов с помощью высокочастотных звуковых волн.
- Рентгенография – первичный метод сканирования, позволяющий получить снимок пораженного органа.
- Компьютерная и магнитно-резонансная томография – высокоточные методы сканирования, дающие врачу возможность получить уточненные изображения органов и тканей. Результаты КТ и МРТ также необходимы для поиска метастазов.
- Эндоскопическое обследование.
- Биопсия опухолевой ткани – основной способ лабораторной диагностики, позволяющий исследований аномальные клетки. Результаты биопсии необходимы для определения гистологической формы онкологии.
Во время диагностики врач также исключает наличие противопоказаний и уточняет локализацию опухоли для проведения точечного облучения.
Таким образом, рецидив после лучевой терапии является возможным негативным последствием лечения. Консультация онколога поможет пациенту узнать больше о рисках противоопухолевой терапии.
Внешняя лучевая терапия - эффективный метод лечения отдельных случаев ретинобластомы. Иногда внешнее облучение провоцирует развитие вторых злокачественных опухолей, особенно у детей с семейной ретинобластомой, и может осложняться симптомами сухого глаза, катарактой, лучевой ретинопатией и косметическими дефектами в зоне облучения. Этот метод применяется в основном для лечения крупных опухолей или опухолей с обширной диссеминацией в стекловидное тело или субретинальное пространство.
Брахитерапия с применением радиоактивного аппликатора - эффективный метод лечения отдельных случаев ретинобластомы, особенно четко отграниченных опухолей при отсутствии обширной диссеминации в стекловидное тело. Преимущества этого метода перед внешней лучевой терапией заключаются в том, что полный курс лучевой терапии занимает только 3-4 дня, осложнения со стороны глаза развиваются реже, и, как оказалось, брахитерапия реже вызывает развитие вторых злокачественных опухолей. Небольшим недостатком этого метода является необходимость хирургического вмешательства для точной фиксации аппликатора. Брахитерапия с применением аппликатора особенно эффективна при лечении остаточных или рецидивировавших опухолей после того, как другие методы лечения оказались неэффективны. Мы полагаем, что низкая частота развития вторых злокачественных опухолей после брахитерапии обусловлена экранированием радиоактивного аппликатора с целью не допустить облучения окружающих тканей.
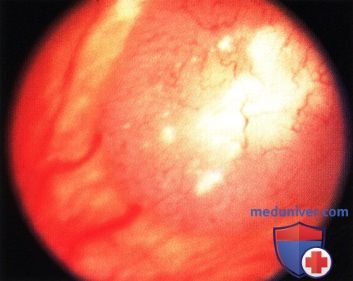
Четко отграниченная ретинобластома в верхненосовом квадранте у годовалого ребенка. Парный глаз был энуклеирован по поводу распространенной опухоли. 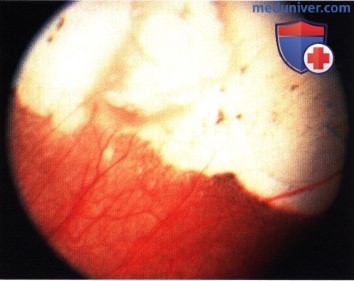
Та же опухоль, что и на рисунке выше два года спустя после брахитерапии. Отмечается очаг кальциноза белого цвета, окруженный зоной атрофии пигментного эпителия сетчатки. 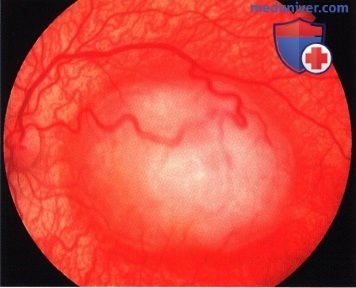
Ретинобластома в центре макулярной области. 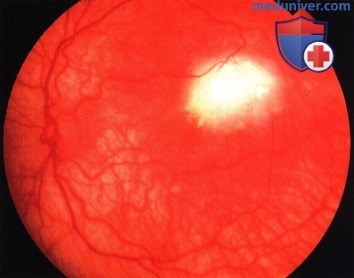
Та же опухоль, что и на рисунке выше месяц спустя после брахитерапии: отмечается выраженный регресс опухоли. В дальнейшем наблюдалась прогрессирующая атрофия пигментного эпителия сетчатки, окружающего опухоль. 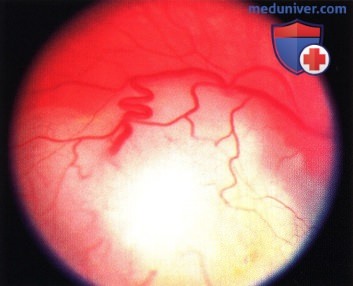
Более крупная опухоль макулярной зоны: определяются расширенные сосуды сетчатки. 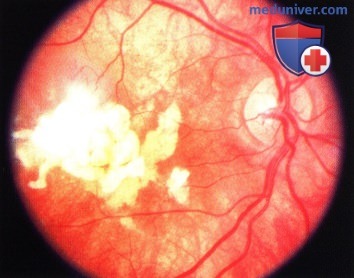
Та же опухоль, что и на рисунке выше два года спустя после брахитерапии: отмечается заметный регресс опухоли. Новообразование оставалось стабильным в течение девяти лет.
С помощью лучевой терапии с применением аппликатора можно добиться выраженного регресса ретинобластомы с хорошим косметическим результатом. Такой случай показан ниже.
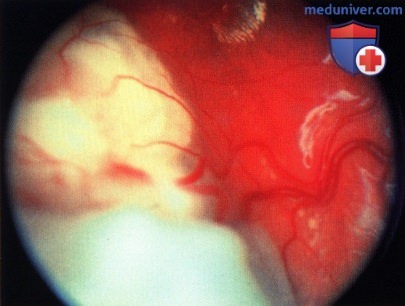
Крупная ретинобластома с эндофитным и экзофитным компонентами, с нижневисочной стороны от фовеолярной области. 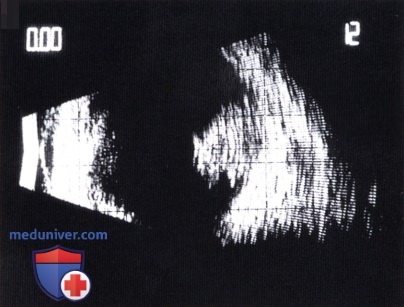
Та же опухоль, что и на рисунке выше при УЗИ. 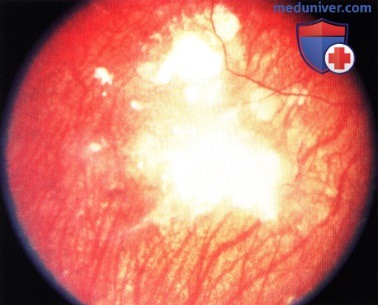
Вид опухоли через шесть месяцев после брахитерапии с применением аппликатора: отмечается выраженный регресс опухоли. 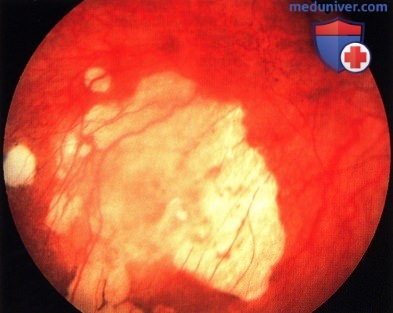
Вид глазного дна одиннадцать лет спустя после проведения брахитерапии с применением аппликатора: опухоль полностью резорбировалась, признаки рецидива отсутствуют. 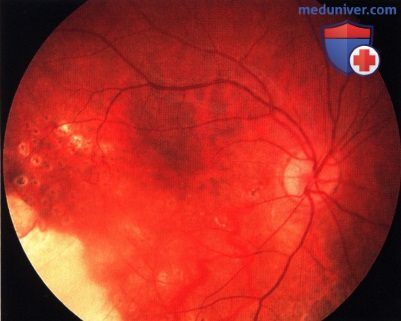
Вид фовеолярной области одиннадцать лет спустя после лечения: отмечаются небольшие изменения пигментного эпителия сетчатки. Острота зрения составляла 6/9 (20/30). 
Внешний вид пациентки через шесть лет после лечения: отмечается хороший косметический результат. Сравните с внешним видом пациента, показанного на рисунке выше получавшим внешнюю лучевую терапию.
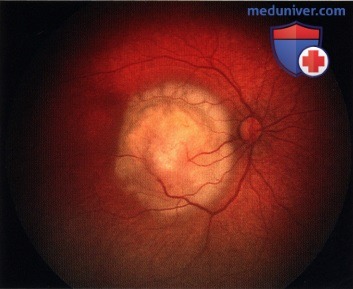
Ретинобластома макулярной области правого глаза. 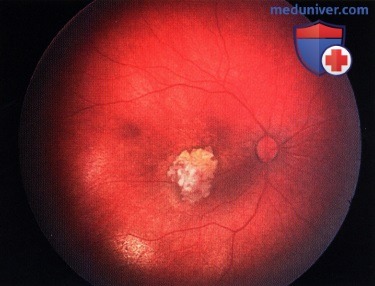
Регресс 1 типа. Та же опухоль, что и на рисунке выше через 18 месяцев после лучевой терапии с помощью аппликатора: заметный регресс опухоли с полным ее кальцинозом. 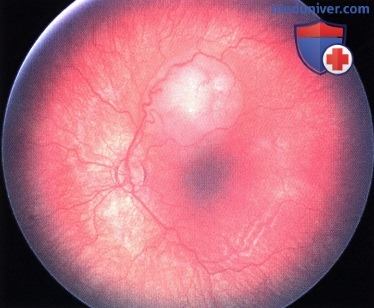
Ретинобластома сверху от фовеолярной области левого глаза. 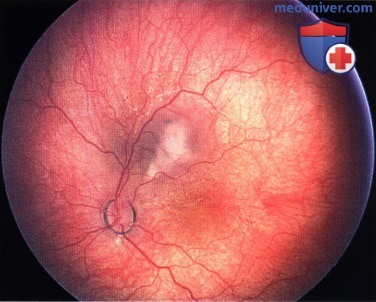
Регресс 2 типа. Та же опухоль, что и на рисунке выше. 27 год спустя после брахитерапии с применением аппликатора: наблюдается прозрачная опухоль с очагом атрофии на фоне фиброза, кальциноз отсутствует. 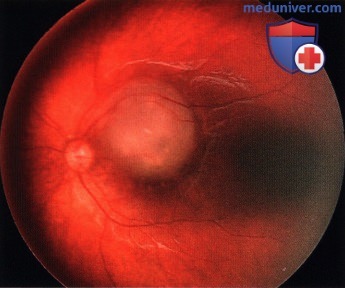
Ретинобластома области верхней части папилломакулярного пучка левого глаза. 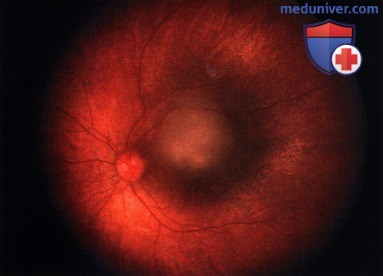
Регресс 3 типа. Та же опухоль, что и на рисунке выше четыре месяца спустя после лучевой терапии с применением аппликатора: наблюдается лишь небольшой регресс и частичный кальциноз опухоли.
Брахитерапия с применением аппликатора - эффективный метод адъювантной или консолидирующей терапии, дополняющий хеморедукцию, а также лечения рецидивировавших после безуспешных хеморедукции, термотерапии или криотерапии опухолей. Ниже проиллюстрированы результаты брахитерапии ретинобластомы макулярной области.
Ретинобластома, по поводу которой ранее была проведена хеморедукция. В задней части опухоли возник рецидив - жизнеспособная опухолевая ткань. 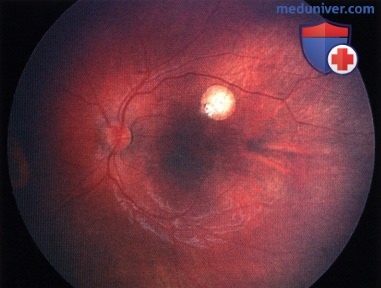
Опухоль, показанная на рисунке выше, после терапии маленьким радиоактивным аппликатором с элементами I-125. Наблюдается выраженный регресс опухоли (главным образом регресс 4 типа, лишь с сомнительным очагом кальциноза. 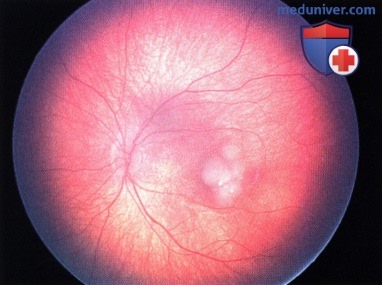
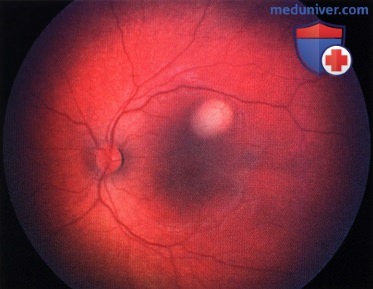
Ретинобластома, по поводу которой ранее была проведена хеморедукция. С височной стороны от фовеолярной области возник рецидив - жизнеспособная опухолевая ткань. 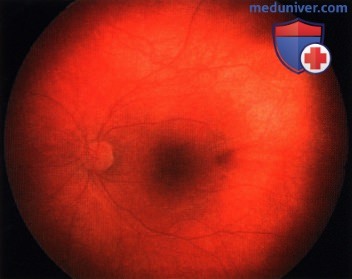
Опухоль, показанная на рисунке выше, после терапии небольшим радиоактивным аппликатором с элементами I-125. Наблюдается выраженный регресс опухоли по 0 типу. 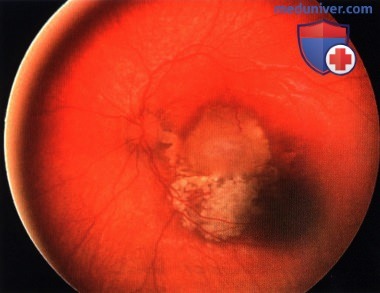
Ретинобластома, по поводу которой ранее была проведена хеморедукция. Наблюдается рецидив: в центре макулярной области развилась жизнеспособная опухолевая ткань. 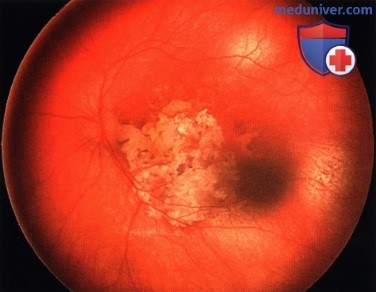
Опухоль, показанная на рисунке выше, после терапии маленьким радиоактивным аппликатором с элементами I-125. Наблюдается выраженный регресс опухоли по 1 типу.
Редактор: Искандер Милевски. Дата публикации: 19.6.2020

Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
- Виды лучевой терапии
- Этапы лучевой терапии
- Побочные эффекты лучевой терапии
- Химиолучевая терапия

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:

