Рак легкого прорыв в лечении рака
– Елена Владимировна, с чем, на Ваш взгляд, связан прорыв в лекарственном лечении немелкоклеточного рака легкого (НМРЛ) в последнее время?
– Является ли для Вас иммунотерапия революцией?
– Конечно, да, это настоящая революция в онкологии. Началом иммунотерапии злокачественных опухолей можно считать применение в 1890 г. токсина Colley на основе инфекционного возбудителя Erysipelothrix rhusiopathiae. Этот токсин индуцировал регрессию опухоли у некоторых пациентов, однако отсутствие теоретической базы в сочетании с непредсказуемостью результатов поставили крест на данном направлении. Прошло целых 100 лет непрерывных иммунологических исследований, важных теоретических открытий и, к сожалению, достаточно скромных практических результатов, пока в 1992 г. японский исследователь Ishida Yasumasa не открыл рецептор PD-1. После расшифровки роли этого рецептора в блокаде механизма распознавания и уничтожения опухолевой клетки иммунной системой в 2000 году Tasuku Honjo синтезировал МКА к PD-1. Наверное, именно это событие открыло новую эру иммунотерапии злокачественных опухолей, и в настоящее время анти-PD1 и анти-PD-L1 МКА используются при различных нозологиях и в различных клинических ситуациях/линиях терапии. Особенно впечатляющие результаты были достигнуты при распространенном НМРЛ с прогрессированием после предшествующей химиотерапии, а также в 1-й линии лечения у больных с высокой экспрессией PD-L1. Кроме того, получены первые данные о высокой эффективности иммуноонкологических препаратов в качестве консолидирующего лечения местно-распространенного нерезектабельного НМРЛ III стадии после завершения курса химиолучевой терапии (это первый успех консолидирующей стратегии за 20 лет исследований).
– Традиционно считается, что в нашей стране преобладает заболеваемость плоскоклеточным раком легкого. Эффективность иммунотерапии в этой группе такая же, как у пациентов с аденокарциномой?
– Данных по частоте различных гистологических типов НМРЛ в России очень немного. Существует анализ исследования EPICLIN Lung, в котором было показано, что более половины (54%) пациентов с НМРЛ – это плоскоклеточный вариант. Плоскоклеточный НМРЛ чаще развивается у курильщиков и характеризуется более агрессивным течением и худшим ответом на терапию по сравнению с аденокарциномой. В эпидемиологическом исследовании было показано, что двухлетняя общая выживаемость при аденокарциноме составляет 9,9%, а при плоскоклеточном раке – 7,2%. Кроме того, при плоскоклеточном варианте очень редко наблюдаются драйверные мутации (менее 10%), позволяющие назначить эффективную таргетную терапию. До появления иммунотерапии у этой группы пациентов не существовало эффективных опций лечения, особенно во второй линии.
Необходимо отметить, что в исследованиях по оценке эффективности иммунотерапии на смешанной когорте больных НМРЛ большую часть случаев составляли пациенты с неплоскоклеточным НМРЛ (то есть с аденокарциномой). Сравнение иммунотерапии и химиотерапии доцетакселом во второй линии лечения только плоскоклеточного НМРЛ было проведено в исследовании CheckMate 017. Показаны существенные преимущества иммунотерапии по сравнению с химиотерапией как по продолжительности жизни больных: однолетняя общая выживаемость составила 42% против 24%, двухлетняя – 23% против 8% соответственно, так и по частоте и длительности объективного ответа.
Очень важно, что экспрессия PD-L1 на опухолевых клетках не влияет на эффективность иммунотерапии при плоскоклеточном НМРЛ. Так, в исследовании CheckMate 017 (только плоскоклеточный НМРЛ) однолетняя общая выживаемость при экспрессии PD-L1 ≤1% и ≥1% составила 43% и 44% соответственно. Аналогичные цифры однолетней общей выживаемости были получены в подгруппах с более высоким уровнем экспрессии PD-L1 (≥5 – 45%, ≥10 – 47% соответственно). В отличие от плоскоклеточного гистологического подтипа, при неплоскоклеточном НМРЛ по данным подгрупповых анализов отмечена тенденция к увеличению показателей выживаемости на иммунотерапии с увеличением уровня экспрессии PD-L1.
Прямые сравнительные исследования эффективности иммунотерапии при различных гистологических подтипах НМРЛ не проводились (да и необходимости в этом нет). Если провести непрямое сравнение отдаленных результатов применения иммунотерапии во второй линии лечения НМРЛ, то можно отметить отсутствие серьезных различий в выживаемости: так, по данным исследований CheckMate 017 (плоскоклеточный подтип) и CheckMate 057 (неплоскоклеточный подтип), 2-летняя общая выживаемость составила 23% и 29% соответственно (эти результаты были доложены на ESMO 2016). Кроме того, по более ранним программам доложены уже 5-летние данные по общей выживаемости при проведении иммунотерапии в качестве 2-й линии лечения НМРЛ (исследование CA209-003): для плоскоклеточного НМРЛ 5-летняя общая выживаемость составила 16% (при историческом контроле 4%), для неплоскоклеточного НМРЛ – 15%.
– Таргетная терапия применяется уже более 10 лет у больных НМРЛ. Какие есть новости в этой области и перспективы развития данного метода?
– Таргетная терапия остается основой лечения данной категории пациентов, так как она увеличивает выживаемость, обеспечивает очень высокую частоту объективного ответа и характеризуется быстротой наступления регрессий, что очень важно при симптомном течении заболевания и большой распространенности опухолевого процесса. Что касается иммунотерапии, то по данным подгрупповых анализов и мета-анализа рандомизированных клинических исследований иммунотерапия не имеет преимуществ перед химиотерапией у больных с драйверными мутациями.
К сожалению, у большинства пациентов с наличием активирующих мутаций в гене EGFR медиана выживаемости без прогрессирования на фоне терапии ингибиторами тирозинкиназы (ИТК) EGFR 1 и 2 поколения составляет около 1 года (от 8 до 13,6 мес.). Причиной прогрессирования является развитие приобретенной резистентности, причем механизмы и мутации, вызывающие первичную и приобретенную резистентность к ИТК EGFR, отличаются. Наиболее частым механизмом резистентности к ИТК EGFR (до 68%) является появление вторичной мутации T790M в 20 экзоне гена EGFR. Эта мутация может быть выявлена при повторной биопсии или при исследовании плазмы крови (анализ циркулирующей опухолевой ДНК). До последнего времени у нас не было реальной возможности помочь таким пациентам, но недавно в РФ был зарегистрирован инновационный препарат осимертиниб – ингибитор тирозинкиназы EGFR 3-го поколения, который эффективен при мутации Т790М. В рандомизированном исследовании 3 фазы AURA3 сравнили осимертиниб и химиотерапию у больных НМРЛ с прогрессированием на ИТК EGFR 1-2 поколения (и с подтвержденной мутацией резистентности Т790М). Осимертиниб более чем в 2 раза увеличил медиану выживаемости без прогрессирования по сравнению с ХТ (по независимой оценке 11,0 мес. против 4,2 мес.), а также медиану общей выживаемости, частоту объективного ответа и все показатели эффективности терапии в подгруппе больных с метастазами в ЦНС.
– Как таргетная терапия повлияла на 5-летнюю выживаемость?
– Доказано, что таргетная терапия улучшает клинические исходы у больных с онкогенными драйверными мутациями. Так, Kriset с соавторами проанализировали результаты лечения 938 пациентов с метастатической аденокарциномой легкого, разделив их на 3 группы: нет драйверной мутации, есть мутация, но проводилось традиционное лечение, есть мутация, проводилась соответствующая таргетная терапия. Медианы общей выживаемости в первых двух группах были одинаковыми (2,1 года и 2,4 года соответственно), в отличие от группы №3, где медиана общей выживаемости была значительно больше и составила 3,5 года.
По данным российской статистики можно отметить снижение одногодичной летальности больных НМРЛ с 54,3% в 2010 г. до 52,4% в 2012 г. и предположить, что определенный позитивный вклад в эту динамику был внесен в 2011 г. с изменением в нашей стране показаний для гефитиниба (первая линия терапии НМРЛ EGFRmut+).
– Пожалуйста, опишите Ваш алгоритм назначения лекарственного лечения пациенту с распространенным НМРЛ.
– Современная системная терапия распространенного НМРЛ включает в себя три направления: химиотерапию, таргетную терапию и иммунотерапию (ингибиторы контрольных точек иммунитета). Выбор оптимальной стратегии для каждого конкретного пациента осуществляется в результате персонализации и предусматривает: 1) выявление драйверных мутаций (и, соответственно, назначение таргетной терапии), 2) определение гистологического подтипа НМРЛ и выбор режима химиотерапии при отсутствии драйверных мутаций с последующим решением вопроса о проведении поддерживающей терапии, 3) определение экспрессии PD-L1 для назначения анти-PD1 моноклональных антител в первой линии или решение вопроса о более позднем применении иммуноонкологических препаратов с/без определения экспрессии PD-L1 (в зависимости от выбора конкретного моноклонального антитела.
Подробно алгоритм назначения лекарственного лечения пациенту с распространенным НМРЛ описан в рекомендациях RUSSCO.
– Можем ли мы с первого визита пациента запланировать сразу несколько линий терапии?
– Да, конечно, теперь у нас есть оптимальная последовательность назначения таргетных препаратов, химиотерапии (в зависимости от гистологии) и иммунотерапии, а наши возможности за последние 1-2 года значительно расширились.
![]()
Андрей Каприн: дефицит онкологов в первичном звене – более 50%![]()
Главный онколог СЗФО рассказал, почему в Петербурге не снижается смертность от рака![]()
Молчание поневоле. Как помочь, если голос пропал

- Дмитрий Александрович, почему именно при раке легких такая высокая смертность?
- Во-первых, потому что этот рак очень сложно выявить рано — большинство пациентов впервые обращается к онкологу, когда заболевание достигло уже 3-4-й стадии и радикальное лечение невозможно. Даже в ходе диспансеризации выявляются чаще всего поздние стадии болезни. По России это 70-80%.
Это происходит потому, что развивается он долгое время бессимптомно, а его осложненные формы мимикрируют - скрываются за пневмониями, бронхитами, астмой, остеохондрозом, и пациент годами лечится у неврологов, пульмонологов, терапевтов. Когда появляются типичные симптомы, это уже распространенный процесс.
- Сейчас на всех уровнях власти говорят о том, что необходима программа скрининга рака легкого. В Москве она уже год действует, закуплены низкодозные компьютерные томографы (КТ). В Петербурге тоже планируется запуск такого проекта, пока пилотного. Хотя говорят, что и в рамках обычной ежегодной диспансеризации выявляются новообразования в легких.
- В некоторых странах скрининги работают уже много лет, и эксперты оценивают их эффективность по-разному.
- Поскольку смертность от рака легкого выше, чем от других онкологических заболеваний, усилия по снижению смертности должны, вероятно, направляться на его раннее выявление и лечение? Значит, нам все-таки нужен скрининг рака легкого?
- Единственный эффективный метод скрининга, и то не всеми признаваемый — низкодозная КТ. Чтобы он был действительно эффективным, необходим массовый охват населения из групп риска - курильщиков со стажем более 20-30 лет в возрасте от 40 до 75 лет. Но просто закупить КТ и всех обследовать не достаточно. Это очень чувствительный метод диагностики, по его результатам выявляются самые разные образования, в том числе не злокачественные. Но они тоже требуют внимания: дополнительной диагностики, наблюдения, причем в течение не одного года. Чтобы скрининг был эффективным, нужны грамотные рентгенологи, терапевты, пульмонологи, то есть первичное звено должно быть готово к приему таких пациентов и работе с ними. Отправлять всех к онкологам невозможно, они не в состоянии принять всех, особенно учитывая, что скрининг первые годы будет выявлять всё подряд, в том числе запущенные раки. А он нужен не только, чтобы выявлять рак легкого на ранних стадиях, но и лечить: онкологические стационары должны иметь для этого все возможности.
Дело в том, что радикальное хирургическое лечение может быть не всем доступно. Курение провоцирует развитие не только онкологических заболеваний, но и атеросклероз, ХОБЛ, ИБС, гипертонию и так далее. Сопутствующие заболевания становятся противопоказаниями для радикального лечения. У меня сейчас есть пациент с ранним раком, которому хирургия противопоказана из-за выраженной сопутствующей патологии. К счастью, есть и нехирургическое лечение первичной опухоли — стереотаксическая терапия, кибер-нож, можно провести радиочастотную абляцию опухоли, термо- или криоабляцию. В некоторых странах такие методики лечения рака легкого у пожилых входят в стандарты лечения наравне с хирургией. И мы должны развивать эти методы в условиях, когда расширяются возможности диагностики. Иначе зачем его выявлять, если лечить нечем?
- Почему эффективность скрининга с применением низкодозных КТ оценивается в странах, где он проводится, неоднозначно?
- Перед нами стоит цель - снижение смертности, это и есть показатель эффективности скрининга. Она оценивается через 6-8 лет с момента старта программы. Из существующих скринингов наш самый дорогой. И если государство тратит на него огромные деньги, а результаты незначительные — например, смертность снизилась на полпроцента, скрининг признается неэффективным.
Как показывает опыт стран, раньше нас начавших борьбу с раком легкого, с помощью многолетнего скрининга мы можем снизить смертность на 0,5-3 %, увеличив выявляемость заболевания на ранней стадии, но это неполное решение проблемы. Заметные результаты принесет исчезновение основного фактора риска - курения. Теоретические расчеты говорят о том, что если все резко бросят курить, лет через 15 мы можем получить прогнозируемое снижение смертности от онкологических заболеваний на 20-30%.
- Почему только через 15 лет?
- 15 лет — срок, по истечении которого считается, что риск, нажитый за предыдущие годы курения, нивелирован. Конечно, возникшие изменения никуда не денутся, но с каждым прожитым без сигареты годом вероятность заболевания снижается. Поэтому скрининговые программы выявления рака легких предназначены для курящих в настоящем и в прошлом – только через 15 лет человек, бросивший курить, не входит в группу риска, для которой проводится скрининг: если рак возникнет позже, курение не считается его причиной.
Есть другая теория, по которой последствия курения нивелируются ровно через столько лет, сколько лет человек курил. Скажем, если его стаж - 20 лет, значит, риск развития заболевания, спровоцированного курением, исчезает через 20 лет. С каждым годом риск уменьшается. А продолжая курить, человек увеличивает вероятность развития разных онкологических заболеваний.
- Считается, что 90% раков легких спровоцированы курением. Почему, когда все бросят курить так невелико снижение заболеваемости — 20-30%?
- Потому, что процессы канцерогенеза и превращения нормальных клеток в атипичные — неизбежность: мутации и патологические митозы (изменения клеток) накапливаются с каждым делением клетки. Даже у здоровых людей постоянно появляются либо раковые клетки, либо потенциально раковые, но они уничтожаются иммунной системой. Если она не справляется, клетки размножаются, развивается злокачественное новообразование. А факторами извне мы лишь провоцируем его появление раньше. Существует также много так называемых наследственных раков.
- Вторую стадию называют ранней, и когда она обнаружена, человек радуется — заболевание легче поддается лечению. Но, как говорит главный онколог страны, она бывает разной.
- Радоваться надо тому, что диагноз поставили правильно: не занижая и не завышая стадию. Это очень важно, потому что при правильном стадировании, правильной диагностике возможно и прогнозирование. Вообще-то, ранним раком можно называть только рак in situ – энтраэпителиальный (1-я А стадия), при котором аномальные клетки находятся там, где они возникли, — это опухоли размером до 1 см без поражения лимфоузлов. Как правило, это случайные находки. Все, что больше, уже имеет высокий риск как лимфогенного, так и гематогенного метастазирования, которое может проявиться даже спустя годы.
1-2-я - это те стадии, на которых возможен весь спектр радикальных воздействий, если нет противопоказаний по общему состоянию здоровья. А значит, и прогнозы оптимистичнее.
- Почему говорят, что рак легких раньше был другим, и его практически не лечили?
- Лечили, конечно, но безуспешно. Тогда было много плоскоклеточного рака и мелкоклеточного (самый агрессивный рак, даже при небольших размерах опухоли он очень активно метастазирует), и в основном центральных форм. С их лечением есть сложности и сегодня. Но этих видов рака стало меньше, сейчас преобладает немелкоклеточный рак.
На самом деле нет хорошего и плохого рака. Например, один вид злокачественной опухоли медленно развивается и медленно метастазирует, но плохо поддается лекарственной терапии. Более агрессивный рак чувствительнее к химиотерапии.
Рак легких — по сути не одно, а группа разных заболеваний, объединенных по локализации — органу, в котором образовалась опухоль. Он может быть мелкоклеточным и немелкоклеточным, среди немелкоклеточного есть, например, нейроэндокринные опухоли, образующиеся из бронхиальных желез, которые могут расти медленно и нечасто метастазируют. Аденокарциномы, железистый рак бывают очень злокачественными, быстро растущими, по типу мелкоклеточного метастазирующими, не имеющими мутаций и с трудом подвергающимися лекарственной терапии. И есть медленно растущие аденокарциномы. Крупноклеточный рак по злокачественности - между железистым и мелкоклеточным. У пожилых людей рак может расти 30 лет, пока перерастет в клиническую форму. Скорость развития (удвоения, метастазирования) у молодых и у пожилых разная. Обычно опухоль развивается от 5 до 15 лет до стадии 1А, то есть до той формы, в которой мы можем ее увидеть.
У каждого вида рака – свои особенности в терапии. А сейчас мы владеем и молекулярно-генетической диагностикой, что тоже разделяет и выделяет определенные группы опухолей, чувствительных к современной таргетной и иммунотерапии.
- Мы говорим, что шансов на выздоровление больше у тех, кому выполнена радикальная операция. Но за последнее десятилетие появились большие успехи в лекарственной противоопухолевой терапии рака легкого - таргетная терапия, иммунотерапия. И всякий раз с появлением новых классов лекарств мы говорим, что это прорыв в лечении. А потом оказывается, что это всего лишь шаг к прорыву.
- Торакальная хирургия, действительно, далеко продвинулась вперед, стала органосохраняющей. Но успех лечения связан сейчас не столько с ней, сколько с терапией — гормонотерапией, химиотерапией, лучевой терапией – до и после операции, а также во время хирургического вмешательства (интраоперационной). При лечении рака легкого эти методы пока слабее развиты в сравнении с лечением опухолей в других органах. Потому что искать стали поздно — раньше ведь считалось, что его вообще бесполезно лечить химиотерапией. Но сейчас эти направления активно развиваются и уже дают хорошие результаты.
Нашим пациентам доступны все методы лекарственного лечения: классическая химиотерапия, таргетная терапия, иммунотерапия. Но таргетные препараты и лекарства для иммунотерапии разработаны пока не для всех видов рака. Их, безусловно, можно назвать прорывом, в том числе в лечении рака легкого.
- Сколько пациентов в Петербурге получают таргетную терапию и можно ли сравнить ее эффективность с традиционной химиотерапией.
Но проигрывая во времени, выигрываем в лечении: если находим мишень, для которой существует таргетный препарат, мы переводим рак легкого в хроническое контролируемое заболевание.
Да, результаты лечения на таргетной терапии лучше, чем на химиотерапии, только сравнивать их нельзя. Пациенты, которые получают традиционную химиотерапию и таргетные препараты это пациенты с разными раками легкого - чтобы получать таргетную терапию надо иметь соответствующие мутации. Чаще всего они есть у некурящих женщин, и очень редко обнаруживаются у мужчин-курильщиков,
- Тут все индивидуально, у нас есть пациенты, которые более 5 лет живут на таргетной терапии без прогрессирования заболевания. Но, да, при определенной поломке гена (мутации) через несколько месяцев или год-полтора у большинства возникает резистентность. Опухоль начинает по-другому прогрессировать, у нее появляются другие мутации. То есть происходит селекция опухолевых клеток, поскольку они хотят жить и размножаться, а значит, сопротивляются воздействию препарата.
Когда развивается резистентность к таргетным препаратам 1-2 поколения, повторно проводится весь спектр молекулярно-генетической диагностики и при нахождении мишеней выбираются препараты 3-го поколения, их можно назвать политаргетными.
- Почему и иммунотерапия показана не всем? В чем ее отличие от других видов лекарственной терапии?
- Около 10% из всех иммуночувствительных опухолей дают полный и длительный ответ на иммунотерапию. Предназначенные для нее препараты включают собственную иммунную систему, чтобы она атаковала опухоль.
Разница между химиотерапией и иммунотерапией в том, что цитостатики разрушают клетку или на каком-то этапе ее жизнедеятельности блокируют деление. Причем под их воздействие попадают не только опухолевые клетки, но и здоровые.
Отличие таргетных препаратов от иммунобиологических — в том, что первые воздействуют на какую-то поломку, которая есть только в этой опухолевой клетке, а иммунобиологические запускают механизмы противоопухолевого иммунного ответа, воздействуя на определенный рецептор в клетке.
При раке легкого есть зарегистрированные в России иммунобиологические препараты 1-й, 2-й и последующих линий. Это новые, а значит дорогие препараты, поэтому закупаются они индивидуально. Для их назначения также важен отбор пациентов. В ходе исследования у пациента ищется экспрессия специальных маркеров чувствительности к иммунотерапевтическому препарату. Чем она выше, тем лучше эффективность: препараты работают только при экспрессии более 50. В этом и заключается отбор - нет смысла назначать ее всем подряд, она не каждому поможет.
Да, иммунотерапия — одно из самых перспективных направлений в онкологии. Но она предназначена для распространенных раков, а мы бы хотели выявлять его на ранних этапах и не доводить до необходимости ее применения.
Вообще, онкология - такая область медицины, в которой нельзя концентрироваться на одном направлении. Мы победим в одном, обойдут с другого. Потому что клетки независимо ни от чего делятся, мы стареем, мутации накапливаются, какие-то поломки исправляются, какие-то — нет, с возрастом количество поломок накапливается.
- Надо ждать появления других методов терапии?
- Конечно. В онкологию уже идут космические технологии. Например, запуск в кровоток диагностических маркеров, при котором задействуются роботы, наночастицы. Это не фантастика, разработки ведутся, до клинических исследований, правда, дело еще не дошло. Они начались в Америке, когда собрались на десятки лет отправлять человека в космос. Чтобы экипаж не вымер от болезни, надо понимать, не разовьется ли у него через несколько лет рак. Идея переросла в метод диагностики под названием тераностика. Это выявление заболевания и лечение одновременно. Допустим, введение наночастиц для диагностики при обнаружении опухолевых клеток позволяет одновременно воздействовать на ее клетки и разрушать их до клинических проявлений опухоли.
- Какое лечение рака легкого доступно сегодня петербуржцам?
- Большинство современных препаратов и схем лечения доступны за счет городского бюджета. Хотя, безусловно, есть и проблемы. В бюджет заложено приобретение определенного количество, допустим, таргетного препарата на уже существующих пациентов с установленной мутацией – мишенью. В течение года появляется еще 1 - 2 пациента с такой мутацией и препарата не хватает. Нужны дополнительные закупки. И тут могут возникнуть разные проблемы, поскольку лекарственное обеспечение планируется заранее — на весь год. Но даже если есть возможность организовать дополнительные закупки, это потеря времени.
Кроме того, мы должны просчитывать экономику — препарат, в отличие от химиотерапии, у которой есть ограниченное количество курсов, назначается для постоянного применения на годы. Сумеем мы обеспечить им пациента через два года? А через 5? Это не значит, что мы отказываем пациентам в таргетной терапии. Но определенные сложности есть.
Выходим из положения за счет программ расширенного доступа, которые проводятся фармкомпаниями через Минздрав - они обеспечивают пациентов препаратами, либо проходящими регистрацию, либо еще не зарегистрированными в нашей стране, но показавшими в клинических исследованиях хорошие результаты. Если пациент подходит по определенным критериям, он вступает в эту программу за счет другой формы финансирования.
- Рак легких — заболевание, которое даже после излечения будет портить человеку всю оставшуюся жизнь. Почему?
- Потому что даже избавив человека от злокачественной опухоли, мы не должны забывать, что риск развития рака у этого человека остался прежним. Допустим, мы выявили рак у пациента из группы риска: опухоль удалили, провели курс химиотерапии. Но даже если бросил курить, он остался в группе риска развития рака, пока не прошло 15 лет. То, что мы вылечили один рак легкого, не выводит его из группы риска по развитию другого рака. Это вовсе не особенность рака легкого, это особенность всех онкологических заболеваний. Скажем, при раке молочной железы — риск развития опухоли в другой железе на 30%. Вообще, если человек перенес один рак, риск развития другого вырастает на 30%, пережил два рака — еще на 30%. Но этого не следует бояться. Важно помнить о риске, своевременно обследоваться и лечиться. Потому что даже когда этот риск реализуется, люди лечатся и живут долгие годы.

Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Наши эксперты – специалисты-онкологи, участники Российского общества клинической онкологии (RUSSCO):

заместитель директора по научной и инновационной работе ФГБУ НМИЦ онкологии им. Н. Н. Блохина Минздрава РФ, член-корреспондент РАН, профессор, доктор медицинских наук Всеволод Матвеев;

ведущий научный сотрудник отделения амбулаторной химиотерапии ФГБУ НМИЦ онкологии им. Н. Н. Блохина Минздрава РФ, доктор медицинских наук Елена Артамонова;

ведущий научный сотрудник лаборатории клинической иммунологии опухолей ФГБУ НМИЦ онкологии им. Н. Н. Блохина Минздрава РФ, академик РАЕН, заслуженный деятель науки, профессор, доктор медицинских наук Заира Кадагидзе.
Джуди (на фото с мужем) – первая пациентка, чей иммунитет полностью уничтожил рак.
Наступило прозрение!
Практически единственным способом лекарственного лечения рака до недавнего времени была химиотерапия – тяжело переносимая и чреватая многими побочными эффектами. Но сегодня, хотя химия по-прежнему остаётся методом № 1, у неё появилась реальная и в некоторых случаях более эффективная альтернатива.
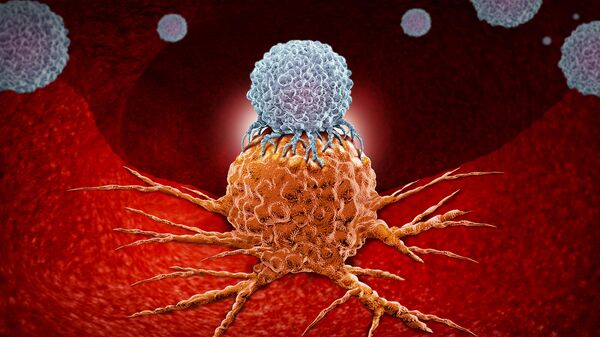
Иммунитет играет важную роль в развитии рака. Ведь именно нарушения в его работе способствуют бесконтрольному размножению клеток опухоли. Наша защитная система просто не замечает растущее в организме зло, принимая клетки опухоли за свои.
Ранее учёные не знали, как эффективно воздействовать на иммунитет, а все методы сводились в основном к его стимуляции. Но оказалось, что у иммунной системы существуют так называемые контрольные точки, которые как раз и останавливают противоопухолевый иммунный ответ. Блокада этих точек может перезагрузить иммунную систему и восстановить её работу. Применяемые сегодня иммунные препараты помогают нашей защитной системе прозреть и приняться за дело, для которого, собственно, она и нужна. То есть бороться с нарушителями работы организма, в данном случае с раком.

Взаимодействие иммунной системы и опухоли проходит три этапа.
– прогрессия опухоли. За счёт усиленного деления злых клеток, способных подавлять иммунную систему или уклоняться от её воздействия, новообразование продолжает захватывать организм.
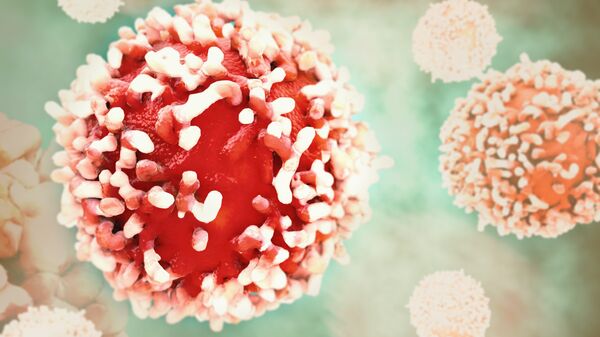
Современная стратегия иммунотерапии рака связана с открытием так называемых контрольных точек иммунитета, которые не позволяют нашей защитной системе проявлять свою противоопухолевую активность. Именно эти точки и защищают опухоль, делая её невидимой для иммунитета. Соответственно, заблокировав их с помощью инновационных препаратов, можно перезапустить иммунную систему, добившись от неё формирования адекватного противоопухолевого ответа. В результате переученные Т‑лимфоциты уже могут распознавать, атаковать и уничтожать чужеродные раковые клетки. При этом таких побочных эффектов, как при химиотерапии, при иммунотерапии не возникает и госпитализация не требуется – всё делается амбулаторно.

Не теряя надежды
Сегодня уже существует большой ряд иммунных препаратов, а несколько сотен других (в том числе и отечественных) готовятся выйти на рынок, а пока проходят клинические испытания в разных фазах. Это даёт реальный шанс больным даже с раком 4‑й стадии, что их болезнь из фазы метастазирования уйдёт в хроническую фазу и жизнь будет продолжаться. Исследуются и возможности иммунных лекарств в отношении профилактики рака. И хотя пока нет данных об эффективности их использования у больных с высоким риском рецидива, тем не менее поиски в этом направлении ведутся.
Разумеется, ещё далеко до того, чтобы научить иммунную систему на корню уничтожать рак. Но, как утверждают специалисты, мы стоим на пороге новых достижений, благодаря которым иммуноонкология будет главным направлением в лечении злокачественных опухолей в ближайшие годы.
Кому это доступно
Хотя иммунные препараты достаточно дороги, их стоимость с каждым годом снижается. А некоторые из них уже вошли в список жизненно важных лекарственных препартов (ЖНВЛП), отпускаемых за государственный счёт в рамках ОМС. Больные их могут получить в онкодиспансерах после решения врачебной комиссии. Кроме того, у пациентов есть возможность пролечиться бесплатно, участвуя в клинических исследованиях новых препаратов или в программах раннего доступа, которые организуются фармацевтическими компаниями при выпуске первых партий лекарств на рынок.

Помогает не всем
Несмотря на обнадёживающие новости, иммунотерапия пока всё же не является заменой химиотерапии. Это лишь альтернативный метод лечения рака, применяемый по строгим показаниям. И помогает такое лечение не всем, поэтому врачам очень важно выявлять тех пациентов, которым он подходит, чтобы не тратить средства понапрасну там, где это не даст результата.
Тем не менее исследования доказали, что у 15–20% больных с прогрессированием опухоли после предшествующей химиотерапии удаётся получить длительный (иногда многолетний) клинический выигрыш. Сегодня во всём мире проводятся широкомасштабные исследования биомаркеров, способных предсказать высокую эффективность иммунных препаратов для лечения рака. Иммунотерапия уже показала эффективность при метастатическом раке почки, головы и шеи, раке лёгкого, меланоме, лимфомах и некоторых других злокачественных новообразованиях. Например, больные с диссеминированной меланомой, раньше погибавшие в течение месяцев, на иммунных препаратах живут уже более 10 лет.
Читайте также:




