Радикальное лечение рака поджелудочной железы
Лечение рака поджелудочной железы в полном объёме, включающем радикальную операцию и химио- или химиолучевую терапию, далеко не всегда осуществимо: на момент установления диагноза радикальная операция возможна только у 10-20% больных, а 25% из этого числа не смогут пройти химиотерапию в связи с неудовлетворительным общим состоянием после оперативного вмешательства.
Радикальная операция подразумевает полное удаление первичной опухоли и ряда регионарных лимфоузлов, которые могут быть поражены микроскопическими метастазами.
Раковые опухоли бывают резектабельными (если имеется техническая возможность выполнения радикальной операции) и нерезектабельными (если такой возможности нет).
Возможность выполнения радикальной операции по поводу аденокарциномы поджелудочной железы оценивается согласно критериям разработанных для этого шкал резектабельности и зависит от того, насколько вовлечены в патологический процесс магистральные сосуды – чревный ствол, общая печёночная артерия, верхняя брыжеечная вена с ветвями, портальная вена.
Причины столь низкой доли резектабельных опухолей:
- значительные трудности с ранней диагностикой;
- близкое соседство опухоли с крупными сосудами.
Ранняя диагностика рака поджелудочной железы затруднена ввиду того, что ранние симптомы (ощущение боли или дискомфорта в верхней части живота) характерны для массы других заболеваний, а надёжных тесты для выявления ранних стадий этой опухоли на сегодняшний день отсутствуют.
Кроме того, больной может быть неоперабельным по другим причинам, например, ввиду выраженного нарушения функций жизненно важных органов - как развившихся в связи с ростом опухоли, так и безотносительно к ней.
- радикальные хирургические вмешательства;
- нерадикальные вмешательства, направленные на поддержание важных функций;
- химио- или химиолучевую терапию;
- паллиативную помощь.
Однако даже радикальная операция в комбинации с химио- и лучевым лечением часто не способны отложить прогрессирование болезни на длительное время. Основная причина этого – раннее, ещё на стадии формирования, метастазирование опухоли. Микрометастазы в отдалённых органах невозможно выявить во время обследования, вследствие чего при установлении диагноза стадия бывает зачастую снижена. Соответственно, даже радикальное удаление первичной опухоли практически не влияет на неблагоприятный исход, а химиотерапия лишь замедляет рост метастазов. Печальная статистика – лишь 10-20% пациентов после радикальной операции живут пять и более лет.
Жёлчеотведение
Опухолевое поражение поджелудочной железы часто сопровождается обструкцией (нарушением проходимости) жёлчных путей, симптомы которой нарастают по мере роста опухоли и степени сдавления ею жёлчных протоков. Обструкция жёлчных путей – осложнение, характерное для локализации опухоли в головке поджелудочной железы.
Обструкция жёлчных путей сопровождается:
Зуд, желтуха и изменение цвета физиологических отправлений являются следствием холестаза (частичного или полного прекращения оттока жёлчи в кишечник) и поступления в кровь билирубина. Прямой билирубин – продукт естественного распада эритроцитов – в норме перерабатывается печенью, а затем поступает с жёлчью в желудочно-кишечный тракт, откуда выводится с калом и мочой. При обструкции жёлчевыводящих путей билирубин начинает накапливаться в крови.
Операция жёлчеотведения (декомпрессия жёлчных путей) применяется:
- для стабилизации больного перед радикальной операцией по поводу рака поджелудочной железы;
- для облегчения страданий больных на поздних стадиях, когда радикальное лечение невозможно.
Предоперационная декомпрессия назначается больным с обструкцией жёлчевыводящих путей, у которых опухоль признана резектабельной, однако откладывается из-за сопутствующего холестазу холангита (воспаления жёлчных путей), обменных нарушений, связанных с расстройством пищеварения (в котором жёлчь принимает непосредственное участие). Обычно предоперационная декомпрессия назначается при повышении билирубина в крови более 200 мкг/л.
В такой ситуации радикальная операция без предварительного жёлчеотведения чревата значительным повышением вероятности осложнений. Так, длительный холестаз (в течение месяца и более) может привести к кровотечению из стенок жёлчных протоков во время или после операции. В случае послеоперационных осложнений возникает необходимость откладывать химиотерапию, раннее начало которой улучшает прогноз.
Жёлчеотведение необходимо и лицам, которым перед операцией назначена химиотерапия или необходимо проведение дополнительных исследований.
В случае невозможности проведения радикальной операции (поздняя стадия рака, сердечно-сосудистая недостаточность и другие факторы, снижающие благоприятный исход операции), жёлчеотведение показано для улучшения качества жизни пациента.
Декомпрессия жёлчных путей осуществляется следующими методами:
- стентирование;
- наложение билиодигестивного анастомоза.
Стентирование – это введение в просвет протока пластикового каркаса, препятствующего сдавлению. Стентирование может осуществляться разными методами.
Билиодигестивный анастомоз – это операция по соединению жёлчного протока с двенадцатиперстной или тощей кишкой в обход сдавленного участка.
Выбор метода декомпрессии зависит от состояния больного, прогнозов, индивидуальных особенностей анатомических нарушений.
Общие принципы лечения больных с резектабельной опухолью
Резекция поджелудочной железы является основной (но не единственной) составляющей лечения рака, позволяющей максимально увеличить продолжительность жизни больного. Однако резекция должна обязательно дополняться химиотерапией или химиолучевой терапией.
Радикальная хирургическая операция направлена:
- на предотвращение местного рецидива новообразования;
- одновременно – на сохранение функции пищеварительной функции на таком уровне, который позволит максимально безопасно проводить химиотерапию (и чаще всего далеко не единственный курс).
Перед операцией врач должен убедиться, что:
- функциональное состояние жизненно важных органов позволит больному благополучно перенести и операцию, и последующее агрессивное консервативное лечение;
- нет отдалённых метастазов опухоли;
- опухоль соответствует критериям резектабельности.
Для этого проводится соответствующая диагностика. Только после полноценного обследования врач, а нередко – врачебный консилиум, принимает решение о целесообразности хирургического вмешательства. Тем не менее, после операции у четверти больных осуществление химиотерапии бывает невозможно.
Виды хирургических операций:
- гастропанкреатодуоденальная резекция (ГПДР) или панкреатодуоденальная резекция (ПДР);
- дистальная резекция поджелудочной железы;
- панкреатэктомия.
ГПДР – иссечение головки поджелудочной железы, части желудка, двенадцатиперстной кишки, общего жёлчного протока и жёлчного пузыря. При ПДР желудок не резецируется. Кроме того, в ходе операции удаляются регионарные лимфатические узлы, могут иссекаться сосуды и нервы. После иссечения проводится реконструкция желудочно-кишечного тракта, пластика сосудов. Операции в подобном объёме выполняются при раке головки поджелудочной железы. ГПДР и ПДР могут повлечь нарушения функций пищеварительной системы разной степени тяжести, панкреонекроз, внутренние и желудочно-кишечные кровотечения.
Дистальная резекция может выполняться в следующем объёме:
- удаление хвоста поджелудочной железы;
- удаление хвоста и тела;
- удаление хвоста, тела и перешейка;
- субтотальная дистальная резекция – удаление хвоста, тела, перешейка и большей части головки поджелудочной железы.
Такие операции в большинстве случаев сопровождаются удалением селезёнки ввиду нарушения её кровоснабжения. Операция выполняется при раке тела или хвоста поджелудочной железы, в случае внутрипротоковой аденокарциномы – только в объёме субтотальной резекции. При нейроэндокринныех опухолях (НЭО) высокой и умеренной дифференцировки (грубо говоря, низкой и умеренной степени злокачественности) возможна дистальная резекция в меньшем объёме, в том числе и с сохранением селезёнки. В зависимости от объёма операции, больному может потребоваться пожизненный контроль сахара в крови, приём инсулина.
Тотальная панкреатодуоденэктомия (панкреатэктомия) – удаление всей поджелудочной железы, двенадцатиперстной кишки, жёлчного пузыря и общего жёлчного протока, селезёнки, регионарных лимфатических узлов – выполняется в случае обнаружения нескольких очагов опухоли или распространения опухоли тела поджелудочной железы на хвост и головку. После операции требуется пожизненный частый контроль диабета и приём пищеварительных ферментов. Невозможность обеспечения такого контроля является противопоказанием к операции.
Адъювантная (послеоперационная) терапия является обязательным этапом лечения рака, поскольку:
- согласно данным новых исследований, аденокарцинома поджелудочной железы способна метастазировать ещё на этапе формирования первичной опухоли;
- отдалённые метастазы трудно выявить своевременно, и они являются основной причиной смерти после радикальной операции.
Химиотерапия замедляет рост отдалённых метастазов, отодвигая время их проявления, тем самым позволяя увеличить продолжительность жизни больного. С той же целью в комбинации с химиотерапией применяется лучевое лечение, но вопрос эффективности последней пока остаётся открытым. Больные, получающие послеоперационную химио- или химиолучевую терапию, живут в среднем в полтора-два раза дольше по сравнению с теми, кто её не получает, однако такое лечение может существенно снижать качество жизни.
Общие принципы лечения больных нерезектабельным раком поджелудочной железы
Основная задача лечения нерезектабельных опухолей – перевод их в категорию резектабельных. Иногда этого удаётся добиться при помощи неоадъювантной (предоперационной) химиотерапии (или химиолучевой терапии).
Нерезектабельные опухоли поджелудочной железы бывают разные – со значительным поражением местным распространением и лишь немного не соответствующие критериям нерезектабельности. Последние называют пограничнорезектабельными. Такие опухоли являются особенно перспективными в плане последующего осуществления радикальной операции.
Если опухоль достаточно чувствительна к химиотерапии, неоадъювантное противоопухолевое лечение подавляет рост не определённых на момент установления диагноза метастазов и замедляет местное распространение – поэтому, если в дальнейшем удастся провести радикальную операцию, такое лечение может улучшить прогноз.
В случаях резектабельной опухоли назначение дооперационной химиотерапии сопряжено с рисками: во-первых, за время консервативного лечения малочувствительная к химиотерапии опухоль может стать нерезектабельной, во-вторых, химиотерапия (и лучевое лечение), ввиду высокой токсичности, может привести к ухудшению общего состояния и невозможности выполнения операции.
Больные, перенёсшие адъювантное противоопухолевое лечение и последующую радикальную операцию, после хирургического вмешательства продолжают получать химиотерапию.
Паллиативное лечение рака поджелудочной железы
Паллиативное лечение направлено на устранение мучительных симптомов, которыми чаще всего сопровождается рак поджелудочной железы (особенно на 4 стадии).
Такое лечение не приостанавливает рост опухоли и процесс метастазирования, однако значительно облегчает жизнь больному.
Паллиативное лечение рака поджелудочной железы направлено на устранение:
- симптомов, обусловленных сдавлением опухолью жёлчевыводящих путей;
- развития нарушения проходимости двенадцатиперстной кишки (дуоденальной обструкции), также связанного с её сдавлением;
- изнуряющего болевого синдрома;
- симптомов, обусловленных интоксикацией: сильнейшей слабости, потери аппетита и прочих;
- психических нарушений, связанных как с самим фактом выявления смертельной болезни, так и с вызванными заболеванием физическими страданиями.
При обструкции жёлчевыводящих путей выполняется стентирование или билиодигестивный анастомоз.
При дуоденальной обструкции выполняется гастроэнтероанастомоз - формирование соединения желудка в обход двенадцатиперстной кишки с другими отделами тонкого кишечника
Несмотря на короткий срок жизни больных с распространённым раком поджелудочной железы, согласно данным ряда исследований, проведённых за рубежом, 40% доживает до того момента, когда начинает развиваться непроходимость двенадцатиперстной кишки. Поэтому некоторые зарубежные специалисты рекомендуют совмещать билиодигестивный анастомоз с гастроэнтероанастомозом. По наблюдениям этих авторов, такая операция позволяет продлить жизнь и улучшить её качество по сравнению со случаями, когда профилактическое наложение гастроэнтеростомоза не выполняется. В России, в целом, не принята тактика профилактического гастроэнтеростомоза, а соответствующие исследования не проводились.
Если на момент установления диагноза боль отмечается у 25-40% пациентов, в терминальной стадии этот симптом наблюдается уже у 80% больных раком поджелудочной железы. Боли бывают разной интенсивности, однако даже умеренная постоянная боль истощает, отнимает последние силы. Для купирования болевого синдрома применяются анальгетики, преимущественно - наркотические.
Хороший результат даёт в комбинации с медикаментозным лечением спланхникэктомия – хирургическое иссечение чревного узла солнечного сплетения или его разрушение с помощью введения химических веществ. В результате такой процедуры болевые импульсы из зоны, поражённой опухолью, перестают передаваться в мозг и боль перестаёт ощущаться.
При распространённом (местно или по всему организму) раке с целью продления жизни нередко назначается химиотерапия, но чаще всего качество жизни при этом весьма сомнительно.
Лечение народнеыми средствами
Лечить рак поджелудочной железы лучше в специализированных центрах, где опыт и навык специалистов несравнимо выше, чем в неспециализированных больницах. Например, в Москве это Институт хирургии им. А. В. Вишневского, Московский клинический научный центр, Московский научно-исследовательский онкологический институт им. П. А. Герцена.
Врач высшей категории, в медицине более 20 лет. Интерес к написанию популярных статей на медицинские темы появился несколько лет назад, когда всё чаще стала замечать на просторах Интернета тексты на онкологическую тематику, пестрящие фактическими ошибками и вводящие читателя в заблуждение…
Комментарии
Рак поджелудочной железы встречается сравнительно редко, составляя чуть более 3% от всех злокачественных опухолей, регистрируемых в нашей стране. При этом смертность от него практически вдвое выше. Опухоль занимает пятое место в структуре смертности от онкозаболеваний и чаще встречается у мужчин, чем у женщин. Средний возраст пациентов составляет 64 и 70 лет соответственно. Сегодня в мире регистрируется рост заболеваемости раком поджелудочной железы, при этом тенденции к снижению смертности от него не отмечается.
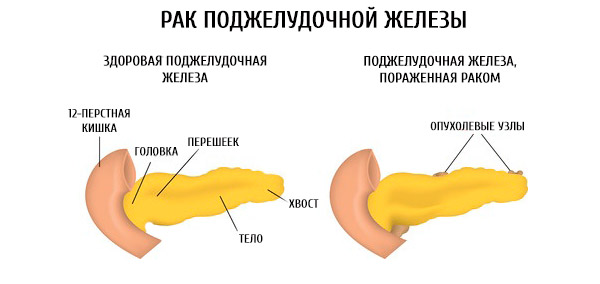
Подавляющее большинство злокачественных опухолей поджелудочной железы (более 95%) являются протоковыми аденокарциномами — опухолями из железистого эпителия протоков органа. Рак может сформироваться в любом его отделе, но наиболее часто возникает в головке — в 60-80% случаев.
Факторы риска
По мнению отечественных специалистов, до 10% случаев рака поджелудочной железы связаны с генетическим фактором, а именно с наследуемыми синдромами, в том числе:
- синдром Линча — наследственное заболевание, связанное с мутацией в генах, отвечающих за исправление ошибок при делении ДНК. Заболевание обусловливает рак толстой кишки, яичников, мочевого пузыря и других органов;
- синдром Пейтца-Егерса — патология, которая сопровождается полипозом желудка, кожными проявлениями и связана с раком матки и яичников;
- синдром наследуемого рака молочной железы, вызванный мутацией гена BRCA, который участвует в поддержании генома, обеспечивая нормальное деление ДНК.
Все остальные факторы риска носят случайный характер, и выделить из них сколь-либо лидирующий достаточно сложно. Обычно к ним причисляют: дефицит холекальциферола, хронический панкреатит, сахарный диабет, табакокурение, чрезмерную массу тела. Алкоголь не относится к факторам риска, однако следует помнить, что злоупотребление крепкими спиртными напитками ведет к хроническому панкреатиту, то есть косвенно влияет на развития рака.
Симптомы
Симптомы заболевания появляются лишь на его поздней стадии, поэтому 9 из 10 пациентов попадают к врачу с распространенным раком или отдаленными метастазами.
Клиника заболевания складывается из общих симптомов интоксикации, обструкции панкреатических и билиарных протоков, а также функциональных нарушений органа:
- опоясывающие боли в верхних отделах живота с иррадиацией в спину;
- прогрессирующая потеря веса;
- обструктивная желтуха (до 90% пациентов);
- увеличение селезенки при нарушении кровообращения в селезеночной вене;
- варикозное расширение вен пищевода и желудка;
- сахарный диабет;
- мальабсорбция (нарушение всасывания пищи).
По мере роста опухоли нарастают признаки интоксикации: слабость, снижение аппетита, умеренное повышение температуры тела, головная боль, недомогание.
Стадирование
Стадирование проводится по системе ТNМ, где
Т — инвазивный рост первичного очага;
N — распространение в лимфатические узлы;
М — отдаленные метастазы;
0 — отсутствие признака.
Диагностика
Диагностические мероприятия при раке поджелудочной железы проводятся в объеме, который даст достаточный объем информации для определения тактики лечения. Обычно с этой целью применяются:
- Биопсия с целью получения материала для гистологического исследования. Если при оперативном лечении эта процедура в некоторых случаях может не применяться, то при планировании консервативных процедур биопсия обязательна.
- ФГДС — эндоскопическое исследование, обязательное при подозрении на рак поджелудочной железы. С его помощью врач может визуализировать опухоль, ее локализацию и степень инвазивности.
- Компьютерная томография грудной клетки и брюшной полости незаменима в поиске отдаленных метастазов, для чего наиболее эффективна КТ с внутривенным контрастированием. Кроме того, исследование помогает определить размеры новообразования и его связь с соседними органами.
- Рентгенография грудной клетки показана в сочетании с УЗИ брюшной полости, если недоступна КТ.
- Ангиография — исследование сосудов, которое помогает оценить резектабельность опухоли, если КТ не дает для этого достаточной информации.
- Эндосонография — ультразвуковое исследование, которое используется для навигации при проведении биопсии и дополнительной оценки инвазивности процесса.
- Магнитно-резонансная терапия с контрастированием применяется при подозрении на метастазы в печень и головной мозг, которые не удается обнаружить иными методами.
При соответствующем оснащении клиники могут применяться также ПЭТ/КТ, остеосцинтиграфия и другие методы диагностики.
Принципы лечения
В подавляющем большинстве случаев (до 80- 90%, по мнению некоторых специалистов) к моменту постановки диагноза опухоль уже является неоперабельной либо вследствие прорастания в крупные сосуды, либо наличия отдаленных метастазов.
При операбельном раке железы рекомендовано оперативное лечение. Объем операции связан с локализацией и распространением новообразования.
Химиотерапия
Системная терапия применяется самостоятельно или в комбинации с хирургическим лечением:
- Погранично операбельный рак, например Т3N1М0, требует предоперационной (неоадъювантной) химиотерапии, при положительном результате которой проводится операция.
- При неоперабельных опухолях назначается индукционная (то есть направленная на достижение ремиссии) химиотерапия, по результатам которой судят о возможности хирургического лечения.
- Адъювантная (послеоперационная) химиотерапия показана всем пациентам после операции.
- Метастатические опухоли требуют назначения системной химиотерапии.
Пациентам с резектабельным раком рекомендована адъювантная терапия с гемцитабином или капецитабином. Эта же комбинация может применяться при местнораспространенном, но неоперабельном раке, обеспечивая среднюю продолжительность жизни около 1 года. Пациентам с метастазами может быть предложена химиотерапия, однако прогноз, несмотря на проводимое лечение, остается неблагоприятным.
Роль лучевой терапии на сегодняшний день окончательно неясна. В классическом варианте, она входит в состав неоадъювантной химиолучевой терапии. Проведенные исследования не выявили преимуществ адъювантной химиолучевой терапии перед самостоятельной хирургической операцией.
Некоторые иностранные эксперты рекомендуют проведение дистанционного радиологического лечения в комбинации с 5-фторурацилом в составе адъювантной терапии при местнораспространенных неоперабельных новообразованиях.
Стоимость лечения рака поджелудочной железы
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
TomoTherapy и рак поджелудочной железы
Применение лучевой терапии при использовании обычных доз и режимов ограничено ее токсическим влиянием на организм в целом и на прилежащие критические органы и структуры. Поэтому взгляды специалистов со всего мира сегодня прикованы к принципиально новым методам лучевой терапии, которые позволяют сфокусировать ионизирующее излучение строго на опухоли, не затрагивая остальные ткани. Один из таких методов — лучевая терапия под визуальным контролем с модулированной интенсивностью излучения (IG\IMRT), который реализуется в частности в уникальной системе TomoTherapy.
Исследований, посвященных лечению рака поджелудочной железы с применением TomoTherapy пока не очень много, но те, что уже проведены, показывают высокую эффективность этого метода и достоверное снижение токсического действия на организм. В результате удается добиться снижения продолжительности лечения и его лучшей переносимости. TomoTherapy избирательно может применяться у пациентов, которые уже проходили курсы лучевой терапии, при наличии медицинских показаний.
В каждом из трех Центров Лечения Рака в США используются аппараты TomoTherapy, которые по признанию многих специалистов можно считать будущим радиотерапии. В России имеется 2 таких аппарата. Один из них установлен в клинике СакНур, где проходят лечение пациенты из республики Татарстан и других регионов России.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.
Читайте также:

