Прорыв в лечении рака поджелудочной железы


– Илья, Анатольевич, у кого чаще всего диагностируют РПЖ?
– На сегодняшний день РПЖ чаще диагностируется у женщин. Риск развития заболевания увеличивается с возрастом. Если говорить про средний возраст пациентов, то это люди старшего возраста, около 60 лет.
– Как выглядит путь пациента от момента подтверждения диагноза и до окончания лечения? Какие этапы терапии существуют?
– Мы можем говорить о двух этапах лечения, хирургическом и химиотерапевтическом. Их последовательность может меняться в зависимости от случая.
После обследования пациенту с цитологически или гистологически подтвержденным диагнозом показано выполнение операции в объеме резекции поджелудочной железы, иногда в сочетании с двенадцатиперстной кишкой, в зависимости от локализации. После этого ему показано проведение профилактической химиотерапии в течение полугода.
Иногда даже при отсутствии метастазов, но при большом размере опухоли хирург не может выполнить операцию на первом этапе из-за вовлечения в опухолевый процесс жизненно важных сосудов. Тогда пациенту проводят несколько курсов химиотерапии, иногда лучевой терапии, с последующим решением вопроса об операции.
– Отличаются ли подходы к терапии в случае, если опухоль не поддается оперативному вмешательству?
– Если опухоль не поддается оперативному вмешательству, то пациенту назначается химиотерапия. При отдаленных метастазах протокол лечения включает в себя интенсивные режимы химиотерапии, о хирургическом лечении этого пациента не может быть и речи. Химиотерапия проводится неограниченное время, пока она помогает пациенту. Если у пациента нет отдаленных метастазов, то химиотерапия проводится в течение 6 месяцев.
– Каких целей позволяет добиться терапия?
– Если речь идет о неметастатическом процессе, то цель терапии – выздоровление. К сожалению, статистика против нас, и болезнь, несмотря на радикальную операцию и адекватный объем химиотерапии, в большинстве случаев прогрессирует. Только в 20% случаев мы можем рассчитывать на отсутствие рецидива в течение 5 лет, что примерно приравнивается к выздоровлению пациента.
Если у пациента есть отдаленные метастазы, то лечение направлено на достижение стабилизации и отсутствие прогрессирования заболевания. У таких пациентов средняя продолжительность жизни в среднем не превышает одного года.
– Как изменились подходы к терапии пациента с РПЖ за последние 15–20 лет? Какие новые возможности терапии существуют?
– Подходы к терапии изменились принципиально, и мы это видим по ее результатам – увеличилась средняя продолжительность жизни наших пациентов. Если раньше мы говорили о нескольких месяцах, то сейчас можем говорить об одном годе, а многие пациенты живут более двух лет.
Долгое время до 2012 года мы имели в своем распоряжении только один эффективный противоопухолевый препарат. Сейчас же мы применяем агрессивную многокомпонентную химиотерапию, включающую в себя четыре противоопухолевых препарата, используем другие комбинации, связанные с применением современных препаратов типа нанодисперсного паклитаксела, стабилизированного альбумином. В некоторых случаях с успехом применяется иммунотерапия, хотя эта редкая ситуация для РПЖ – далеко не каждая опухоль чувствительна к ней.
Принципиально продвинулась терапия местно-распространенного РПЖ. Раньше, при отсутствии эффективных терапевтических возможностей и контроля опухолей, пациенты получали паллиативную химиотерапию на протяжении нескольких месяцев, после чего перспективы дальнейшего лечения для них не просматривались. Сейчас значительная когорта этих пациентов (от 20 до 30%) имеет шанс после проведения предоперационной терапии быть прооперированными в радикальном объеме. И у этих пациентов теоретически есть шанс выздороветь. Есть статистика по 5-летней выживаемости таких пациентов. Это значительный прорыв: болезнь, которая раньше считалась абсолютно неизлечимой, в настоящее время начинает поддаваться терапии, и с каждым годом мы видим все более высокие цифры выживаемости пациентов.
– Каков на сегодняшний день прогноз пациентов с РПЖ?
– Статистика такова, что продолжительность жизни на современных режимах химеотерапии в среднем составляет от 7 месяцев до 1 года. Она определяется не только схемой химиотерапии, но и исходной распространенностью болезни. Скажем, при метастатическом процессе и при удовлетворительном состоянии пациент может прожить один год и больше. Если пациент в тяжелом состоянии, то продолжительность жизни, конечно, ниже.
Добиться полного выздоровления пациентов с метастатическим РПЖ все еще не получается, но они уже живут дольше, и симптомы заболевания контролируются лучше, чем раньше.
Источник
- Попова А.С., Покатаев И.А., Тюляндин С.А. Комбинированные режимы химиотерапии. Медицинский совет, 10.21518/2079-701X-2017-6-62-70.
- Покатаев И.А., Алиева С.Б., Гладков О.А., Загайнов В.Е., Кудашкин Н.Е., Патютко Ю.И. и соавт. Практические рекомендации по лекарственному лечению рака поджелудочной железы // Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 401–413.

В ходе недавнего исследования американские ученые обнаружили ген, ответственный за развитие рака поджелудочной железы, одного из самых агрессивных и смертоносных видов онкологии. Они провели эксперимент на лабораторных мышах, который подтвердил: удалив конкретный ген, можно блокировать формирование опухоли.
Рак поджелудочной железы считается одним из наиболее опасных онкологических заболеваний. Для таких опухолей характерен стремительный рост и раннее метастазирование. Из-за неспецифичности симптомов их крайне сложно диагностировать на начальных стадиях, а в запущенной форме они практически не поддаются лечению.
Ответственный автор исследования доктор Диана Симеон, занимающая должность руководителя Центра по лечению рака поджелудочной железы, функционирующего в составе онкологического центра при больнице Нью-йоркского университета, и ее коллеги провели эксперимент на лабораторных мышах и образцах человеческой опухоли. В ходе исследования они изучали роль гена ATDC в формировании злокачественных опухолей поджелудочной железы. Результаты своей работы ученые обнародовали в последнем номере научного журнала Genes & Development.
Как нормальные клетки трансформируются в раковые
В нынешнем исследовании доктор Симеон и ее коллеги сосредоточили внимание на ацинарных клетках поджелудочной железы. Эти клетки вырабатывают пищеварительные ферменты, которые также могут провоцировать повреждения тканей тонкой кишки. Чтобы запустить процесс регенерации поврежденных тканей, ацинарные клетки способны быстро возвращаться к уровню стволовых, которые характеризуются стремительным ростом.
По словам исследователей, ацинарные клетки могут трансформироваться в злокачественные, если в их ДНК образуются мутации, в том числе в онкогене KRAS. Если точнее, то в условиях стресса клетки этого типа способны преобразовываться в так называемую ацинарно-протоковую метаплазию, которая считается промежуточной стадией формирования примитивных быстрорастущих клеток. В дальнейшем эти клетки могут трансформироваться в интраэпителиальную неоплазию поджелудочной железы – состояние, при котором клетки размножаются гораздо быстрее, чем должны.
Мощная блокировка развития рака
В нынешнем исследовании команда доктора Симеон впервые использовала лабораторных мышей для создания модели панкреатита – воспалительного заболевания, при котором ацинарные клетки поджелудочной железы часто преобразуются в быстрорастущие протоковые клетки. Последние по некоторым параметрам схожи с примитивными эмбриональными протоками и могут сохранять способность производить эндокринные клетки.

Ученые установили, что экспрессия гена ATDCвыросла уже через несколько дней после того, как панкреатит спровоцировал повреждение тканей поджелудочной, достигнув уровня, необходимого для превращения анциарных клеток в протоковые. Они также обнаружили, что при наличии мутаций сразу в обоих генах – ATDCи KRAS– у всех без исключения подопытных грызунов развился агрессивный рак поджелудочной железы.
После того как исследователи удалили ген ATDC, ни у одной из мышей с искусственно созданной предрасположенностью к онкологии не сформировалась опухоль. Более того, ацинарные клетки даже не прошли стадию преобразования в ацинарно-протоковую метаплазию и тем более – в интраэпителиальную неоплазию поджелудочной железы.
После этого исследователи провели серию дополнительных экспериментов, которые помогли установить дополнительные детали механизма цепной реакции, которые объясняют, каким именно образом ген ATDC стимулирует развитие рака. Ученые, в частности, выявили еще один сигнальный белок и еще один ген, которые вовлечены в процесс формирования злокачественной опухоли, и отметили, что они могут быть использованы в качестве потенциальных мишеней при разработке новых методов профилактики и лечения рака поджелудочной железы.

Ключевой элемент
Рак поджелудочной железы — это онкозаболевание с одними из худших показателей выживаемости. После постановки диагноза, который часто ставится уже на поздней стадии, большинство пациентов умирает в течение 3-8 месяцев. Операция по удалению опухоли во многих случаях невозможна из-за риска повреждения других жизненно важных органов.
Можно ли уменьшив строму сделать ее проницаемой и найти ключевой элемент, который можно атаковать? Это были основные вопросы, с которых начал профессор Джай Пракаш из Университета Твенте в Нидерландах и его команда.

После многих сравнительных исследований ученые сумели найти белок под названием интегрин альфа 5 (ITGA5), который и оказался решающим в выживаемости пациентов с раком поджелудочной железы.
Для этого были обследованы опухолевые ткани
140 пациентов. Кроме того, с помощью обширных биологических экспериментов команда доказала, что биологическое нападение на ITGA5 уменьшит строму и даст лучший доступ химиотерапевтических препаратов к опухоли.
Следующий важный вопрос был в том, можем ли мы найти вещество для эффективной атаки на ITGA5?
Восемьдесят процентов снижения
В своей работе исследователям удалось выделить небольшую последовательность из семи аминокислот, которая скрыта в большом белке нашего организма под названием фибронектин, состоящим из более чем тысячи аминокислот.
Эта последовательность была названа пептидом AV3 и оказалась лучшим кандидатом для блокирования ITGA5. Первые тесты с опухолевой тканью и стромой помещенной в трехмерную биокультуру, показали, что объем опухоли может быть уменьшен после добавления AV3 и гемцитабина. Тесты с человеческой опухолью, привитой мышам, также показали уменьшение объема опухоли до 80%.

Такое значительное уменьшение размера опухоли уже может открыть путь к операции. Но, по словам Джая Пракаша, более высокие дозы AV3 с цитостатиками могут даже вызвать полное разрушение опухоли.
Перспективы использования в клинической практике
Перед тестированием нового препарата на людях необходимо определить реакцию здоровых пациентов на введение AV3. До сих пор вещество не показало признаков токсичности, но пока данных очень мало. После того, как AV3 будет признан безопасным, потребуется процедура одобрения, за которой последуют клинические испытания с использованием как AV3, так и цитостатиков.
Джай Пракаш запатентовал этот пептид и основал компанию ScarTec Therapeutics при поддержке Совета исследований Нидерландов (NWO-TTW) и Совета Европы для ускорения внедрения нового лекарства. ScarTec активно ищет инвестиции для промышленного синтезирования этого пептида, чтобы охватить пациентов в ближайшем будущем. Джай Пракаш говорит, что, если необходимые инвестиции будут успешно получены, первое исследование на добровольцах ожидается в 2021 году, а первые назначения пациентам онкологических клиник в Европе могут начаться в 2022-2023 годах.
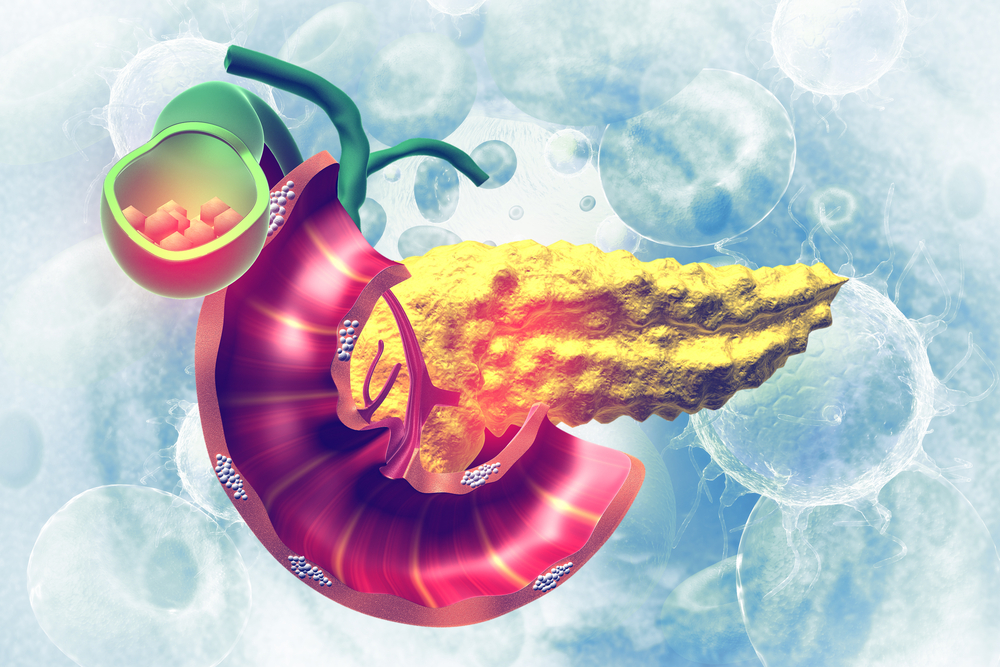
За последние 40 лет случаи развития этой болезни у мужчин увеличились в 2 раза, а у женщин — в 3. Рассказываем, как выявить и вылечить опасный недуг.
Опухоль вырастает из клеток, вырабатывающих панкреатический сок. Новообразование может появиться как на органе, так и на соседних тканях. Оно перекрывает жёлчные пути или провоцирует сжатие желудка и кишечника.
В основном болезнь диагностируют у людей старше 40 лет. Среди факторов риска выделяют наследственность, курение, лишний вес, диабет, острый панкреатит, желтуху, пародонтит и постоянный контакт с вредными химическими веществами.
На ранних стадиях особых признаков практически не бывает. Они развиваются по мере роста опухоли:
- Вначале появляется боль из-за сдавливания нервных клеток или проникновения опухоли в ткани;
- Затем становятся заметны следующие симптомы: желтушность кожи, потеря цвета кала, тёмный цвет мочи, увеличение печени и жёлчного пузыря, повышение температуры, зуд, рвота, отрыжка, сухость кожи, потеря аппетита, снижение веса и общая слабость.
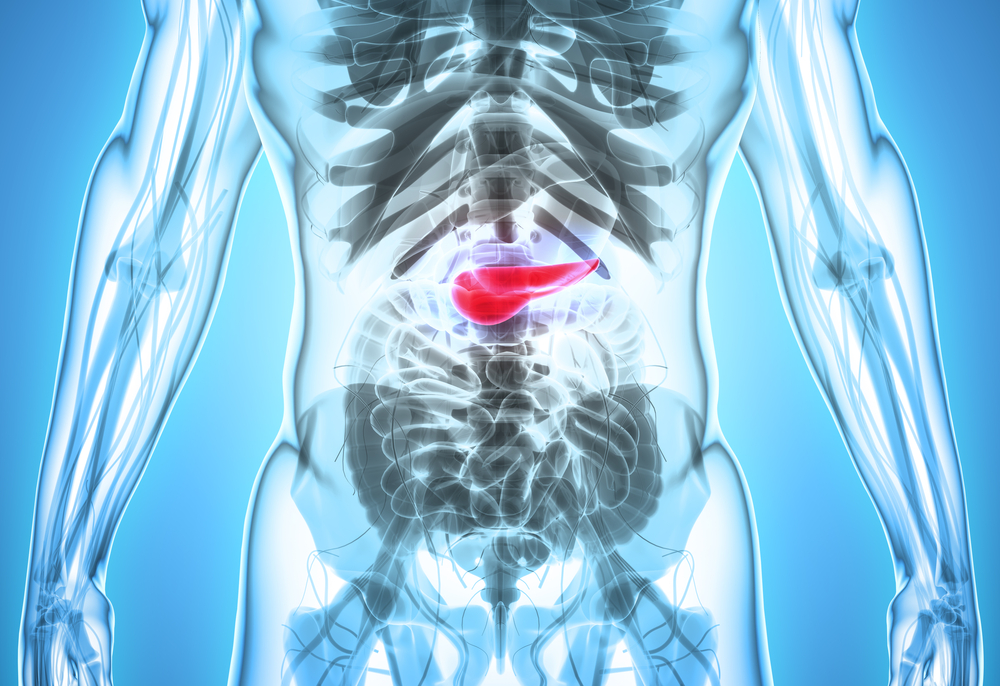
Чем раньше вы обратиться к врачу, тем лучше. Обычно назначают следующие процедуры:
- КТ (компьютерная томограмма) — она определит расположение опухоли, её близость к кровеносным сосудам и отдалённость метастазов;
- УЗИ выявит контуры опухоли и увеличение органов;
- МРТ (магнитно-резонансная терапия) органов брюшной полости назначают, чтобы определить отличия между воспалительным процессом и опухолью, а также диагностировать новообразования в жёлчных протоках и метастаз в печени;
- Лапароскопия подтвердит изменения в жёлчном пузыре, печени и брюшине;
- Позитронно-эмиссионная томография в комбинации с компьютерной томографией (ПЭТ-КТ) совмещает в себе диагностику структуры и функций тканей;
- Фиброгастродуоденоскопия диагностирует, насколько сдавлены кишечник и желудок. Также процедура позволит увидеть метастазы и взять материал для биопсии;
- Рентген может показать деформацию двенадцатиперстной кишки и желудка.
Ещё 20 лет назад рак медики использовали только стандартные методы: химиотерапию и операцию. Однако раковые клетки поджелудочной слабо снабжены кровеносными сосудами и окружены плотной соединительной тканью — а потому более устойчивы к химии. Поэтому учёные изобрели новые способы лечения:
- Операции с помощью роботов Да Винчи и эндоскопических роботов. Во время процедуры хирург сидит перед экраном компьютера и управляет движением рук робота. Благодаря этому пациенту более точно удаляют опухоль, не затрагивая здоровые ткани.
- Кибер-нож — альтернатива операции, при которой злокачественные клетки убивают при помощи излучения.
- Таргетированная терапия — в отличие от химии, она разрушает только раковые клетки.
- Лечение с помощью радиоактивных бактерий — дополнительный метод, при котором микроорганизмы проникают в органы, обнаруживают метастазы и уничтожают их.
В послеоперационный период помимо стандартных химио- и радиотерапии, применяют новые технологии: химиоэмболизацию и радиоэмболизацию. При таких методах лечения большие дозы препаратов вводят непосредственно в сосуды, идущие к опухоли.

В 2018 году медики в России выявляли в среднем по 47 000 новых случаев онкологических заболеваний ежемесячно — таковы данные Минздрава, с января по август обнаружено 379 351 новых случаев злокачественных опухолей.
В последние годы данный показатель стабильно рос: если в 2012 году в РФ было зафиксировано около 526 тысяч заболевших раком, то по итогам 2017 года эта цифра составила уже свыше 617 тысяч человек.
Федеральное агентство новостей обратилось в Министерство здравоохранения РФ и в ведущий профильный исследовательский центр, НМИЦ радиологии, с вопросом: когда рак в России перестанет быть непобедимой болезнью? В ответ Минздрав и ученые рассказали о передовых технологиях лечения рака в нашей стране, однако точных дат эксперты не назвали.
Дело в том, что медицина за последнее время изучила десятки тысяч разновидностей злокачественных опухолей. У каждой — своя локализация, сценарии лечения и прогнозы выживаемости — и найти рецепт или изобрести вакцину от всего сразу невозможно. Но ответы все равно получились обнадеживающими. По некоторым из видов рака доля прошедших успешное лечение и вернувшихся к обычной жизни пациентов уже сейчас составляет 99,6%.
Еще пару десятилетий назад в лечении онкологических заболеваний все было относительно просто. Врачи различали виды рака только по органам, в которых он образовался, — например, лечили рак поджелудочной железы, не вдаваясь в подробности, какой вид мутации клеток в какой части органа вызвал опухолевый процесс. Весь спектр способов терапии чаще всего сводился к двум основным: химиотерапии и операции по удалению органа или его части.
Сегодня стало намного легче запутаться: тысячи видов рака, десятки методов воздействия на неправильные клетки, вплоть до редактирования генетического кода, — плюс еще большее количество комбинаций различных технологий, персонифицированных под каждого отдельный случай.
Впрочем, показатель общего числа смертей от рака при этом пока заметно не изменился. Если в 2012 году на 100 тысяч населения России приходился 201 случай смерти от онкологических заболеваний, то в прошлом году он составил в среднем 197,7 летальных исходов на то же число россиян. Получается, что медикам все чаще удается продлевать жизнь больным на несколько лет, но доля полностью выздоровевших пациентов пока ощутимо не выросла.

Протонный ускоритель, гамма-нож и лечение светом
Специалисты не исключают, что в ближайшее время удастся изменить показатели выживаемости и смертности при онкологических заболеваниях. Ведь с учетом современных темпов развития технологий, российская медицина образца января 2018 года уже серьезно отличается даже от нынешнего положения дел.
Важнейшим событием этого года в Минздраве РФ считают открытие в Обнинске Центра высокоточной радиологии Gamma Clinic.
Кроме того, Андрей Каприн отмечает еще одно достижение специалистов на базе Медицинского радиологического центра им. А.Ф. Цыба в Обнинске: там начали применять протонный ускоритель для воздействия на раковые клетки.

Еще одним значимым событием профессор называет начало производства отечественных радиоизотопов на базе одной из разновидностей йода. За эту работу коллектив ученых из НМИЦ радиологии и Физико-энергетического института им. Лейпуновского был удостоен премии правительства РФ в области науки и техники.
Сегодня метод брахитерапии, в котором используются радиоактивные фармпрепараты, применяют на целом ряде злокачественных новообразований: предстательной железы, матки, молочной железы, печени. Впервые в России он начал использоваться и при раке поджелудочной железы.

Кроме того, по словам медика, с помощью протонного ускорителя в России все чаще лечат опухоли головного мозга, легких и молочных желез. Активно развиваются комбинированные и комплексные методы лечения с использованием методик ядерной медицины: это адронная, протонная, нейтронная, радионуклидная терапии.
Российская система здравоохранения берет на вооружение и все последние достижения мировой науки. Одним из по-настоящему прорывных направлений в этой области является таргетная терапия, в том числе с использованием иммунных препаратов.
По мнению Андрея Каприна, проблемы онкозаболеваний нужно решать, объединяя усилия нескольких разнопрофильных специалистов и структур.

Совместно с учеными ИМЕТ РАН и МГУ в НМИЦ радиологии учатся восстанавливать вырезанные вместе с опухолью части органов и тканей, заново отпечатывая на 3D-принтере трехмерные импланты нужных параметров из биоматериалов и насыщая их необходимыми препаратами для лечения и восстановления утраченных функций.
На вопрос о том, когда будет найдено универсальное оружие для победы над раком, все специалисты единогласно отвечают: это невозможно.
Впрочем, по словам представителей ведомства и самих медиков, отсутствие универсального оружия еще не означает, что враг непобедим.
К слову, упомянутая медиком программа предполагает переоснащение около ста региональных учреждений в России для помощи онкобольным, формирование сети протонных центров для развития ядерной медицины, кластеров по подготовке радиохимиков, медицинских физиков, радиофизиков, амбулаторных онкологических служб на межрайонном и межмуниципальном уровнях.
Наиболее перспективной стратегией, по мнению специалистов Минздрава РФ, станет соединение различных подходов к лечению: от таргетной терапии до радиолучевого воздействия, а также персонализация лечения — выявление наиболее эффективных методов воздействия для каждого отдельного пациента.
Если с вектором движения и даже первыми успехами на этом пути в целом уже понятно, то с ответом на вопрос, когда рак больше не будет приговором, все сложнее. Впрочем, и здесь есть ориентиры, которые Министерство здравоохранения обозначило в своем ответе ФАН.
Есть шанс, что статистика следующих пяти лет будет заметно отличаться от нынешней в лучшую сторону. С точки зрения современного развития технологий, 2019 год может ознаменоваться переходом к новой эре оказания медицинской помощи онкобольным: каждый месяц практикующие врачи, ученые, фармацевты, инновационные предприниматели всего мира делают пусть незначительный, но шаг вперед к одной общей цели — победе человечества над раком.
Клетки рака поджелудочной железы переваривают собственные белки, которые могут выдать их иммунной системе.
Иммунитет должен уничтожать не только вирусы с бактериями, но и злокачественные клетки. Но у злокачественных клеток есть разные уловки, которые позволяют им оставаться незаметными для иммунитета. Однако если иммунной системе, так сказать, открыть глаза, то она увидит опухоль и начнёт её истреблять. Суть иммунотерапии в том и заключается, чтобы активировать противораковые свойства иммунитета. Здесь используют разные подходы, и два иммунотерапевтических открытия даже удостоились недавно Нобелевской премии.
Но разные виды рака по-разному реагируют на иммунотерапию, и рак поджелудочной железы в этом смысле один из самых стойких. Он не реагирует как раз на «нобелевские « методы терапии, основанные на том, что у иммунитета в прямом смысле отключают тормоза.
У иммунной системы есть предохранители, клетки и молекулы, которые следят, чтобы защитная реакция была по делу и адекватна угрозе – чтобы иммунитет не впадал в агрессию без повода и чтобы иммунная активность утихала по мере исчезновения опасности. В число таких предохранителей входят белки PD-1 и CTLA-4, сидящие на поверхности Т-лимфоцитов, которые обычно уничтожают больные клетки, в том числе и раковые.
PD-1 и CTLA-4 успокаивают Т-лимфоциты, то есть если PD-1 и CTLA-4 активны, Т-лимфоциты никого не убивают. Раковые клетки как раз поддерживают PD-1 и CTLA-4 во включённом состоянии, так что иммунитет опухоль игнорирует. Но если отключить PD-1 и CTLA-4 – иными словами, сорвать лимфоцитам тормоза – то иммунная система начнёт охотиться на раковые клетки.
Но и Т-лимфоциты с сорванными тормозами всё равно почему-то не трогают клетки рака поджелудочной железы. Тут может быть несколько причин. Во-первых, активность иммунных клеток зависит не только от этих двух белков. И в самой раковой опухоли могут быть какие-то другие клетки, которые усыпляют бдительность Т-лимфоцитов, используя какие-то другие клеточно-молекулярные механизмы. Во-вторых, собственно у раковых клеток могут быть особенности, из-за которых лимфоциты просто не могут их обнаружить.
Почему иммунные клетки начинают атаковать раковые? Потому что иммунные клетки чувствуют на поверхности раковых клеток особые молекулы, которые выдают раковые клетки с головой. Но особые раковые молекулы не появляются на поверхности клеток просто так. На днях мы писали о белках главного комплекса гистосовместимости (MHC), или человеческих лейкоцитарных антигенах (HLA), которые служат чем-то вроде клеточного паспорта: они сидят на клеточной мембране и держат на себе обломки разных клеточных белков.
Иммунные клетки проверяют, что держат на себе белки MHC: если они держат обломки обычных клеточных белков, то клетка здорова и трогать её не надо; если же они держат обломки вирусных или бактериальных молекул, то клетка инфицирована и её нужно уничтожить. И если белки MHC держат обломки других белков, которые присущи раковым клеткам, то такую клетку тоже нужно уничтожить.
Говорят, что белки MHC занимаются презентацией антигенов – молекул, на которые иммунная система может отреагировать. И если в генах MHC случается мутация, то они уже не могут показывать иммунным клеткам разные антигены, или показывают их плохо. Некоторые раковые клетки спасаются от иммунитета как раз благодаря тому, что в генах MHC у них мутированы.
Но рак поджелудочной железы в этом смысле особенный: мутации в генах MHC у него встречаются не более чем в 1% случаев, и одновременно в клетках рака поджелудочной в более чем 60% случаев уровень MHC ниже должного, или же MHC вовсе отсутствуют (что особенно заметно у метастазных клеток).
Исследователи из Нью-Йоркского университета пишут в Nature, что клетки рака поджелудочной избавляются от белков MHC с помощью важного клеточного процесса под названием аутофагия. С помощью аутофагии клетка переваривает ставшие ненужными белки и целые органеллы, чтобы из их запчастей снова сделать что-нибудь полезное (кстати, за расшифровку механизма аутофагии тоже дали Нобелевскую премию несколько лет назад). То, что нужно переварить, расщепить, разобрать на части, метится специальной меткой, после чего помеченный мусор упаковывается в мембранный пузырёк – аутофагосому; потом аутофагосома сливается с другим мембранным пузырьком – лизосомой, которой содержатся расщепляющие ферменты.
Если у подопытных мышей с раком поджелудочной аутофагию каким-то образом подавляли, то у мышей активировались Т-лимфоциты, задача которых была в истреблении раковых клеток – эти Т-лимфоциты массово приходили в опухоль, а если мышам ещё и давали иммунотерапевтические препараты, то болезнь у животных заметно отступала.
На самом деле, как пишет портал Nature, специалисты давно знали о том, что для рака поджелудочной железы аутофагия очень и очень важна; неясно было только, чем именно аутофагия так полезна именно раковым клеткам. Также сравнительно давно блокируют одну из стадий аутофагии; оба вещества, которые уже не одно десятилетие используют как средство от малярии, испытывали против злокачественных опухолей, но результаты тогда получались не слишком выдающиеся.
Возможно, что после новых данных интерес к противораковым свойствам хлорохина снова воскреснет, и рак поджелудочной железы можно будет успешно лечить иммунотерапевтическими методами, усиленными этим противомалярийным средством или же его аналогом.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
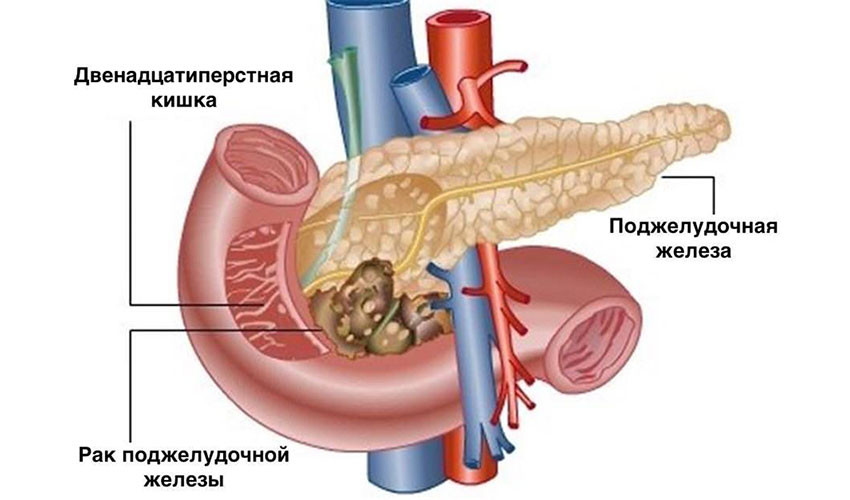
Хирургическое лечение
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар), оксалиплатин (Элоксатин), иринотекан (Камптозар), , цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.
Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.
Читайте также:





