Отдаленные последствия лечения злокачественных опухолей у детей
По мере того как все большее количество больных детского и юношеского возраста вылечивается от рака, ощущается все большая тревога по поводу проявления отдаленных последствий лечебных процедур. Ввиду важности этой проблемы для некоторых опухолей были даже пересмотрены схемы первичного лечения различных стадий заболевания.
При этом отдавалось предпочтение терапевтическим методам, которые при равной эффективности отличались меньшим риском развития отдаленных последствий. К числу наиболее существенных последствий лечения онкологических заболеваний детского возраста относятся влияние на рост, половую функцию и развитие вторичных раков.
При лечении острого лимфолейкоза с использованием химиотерапии и профилактического облучения области головы наблюдалось значительное снижение веса больных. Приостановка лечебных процедур позволяла больным снова набирать вес, хотя и в различном темпе.
Причины этого феномена точно не неизвестны, однако не вызывает сомнений, что в его основе лежит развитие дефицита ростового гормона и снижение реактивности шишковидного тела, которые происходят под влиянием химиотерапевтических препаратов.
У части детей, которым по поводу опухоли мозга назначали курс лучевой и химиотерапии, отмечалось большее отставание в росте, чем у тех, кто проходил только курс лучевой терапии. Неизвестно, какие из цитотоксических агентов способны вызывать нарушение роста.
Облучение эпифиза приводит к задержке роста кости в месте облучения. Величина дозы, способная вызвать подавление роста эпифиза, точно не известна, однако в большинстве случаев после проведения лучевой терапии рост эпифизов прекращается.
У маленьких детей это приводит к неравномерному росту конечностей, порокам развития позвоночника (например, после лучевой терапии болезни Ходжкина) или к ассиметрии грудной клетки, головы или шеи.
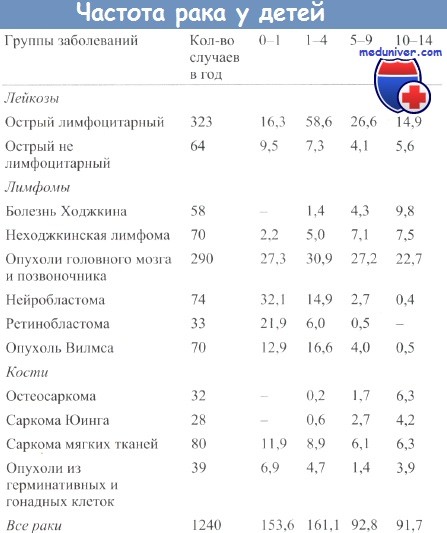
Среднегодовое число зарегистрированных случаев рака в Великобритании, и заболеваемость на 1 млн населения по каждой возрастной группе.
У детей с опухолью мозга, леченых нитрозомочевиной и прокарбазином, часто наблюдается дисфункция гонад. Хотя процессы полового созревания протекают нормально, уровень фолликулостимулирующего гормона остается высоким (в меньшей степени это проявляется для лютеинизирующего гормона). Впоследствии у мальчиков развиваются маленькие яички и устойчивая олигоспермия. У девочек функция яичников возвращается к норме и фертильность не нарушается. Неизвестно, наступает ли у них ранняя менопауза.
При использовании некоторых схем лучевой терапии острых лимфолейкозов, облучение позвоночника может приводить к дисфункции или яичников, или яичек.
Если мальчиков не лечили алкилирующими агентами, то у них отмечалось гораздо меньшее поражение клеток герминогенного эпителия. При лечении болезни Ходжкина мустином, винкристином (онковином), преднизолоном и прокарбазином, как правило, развивается устойчивая олигоспермия и увеличивается уровень фолликулостимулирующего гормона. Если лечение проводится в препубертатном периоде, то эти нарушения проходят быстрее.
Для детского возраста из-за большой продолжительности периода риска возможность развития вторичных раков после лечения имеет особое значение. Одним из наиболее распространенных вторичных раков радиогенного происхождения является саркома костей, обычно остеосаркома.
Относительный риск развития саркомы зависит от первичного диагноза. В большинстве случаев саркома развивается на местах, которые подвергались облучению (хотя это не всегда наблюдается при наследственных ретинобластомах).
После проведения химиотерапии может развиться острый нелимфобластный лейкоз. Наииболее вероятно, что лейкоз вызвают алкилирующие агенты — этопозид и нитрозомочевины. После лечения болезни Ходжкина (с применением лучевой терапии) отмечается более высокий риск развития вторичных раков. Лейкозы часто развиваются после лечения опухолей головного мозга.
Вообще говоря, по данным исследований The Late Effects Study Group относительный риск развития лейкозов увеличился в 14 раз. Согласно последним данным из той же группы, увеличилось число случаев солидных опухолей, особенно рака легкого. Примерно в двуз из трех случаев он развивался у больных, которых лечили методами лучевой и химиотерапии, причем, в основном, это были женщины.
В потомстве лиц, вылечившихся от детских раков, не наблюдается увеличения онкологической заболеваемости. В то же время, остается повышенным риск развития рака у детей, родившихся от родителей, вылечившихся от наследственных раков, например от ретинобластомы.

Какой прогноз на выздоровление у малышей? Если в семье заболел один ребёнок, есть ли риск возникновения рака у его братьев или сестёр?
Чудо? Зафиксируйте!
Маргарита Белогурова: Больше всего детей заболевают на первом году жизни. Далее заболеваемость падает – и второй пик приходится на подростковый возраст. Больше всего маленьких пациентов с острым лимфобластным лейкозом (рак крови), с опухолями центральной нервной системы (главным образом с опухолями головного мозга) и лимфомами (заболевания лимфатической ткани).

– С какими заболеваниями детские онкологи уже научились справляться?
– Прорыв в лечении детей со злокачественными новообразованиями произошёл в 90‑е годы прошлого века, когда в Россию пришли западные протоколы и методы интенсивного лечения детских опухолей. Сегодня в крупных центрах онкологи достигли впечатляющих результатов лечения: при лимфобластных лейкозах – 80% излечения, при некоторых его видах – больше 90%, при лимфоме Ходжкина – почти 95%, при опухоли Вилмса (почки) – почти 90%.
– Правда ли, что шанс на излечение у детей выше, чем у взрослых?
– У детей другая биология опухолей, благодаря которой эти опухоли хорошо отвечают на лечение. Поэтому прогнозы на излечение от рака у детей более благоприятные. Нередко мы видим, что детская опухоль (даже на запущенной четвёртой стадии заболевания, с распространёнными метастазами) тает, как снег, буквально на глазах. И речь идёт не о продлении жизни (как у взрослых), а о полном излечении от рака.
У детей также фиксируются случаи спонтанного исцеления от рака. Например, если ребёнок заболел нейробластомой до года, есть вероятность того, что опухоль исчезнет независимо от того, лечили его или нет. Такое чудо происходило в практике любого детского онколога, в том числе и в моей. Все они описаны, задокументированы и подтверждены снимками и результатами исследований.

Родные в группе риска
– Если ребёнок благополучно вылечился, могут ли родители выдохнуть и навсегда забыть о болезни?
– Это зависит от того, чем ребёнок болел. Например, если ребёнок вылечился от лимфомы Беркитта и с момента выздоровления прошёл год – о болезни можно забыть, поскольку рецидивов после года этой агрессивной опухоли не бывает. После опухоли костей выдохнуть можно только спустя 6–8 лет. Однако нужно помнить, что онкологи лечат ребёнка, который растёт, тяжёлыми препаратами, негативно влияющими на сердце, почки, рост, половое развитие. Поэтому наши пациенты нуждаются в пожизненном наблюдении. В первые годы оно нужно, чтобы вовремя выявить и ликвидировать рецидив, в последующие – чтобы своевременно корректировать возможные последствия перенесённого лечения.

– На родительских форумах самая обсуждаемая тема – вероятность возникновения рака у родных братьев и сестёр заболевшего ребёнка?
– Раньше мы успокаивали родителей, говоря, что в одну воронку бомба два раза не падает. Современные исследования показывают, что раковые бомбы – исключение. Поскольку рак – болезнь генов, то чем ближе генетический материал детей, тем выше вероятность того, что болезнь возникнет и у другого ребёнка. Наивысшая степень риска у близнецов. У родных братьев и сестёр заболевшего ребёнка вероятность возникновения рака на 25% выше, чем в семьях, где нет онкобольных. Наблюдаться у врача они тоже должны пожизненно, поскольку рак может возникнуть не только в детстве, но и спустя 20–40 лет.

Везде и повсеместно
– Везде ли врачи лечат одинаково успешно? Зависит ли прогноз на выздоровление от места, где ребёнок живёт?
– Если наш пациент живёт там, где у него нет возможности полноценно лечиться (а центров, где представлены не все спектры возможностей современной онкологии в России, к сожалению, немало), то местные врачи должны отправить его в федеральную клинику. Другое дело, что из-за нехватки мест там его могут не принять на лечение. Но даже в таких случаях ребёнок возвращается на лечение по месту жительства с конкретными рекомендациями, а процесс контролируется врачами из федеральной клиники.
Кстати, федеральные центры в Москве и Санкт-Петербурге не берут на лечение местных малышей, поскольку нацелены на лечение детей из регионов. Но всех они принять, к сожалению, не могут.

– Когда говорят, что в России лечат так же и с тем же результатом, что и на Западе, это часто воспринимается как лукавство.
– Между тем это правда. В России лечат по западным протоколам и теми же лекарствами, что и в европейских и американских клиниках. Поэтому результаты лечения полностью сопоставимы. Другое дело, что это хрупкое равновесие. Если лекарства наших пациентов попадут под ответные санкции и мы будем вынуждены работать с неизвестными препаратами, удержать эту планку нам вряд ли удастся.
Почему у детей возникает рак?
У детей опухоли преимущественно эмбриональной природы. Если при закладке произошёл какой-то сбой или ошибка (порок сердца, неопущение яичка, удвоение почки) или ребёнок – носитель патологического гена, за ним нужно пристально следить: вовремя проходить врачей-специалистов (узкие специалисты знают ассоциативные связи патологии и видов опухолей) и дважды в год делать УЗИ.
Нефробластома, или опухоль Вилмса – опухоль почки, составляет 6% от всех злокачественных опухолей детского возраста. Опухоль названа по фамилии немецкого хирурга Макса Вильмса, впервые описавшего это заболевание в конце XVIII века.
Стандартом в лечении нефробластомы является комплексный подход: химиотерапия, туморнефроуретерэктомия и лучевая терапия. Прогноз заболевания при современных подходах к терапии благоприятный: выживаемость достигает 80%.
Распространенность нефробластом у детей
- Нефробластома – врожденная эмбриональная злокачественная опухоль почки.
- Заболеваемость составляет 1:100000 детей в возрасте до 14 лет.
- Опухоль выявляется преимущественно в возрасте 1-6 лет.
- Нет различий заболеваемости по полу.
- В 5% случаев наблюдаются двусторонние нефробластомы.

Точные причины возникновения опухоли Вильмса не установлены. Предполагается связь развития заболевания с мутацией в гене 1 опухоли Вильмса (WT 1), расположенного на 11 хромосоме. Этот ген важен для нормального развития почек и любые поломки в нем могут приводить к возникновению опухоли либо других аномалий развития почек. В 12-15% случаев опухоль Вильмса развивается у детей с врожденными аномалиями развития. Чаще всего имеют место аниридия (отсутствие радужной оболочки), синдром Беквита-Видемана (висцеропатия, макроглоссия, пупочная грыжа, грыжа белой линии живота, олигофрения, микроцефалия, гипогликемия, постнатальный гигантизм), урогенитальные аномалии, синдром WAIR (опухоль Вильмса, аниридия, мочеполовые аномалии, олигофрения), синдром Дениса-Драша (Опухоль Вильмса, нефропатия, аномалия гениталий, задержка роста, аномалии ушной раковины).
Классификация опухолей почек у детей
Существует гистологическое и клиническое стадирование опухоли Вильмса:
I) Гистологическое стадирование по Smidt/Harms проводится после удаления новообразования и предусматривает выделение 3х степеней злокачественности, влияющих на прогноз заболевания (низкой, средней и высокой) в зависимости от строения опухоли.
II) Клиническое стадирование
В настоящее время используют единую систему стадирования нефробластомы, которая является определяющей для лечения:
I стадия – опухоль локализуется в пределах почки, возможно полное удаление
II стадия – опухоль распространяется за пределы почки, возможно полное удаление, в т.ч.:
- прорастание капсулы почки, с распространением в околопочечную клетчатку и/или в ворота почки,
- поражение регионарных лимфатических узлов (стадия II N+),
- поражение внепочечных сосудов,
- поражение мочеточника
III стадия — опухоль распространяется за пределы почки, возможно неполное удаление, в т.ч.:
- в случае инцизионной или аспирационной биопсии,
- пред- или интраоперационный разрыв,
- метастазы по брюшине,
- поражение внутрибрюшных лимфоузлов, за исключением регионарных,
- опухолевый выпот в брюшную полость,
- нерадикальное удаление
IV стадия – наличие отдалённых метастазов
V стадия – двусторонняя нефробластома
Классификация нефробластомы по системе TNM в настоящее время сохраняет, в основном, историческое значение и в клинической практике не используется.
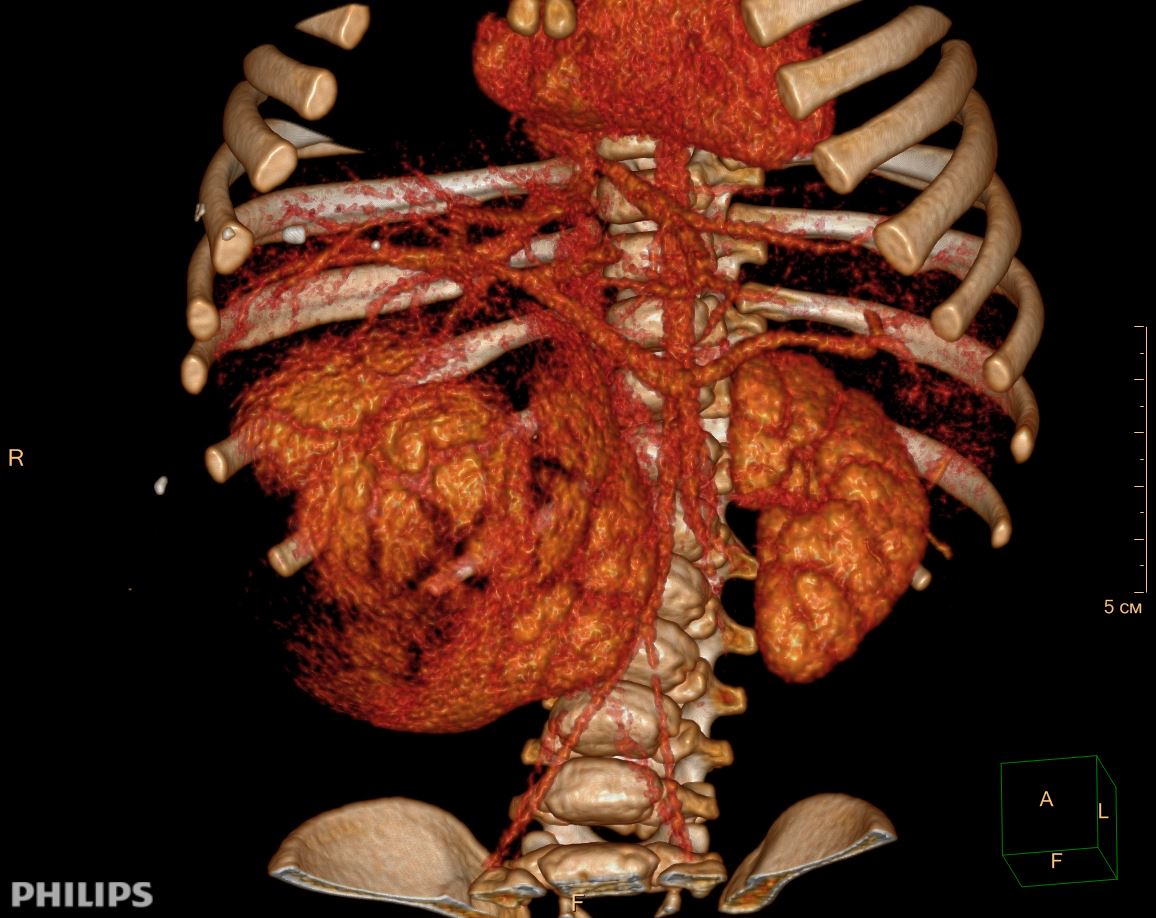
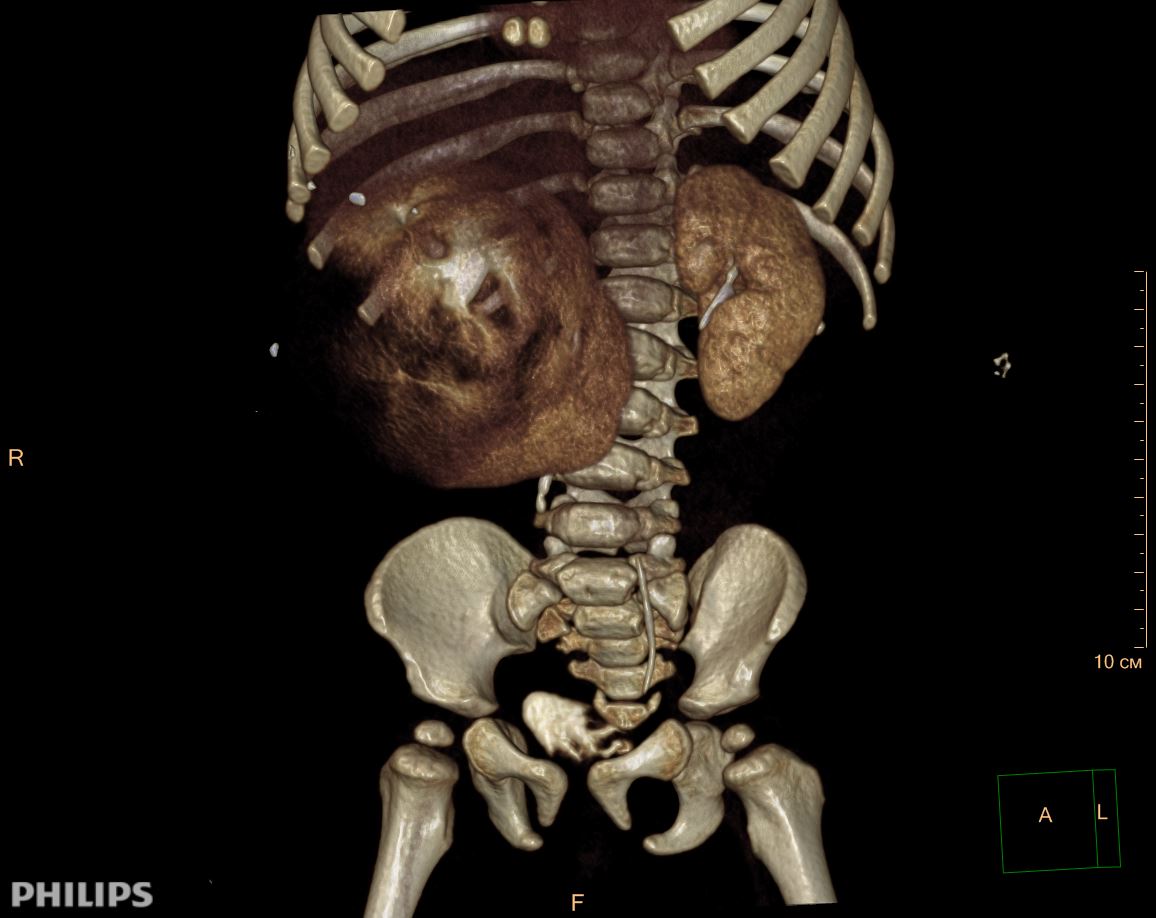
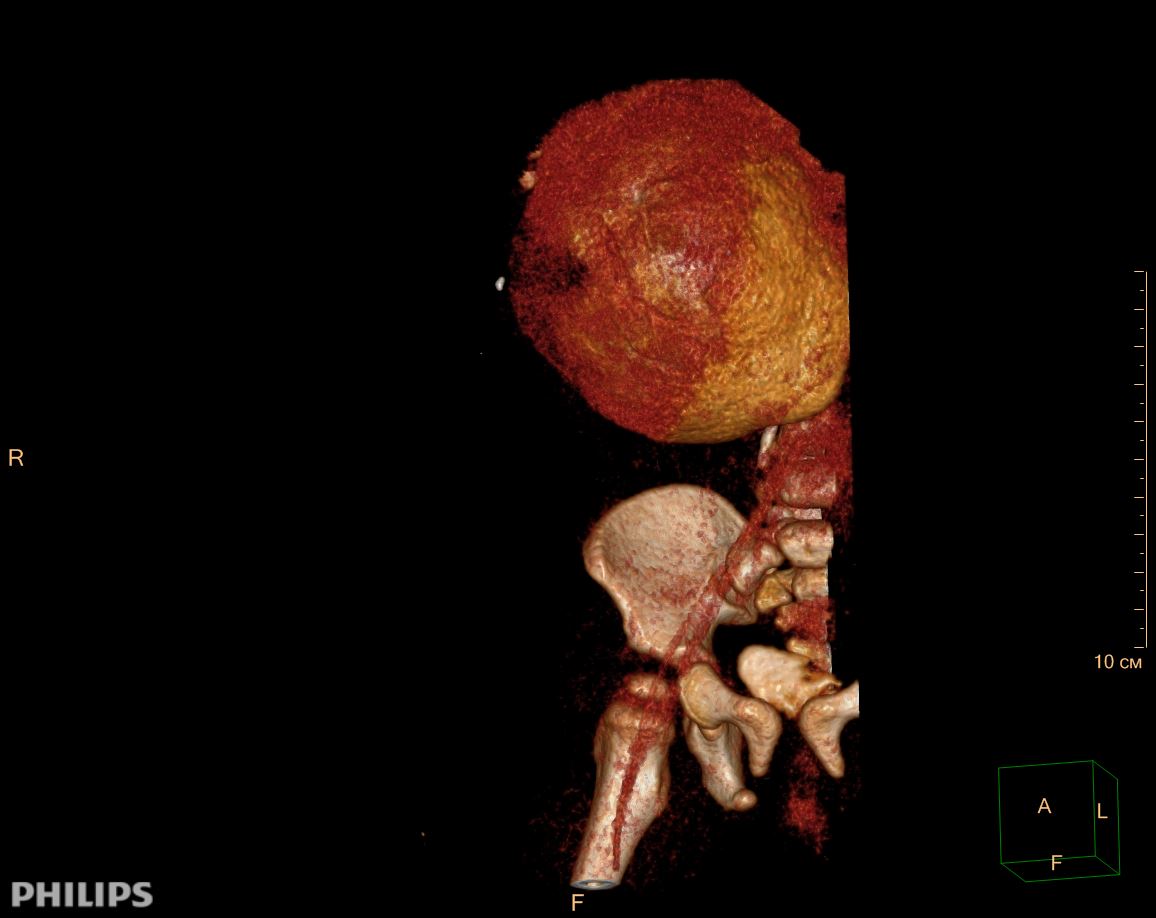
3D-реконструкции опухоли Вильмса пациентов детского отделения НМИЦ онкологии им. Н.Н. Петрова
Клинические симптомы опухоли почки у детей
Нефробластома может длительное время протекать бессимптомно. Первым признаком заболевания, который замечают родители, является увеличение размеров живота. Иногда ребенок жалуется на боли в животе. При микроскопическом исследовании мочи можно выявить микрогематурию.

Диагностика нефробластомы
Диагностические мероприятия при подозрении на опухоль Вильмса направлены, в первую очередь, на морфологическую верификацию диагноза и определение степени распространенности процесса в организме.
Основными инструментальными методами в диагностике опухоли почек у детей и подростков являются:
- УЗИ органов брюшной полости и забрюшинного пространства.
- Компьютерная томография органов брюшной полости и забрюшинного пространства с оральным и внутривенным контрастированием.
- Магнитно-резонансная томография брюшной полости и забрюшинного пространства без и с контрастным усилением (даёт дополнительную информацию о распространённости и связи опухоли с окружающими органами).
- Радиоизотопное исследование почек – реносцинтиграфия позволяет оценить как суммарную функцию почек, так и отдельно функцию каждой из них.
- Для исключения метастатического поражения легких проводятся рентгенография и компьютерная томография органов грудной клетки.
Лабораторные исследования являются рутинными и включают в себя: клинический анализ крови, общий анализ мочи, биохимический анализ крови.
Непременным условием для постановки диагноза является выполнение тонкоигольной аспирационной биопсии опухоли под УЗИ-навигацией с проведением цитологического исследования полученного материала.
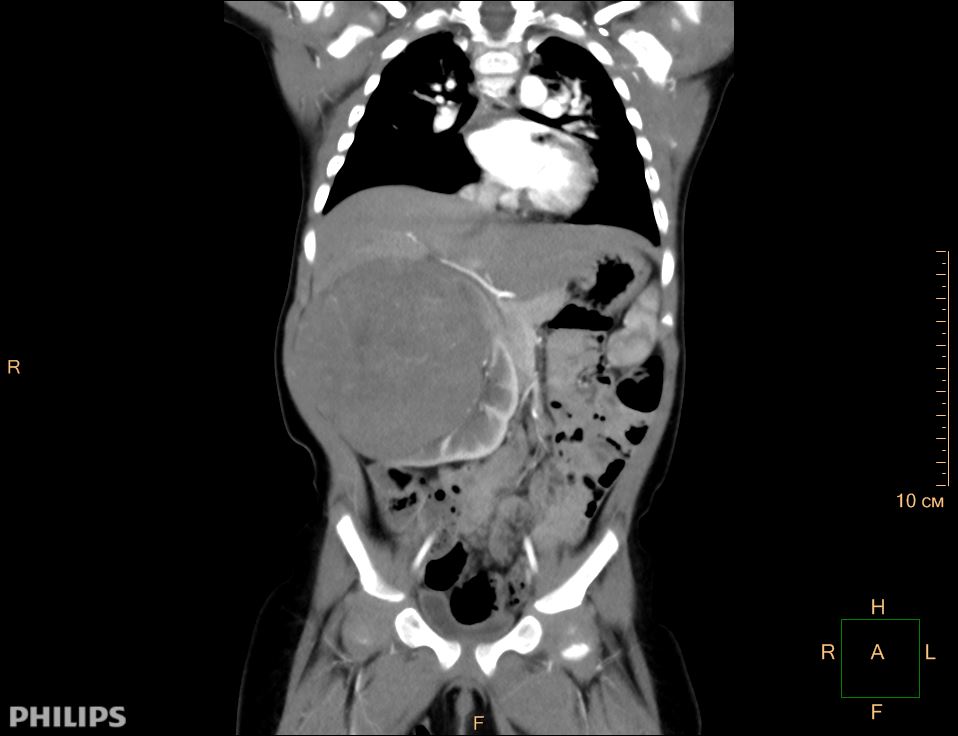
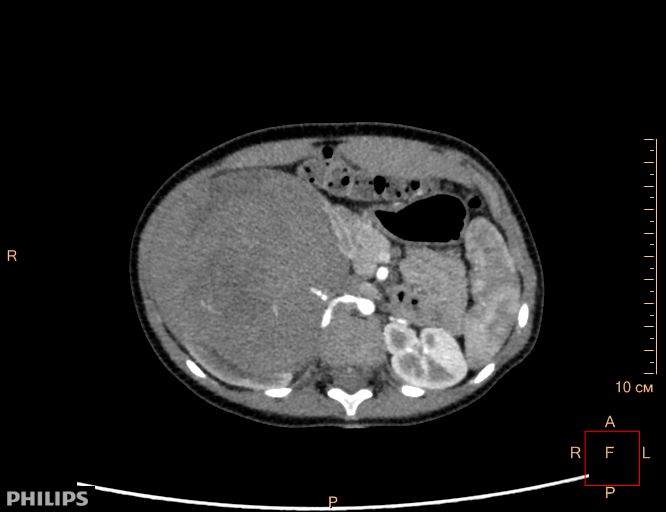
Опухоль Вильмса. Компьютерная томография
Общие принципы лечения опухолей почки у детей и подростков
Лечение нефробластомы у детей осуществляется по стандартным методикам, принятым в европейских странах, и включает в себя проведение неоадьювантного курса полихимиотерапии, операции – туморнефроуретерэктомии, послеоперационной химиотерапии и, по показаниям, лучевой терапии.
Предоперационный курс химиотерапии длится от 4-х до 6-ти (при IV стадии) недель. Задача терапии – максимальное уменьшение размеров опухоли с целью предотвращения ее интраоперационного разрыва и достижения максимальной резектабельности. Базовыми препаратами, используемыми в данном курсе, являются винкристин и дактиномицин.
Оперативный этап лечения опухоли почки заключается в радикальном одномоментном удалении всей ткани опухоли. Туморнефроуретерэктомию проводят из срединного доступа. Обязательной является ревизия печени, контралатеральной почки и регионарных лимфатических узлов.
Послеоперационная химиотерапия проводится после разделения больных на группы риска в соответствии с гистологической структурой опухоли и стадии заболевания.
Лучевая терапия проводится параллельно послеоперационной полихимиотерапии, начинается на 2-3 неделе после удаления опухоли. Длительность лучевой терапии составляет 7-10 дней. Объем облучения зависит от результатов операции.
Показаниями к послеоперационной локальной лучевой терапии с облучением ложа опухоли являются:
- Стандартный риск нефробластомы, III стадия.
- Высокий риск, стадия II и стадия III
- Стадия IV и V – в зависимости от локальной стадии.
Диспансерное наблюдение при нефробластомах
Наблюдение за излеченными пациентами осуществляется для выявления рецидива и отдаленных последствий лечения.

В течение первых двух лет после окончания терапии пациенты обследуются каждые три месяца. Далее, до достижения пятилетнего срока наблюдения – каждые 6 месяцев. В алгоритм обследования включаются: УЗИ органов брюшной полости, рентгенография органов грудной клетки при каждом визите. При необходимости дополнительно рекомендуются проведение исследования функции почки (анализ мочи, биохимическое исследование крови, ренография), углубленное исследование сердечно-сосудистой деятельности (ЭКГ, ЭХО-КГ), исследование слуха методом аудиометрии.
После пяти лет наблюдения пациенты обследуются не чаще одного раза в год.
Все дети, закончившие программное лечение, могут продолжить посещение организованных детских коллективов (школа, детский сад).

Авторская публикация:
КУЛЕВА СВЕТЛАНА АЛЕКСАНДРОВНА
заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, доктор медицинских наук
К ранним побочным эффектам лечения опухолей у детей относятся метаболические нарушения, угнетение кроветворения и нарушение иммунитета. Одновременная гибель большого количества клеток при крупных опухолях сопровождается нарушением функции почек вследствие образования кристаллов мочевой кислоты в почечных канальцах, что наиболее характерно для больных с лейкозом или лимфомами (в том числе с лимфомой Беркитта), но бывает и при солидных опухолях (гепатобластома, герминогенная опухоль или нейробластома).
Перед началом лечения важно определить уровень мочевой кислоты и креатинина в крови, а при необходимости назначить инфузионную терапию и ингибиторы ксантиноксидазы (аллопуринол). При синдроме распада опухоли гибель опухолевых клеток приводит к массивному выходу в кровеносное русло фосфатов и калия. При нарушенной функции почек развивается симптоматическая гиперкалиемия и гиперфосфатемия, а впоследствии — гипокальциемия.
Лихорадка у ребенка с лейкопенией служит показанием к его госпитализации в стационар и внутривенному введению антибиотиков широкого спектра действия до выявления специфического возбудителя и его чувствительности к конкретным антибиотикам (см. т. 3, гл. 232). Лечение продолжают до тех пор, пока не исчезнет лихорадка и не нормализуется уровень лейкоцитов. Лихорадка в течение 1 нед. и более на фоне терапии антибиотиками широкого спектра действия свидетельствует о возможности развития инфекции. У детей с иммунодефицитом наиболее распространена грибковая инфекция, вызванная Aspergillus и Candida. Оппортунистические инфекции (например, Pneumocystis carinii) способны вызвать пневмонию со смертельным исходом.
При возможном иммунодефиците детям с профилактической целью назначают триметоприм/сульфаметоксазол (бисептол).
В условиях иммунодефицита, обусловленного злокачественным новообразованием или его лечением, возможно развитие тяжелых вирусных инфекций. Живые противовирусные вакцины детям обычно не назначают. Если в процессе химиотерапии ребенок контактировал с человеком, больным ветряной оспой, ему проводят иммунизацию иммуноглобулином против вируса varicella-zoster. При развитии клинической картины ветряной оспы больного госпитализируют и внутривенно вводят ацикловир.
Крайне важно адекватное обезболивание пациентов. Лечение болевого синдрома при злокачественных новообразованиях изложено в соответствующем руководстве ВОЗ.
В процессе противоопухолевого лечения дети теряют до 10 % массы тела в связи с ограниченным потреблением пищи из-за тошноты, стоматита или рвоты. Следует помнить, что потерю аппетита не рассматривают в качестве опасного признака заболевания. Истощение особенно вероятно у детей, получавших химиотерапию на область брюшной полости, головы, шеи, а также при высокодозной химиотерапии или облучении всего тела до трансплантации костного мозга. В ряде случаев детям назначают зондовое либо парентеральное питание.
Поражение здоровых тканей в условиях сниженного потенциала репарации приводит к длительному нарушению функции тех или иных органов. Так поражение сердца вследствие применения антрациклинов способствует нарушению сократительной функции миокарда, а лейкоэнцефалопатия как следствие интратекального введения метотрексата либо облучения ЦНС в большинстве случаев обратима лишь частично.
Поздние побочные эффекты противоопухолевого лечения способны существенно нарушать качество жизни. Резекция новообразования, а также высокодозная лучевая терапия могут в итоге привести к ограничению или потере функции ряда органов. Некоторые последствия лучевой терапии, например неодинаковая длина конечностей, проявляются только у взрослого. Облучение эндокринных органов способно привести к гипотиреозу, недостаточности функции гипофиза либо бесплодию. Облучение черепа в достаточных дозах приводит к неврологическим нарушениям, а поражение позвоночника — к задержке роста.
Необратимое поражение внутренних органов возможно и при химиотерапии. Особое внимание следует обращать на лейкоэнцефалопатию, вызванную метотрексатом в высоких дозах, бесплодие у юношей под действием циклофосфамида, пневмо-склероз при лечении блеомицином, панкреатит под действием аспарагиназы, нарушение функции почек под влиянием ифосфамида, нитрозомочевины и препаратов платины, а также потерю волос как следствие лечения цисплатином. Развитие указанных симптомов зависит от дозы препарата и в большинстве случаев необратимо. До начала и в процессе лечения крайне важно оценивать функцию указанных выше органов.
Возможно, одно из самых тяжелых осложнений — развитие второго злокачественного новообразования после успешного лечения первого. Риск этого осложнения повышается каждый год на 0,5 %, достигая 12 % через 25 лет после лечения. Лица, лечившиеся от рака в детском возрасте, должны осматриваться ежегодно на возможность поздних побочных эффектов лечения, в том числе развития других злокачественных новообразований.
На всех этапах злокачественного процесса основным принципом паллиативного лечения служит облегчение боли и страданий ребенка, а также обеспечение его всесторонней поддержки. Боль — довольно распространенная жалоба детей со злокачественными новообразованиями; боль может вызвать сдавление и нарушение проходимости органа, метастазы в костной ткани, а также органическое поражение нервных сплетений. Согласно рекомендациям ВОЗ, лечение болевого синдрома должно включать несколько этапов. В каждом случае необходим выбор адекватного препарата, его дозы и пути введения.
При постоянной боли в дополнение к плановым введениям должно быть предусмотрено введение дополнительных препаратов при усилении боли. Профилактика и лечение побочных эффектов лечения в ряде случаев предполагает значительное снижение дозы анальгетиков.
Лечение умирающих заключается в смягчении страданий самого ребенка и родителей. В данной ситуации важно следовать пожеланиям семьи с учетом клинических, культурных и этических особенностей конкретного случая.
Статистика
Общая заболеваемость злокачественными опухолями у детей относительно невелика и составляет примерно 15 случаев на 100 000 детей. Это означает, что заболеть раком за период детства рискует один ребёнок из 450, в то время как у взрослых этот показатель в десятки раз выше. Среди общего количества больных злокачественными новообразованиями дети до 15 лет составляют не более 2%. Тем не менее сегодня в России ежегодно выявляется 4,5 - 6,5 тысяч детей со злокачественными опухолями. По статистике Всемирной организации здравоохранения, рак - вторая по частоте причина смертности у детей после насильственной смерти (травматизм, убийства, самоубийства).
К счастью, более 70-80% детских онкологических заболеваний излечимы. Это связано с особенностями физиологии и гистологии встречающихся в детском возрасте опухолей.
Причины рака у детей
Причиной любого онкологического заболевания является генетическая поломка в одной из клеток, которая приводит к неконтролируемому росту и размножению опухолевой ткани. Однако если у взрослых, мы можем выделить ряд факторов риска, которые могут привести к подобным мутациям, то в случае детей причиной рака являются небольшие генетические аномалии, переданные ему от родителей. Такие аномалии есть у большинства из нас, только не все они приводят к развитию опухолей. Факторы риска, действующие на самого ребёнка (радиация, курение, неблагоприятная экологическая обстановка) не имеют столь большого значения.
Следует помнить, что многие генетические заболевания, такие как синдром Дауна или синдром Кляйнфельтера, анемия Фанкони ассоциированы с повышенным риском развития онкологических заболеваний.
Классификация онкологических заболеваний.
Наиболее часто дети болеют раком кроветворных органов (лейкозы, злокачественные лимфомы, лимфогранулематоз) - 70%. Эти опухоли называют гемобластозами. Реже встречаются опухоли центральной нервной системы, костей и мягких тканей. Наиболее редкими являются "взрослые" формы рака - 3% (опухоли кожи, полых органов и др.).
Диагностика рака у детей
Сложность диагностики рака у детей заключается в том, что во многих субъективное самочувствие ребенка может оставаться удовлетворительным даже на поздних стадиях заболевания. Часто опухоли обнаруживаются случайно, при профилактическом обследовании. Именно поэтому регулярные диспансеризации так важны. При подозрении на онкологическое заболевание педиатр направляет ребенка на проведение дополнительных анализов и исследований.
Окончательный диагноз в большинстве слкчаев устанавливается после проведения биопсии. Биопсия – это небольшая операция, при которой отделяют участок опухолевой ткани для проведения гистологического исследования. По результатам биопсии уточняют вариант опухоли и определяют стадию заболевания. От стадии зависит выбор метода лечения. При опухолях кроветворных органов такой биопсией является пункция костного мозга.
Лечение
Лечением злокачественных опухолей у детей занимаются детские онкологи и онкогематологи. Лечение злокачественных опухолей проводится в специализированных онкологических (онкогематологических) отделениях крупных детских больниц и в специализированных НИИ. После выписки из стационара, ребенок наблюдается у онколога детском отделении онкологических диспансеров. Для лечения рака кроветворных органов детские онкогематологи используют консервативную терапию - химиотерапию и лучевую терапию. При лечении всех остальных видов рака у детей (так называемые солидные опухоли), кроме того, используется хирургический метод.
Современное лечение проводится по международным программам - протоколам лечения, разработанным для каждого заболевания. Отступление от протокола ведёт к ухудшению результатов лечения. Возможность полного излечения обеспечивает высокая чувствительность опухолей детского возраста к цитостатическим агентам.
После основного курса лечения пациенты нуждаются в длительной поддерживающей терапии и реабилитации. В этот момент ответственность за состояние ребенка и уход за ним целиком ложится на плечи родителей. От скрупулезности выполнения всех рекомендаций врача во многом зависят результаты лечения.
Необходимость применения множества дорогостоящих препаратов и методов лечения превратила детскую онкологию в наиболее инвестируемую область педиатрии. Ежегодно на счета детских онкологических центров и благотворительных фондов сотни людей перечисляют денежные средства. Кроме того, пациенты получающие химиотерапию нуждаются в регулярных трансфузиях препаратов крови. Именно поэтому средства массовой информации пестрят заметками о безвозмездном донорстве. К счастью, сотни людей ежедневно сдают кровь и помогают врачам в лечении маленьких пациентов.
Читайте также:

