Основные методы лечения злокачественных опухолей челюстно-лицевой области
Лечение доброкачественных опухолей ЧЛО в основном проводится в стационарных челюстно-лицевых отделениях городских или областных стационаров. Основным методом лечения является хирургическое удаление в пределах здоровых тканей. При необходимости выполняется одномоментное или отсроченное устранение пострезекционного дефекта.
Специальное противоопухолевое лечение злокачественных новообразований проводится в онкологических диспансерах или Республиканском научно-практическом центре онкологии и медицинской радиологии им.Н.Н.Александрова. Основные методы лечения злокачественных опухолейЧЛО: хирургический илучевой. Противоопухолевая химиотерапия используется в качестве вспомогательного метода.
Хирургическое вмешательство по поводу злокачественных опухолей предполагает удаление фрагмента тканей с отступлением от краев патологического очага не менее 1-2 см с соблюдением основных принципов абластики и антибластики. Контроль радикальности операции в настоящее время проводится путем гистологического исследования краев резекции. После таких вмешательств, как правило, образуются значительные изъяны мягких тканей и/или костей, нарушается функция мышц, изменяется внешность пациента. Пластическое замещение дефекта производится одномоментно или спустя некоторое время, порой в несколько этапов. При наличии метастазов в шейных лимфатических узлах выполняют удаление шейной клетчатки в пределах фасциальных футляров.
Лучевое лечение проводится в виде дистанционного облучения или внутритканевой терапии. Воздействие осуществляется непосредственно на опухоль, прилежащие ткани и зоны регионарного метастазирования. Этот метод лечения позволяет сохранить целостность тканей. Побочный эффект облучения - снижение секреторной функции слюнных желез, нарушение микроциркуляции в тканях.
При лечении злокачественных опухолейЧЛО осуществляется воздействие как на первичный очаг опухоли, так и на зоны возможного регионарного метастазирования. План лечения составляют строго индивидуально с учетом гистологического строения опухоли, стадии, локализации и общего состояния больного. В настоящее время применяется система протоколов. Суть ее состоит в том, что для каждого варианта распространенности и локализации процесса предусматривается типовая схема лечения, которая может включать один или несколько методов в строгой последовательности. Если опухоль характеризуется высоким риском рецидива, проводится лечение с применением двух или трех методов; если существует высокий риск метастатического поражения, проводится профилактическое воздействие на зоны предполагаемого метастазирования. При большинстве злокачественных опухолей ЧЛО I-II стадии применяют лучевое или хирургическое лечение, реже - оба метода последовательно; при опухолях III-IV стадии лечебная схема может включать операцию и последующую химиотерапию и лучевую терапию, реже - курсы химиотерапии и лучевое лечение.
Основные направления повышения эффективности лечения опухолей ЧЛО - своевременная диагностика новообразований, совершенствование техники лучевой терапии, послелечебная реабилитация пациентов.
Классификация новообразований челюстно-лицевой области
Новообразования в ЧЛО классифицируют по нескольким признакам. Выделяют истинные опухоли, кисты, опухолеподобные образования. По клиническому признаку поражения подразделяют на два вида:
- Доброкачественные. Клетки видоизменяются и делятся неконтролируемо, при этом частично сохраняют функции. Растут медленно, сдавливают соседние органы, но поддаются лечению.
- Злокачественные. Наблюдается аномальное и интенсивное деление клеток, причину которого установить довольно сложно. Новообразование быстро прорастает в соседние органы, затрагивает сосуды кровеносной и лимфатической систем. Прогноз в запущенных случаях неблагоприятный.
Доброкачественные опухоли ЧЛО
Основное отличие доброкачественных состояний от онкологических заболеваний:
- нередко бывают врожденными, возникают вследствие аномалий внутриутробного развития;
- обычно не метастазируют;
- растут медленно, иногда в отдельной капсуле, которую хирурги удаляют;
- подвижны при локализации в мягких тканях;
- могут озлокачествляться.
В стоматологии диагностируют такие формы поражений костных тканей ЧЛО:
В мягких тканях диагностируют:
- Липомы. Имеют форму шара или овала, образуются в жировой ткани. Они находятся в отдельной капсуле, которая подлежит хирургическому удалению.
- Фибромы. Аномалии с широким основанием поражают соединительные ткани и располагаются во рту, в толще мягких тканей лица.
- Гемангиомы. Доброкачественные поражения, которые имеют вид сконцентрированных в одной области кровеносных капилляров.
- Лимфангиомы. Имеют врожденную природу, локализуются в толще языка или губ.
Раковые новообразования
Раковые поражения ЧЛО отличают:
- наличие анаплазии – состояния клетки, при котором невозможно определить ее происхождение;
- новые клетки наследуют свои качества от предыдущих;
- метастазирование, когда границы между нормальными и патологическими клетками определить невозможно;
- угнетение клеточного и гуморального иммунитета.
При онкологии пациенты жалуются на то, что челюсть опухла и болит внутри. Для диагностики врач проводит осмотр, направляет на рентген, компьютерную томографию и биопсию. По результатам устанавливается вид патологии и назначается терапия.
Опухолеподобные образования
К приобретенным опухолеобразным образованиям относят папилломы и атеромы. Папилломы локализуются в области альвеолярного отростка, на внутренней слизистой оболочке щек. Атеромы – это кисты сальных желез ретенционного типа. К врожденным относят кисты дермоидного и эпидермоидного типа. Они обладают четкими границами и округлой формой, редко вырастают до значительных размеров. Лечение подбирается в зависимости от характера патологии. Обычно это хирургическое вмешательство, после которого риск рецидивов минимален.
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ
Злокачественные новообразования неэпителиального происхождения чаще всего представлены различными вариантами сосудистых опухолей (лимфома, гемангиома, гемангиолимфома).
Среди злокачественных опухолей из эпителия преобладает плоскоклеточный рак, как правило, ороговевающий, т. е. высокодифференцированный, реже — низкодифференцированный или анапластического строения. В области корня языка, там, где есть железистый эпителий, иногда встречаются аденокарциномы.
Хирургическое лечение. Развитие способов хирургического лечения рака органов лица и полости рта на протяжении XVII—XIX веков и первых десятилетий нашего столетия осуществлялось главным образом на основе клинического опыта, прежде всего за счет совершенствования доступов оперативного вмешательства.
В связи с частым рецидивированием рака полости рта даже при использовании наружных доступов развитие хирургического лечения злокачественных опухолей этих локализаций основывалось главным образом на увеличении объема вмешательства. Однако, с одной стороны, увеличение объема операции не могло быть бесконечным, так как чрезмерно обширные операции нефизиологичны, с другой — даже значительное увеличение объема операции не всегда обеспечивает необходимый радикализм хирургического вмешательства.
Лучевое лечение. С открытием в конце XIX века рентгеновских лучей и лучей радия совпало начало применения в лечении больных с опухолями лучевой терапии. В 1902 г. рентгеновские лучи были впервые использованы при лечении рака языка. Результат был отрицательным. Впоследствии в связи со сравнительно небольшой величиной энергии р-частиц, поток которых образует рентгеновское излучение, рентгенотерапия как самостоятельный способ лечения сохранила свое значение только при раке кожи, красной каймы губ, т. е. при поверхностно располагающихся злокачественных опухолях.
На рубеже первых двух десятилетий XX столетия в клиническую практику вошел другой способ лучевой терапии — теле-кюритерапия, основанная на облучении опухоли с помощью потока α- и γ-частиц, обладающих большим запасом энергии и способностью проникать в биологические ткани на значительную глубину. В нашей стране методика такого облучения впервые была детально описана в 1932 г. Н. Н. Петровым. В эти же годы развивалась внутритканевая кюритерапия, основанная на обкалывании тканей в области расположения опухоли иглами, содержащими препарат радия. В дальнейшем совершенствование способа телегамматерапии происходило за счет внедрения в практику мощных гамматронов, улучшения конструктивных особенностей игл для внутритканевой кюритерапии, использования, кроме радия, и других радиоактивных изотопов (кобальт и др.).
За последние годы в различных странах в связи с усовершенствованием аппаратуры и получением возможности осуществлять внутриполостную близкофокусную рентгенотерапию при лечении рака слизистой оболочки полости рта сложилась практика использования сочетанной лучевой терапии. Наружное дистанционное глубокое облучение проводится с помощью телегамматерапевтических установок. Оно дополняется внутри-ротовой близкофокусной рентгенотерапией первичной опухоли полости рта. Такая методика позволяет уменьшить суммарную дозу глубокого облучения, приходящуюся в том числе и на окружающие опухоль здоровые ткани, и тем самым, не снижая эффекта лучевого лечения, свести к минимуму лучевое повреждение нормальных тканей.
Различают лучевую терапию, которая проводится в пред-или послеоперационном периоде, а следовательно, направлена на получение стабильного результата, а паллиативное воздействие на опухоль. В последнем случае клиницист рассчитывает лишь на кратковременный положительный эффект.
Химиотерапевтическое лечение. Теоретическим фундаментом этого вида лечения злокачественных опухолей считаются работы Эрлиха, а также достижения экспериментальной онкологии с использованием перевиваемых опухолей.
Цитотоксические препараты (группа алкилирующих соединений, истинные кариокластические яды) при непосредственном контакте с опухолью действуют на химические соединения, входящие в состав клеточных структур. Следствием этого являются физико-химические изменения внутриклеточных компонентов, подавление биокаталитических процессов с последующим нарушением механизма деления клетки. В результате нарушения форм деления клеточных ядер происходит гибель опухолевых клеток. Из веществ этой группы наибольшее распространение в клинике получили эмбихин, эндоксан, сарколизин, тиофосфамид (ТиоТЭФ).
Антиметаболиты являются структурными аналогами веществ, участвующих в биосинтезе и обеспечивающих жизнедеятельность клетки. Замещая в химических реакциях благодаря сходству с ними естественные метаболиты, антиметаболиты действуют на раковую клетку в стадии интерфазы, нарушая при этом синтез соединений, которые необходимы для вступления клетки в стадию митоза. Наиболее известны химиопрепараты, блокирующие синтез нуклеиновых кислот, — метотрексат и 5-фторурацил.
Гормоны и антигормоны в лечении больных раком лица и полости рта, как правило, не используются.
Современные противоопухолевые препараты не обладают выраженной избирательностью действия. При введении их в организм человека отмечается нарушение роста и деления не только опухолевых клеток, но и клеток в здоровых тканях. В процессе лечения противоопухолевыми препаратами страдают костный мозг, слизистая оболочка желудочно-кишечного тракта, нервная система. Малая избирательность действия этих веществ ограничивает возможность их использования, забавляет искать пути наиболее рационального введения препаратов в организм.
Ввиду того что при прямом контакте с химиопрепаратами слизистая оболочка полости рта поражается значительно, введение лекарств внутрь по существу не применяется. Если химиотерапевтическое лечение проводят с целью получения паллиативного результата, то, как правило, лекарственное вещество вводят внутримышечно либо внутривенно. Этому контингенту больных можно проводить комбинированную химиотерапию или комбинированное лечение в виде химиотерапевтиче-ского и лучевого воздействия на опухоль.
Наиболее результативным способом лекарственного лечения злокачественных опухолей органов и тканей лица и полости рта является регионарная внутриартериальная химиотерапия. Она обеспечивает локальное подведение лекарственного вещества к опухоли в его максимальной концентрации. Для получения выраженного эффекта применяют способы длительной внутриартериальной химиотерапии рака, которая позволяет осуществить продолжительный контакт химиопрепарата и опухолевых клеток. Длительную регионарную внутриартериальную химиотерапию проводят либо непрерывно (способ инфузии), либо дробно через определенные промежутки времени (фракционный способ). Внутриартериальная инфузия — непрерывное капельное введение препарата в сосудистое русло — осуществляется в течение нескольких дней. Это единственный способ химиотерапии, позволяющий рассчитывать на подавление дальнейшего роста 90—100% раковых клеток.
При выполнении внутриартериальной инфузии применяют главным образом антиметаболиты (метотрексат, 5-фторурацил и др.). Постоянную инфузию можно проводить с помощью обычной системы для переливания крови, поднятой на высоту около 3 м. При фракционной регионарной химиотерапии нередко используют алкилирующие препараты, однако чаще в больших дозах. В связи с тем, что при сохраненном в наружной сонной артерии регионарном кровотоке наблюдается значительный сброс лекарственного вещества в общее русло кровообращения, при катетеризации a carotis externae на уровне соответствующей пораженному раком органу регионарной артерии целесообразно создать условия замкнутого кровообращения. Достигается это путем лигирования наружной сонной артерии выше и ниже места ее катетеризации. Все хирургические манипуляции в области каротидной зоны производят выше места расположения бифуркации a. carotis communis. Кроме того, перевязывают общую лицевую и наружную яремную вены. Операцию катетеризации выполняют обычно под местной анестезией. Однако по показаниям может использоваться и общее обезболивание.
После завершения катетеризации наружной сонной артерии и создания условий замкнутого регионарного кровообращения устанавливают область распределения противоопухолевого препарата. Для этого можно использовать, например, введение через катетер в область замкнутого регионарного кровообращения стерильного 1% раствора метиленового синего.
В случае положительного эффекта степень выраженности регрессии злокачественной опухоли оценивается в процентах по отношению к первоначальным размерам новообразования (менее, около или более 50%). В отличие от внутривенной и внутримышечной химиотерапии регионарное внутриартериальное введение противоопухолевых лекарственных веществ рассматривается как один из способов комбинированного лечения, позволяющего рассчитывать на хороший стабильный результат у определенной части больных раком челюстно-лицевой области. Однако необходимо иметь в виду, что чем больше раковая опухоль, тем меньшее количество химиопрепарата проникает в различные ее участки даже при внутриартериальном введении. Как и при других способах лечения, решение вопроса о показаниях или противопоказаниях к этому виду химиотерапии прямо зависит от стадии опухолевого роста.
Исследования последних лет свидетельствуют о том, что раковые опухоли, в частности полости рта, могут быть представлены несколькими субпопуляциями клеток, которые отличаются друг от друга разной чувствительностью к лучевой терапии и химиотерапевтическому воздействию. По существу это означает, что успешным может быть только комбинированное лечение рака органов и тканей этой локализации, обязательным элементом которого является радикальное удаление первичной злокачественной опухоли.
Криогенное лечение. Этот способ лечения новообразований основан на принципе локального низкотемпературного воздействия на ткани той анатомической области, в пределах которой возникла опухоль. Применяется для разрушения главным образом опухолевой ткани, а также для достижения лечебного эффекта посредством изменения физиологических тканевых процессов. В клинической практике криогенный способ лечения используется преимущественно для радикального удаления доброкачественных опухолей или при паллиативном лечении злокачественных новообразований.
Идеи комбинированного лечения рака челюстно-лицевой области, сформулированные более 40 лет назад основоположником отечественной онкологии Н. Н. Петровым, сохранили актуальность и по настоящее время. В частности, это касается вопросов, связанных с последовательностью этапов лечения первичного рака и регионарных метастазов. Несмотря на значительное усовершенствование оперативной техники, комбинированные операции с одномоментным вмешательством на регионарном лимфатическом аппарате даже при большом опыте исследователя возможны главным образом в объеме верхней шейной лимфаденэктомии. Одномоментное выполнение операции Крайля чревато смертельными исходами за счет аррозии стенок a. carotis communis и ее ветвей, обусловленной воздействием банальной раневой микрофлоры. Менее опасна в этом отношении операция фасциально-футлярного удаления клетчатки шеи. В связи с этим в большинстве случаев лечение первичного рака челюстно-лицевой области в объеме комбинированного воздействия осуществляется в качестве первого этапа, а оперативное удаление регионарных лимфатических узлов и клетчатки подчелюстной, подподбородочной, надключичной областей и шеи рассматривается как второй, заключительный этап комбинированной терапии.
Отдаленные метастазы при раке лица и полости рта встречаются редко. Вероятно, это связано с тем, что регионарный лимфатический аппарат является мощным биологическим барьером, в большинстве случаев предотвращающим лимфогенное распространение метастазов рака.
Рак челюстно-лицевой области требует комплексного лечения, а также во многих случаях последующего восстановления тканей.
Челюстно-лицевая область имеет достаточно сложное строение и выполняет ряд функций.
Преимущественно опухоли в области головы образуются в ротовой полости и в придаточных пазухах носа.
Назначить лечение рака челюстно-лицевой области можно только после комплексной диагностики.
Реабилитация и наблюдение являются важными составляющими лечения онкологических больных.
Из всех существующих на сегодняшний день хирургический метод лечения является наиболее эффективным. В ходе операции удаляют опухоль, ткань вокруг неё и (при наличии) метастазы. При этом иссечкают также лимфатические узлы и сосуды в области шеи, так как опухоли полости рта и челюсти часто образуют лимфогенные метастазы. Отдалённые опухолевые очаги, например, в печени или лёгком, напротив, формируются редко.
Операция в области головы и шеи включает в себя, в основном, два этапа: резекцию (удаление опухолевой ткани) и пластическую реконструкцию (восстановление оперируемой области).
В ходе реконструкции происходит замещение утраченных мягких тканей или костей. Для этого существует множество методов: возможна пересадка тканей с груди, предплечья, бедра, спины или других органов в полость рта или на лицо. Для замены костей формируют трансплантат костей из тазовой или малоберцовой кости, ребра и других костных структур.
В зависимости от разновидности заболевания после операции возможно проведение лучевой и / или химиотерапии и / или иммунотерапии.

Лучевая терапия (радиотерапия) является одним из важнейших методов в лечении рака. Ионизирующее излучение воздействует на ядро клетки. Оно разрушает ее генетическую информацию (ДНК), в результате чего клетка больше не может делиться. В то время как здоровые клетки в большинстве случаев восстанавливаются после таких воздействий, опухолевые клетки не могут справиться с повреждениями, нанесенными излучением, и поэтому погибают. Излучение, используемое при лучевой терапии, аналогично рентгеновскому, но намного сильнее. Человек его не видит и не ощущает, поэтому лучевая терапия безболезненна.
Лучевая терапия действует только на тех участках, на которые поступают большие дозы излучения. Определить необходимую дозу очень непросто. Лучевая терапия должна быть тщательно спланирована. С одной стороны, доза должна быть достаточно высокой, чтобы уничтожить патологические клетки, с другой стороны — достаточно низкой, чтобы не повредить здоровую ткань.
Область и необходимая доза облучения, измеряемая в греях (Гр), рассчитывается при помощи компьютера. Для облучения используется специальный прибор — линейный ускоритель.
Наличие побочных эффектов после лучевой терапии во многом зависит от того, какое лечение пациент получал до этого, например, проходил ли он курс химиотерапии. Также имеют значение вид и объем лучевой терапии.
Различают острые побочные эффекты, возникающие в ходе курса лучевой терапии и исчезающие в течение трех недель после ее завершения, и отсроченные побочные эффекты. К острым побочным эффектам относятся раздражение кожи в зоне облучения, воспаления слизистых оболочек рта или глотки, сухость во рту, изменение или потеря восприятия вкуса, у мужчин — выпадение волос на лице.
Химиотерапия разрушает клетки, которые быстро делятся. Медикаменты (цитостатические препараты), которые используются при этом, вмешиваются в процессы деления клеток. Кровь распространяет действующее вещество по всему организму (системная терапия). Недостаток состоит в том, что они влияют также и на здоровые быстро делящиеся клетки, в частности в слизистых оболочек и корнях волос, от чего и возникают побочные эффекты.
Цитостатические препараты могут использоваться по отдельности (монотерапия) или комбинированно по так называемым схемам. Применяемые медикаменты очень токсичны, поэтому принимать их следует с большой осторожностью под контролем опытных специалистов. Также необходимо постоянно контролировать полезное и побочное действие препаратов.
В качестве альтернативы в целях предотвращения рецидива может быть применена местная иммунотерапия, которая должна активировать иммунную систему организма. Недостатком иммунотерапии является то, что она вызывает более тяжелые побочные эффекты, нежели химиотерапия.
К наиболее распространенным побочным эффектам химиотерапии относятся:
- нарушение кроветворной функции костного мозга (например, сокращение количества белых кровяных телец, которые отвечают за иммунную защиту организма);
- подавление всех ростков костного мозга с развитием панцитопении и, как следствие, подверженность инфекциям, анемия, кровотечения;
- потеря аппетита;
- тошнота, рвота;
- воспаление слизистых оболочек и нарушения глотания;
- выпадение волос.
После резекции опухолей в челюстно-лицевой области для пациента особенно важно наилучшее восстановление внешнего вида и поражённой части. Для этого существует много возможностей.
В ходе операций порой удаляют значительные участки челюстной кости и прилегающих мягких тканей лица и шеи. Восстановить кожный покров или костную ткань можно при помощи:
- реконструктивной хирургии, с пластикой местными тканями, стягиванием краев раны (после удаления небольших опухолей);
- трансплантации кожных покровов: хотя хирурги всегда стараются делать разрезы таким образом, чтобы рубцы располагались по линиям натяжения кожи, иногда приходится делать ещё несколько надрезов, чтобы вернуть коже подвижность; части ротовой полости и слизистой оболочки можно заменить пересадкой тканей предплечья, груди или спины, при этом важно, чтобы ткань в достаточной мере снабжалась кровью, поэтому большие участки ткани соединяют со снабжающим их кровеносным сосудом;
- замещения костной ткани: удалённые участки можно заменить металлическим протезом. По возможности хирурги стараются использовать кости из других частей организма, например, подвздошную или малоберцовую кость, ключицу, верхнюю суставную поверхность большеберцовой кости или фрагмент ребра.
Для восстановления нервов, в частности лицевых, можно использовать следующие методы: первичная нейрорафия (сшивание нервов) или имплантация донорского материала (нервная вставка).
Несмотря на непрерывное совершенствование пластической хирургии, иногда имплантированные участки не приживаются, отмирают. В этом случае может потребоваться повторная операция.
Перед и после операции пациент принимает антибиотики, так как при имплантации инородного материала всегда существует опасность инфицирования зоны операции.

При иссечении опухолей в полости рта иногда приходится удалять отдельные зубы или целые участки челюсти. Это может привести не только к нарушению внешнего вида пациента, но и к трудностям при жевании. Заменить зубы или челюсть непосредственно в ходе операции по удалению опухоли невозможно. Требуются недели и даже месяцы для оценки возможности восстановления челюсти.
Самый простой способ восстановления — протезирование зубов. Послеоперационные рубцы, контрактуры и трансплантированные ткани затрудняют процесс протезирования. После удаления опухоли в области верхней челюсти часто резецируют ткань твёрдого и мягкого нёба, которую можно заменить непосредственно во время операции. Как правило, для закрытия дефектов нёба устанавливают специальные протезы — обтураторы.
Имплантация обтуратора является более предпочтительной процедурой, чем хирургическая коррекция с закрытием образовавшегося отверстия собственными тканями. Это объясняется тем, что при наблюдении за областью, в которой первоначально возникла опухоль, обтуратор можно просто вынуть. Однако спустя несколько месяцев или лет после первичной операции по удалению опухоли, закрыть образовавшееся отверстие можно произведя трансплантацию кожных лоскутов.
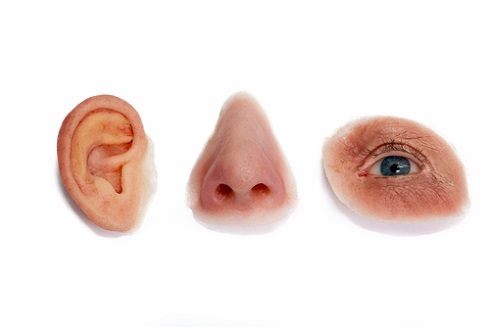
Если пересадка тканей невозможна, проводят имплантацию специальных протезов кожи — эпитезов, которые состоят из мягкого пластика и которым специалисты придают как можно более схожий с естественной кожей вид.
Сначала с соответствующей части лица делают восковой слепок, в котором учитываются даже такие мелкие детали, как поры или складки ткани. Затем из полученной модели формируют эпитез, которому придают соответствующий цвет и дополняют волосяным покровом. Закрепить эпитез можно по-разному: например, при помощи специального клея, который наносится на кожу, либо имплантатов, которые закрепляются на костях в области лица, либо при помощи очков.
Так как кожа лица стареет, необходимо регулярно обновлять или изменять также и эпитез.
Когда требуется восстановление тканей глазницы, носа или ушей, более предпочтительным вариантом считается именно использование эпитезов, а не трансплантация кожных покровов или полнослойного тканевого лоскута.
Органы и ткани челюстно-лицевой области относительно часто поражаются раком и саркомой (от 2 до 7% общего числа больных злокачественными опухолями). Так, рак языка, слизистой оболочки полости рта встречается в 2% случаев рака, рак челюсти — в 3%, рак губы — в 7%.
Этиология: влиянием постоянных раздражителей на лицо человека (ультрафиолетовые лучи, смена температуры воздуха, химические факторы); при употреблении чрезмерно горячей или холодной пищи, острой или грубой пищи, длительном механическом раздражении слизистой оболочки острым краем разрушенной коронки зуба или плохим зубным протезом; вредные привычки — жевание табака, вдыхание табачного дыма.
Предрасполагающими факторами возникновения злокачественной опухоли являются хронические воспалительные процессы (хронический гайморит, длительно незаживающие трещины, язвы, лейкоплакия).
Рак губы встречается наиболее часто, преимущественно у мужчин, в основном, нижняя губа.
Предрасполагающие факторы: курение, хейлиты, гиперкератозы, хронические трещины.
Протекает относительно благоприятно.
По своему строению является ороговевающим.
Объективно: появление инфильтрата в подслизистом слое губы, затем язва с плотным валиком, позже — метастазы в подподбородочные и поднижнечелюстные лимфатические узлы. Узлы при этом умеренно увеличены, плотны, подвижны, безболезненны. Дно язвы выстлано некротическими тканями, края выворочены, приподняты над поверхностью губы. Губа значительно увеличивается, подвижность ее ограничена. Через некоторое время раковая опухоль распространяется на костную ткань челюсти.
Лечение: устранение первичной опухоли, лучевая терапия, криодеструкция, иссечение участка, превентивная операция на регионарном лимфатическом аппарате, лечение метастазов, симптоматическое лечение.
Рак языка возникает чаще на боковой поверхности языка и в области его кончика. Болеют чаще мужчины.
Предрасполагающие факторы: механическая травма языка острыми краями разрушенных зубов или плохо подогнанными протезами, термическое и химическое раздражение, длительно существовавшая лейкоплакия.
Объективно: появление инфильтрата в подслизистом слое или плотное эпителиальное разрастание типа папилломы, после его распада образуется язва с вывороченными краями, легко кровоточит. Язык теряет способность активно двигаться, затрудняется процесс самоочищения полости рта. Сопутствующая микрофлора усугубляет некроз тканей языка. В связи с этим у таких больных могут возникнуть воспалительные явления, маскирующие основной процесс. Отмечается резкий, зловонный, гнилостный запах изо рта.
При раке языка быстро возникает метастазирование клеток опухоли в поднижнечелюстные, под подбородочные, шейные лимфатические узлы.
Лечение: проводят рентгено- и радиотерапию первичного очага, половинная резекция (электрорезекция). Проводится иссечение клетчатки, лимфатических узлов, поднижнечелюстных слюнных желез в поднижнечелюстной области и в области шеи (фасциально-футлярное иссечение).
Рак слизистой оболочки полости рта встречается в 1% случаев поражения раком.
Процесс может развиться на слизистой оболочке щек, альвеолярного отростка, мягкого и твердого неба, дна полости рта. Гистологически относится к плоскоклеточному раку.
Объективно: появление папилломатозных разрастаний, которые увеличиваются и изъязвляются с образованием болезненной щелевидной язвы. У основания таких новообразований — плотный безболезненный инфильтрат. Рак слизистой оболочки альвеолярного отростка распространяется на кость челюсти, что приводит к расшатыванию зубов. Отмечается гнилостный запах изо рта.
Лечение: лучевая терапия первичного очага и метастазов, иссечение тканей дна полости рта в сочетании с резекцией нижней челюсти и языка, операции на лимфатическом аппарате.
Рак слизистой оболочки щеки развивается редко, на фоне лейколакии, преимущественно у мужчин старше 50 лет, течение благоприятное.
Объективно: чаще локализуется на слизистой щеки по линии смыкания зубов в виде язвенно-бородавчатого или бородавчатого образования. Со временем прорастает в подлежащие мышцы и кожу щеки, крыловидные складки.
Лечение: лучевая терапия первичного очага и регионарных метастазов, оперативное лечение.
Лечение: лучевая терапия, хирургическое лечение — резекция верхней челюсти.
Читайте также:

