Онколитические вирусы в терапии злокачественных глиом
— Пётр Михайлович, не могли бы вы рассказать, в чём заключается суть вашего метода?
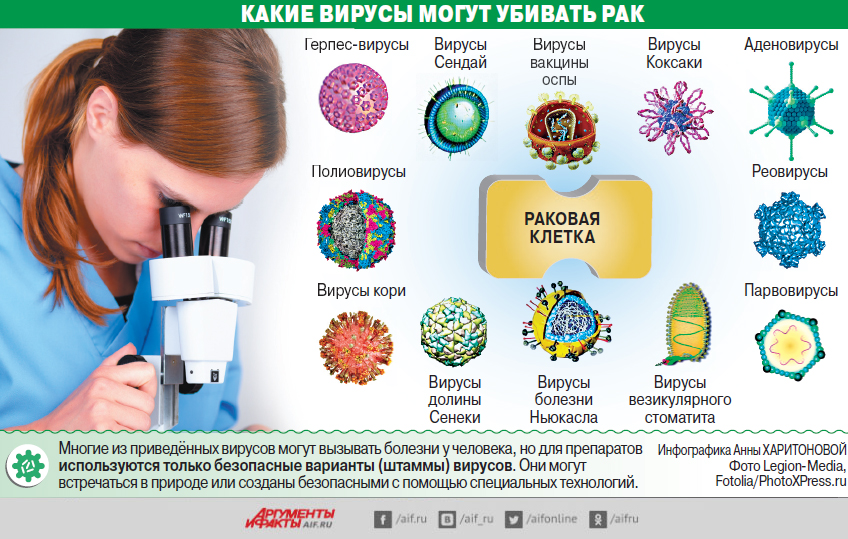
— Есть вирусы, которые могут подавлять рак. Они обладают онколитическими свойствами. И они безвредны для здоровья человека. Этот способ лечения практически не даёт побочных эффектов. Возможно только кратковременное повышение температуры, что является положительным признаком, говорящим о том, что вирус в организме прижился и оказывает реакцию. Это легко снимается обычными жаропонижающими средствами.
— Когда метод станет широко применяться в практической медицине?
— Сейчас основная наша задача — сертифицировать те препараты, которые у нас есть. Эта работа поддерживается Минздравом и Минобрнауки. У нас есть несколько грантов, по которым мы испытываем эти препараты. Мы делаем новые варианты онколитических вирусов с усиленными свойствами. Скоро должны начаться доклинические испытания в институте имени Смородинцева в Санкт-Петербурге. Мы уже передали туда препараты. Врачи говорят, что на испытания уйдёт месяцев пять-шесть. Учитывая ситуацию с коронавирусом, я думаю, что в начале 2021 года испытания могут быть закончены и тогда мы уже сможем договариваться с клиниками о проведении клинических испытаний.
— Что собой представляет препарат, который должен пройти испытания?
— Препарат — это живой вирус, который выращивается на культурах клеток. Это лекарство нового типа, которого не нужно много. Важно, чтобы он попал в организме в те клетки, которые чувствительны к нему. А дальше он сам размножается. То есть лекарство само себя воспроизводит уже в том месте, где оно нужно. Это раствор, 100 млн вирусных частиц в 1 мл. Но самая большая проблема в этом лечении — это способ доставки вируса в опухоль, в случае с глиобластомой — в мозг, в ту область, где находится опухоль.
Если препарат ввести просто внутривенно, то очень небольшая часть вируса может попасть в опухоль. В кровотоке есть неспецифические факторы, которые этот вирус быстро инактивируют. Кроме того, в мозгу есть гематоэнцефалический барьер, который препятствует попаданию туда всяких нежелательных агентов, в том числе и вирусов. Поэтому вирусу очень трудно добраться до опухоли.
— Как вы смогли решить эту проблему?
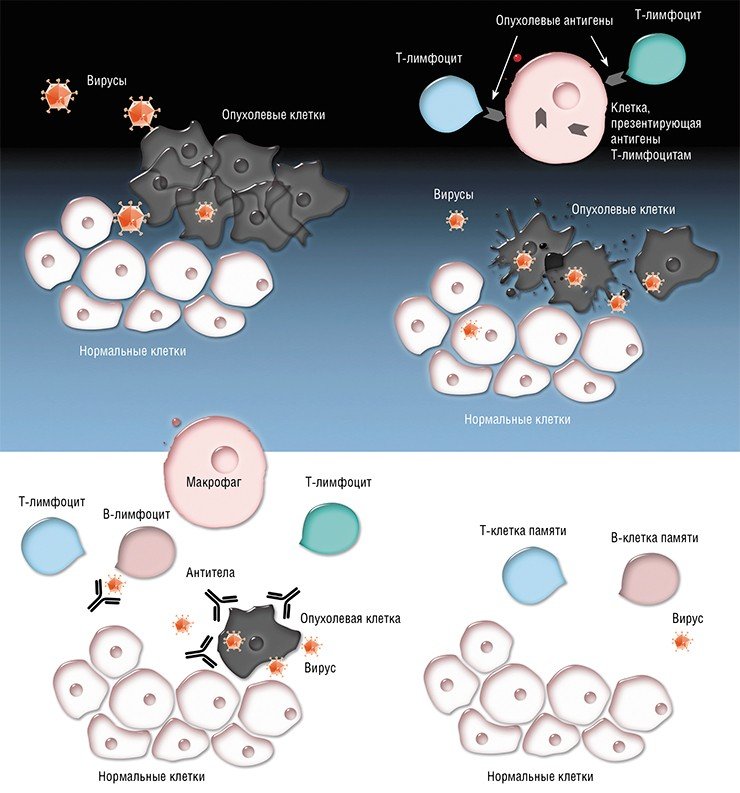
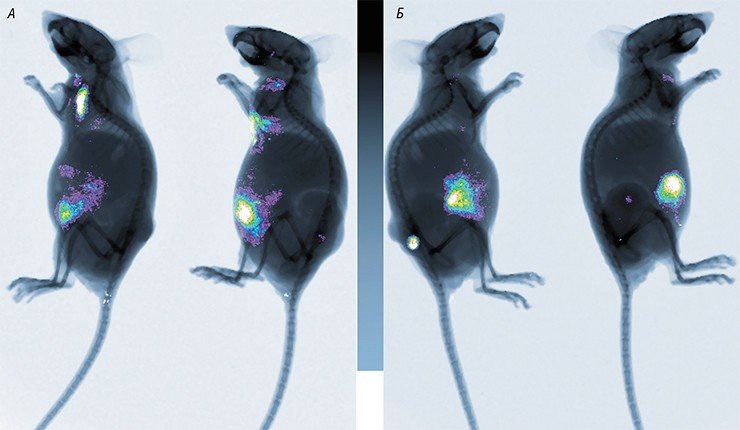
Эти клетки, как торпеды, идут в очаги воспалений, где находится опухоль. Там вирус выходит из них и начинает убивать опухолевые клетки. Этот метод мы уже отработали на нескольких пациентах. Есть хорошие примеры, когда на МРТ или КТ видно, как опухоль уменьшается и исчезает. Но это происходит не у всех.
— Почему же одни и те же вирусы не справляются с одними и теми же видами опухолей?
— Дело в том, что каждый конкретный вирус нашей панели действует только на 15—20% пациентов. Остальные оказываются к вирусу устойчивы. Однако у нас есть много разных вирусов, и мы можем подобрать свой для любого пациента. Но для этого нужно иметь живые клетки пациента.
Сейчас мы разрабатываем такие тесты, которые могут по обычной биопсии быстро показать, к какому вирусу опухоль будет чувствительна. Это очень сложная работа. Возможно, в будущем специальные клинические лаборатории будут получать от пациентов все необходимые материалы и в режиме конвейера проводить тестирование, подбирать препараты и далее — лечение.
Но сейчас к нам обращаются те, кому уже никто не может помочь. Некоторые из них лечатся у нас по полгода и более. Если идёт стабилизация и видно, что опухоль не растёт, мы делаем перерыв до тех пор, пока рост не возобновится. Но есть случаи, когда рост не возобновляется. У нас есть пациент, который живёт уже четыре года, притом что шансов у него не было. Глиобластома — это смертельное заболевание, средняя продолжительность жизни с ним — 12—15 месяцев с момента постановки диагноза.
— Прежде всего должен сказать, что пока это экспериментальное лечение. Когда Макаров доложил об этом методе на совещании у президента, мне кажется, он не рассчитывал на то, что это вызовет такой резонанс. Сейчас меня буквально атакуют письмами десятки больных с просьбой помочь.
Мне кажется, что не стоило рассказывать про Заворотнюк. Я знаю, что родные Анастасии долгое время вообще не комментировали её состояние и не хотели, чтобы в прессе поднимали этот вопрос. Сам я Анастасию ни разу не видел. Ко мне обращались её близкие с просьбой о помощи. Я сказал, что мы могли бы на первом этапе протестировать её клетки.
Дело в том, что во время операции были забраны живые клетки опухоли и переданы в один из институтов, где их удалось вывести в культуру клеток, чтобы они делились в пробирке. Мы взяли их и протестировали на чувствительность к нашим онколитическим вирусам, которые мы рассматриваем как средство лечения глиобластомы. Обнаружилось, что из 30 вирусов 7—8 вполне подходящие. И на этом этапе мы остановились, потому что муж Анастасии Пётр Чернышов сказал, что сейчас ситуация более-менее спокойная, если будет крайняя необходимость, они к нам обратятся. Это всё, что касается Заворотнюк.
Но всё это мы делали и делаем в очень ограниченном масштабе. Сейчас, когда всё выплеснулось в СМИ, мы просто не справимся с таким валом пациентов.
— Можете ли вы прокомментировать связь между ЭКО и появлением глиобластомы? Есть такие исследования?
— Как я понимаю, этот вопрос опять поднят историей Заворотнюк. В данном случае у неё было ЭКО. Но это никак не говорит о том, что есть какая-то связь. Во-первых, ЭКО не так много делают и глиобластомы — это 1% всех опухолей. Глиобластома встречается не только у женщин. Я думаю, что никакой связи нет. Ведь как может воздействовать ЭКО? Повышается уровень половых гормонов. Но тех гормонов, которые достаточно физиологичные, и так всегда есть в организме. Они просто появляются в другое время и в другой дозе. И вряд ли могут оказать влияние именно на глиальные клетки, с тем чтобы они переродились.
— В мире ведутся подобные исследования по лечению глиобластомы? Что вам известно об этом?
— Мы не первые, кто проверяет вирусы на глиобластоме. Сейчас это очень горячая тема во всём мире. И разные вирусы тестируют для лечения разной онкологии во многих странах. Я знаю один случай, который начали лечить в 1996 году вирусом болезни Ньюкасла, это птичий вирус. И больной до сих пор живёт с глиобластомой. Это опубликованные данные. И есть ещё несколько случаев лечения с помощью рекомбинантных вирусов герпеса.
В прошлом году вышла нашумевшая работа о том, что 20% больных глиобластомой могут быть вылечены вакциной рекомбинантного вируса полиомиелита.
Но нейрохирурги — люди консервативные. Они ни за что не согласятся даже в порядке эксперимента проводить такие опыты на людях. Потому что они очень сильно рискуют, если будет осложнение. Поэтому мы должны дождаться доклинических испытаний, с тем чтобы потом убедить их опробовать схему с прямым введением вируса прямо в опухоль.
— А кто и когда впервые заметил действие вируса на раковые клетки?
— Ещё в начале ХХ века учёные заметили, что опухолевые клетки особенно хорошо размножают вирусы. После инфекционных вирусных заболеваний у некоторых больных при разных видах рака наблюдались ремиссии. И уже тогда возникла мысль о том, что в будущем можно будет лечить онкобольных с помощью вирусов.
В 1950-е годы в Америке проводились эксперименты по лечению рака безнадёжных больных с помощью патогенных вирусов. Считалось, что это меньшее зло по сравнению с самим раком. И тогда были получены положительные результаты. Но поскольку многие больные умирали от инфекционных заболеваний, возник очень большой резонанс. Врачи, которые начали это делать, дискредитировали всю эту область на долгие годы. Были введены дополнительные этические правила. Само упоминание о том, что вирусом можно лечить рак, стало табу.
В 1990-е годы уже стало понятно, как устроены вирусы, структура их генома. Учёные научились вносить изменения в геном вирусов, чтобы сделать их безвредными. И тогда во всём мире начался бум разработки препаратов на основе вирусов для лечения рака. Но тут новая беда. Этому стали сопротивляться фармацевтические компании. Потому что это совершенно другой способ лечения, который подрывает базу их благосостояния.
В начале 10-х годов нашего века многие небольшие компании разрабатывали препараты, которые потом проходили какие-то клинические испытания, были показаны какие-то многообещающие свойства. Но фармацевтические компании скупали эти разработки и практически прекращали деятельность этих небольших стартапов.
— Удалось ли кому-нибудь преодолеть фармацевтическое лобби и зарегистрировать препарат?
— Сейчас в мире зарегистрировано три препарата онколитических вирусов. Один препарат разрешён к использованию в США для лечения злокачественных меланом. Ещё один рекомбинантный аденовирус — в Китае, и один энтеровирус — в Латвии. Но, в общем-то, каждый из этих препаратов находит пока очень ограниченное применение, из-за того что все они действуют только на часть пациентов.
— Пётр Михайлович, а как давно вы ведёте свои исследования?
— Всю жизнь, ещё с 1970-х годов. Мне выпало такое время, когда мы вначале практически ничего не знали о вирусах. И по мере того, как мы что-то узнавали, мы вносили какой-то вклад в эту науку и сами учились. И я начинал как раз с вирусов. Потом переключился на проблему рака — фундаментальные механизмы деления клеток: как нормальная клетка превращается в рак. А потом снова вернулся в вирусологию.
Должен сказать, что и мои родители были вирусологами, они занимались противополиомиелитной кампанией. Моя мать в 1970-е годы изучала, как у детей образуются антитела к полиомиелитной вакцине, и она обнаружила, что у многих детей не образуются антитела. Оказалось, что в кишечнике у детей в это время шла бессимптомная инфекция другого безвредного энтеровируса. И он вызывал неспецифическую защиту от вируса полиомиелита. Поэтому вакцинный полиовирус не мог индуцировать антитела у этих детей. Эти безвредные вирусы были выделены из кишечника здоровых детей. И на их основе были созданы живые энтеровирусные вакцины, которые испытывались для того, чтобы предотвращать какие-то ещё неизвестные инфекции.
И вот мы решили возобновить тот подход, который был предложен моей мамой, когда используется панель энтеровирусов. Оказалось, что те больные, которые нечувствительны к одному вирусу, могут быть чувствительны к другому. Возникла идея подбора вируса под пациента. Мы разработали целую панель собственных вирусов, которые могут также обладать усиленными свойствами. Мы продолжаем эту разработку.
— Ваши вирусы могут побеждать рак. А есть вирусы, которые вызывают развитие опухоли?
— Да. Например, рак шейки матки в 95% случаев вызывается вирусом папилломы. Сейчас уже есть даже вакцины против онкогенных папилломовирусов 16—18-го серотипа, которые применяются для девочек, чтобы не заболевали раком шейки матки. Но это самый большой пример. У большинства видов рака сейчас можно полностью исключить вирусную природу.
— Вы используете естественные вирусы или конструируете их?
— У нас разные есть вирусы. Как я говорил, первая панель была выделена из кишечника здоровых детей. Это природные непатогенные вирусы, которые, кстати говоря, хорошо защищают детей от многих вирусных инфекций. Кроме того, мы делаем синтетические и рекомбинантные вирусы, когда мы вводим определённые изменения в их состав, которые усиливают их онколитические свойства.
— На планете есть ещё места, где может быть очень много вирусов, о которых мы ещё и понятия не имеем. Например, те, что живут в океанских глубинах. Как вы считаете, если вдруг кто-то возьмётся за изучение океана именно с точки зрения вирусов, там могут найтись полезные для вас?
— Да, и сейчас это тоже очень горячая тема. Когда разработали метод секвенирования геномов, ДНК, РНК, то возник соблазн: профильтровать сточные воды, океанические воды, из прудов, морей. Уже пробурили скважину в Антарктиде к древнему озеру, чтобы посмотреть, что там, выделить оттуда биологические компоненты и секвенировать их. И оказывается, что нас окружает огромное количество вирусов, которые абсолютно безвредны. И такое впечатление, что наше исходное представление о вирусах как о чём-то вредном и вызывающем только болезни неверно. Болезнетворный вирус — скорее исключение, чем правило.

Цена:
Авторы работы:
Научный журнал:
Год выхода:
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, 2012, том 46, № 6, с. 874-886
УДК 577.2:616-006; 61:578.7
ОНКОЛИТИЧЕСКИЕ ВИРУСЫ В ТЕРАПИИ ГЛИОМ
Новосибирский национальный исследовательский государственный университет, Новосибирск, 630090 Россия 2Государственный научный центр вирусологии и биотехнологии "Вектор", Кольцово, Новосибирская обл., 630559 Россия 3Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук, Москва, 119991 Россия
4Cleveland Clinic Foundation, Cleveland, ОН 41195 USA 5Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, 630090 Россия 6Научно-исследовательский институт патологии кровообращения им. академика Е.Н. Мешалкина Министерства здравоохранения РФ, Новосибирск 630055 Россия
Поступила в редакцию 28.05.2012 г.
Принята к печати 14.06.2012 г.
Несмотря на достижения современной медицины, излечение больных с опухолями глиального происхождения остается трудно достижимой задачей. Инвазивный характер и расположение в жизненно важных областях головного мозга делают этот тип новообразований сложным для хирургического вмешательства, а адъ-ювантная терапия не приносит ожидаемых результатов. Частые рецидивы и злокачественность глиом обусловлены наличием стволовых клеток, обладающих повышенной инвазивностью и устойчивостью к радио-и химиотерапии. Совершенствование технологий конструирования рекомбинантных вирусов позволило создать штаммы, проявляющие онколитическую активность в отношении глиальных опухолей. Большинство этих штаммов прошли первую стадию клинических испытаний и показали безопасность их использования. Несмотря на очевидную перспективность данного подхода, существующие штаммы недостаточно эффективны, что указывает на необходимость их совершенствования. В представленном обзоре рассмотрены наиболее успешные варианты онколитических вирусов, дошедших до клинических испытаний, а также обсуждаются перспективы новых подходов в виротерапии глиом.
Ключевые слова: глиомы, онколитические вирусы, противоопухолевая терапия, молекулярная онкология.
ONCOLYTIC VIRUSES IN THE THERAPY OF GLIOMAS, by N. V. Gubanova15*, A. S. Gaytan6, I. A. Razumov1,2,5, V. A. Mordvinov5, A. L. Krivoshapkin5,6, S. V. Netesov1,2, P. M. Chumakov1,3,4 ^Novosibirsk State University, Novosibirsk, 630090 Russia; *e-mail: nat@bionet.nsc.ru; 2Vctor State Research Center of Virology and Biotechnology, Koltsovo, Novosibirsk Region, 630559 Russia; 3Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, Moscow, 119991 Russia; 4Lerner Research Institute, Cleveland Clinic Foundation, Cleveland, OH 44195, USA; 5Institute of Cytology and Genetics, Siberian Division, Russian Academy of Sciences, Novosibirsk, 630090 Russia; 6Meshalkin Institute of Circulation Pathology, Novosibirsk, 630055 Russia). Despite the advances of modern medicine, malignant glioblastoma cure remains an elusive goal. Both the invasive nature and location in vital areas of the brain make this type of tumors difficult for surgical treatment, while the current adjuvant therapy is not as successful as expected. Frequent recurrence and invasiveness of malignant gliomas is due to resistance of glioma stem cells to conventional radiation and chemotherapy. Technological advances in constructing recombinant viruses have allowed creating strains with high oncolytic activity toward glial tumors. Many of these strains have passed Phase I of clinical trials and demonstrated high safety. Despite the obvious potential of the approach, efficiency of the existing strains is still far from being sufficient for effectively curing the disease and require further improvement. The review summarizes results obtained with the most successful variants of oncolytic viruses that come down to the clinical trials and discusses the prospects for new approaches in virotherapy of malignant gliomas.
Keywords: gliomas, oncolytic viruses, cancer therapy, molecular oncology.
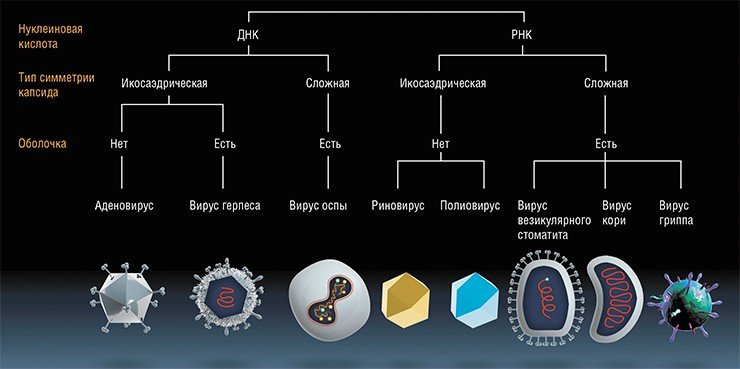
Принятые сокращения: МРТ — магнитно-резонансная томография; EGFR — рецептор фактора роста эпидермиса; СКГ — стволовые клетки глиобластомы; ВБН — вирус болезни Ньюкасла; БОЕ — бляшкообразующая единица; Ad — аденовирус (при названии серотипа); PKR — РНК-зависимая протеинкиназа R; ТЦП — титр цитопатичности; eIF2a — фактор инициации трансляции 2a; RR — рибонуклеотид-редуктаза; ВКМ — внеклеточный матрикс.
* Эл. почта: nat@bionet.nsc.ru
Злокачественные опухоли головного мозга составляют сравнительно небольшую часть всех онкологических заболеваний (1—1.5%), причем происходят они преимущественно из клеток глии (более 60%) [1]. Среди злокачественных глиом в 70% случаев диагностируются мультиформные глиобластомы, реже (15%) — анапластические астроцитомы; остальные 15% приходятся на менее агрессивные глиомы [2]. Злокачественные глиомы имеют исключительно неблагоприятный прогноз, а их лечение представляет особую сложность. Средний безрецидивный период у больных глиобластомой составляет 6 мес., а средняя продолжительность жизни не превышает 9—12 мес. Несмотря на очевидный прогресс в понимании механизмов возникновения и прогрессии злокачественных глиом, а также внедрение множества новых методов лечения, за последние 30 лет средняя продолжительность жизни больных увеличилась всего лишь на 2—3 мес. [3, 4]. В подавляющем большинстве случаев терапевтические воздействия по-прежнему остаются паллиативными. Инфильтративный характер роста и расположение в функционально значимых областях головного мозга делают эти опухоли крайне сложными для радикального хирургического удаления. Про-грессирование заболевания и неизбежный рецидив после проведенного лечения обусловлены, по-видимому, уцелевшими стволовыми клетками глиомы (СКГ), обладающими повышенной инва-зивностью и устойчивостью к радио- и химиоте-рапическим воздействиям [5, 6].
В современной нейроонкологической практике принят комплексный мультидисциплинарный подход, включающий хирургическое удаление опухоли с последующим применением адъювант-ных методов лучевого и химиотерапевтического воздействия. Принцип хирургического метода состоит в максимальном удалении опухолевой ткани без создания нового неврологического дефицита. Для решения данной задачи применяются высокотехнологические нейронавигационные станции [7], все шире внедряются интраопераци-онные высокопольные МРТ-установки. Получил также мировое признание метод микрохирургического удаления злокачественных глиом с применением интраоперационной флуоресценции метаболитов 5-аминолевулиновой кислоты (5-А^), избирательно накапливающихся в клетках злокачественных глиом [8]. Этот метод позволяет с большей точностью вычленять границы распространения глиомы и способствует ее оптимальному удалению [9].
Наряду с продолжающимися исследованиями, направленными на улучшение эффективности хирургического и химиолучевого лечения, продолжаются поиски новых методов. Большие надежды возлагают на такие подходы, как таргетная терапия [10] — генная терапия, иммунотерапия,
избирательное радиологическое воздействие на злокачественные клетки, применение онколити-ческих вирусов.
Значительный интерес вызывают подходы к терапии злокачественных глиом, в которых используются онколитические вирусы. Углубленное понимание механизмов репликации вирусов, их взаимодействия с клеточными системами, достижения в технологии конструирования реком-бинантных вирусов позволили сконструировать вирусные штаммы, обладающие терапевтическими свойствами. Большое число таких штаммов прошло первую стадию клинических испытаний и показало безопасность их использования в предлагаемых концентрациях, но, к сожалению, пока еще низкую эффективность при терапии злокачественных глиом. В представленном обзоре проанализированы свойства наиболее перспективных штаммов онколитических вирусов, дошедших до стадии клинических испытаний и рассмотрены возможности новых подходов в ви-ротерапии злокачественных глиом головного мозга.
ПАТОМОРФОЛОГИЧЕСКАЯ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА
Среди первичных опухолей центральной нервной системы у взрослых большинство составляют глиальные опухоли, которые различаются по уровню клеточной дифференцировки и злокачественности. Анапластическая астроцитома (III степень по классификации ВОЗ) и глиобла-стома (IV степень по классификации ВОЗ) образуют основную группу злокачественных глиом. Анапластическая астроцитома представляет собой инфильтрирующее новообразование, для которого характерны фокальные или дисперсные анаплазии и более высокий индекс пролиферации по сравнению с астроцитомами более низкой градации (пилоцитарная и фибриллярная астроцитомы — степень злокачественности I и II по классификации ВОЗ соответственно). Гистологический диагноз этого заболевания основан на атипичности ядер и повышенной митотической активности клеток опухоли.
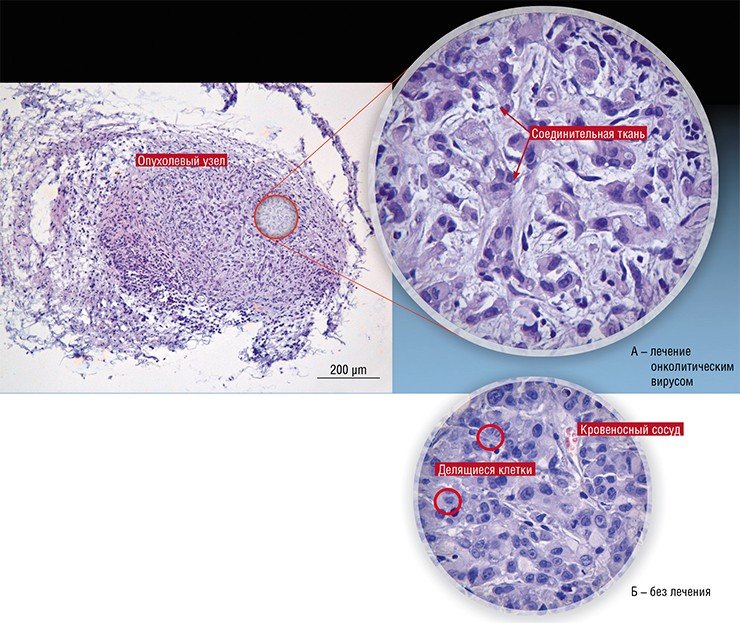
На гистологическом уровне глиобластомы представляют собой ткань с пролиферирующими кровеносными сосудами, содержащую области некроза [11]. Как правило, глиобластома возникает de novo, хотя примерно в 10% случаев ее появление обусловлено прогрессией глиальных опухолей головного мозга с более низкой градацией — фибриллярных астроцитом (II степень злокачественности) или анапластических астро-цитом (III степень), в таких случаях глиобластомы считают вторичными. При МРТ-исследова-
нии глиобластома характеризуется высококонтрастной периферической зоной с нерегулярным контуром, которая окружает гетерогенную область с признаками некротических изменений. Перифо-кальный отек, как правило, значительно выражен.
Развитие опухоли обусловлено наследственными или соматическими мутациями в ряде генов, которые контролируют важные биологические процессы. Мутации или хромосомные аберрации могут приводить к активации онкогенов и/или инактивации генов опухолевых супрессо-ров. Некоторые генетические нарушения сопровождаются потерей гетерозиготности, при которой один аллель может содержать мутации, а другой утрачивается в ре
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
- ОНКОЛИТИЧЕСКИЕ ЭНТЕРОВИРУСЫ
БАБКИН И.В., БАЙКОВ И.К., МОРОЗОВА В.В., НЕТЕСОВ С.В., ТИКУНОВА Н.В., ЧУМАКОВ П.М. — 2012 г.

Пётр Чумаков: В стране не очень много этим занимаются. Мы работаем в Москве, ещё в Новосибирске, но, если проявить волю, можно широко развернуть исследования, кадры и оборудование для этого есть. Наработана огромная база знаний, нужно их просто уметь применять. Сегодня, например, можно синтезировать новый вирус всего за 2 недели.

Растим вирусы

- А почему нужен такой точный подбор вируса для пациента?
- Одна злокачественная клетка чувствительна к одному онколитическому вирусу, другая - к другому. И если мы назначаем его неприцельно, вслепую, то эффективность попадания примерно 15%. Коктейли увеличивают эффективность до 70%. А создание индивидуального препарата ещё эффективнее. Кроме того, раковые клетки быстро меняются - именно поэтому они вырабатывают устойчивость к лекарствам. Это может снижать чувствительность и к вирусам. Поэтому коктейли эффективнее - к ним труднее выработать устойчивость. Возможно, в будущем будут созданы самонацеливающиеся вирусы, которые станут меняться быстрее раковых клеток, и устойчивости к ним не будет.
- А как реально помогают вирусные препараты больным?
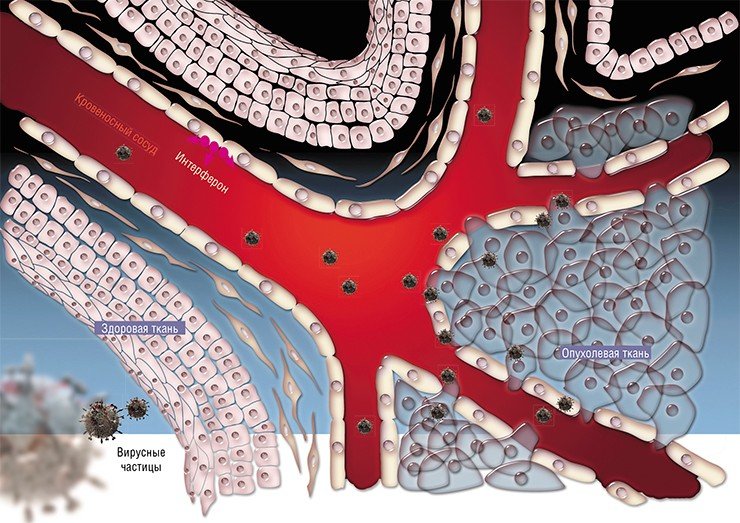
- Поскольку почти все они ещё официально не зарегистрированы, их обычно применяют у терминальных больных, от которых уже отказалась официальная онкология. У таких больных уже очень велики повреждения организма. И лечебные вирусы как минимум продлевают им жизнь на несколько месяцев и уменьшают страдания. Но, если бы лечение можно было назначать на более ранних стадиях, эффект был бы гораздо лучше. Зафиксированы случаи, когда рак излечивался полностью. Например, так бывает при глиоме головного мозга, когда препарат вводят непосредственно в опухоль. Бывает также, что при вскрытии умершего пациента, получавшего лечение на поздней стадии рака, выяснялось, что на месте опухоли - рубец, а смерть наступила по другой причине.
Побочный эффект
Уверен, сейчас это единственный революционный подход к лечению рака. Государству нужно проявить волю: направить силы и средства на эти исследования, изменить систему проведения испытаний, которая работает на большие компании, выпускающие классические лекарства и биопрепараты. Последние баснословно дороги и являются золотой жилой для фармацевтических гигантов. Вирусные препараты можно было зарегистрировать ещё лет 10 назад, уже было ясно, что они могут быть эффективными, безопасными и легче переносятся, чем химиотерапия. Но новые лекарства невыгодны для фармгигантов. В США медицина очень сильная, но нацелена не на профилактику, а на лечение болезней - и очень дорогое. Раньше, когда за лекарства платил сам больной, они стоили недорого. А теперь там платят страховщики, а не пациенты, и это обеспечивает им большие обороты. От этого страдают больные в России и странах третьего мира, где цена таких лекарств не компенсируется.

А онколитические вирусы стоят недорого и в применении достаточно просты. В зависимости от вируса и опухоли их назначают внутрь, как обычные препараты, вводят с помощью шприца внутримышечно, подкожно, внутрикожно, внутривенно или с помощью пункций - в брюшную полость, прицельно в опухоль.
- Какие побочные эффекты бывают при таком лечении?
- В 70% случаев после введения препарата через 12-18 часов повышается температура, возникают гриппоподобные симптомы. Это говорит о заражении злокачественных клеток вирусом - происходит выброс интерферона. Он и вызывает эти симптомы.
*Меланома - злокачественная опухоль кожи.
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
Читайте также:

