Октреотид в лечении рака предстательной железы
Лечение гормонорезистентного рака простаты
Лечение гормонорезистентного рака простаты
Заболеваемость раком простаты (по данным Давыдова М.И., Аксель Е.М., 2007):
- Второе место (после рака легкого) в структуре онкологической заболеваемости в мире
- Шестое место в структуре мировой онкологической смертности – 5,8% от всех умерших
- Среди мужчин выживших более 5 лет больные раком простаты составляют самую большую когорту – 2 369 000
- Выживаемость при раке простаты в развитых странах – 87%, в развивающихся – 45%
- Россия: в 2005г. заболеваемость раком простаты – 20,9 на 100 000 (54%-ный прирост к 2000 г.; 1 место по темпам прироста заболеваемости)
- Смертность 10,1 на 100 000 (прирост 29,5% к 2000 г.; 1 место по темпам прироста смертности)
- За 10 лет в России заболеваемость возросла на 70%; смертность возросла на 10%
- 22% выявляются в IV стадии заболевания
Распределение больных по стадиям РПЖ в РФ:
- Локализованный РПЖ (I-II стадии) – 37,6%
- Местно-распространенный РПЖ(III стадия) – 38,2%
- Метастатический (генерализованный) РПЖ (IV стадия) – 24,2%
Основные задачи лечения генерализованного РПЖ:
- Регрессия опухоли и метастазов
- Увеличение продолжительности жизни
- Улучшение качества жизни больного и его социальная адаптация
Симптомы генерализованного РПЖ и методы их коррекции
Симптомы
Методы коррекции
Локальные симптомы
Локальные боли
Компрессия спинного мозга
Сдавление уретры
Сдавление мочеточников
Компрессия ЧМ нервов
Паллиативная лучевая терапия
Хирургия, Паллиативная лучевая терапия
ТУР
Нефростомия
Паллиативная лучевая терапия
Воспалительный синдром
Повышение температуры
Остеопороз
Гормонотерапия, химиотерапия, введение радиофармпрепаратов
Кортикостероиды, НПВС
НПВС
НПВС
Химиотерапия при генерализованном гормонорезистентном раке простаты (Sternberg et al., 2007; Calabro and Sternberg, 2007 )
- В настоящее время нет стандартного режима химиотерапии, показавшего существенное увеличение продолжительности жизни.
- Достигаемая ремиссия крайне коротка.
- Врачи крайне редко настроены использовать химиотерапию.
У 80% БОЛЬНЫХ С МЕТАСТАТИЧЕСКИМ РАКОМ ПРОСТАТЫ НА ФОНЕ АНТИАНДРОГЕННОЙ ТЕРАПИИ ЧЕРЕЗ 18-24 МЕСЯЦА РАЗВИВАЕТСЯ ГОРМОНОРЕЗИСТЕНТНАЯ ФАЗА ЗАБОЛЕВАНИЯ (Yagoda A. et al., 1993)
Критерии гормонорезистентности на основе показателя ПСА*(простат-специфического антигена)
-
Три последовательных значения показателя при ПСА1 ®
- Октреотид связывается, преимущественно, с рецепторами SSTR 2 и SSTR 5;
- Октреотид, в отличие от соматостатина, подавляет секрецию гормона роста в значительно большей степени, чем секрецию инсулина;
- Введение октреотида не сопровождается феноменом гиперсекреции гормонов по механизму отрицательной обратной связи;
- Октреотид не оказывает существенного влияния на выраженность сахарного диабета, не приводит к снижению потребности в инсулине или пероральных гипогликемических препаратах;
- Применение Октреотида-депо ® сопровождается меньшей частотой побочных эффектов, чем октреотида короткого действия;
- Причина – стабильная концентрация препарата в сыворотке крови.
Возможные схемы применения Октреотида-депо ® при лечении гормонорезистентного ракапростаты
- Монотерапия (малоэффективно)
- Дозы Октреотида, применяемые в комбинированной терапии (от 20-30 до 60 мг/28 дней);
- Аналог соматостатина + дексаметазон (малоэффективно);
- Аналог соматостатина + аналог ЛГРГ (Бусерелин-депо) + дексаметазон (основная схема при Т3-4 Nx-1 M1).
Способ применения и дозы
- Начальная доза Октреотида-депо ® составляет 20 мг каждые 4 недели в течение 3 месяцев.
- В дальнейшем дозу корригируют с учетом динамики концентрации ПСА в сыворотке, а также клинических симптомов.
- Если после 3 месяцев лечения не удалось достичь адекватного клинического и биохимического эффекта (снижения ПСА), дозу можно увеличить до 30 мг, вводимых каждые 4 недели.
- Лечение рака простаты октреотидом-депо сочетают с применением дексаметазона, который назначают внутрь по следующей схеме: 4 мг в сутки в течение 1 месяца, затем 2 мг в сутки в течение 2 недель, затем 1 мг в сутки (поддерживающая доза).
- Лечение октреотидом-депо и дексаметазоном больных, которым ранее проводили медикаментозную антиандрогенную терапию, сочетают с применением аналога гонадотропин-рилизинг гормона (ГнРГ). При этом инъекцию аналога ГнРГ (Бусерелин-депо) проводят 1 раз в 4 недели.
- Пациентам, получающим Октреотид-депо ® , определение концентраций ПСА следует проводить каждый месяц.
- У больных с нарушением функции почек, печени и у пациентов пожилого возраста нет необходимости корригировать режим дозирования Октреотида-депо ® .
В результате проведенных клинических исследований выявлено:
- У больных гормонорезистентным раком предстательной железыувеличивается пул нейроэндокринных клеток, экспрессирующих соматостатиновые рецепторы, афинные к октреотиду (SS2 и SS5 типов), что определяет чувствительность опухоли к октреотиду.
- Применение Октреотида-депо в комплексе с дексаметазоном на фоне андрогенной блокады (медикаментозная или хирургическая кастрация) у больных ГРРПЖ восстанавливает чувствительность к гормональной терапии и приводит к снижению простатического специфического антигена (ПСА) более чем у 50% пациентов.
- У больных ГРРПЖ с метастазами в кости данная терапия сопровождается выраженным и длительным обезболивающим эффектом.
- При этом у всех больных, ответивших на комбинированную терапию гормонорезистентного рака простаты с Октреотидом-депо, существенно улучшается качество жизни и медиана безрецидивной выживаемости.
Октреотид-депо – препарат, обладающий доказанной эффективностью и высокой безопасностью в составе комбинированной терапии у больных с ГРРПЖ, за счет восстановления чувствительности к гормональной терапии, а также улучшающий качество жизни больных ГРРПЖ с метастазами в кости за счет выраженного и длительного обезболивающего эффекта.












Опыт применения октреотида в пролонги-рованной форме выпуска при лечении кастрат-резистентного рака предстательной железы
Целью исследования была оценка эффективности препарата октреотид в зависимости от применяемой дозы (20 мг или 30 мг), путем изучения динамики уровня простатического специфического антигена. В ходе исследования была отмечена большая эффективность октреотида в дозировке 30 мг - положительный ответ на лечение (снижение или стабилизация простатического специфического антигена, симптоматический эффект) отмечен почти у 80% больных.
Рак предстательной железы (РПЖ) в настоящее время считается одной из самых серьезных проблем мужского населения. В Европе РПЖ является наиболее распространенной злокачественной опухолью, заболеваемость которой составляет 214 случаев на 100 тыс. мужчин [1]. В РФ первичная заболеваемость РПЖ в последнее время стремительно возрастает. В 2012 г. было зарегистрировано 29 082 новых случая при приросте заболеваемости 157,78% за 10 лет [2].
Эпидемиологическая ситуация осложняется тем, что более половины впервые выявленных случаев РПЖ диагностируются уже на стадии местнораспространенного – 35,3% – и метастатического рака – 17,8% [3, 4].
Андрогенная депривационная терапия (АДТ) – один из основных методов консервативного лечения распространенных форм РПЖ и более чем 80% больных позволяет стабилизировать процесс [5]. Однако в течение 2 лет у таких пациентов может развиваться резистентность к гормональным методам воздействия в форме кастрационно-резистентного рака предстательной железы (КРРПЖ) [6–8]. Ответ на АДТ продолжается в среднем 18–24 месяцев, после чего отмечается переход болезни в стадию кастрационной резистентности.
К одним из перспективных и недостаточно изученных направлений в лечении КРРПЖ относится назначение комбинированной терапии аналогами соматостатина длительного действия (октреотид) и дексаметазоном на фоне АДТ [9].
Соматостатин – ингибирующий пептид с экзокринной, эндокринной, паракринной и аутокринной активностью (выделен в 1973 г.), включает группу пептидов, содержащих 14 и 28 аминокислот. В настоящее время идентифицировано не менее 5 типов соматостатиновых рецепторов (SSTR 1–5), располагающихся на плазматической мембране клеток. Клетки ряда опухолей и их метастазы экспрессируют рецепторы соматостатина с высокой плотностью, существенно превышающей их плотность на клетках нормальных тканей. Наибольшая экспрессия соматостатиновых рецепторов (2-го и 5-го типов) наблюдается в нейроэндокринных клетках КРРПЖ. Нейроэндокринные клетки присутствуют в нормальной ткани предстательной железы, и их находят на всех стадиях РПЖ. Рецепторы соматостатина и его аналогов служат потенциальными мишенями при лечении РПЖ. Аналоги соматостатина, например октреотид, ингибируют рост рака простаты в эксперименте, оказывая непрямой антигормональный (за счет обратной связи) и прямой антимитотический эффекты, связанные с ингибированием соматостатиновых рецепторов [10, 11].
Потенциальный противоопухолевый эффект аналогов соматостатина может быть связан с торможением клеточного роста и ангиогенеза в опухоли, а также с увеличением интенсивности апоптоза опухолевых клеток. Ингибирующие эффекты на клеточном опухолевом уровне предположительно основаны на прямом действии, зависящем от экспрессии опухолью рецепторов к соматостатину и непрямом, имеющем значение в регуляции нормальных клеток, экспрессирующих рецепторы к соматостатину.
Имеется ряд клинических исследований, показывающих эффективность и безопасность применения аналогов соматостатина с дексаметазоном, на фоне АДТ у больных КРРПЖ [12, 13].
Целью исследования была оценка эффективности препарата октреотид в пролонгированной форме выпуска в зависимости от применяемой дозы (20 или 30 мг) путем изучения динамики уровня простатического специфического антигена (ПСА), оценки влияния препарата на статус активности пациентов, уровня болевого синдрома и метаболических изменений, оценки эффективности в зависимости от гистологического типа опухоли и количества костных метастазов, проведения мониторинга побочных эффектов.
С января 2010 по декабрь 2014 г. на базе Городской больницы № 57 проведено исследование, которое включило 92 пациента с КРРПЖ, получавших лечение аналогом соматостатина октреотидом (пролонгированная форма выпуска) в комбинации с дексаметазоном на фоне хирургической или медикаментозной кастрации.
Средний возраст больных составил 67,4 года (от 51 до 81 года). Пациенты были распределены на 2 группы в зависимости от дозировки октреотида: 1-я группа –37 больных, которым проводилась терапия октреотидом 20 мг в комбинации с дексаметазоном; 2-я группа – 55 больных, получавших октреотид 30 мг в комбинации с дексаметазоном. Пациенты обеих групп получали препарат октреотид в пролонгированной форме внутримышечно 1 раз в 28 дней в сочетании с пероральным применением дексаметазона: 4 мг/сут в течение первого месяца, 2 мг/сут в течение следующих 2 недель терапии, затем 1 мг/сут в качестве поддерживающей дозы до конца курса лечения.
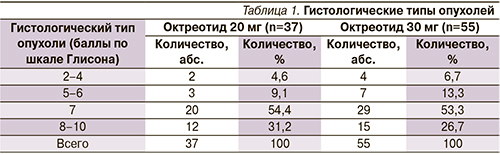
Среднее время от момента установленного диагноза до формирования гормонрезистентной фазы заболевания составило 22 месяца в 1-й группе, 24,3 месяца – во 2-й. При гистологической верификации диагноза преобладали умеренно- и низкодифференцированные формы РПЖ (табл. 1).
Среди пациентов 1-й группы местно-распространенный РПЖ (Т3–4N0M0) был диагностирован у 3 (9,1%), лимфогенно-диссеминированный (N1–M0) – у 5 (13,6%) и метастатический (N0–1M1) – у 28 (75%) пациентов. Во 2-й группе стадия Т3–4N0M0 верифицирована у 4 (6,7%) больных, N1M0 – у 7 (13,3%) и N0–1M1 – у 44 (80%). Средний уровень ПСА в 1-й группе составил 127,5 ± 240,6, во 2-й – 145,5 ± 359,5 нг/мл. Данные представлены в табл. 2.
Группы были однородными по возрасту больных и клинической стадии процесса; наблюдались достоверные различия по уровню ПСА. Перед началом лечения всем пациентам определены статус активности по шкале Карновского и оценка болевого синдрома по шкале ВОЗ. Шестьдесят девять больных были включены со статусом активности 80–100%, 16 со статусом активности 60–70% и 7 со статусом активности 50–60%. Данные по статусу активности представлены в табл. 3.

Большинство больных страдали болевым синдромом, 28 пациентов не нуждались в обезболивании. Нерегулярно принимали ненаркотические анальгетики 42 (45,7%) пациента, 18 (19,6%) больных нуждались в постоянном приеме ненаркотических анальгетиков и 4 (4,3%) периодически принимали наркотические анальгетики для снижения болевого синдрома. Данные представлены в табл. 4.
Эффективность лекарственного лечения оценивали после каждого курса комбинированной терапии, осуществляя гематологический контроль, определение уровня ПСА сыворотки крови, оценку качества жизни и уровня болевого синдрома, а также контроль метаболических изменений по модели IDF (от 2005 г.).
При положительном ответе на лечение комбинированную терапию продолжали до момента наступления прогрессирования (увеличение размеров и количества метастатических очагов или появление новых или 3 последовательных повышения уровня ПСА).
К положительному эффекту относили снижение или стабилизацию уровня ПСА сыворотки крови, положительную динамику показателей общего и биохимического анализа крови, снижение уровня болевого синдрома и улучшение качества жизни пациента.
Результаты исследования показали, что в группе больных, получавших октреотид 20 мг, количество курсов варьировалось от 2 до 12 (среднее 6,2±3,3). Во 2-й группе количество циклов было от 3 до 13 (среднее – 7,7± 3,4). Медиана времени до появления признаков прогрессирования составила 5 (2–13) и 7 (1 –10) месяцев в группах соответственно. По завершении исследования проведен мониторинг количества циклов введения препаратов в зависимости от гистологического типа опухоли и от количества костных метастазов (табл. 5 и 6).
Снижение уровня ПСА >50 % от исходного уровня в 1-й группе отмечено у 15 (40,7%) и у 28 (51,1%) больных во 2-й соответственно. У 5 (14,4%) пациентов, получавших октреотид 20 мг, и у 8 (15,6%) на фоне приема октреотида 30 мг отмечено снижение уровня ПСА >80 %. Стабилизация заболевания отмечена у 8 (22,2%) больных в 1-й группе и 11 (20%) – во 2-й (табл. 7).
При оценке градации боли число пациентов, не требующих приема анальгетических препаратов, в 1-й группе увеличилось на 4,5%, во 2-й – на 10% на фоне проводимой терапии. В то же время полностью отказаться от приема наркотических препаратов с целью обезболивания никто не смог. В целом следует отметить снижение градации болевого синдрома у 16,2% (6 из 37) во 2-й группе против 9,1% (5 из 55) пациентов в 1-й.
Положительная динамика наблюдалась также и в изменении статуса активности больных. Изменение статуса активности в положительную сторону произошло у 3 (9%) пациентов 1-й группы и у 7 (13,3%) в группе октреотида 30 мг. Данные отражены в табл. 8.

При оценке метаболических изменений каких-либо значимых отклонений не наблюдалось у больных обеих групп, за исключением гипергликемии, наблюдавшейся у 6 (16,2%) пациентов 1-й группы и у 13 (23,6%) 2-й. Коррекция углеводного обмена у этих пациентов достигнута использованием диетического стола № 9 и лишь у 2 (5,4%) больных 1-й группы и 4 (7,2%) во 2-й – дополнительным применением пероральных сахароснижающих препаратов.
Следует отметить, что повышение ПСА в течение первых двух месяцев не более чем на 50% (при ПСА 20 нг/мл) не служит поводом для отмены препаратов. Уменьшение боли в костях, улучшение качества жизни и статуса активности пациента – критерии продолжения лечения. Результаты нашего исследования свидетельствуют о том, что уровень ПСА является прогностическим фактором, но не может служить достаточным основанием для отказа от намеченноголечения.
При проведении исследования нами опробована схема ступенчатой терапии, а именно перевод ряда больных с 20 на 30 мг октреотида. Такой переход осуществлялся на разных сроках лечения в случае отсутствия или недостаточного эффекта от использования дозировки 20 мг. Данная методика позволила пролонгировать курс применения октреотида пациентам, но уже в увеличенной дозе.
Лечение больных октреотидом в пролонгированной форме как в 1-й, так и во 2-й группах не сопровождалось какими-либо серьезными специфическими побочными токсическими реакциями.
Применение аналога соматостатина октреотида, его пролонгированной формы, на фоне андрогенной абляции приводит к достижению объективного эффекта, позволяя отодвинуть сроки начала химиотерапии или иных дорогостоящих методов лечения КРРПЖ.
В ходе исследования отмечена большая эффективность октреотида в дозировке 30 мг – положительный ответ на лечение (снижение или стабилизация ПСА, симптоматический эффект) отмечен почти у 80% больных.
Применение октреотида 30 мг имеет удовлетворительный профиль переносимости, что немаловажно при использовании препарата пожилыми и ослабленными пациентами.
Октреотид Инструкция по применению
- Цена на Октреотид от 1805.00 руб. в Москве
- Купить Октреотид в Москве можно в интернет-магазине Apteka.ru
- Доставка препарата Октреотид в 647 аптек
Октреотид
Диамед, ООО/Фарм-Синтез, ЗАО
КОМПАНИЯ ДЕКО, ООО
Компания Деко, ООО/Фарм-Синтез, ЗАО
Сан Фармасьютикал Индастриз Лтд
ФАРМ-СИНТЕЗ ЗАО/ БИОМЕД АО
Аналог соматостатина. Препарат для проведения интенсивной терапии в гастроэнтерологии
1 мл - ампулы (5) - упаковки контурные (1) - пачки картонные.
1 мл - ампулы (5) - упаковки контурные (2) - пачки картонные.
1 мл - ампулы (5) - упаковки контурные пластиковые (1) - пачки картонные.
1 мл - ампулы (5) - упаковки контурные пластиковые (1) - пачки картонные.
1 мл - ампулы (5) - упаковки контурные пластиковые (2) - пачки картонные.
10 ампул по 1 мл в уп
5 ампул по 1 мл в уп
ампулы по 1мл - 10 шт в уп.
ампулы по 1мл - 5 шт в уп.
раствор для внутривенного и подкожного введения 100 мкг/мл по 1 мл в ампуле, имеющей маркировку в виде зеленого кольца
Флаконы темного стекла (1) в комплекте с растворителем (амп.), шприцем одноразовым и иглами д/и (2) - пачки картонные.
Флаконы темного стекла (1) в комплекте с растворителем (амп.), шприцем одноразовым и иглами д/и (2) - пачки картонные.
Флаконы темного стекла (1) в комплекте с растворителем (амп.), шприцем одноразовым и иглами д/и (2) - пачки картонные.
Флаконы темного стекла (1) в комплекте с растворителем (амп.), шприцем одноразовым, иглами д/и (2) и спиртовыми тампонами (2) - пачки картонные.
Лиофилизат для приготовления суспензии для в/м введения пролонгированного действия белого или белого со слабым желтоватым оттенком цвета, в виде порошка или пористой, уплотненной в таблетку массы; приложенный растворитель - бесцветная прозрачная жидкость; приготовленная суспензия - белого или белого
Лиофилизат для приготовления суспензии для в/м введения пролонгированного действия белого или белого со слабым желтоватым оттенком цвета, в виде порошка или уплотненной в таблетку массы; приложенный растворитель - бесцветная прозрачная жидкость; приготовленная суспензия - белого
прозрачная бесцветная жидкость без запаха
Прозрачный, бесцветный раствор
Раствор для в/в и п/к введения 0.005% прозрачный, бесцветный, без запаха
Раствор для инъекций 0.005% прозрачный, бесцветный, без запаха.
Раствор для инъекций 0.01% прозрачный, бесцветный, без запаха.
Раствор для инъекций 0.01% прозрачный, бесцветный, без запаха.
Раствор для инъекций 0.01%, прозрачный
Октреотид-депо представляет собой лекарственную форму октреотида длительного действия для в/м введения, обеспечивающую поддержание стабильных терапевтических концентраций октреотида в крови в течение 4 недель.
Октреотид - синтетический октапептид, являющийся аналогом естественного гормона соматостатина и обладающий сходными с ним фармакологическими эффектами, но значительно большей продолжительностью действия.
Препарат подавляет патологически повышенную секрецию гормона роста, а также пептидов и серотонина, продуцируемых в гастроэнтеропанкреатической эндокринной системе.
У здоровых лиц октреотид, подобно соматостатину, подавляет секрецию гормона роста, вызываемую аргинином, физической нагрузкой и инсулиновой гипогликемией; секрецию инсулина, глюкагона, гастрина и других пептидов гастроэнтеропанкреатической эндокринной системы, вызываемую приемом пищи, а также секрецию инсулина и глюкагона, стимулируемую аргинином; секрецию тиреотропина, вызываемую тиреолиберином. Подавляющее действие на секрецию гормона роста у октреотида, в отличие от соматостатина, выражено в значительно большей степени, чем на секрецию инсулина. Введение октреотида не сопровождается феноменом гиперсекреции гормонов по механизму отрицательной обратной связи.
У больных акромегалией введение Октреотида-депо обеспечивает в подавляющем большинстве случаев стойкое снижение уровня гормона роста и нормализацию концентрации инсулиноподобного фактора роста 1/соматомедина С (ИФР-1).
У большинства больных акромегалией Октреотид-депо существенно уменьшает выраженность таких симптомов, как головная боль, повышенное потоотделение, парестезии, усталость, боли в костях и суставах, периферическая невропатия.
Сообщалось, что лечение октреотидом отдельных больных с аденомами гипофиза, секретирующими гормон роста, приводило к уменьшению размеров опухоли.
При карциноидных опухолях применение октреотида может приводить к уменьшению выраженности симптомов заболевания, в первую очередь, таких как приливы и диарея. Во многих случаях клиническое улучшение сопровождается снижением концентрации серотонина в плазме и экскреции 5-гидроксииндолуксусной кислоты с мочой. При опухолях, характеризующихся гиперпродукцией вазоактивного интестинального пептида (ВИПомы), применение октреотида приводит у большинства больных к уменьшению тяжелой секреторной диареи, которая характерна для данного состояния, что, в свою очередь, приводит к улучшению качества жизни больного. Одновременно происходит уменьшение сопутствующих нарушений электролитного баланса, например, гипокалиемии, что позволяет отменить энтеральное и парентеральное введение жидкости и электролитов. По данным компьютерной томографии у некоторых больных происходит замедление или остановка прогрессирования опухоли, и даже уменьшение ее размеров, особенно метастазов в печень. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида (ВИП) в плазме.
При глюкагономах применение октреотида в большинстве случаев приводит к заметному уменьшению некротизирующей мигрирующей сыпи, которая характерна для данного состояния. Октреотид не оказывает сколько-нибудь существенного влияния на выраженность сахарного диабета, часто наблюдающегося при глюкагономах, и обычно не приводит к снижению потребности в инсулине или пероральных гипогликемических препаратах. У больных, страдающих диареей, октреотид вызывает ее уменьшение, что сопровождается повышением массы тела. При применении октреотида часто отмечается быстрое снижение концентрации глюкагона в плазме, однако при длительном лечении этот эффект не сохраняется. В то же время симптоматическое улучшение остается стабильным длительное время.
При гастриномах/синдроме Золлингера-Эллисона октреотид, применяемый в качестве монотерапии или в комбинации с блокаторами гистаминовых H2-рецепторов и ингибиторами протонового насоса, может снизить образование соляной кислоты в желудке и привести к клиническому улучшению, в т.ч. и в отношении диареи. Возможно также уменьшение выраженности и других симптомов, вероятно связанных с синтезом пептидов опухолью, в т.ч. приливов. В некоторых случаях отмечается снижение концентрации гастрина в плазме.
У больных с инсулиномами октреотид уменьшает уровень иммунореактивного инсулина в крови. У больных с операбельными опухолями октреотид может обеспечить восстановление и поддержание нормогликемии в предоперационном периоде. У больных с неоперабельными доброкачественными и злокачественными опухолями контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с редко встречающимися опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (соматолибериномами), октреотид уменьшает выраженность симптомов акромегалии. Это, по-видимому, связано с подавлением секреции рилизинг-фактора гормона роста и самого гормона роста. В дальнейшем возможно уменьшение размеров гипофиза, которые до начала лечения были увеличены.
У больных гормонорезистентным раком предстательной железы увеличивается пул нейроэндокринных клеток, экспрессирующих соматостатиновые рецепторы, афинные к октреотиду (SS2 и SS5 типов), что определяет чувствительность опухоли к октреотиду. Применение октреотида-депо в комплексе с дексаметазоном на фоне андрогенной блокады (медикаментозная или хирургическая кастрация) у больных гормонорезистентным раком предстательной железы восстанавливает чувствительность к гормональной терапии и приводит к снижению простатического специфического антигена (ПСА) более чем у 50% пациентов. У больных гормонорезистентным раком предстательной железы с метастазами в кости данная терапия сопровождается выраженным и длительным обезболивающим эффектом. При этом у всех больных, ответивших на комбинированную терапию с октреотидом-депо, существенно улучшается качество жизни и медиана безрецидивной выживаемости.
После п/к введения Октреотид быстро и полностью всасывается. Cmax октреотида в плазме крови достигается в пределах 30 мин.
Связывание с белками плазмы составляет 65%. Связывание Октреотида с форменными элементами крови крайне незначительно. Vd составляет 0.27 л/кг.
Общий клиренс составляет 160 мл/мин. Около 32% выводится в неизменном виде почками. После п/к инъекции препарата Т1/2 октреотида составляет 100 мин. После в/в введения выведение октреотида осуществляется в 2 фазы с T1/2 10 мин и 90 мин соответственно.
Фармакокинетика в особых клинических случаях
У пациентов пожилого возраста снижается клиренс, а T1/2 увеличивается.
При тяжелой почечной недостаточности клиренс уменьшается в 2 раза.
При опухолях гипофиза, секретирующих ГР, необходимо тщательное наблюдение за больными, так как возможно увеличение размеров опухолей с развитием таких серьезных осложнений, как сужение полей зрения. В этих случаях следует рассмотреть необходимость применения других методов лечения. У 15-30% больных, получающих октреотид п/к в течение длительного времени, возможно появление камней в желчном пузыре. Распространенность в общей популяции (возраст 40-60 лет) составляет 5-20%. Опыт длительного лечения октреотидом прологированного действия больных акромегалией и опухолями ЖКТ и поджелудочной железы свидетельствует о том, что октреотид прологированного действия, в сравнении с октреотидом короткого действия, не приводит к повышению частоты образования камней желчного пузыря. Тем не менее, рекомендуется проведение УЗИ желчного пузыря перед началом лечения октреотидом и примерно каждые 6 мес в процессе лечения. Камни в желчном пузыре, если все-таки они обнаруживаются, как правило, бессимптомные. При наличии клинической симптоматики показано консервативное лечение (например, применение препаратов желчных кислот) или оперативное вмешательство.
У больных сахарным диабетом 1 типа октреотид может влиять на обмен глюкозы и, следовательно, снижать потребность во вводимом инсулине. Для пациентов с сахарным диабетом 2 типа и пациентов без сопутствующего нарушения углеводного обмена подкожные инъекции октреотида могут приводить к постпрандиальной гликемии. В связи с этим рекомендуется регулярно контролировать уровень гликемии и в случае необходимости корригировать гипогликемическую терапию.
У больных с инсулиномами на фоне лечения октреотидом может отмечаться увеличение выраженности и продолжительности гипогликемии (это связано с более выраженным подавляющим влиянием на секрецию ГР и глюкагона, чем на секрецию инсулина, а также с меньшей длительностью ингибирующего воздействия на секрецию инсулина). Показано систематическое наблюдение за этими больными.
До назначения октреотида больные должны пройти исходное УЗИ желчного пузыря. Во время лечения октреотидом следует проводить повторные УЗИ желчного пузыря, предпочтительно, с интервалами 6-12 мес.
Если камни желчного пузыря обнаружены еще до начала лечения, необходимо оценить потенциальные преимущества терапии октреотидом по сравнению с возможным риском, связанным с наличием желчных камней.
В настоящее время не имеется каких-либо свидетельств того, что октреотид неблагоприятно влияет на течение или прогноз уже имеющейся желчнокаменной болезни.
Ведение больных, у которых камни желчного пузыря образуются в процессе лечения октреотидом.
а) Бессимптомные камни желчного пузыря.
Применение октреотида можно прекратить или продолжить - в соответствии с оценкой соотношения польза/риск. В любом случае не требуется никаких других мер, кроме продолжения проведения осмотров, сделав их, при необходимости, более частыми.
б) Камни желчного пузыря с клинической симптоматикой.
Применение октреотида можно прекратить или продолжить - в соответствии с оценкой соотношения польза/риск. В любом случае больного следует лечить так же, как и в других случаях желчнокаменной болезни с клиническими проявлениями. Медикаментозное лечение включает применение комбинаций препаратов желчных кислот (например, хенодезоксихолевая кислота в дозе 7.5 мг/кг/сут. в сочетании с урсодезоксихолевой кислотой в той же дозе) под ультразвуковым контролем - до полного исчезновения камней.
Влияние на способность к вождению автотранспорта и управлению механизмами
Не имеется данных о влиянии октреотида на способность водить автомобиль и работать с механизмами.
октреотид (в форме свободного пептида) 50 мкг
Вспомогательные вещества: натрия хлорид - 9 мг, вода д/и - до 1 мл.
октреотид (в форме свободного пептида) 50 мкг
Вспомогательные вещества: натрия хлорид - 9 мг, вода д/и - до 1 мл.
октреотид (в форме свободного пептида) 100 мкг
Вспомогательные вещества: натрия хлорид, вода д/и.
октреотид (в форме свободного пептида) 100 мкг
Вспомогательные вещества: натрия хлорид, вода д/и.
октреотид (в форме свободного пептида) 50 мкг
Вспомогательные вещества: натрия хлорид, вода д/и.
октреотид 100 мкг
октреотид 10 мг
Вспомогательные вещества: сополимер DL-молочной и гликолевой кислот, D-маннитол, карбоксиметилцеллюлозы натриевая соль, полисорбат-80.
Растворитель: р-р маннитола 0.8% - 2 мл.
октреотид 10 мг
Вспомогательные вещества: сополимер DL-молочной и гликолевой кислот, D-маннитол, карбоксиметилцеллюлозы натриевая соль, полисорбат-80.
Растворитель: р-р маннитола 0.8% - 2 мл.
В 1 мл раствора содержится:
Активное вещество: Октреотид ацетат (что эквивалентно содержанию октреотида) -0,064(0,050 мг) мкг и 0,128 мг (0,100 мг);
Вспомогательные вещества: уксусная кислота ледяная, натрий ацетат (тригидрат), натрий хлорид, вода для инъекций
октреотид 10 мг
Вспомогательные вещества: сополимер DL-молочной и гликолевой кислот - 270 мг, D-маннитол - 85 мг, карбоксиметилцеллюлозы натриевая соль - 30 мг, полисорбат-80 - 2 мг.
Растворитель: р-р маннитола 0.8% - 2 мл.
Акромегалия (когда адекватный контроль проявлений заболевания осуществляется за счет подкожного ведения октреотида, при отсутствии достаточного эффекта от хирургического лечения и лучевой терапии; для подготовки к хирургическому лечению, для лечения между курсами лучевой терапии до развития стойкого эффекта, у неоперабельных больных).
В терапии эндокринных опухолей желудочно-кишечного тракта (ЖКТ) и поджелудочной железы:
карциноидные опухоли с явлениями карциноидного синдрома;
гастриномы (синдром Золлингера-Эллисона);
глюкагономы (для контроля гипогликемии в предоперационном периоде, а также для поддерживающей терапии).
В терапии эндокринных опухолей желудочно-кишечного тракта (ЖКТ) и поджелудочной железы:
карциноидные опухоли с явлениями карциноидного синдрома;
гастриномы (синдром Золлингера-Эллисона);
глюкагономы (для контроля гипогликемии в предоперационном периоде, а также для поддерживающей терапии).
Соматолибериномы (опухоли, характеризующиеся гиперпр
— детский возраст до 18 лет;
— повышенная чувствительность к октреотиду или другим компонентам препарата.
С осторожностью: холелитиаз (желчнокаменная болезнь), сахарный диабет, беременность, период лактации.
Местные реакции: возможны боль, ощущение зуда, или жжение, краснота или припухлость в месте п/к инъекции (обычно проходят в течение 15 минут).
Выраженность местных реакций можно уменьшить, если использовать раствор комнатной температуры, или вводить меньший объем более концентрированного раствора.
Со стороны ЖКТ: анорексия, тошнота, рвота, спастические боли в животе, вздутие живота, избыточное газообразование, жидкий стул, диарея, стеаторея. Хотя выделение жира с калом может возрастать, на сегодняшний день нет доказательств того, что длительное лечение октреотидом может приводить к развитию дефицита питания вследствие нарушений всасывания (мапьабсорбция). В редких случаях могут отмечаться явления, напоминающие острую кишечную. непроходимость: прогрессирующее вздутие живота, выраженная боль в эпигастральной области, напряжение брюшной стенки. Длительное использование октреотида может приводить к образованию камней в желчном пузыре. Частоту побочных эффектов со стороны ЖКТ можно уменьшить, увеличивая промежутки времени между приемами пищи и введением октреотида. Со стороны поджелудочной железы: сообщалось о редких случаях острого панкреатита, развившегося в первые часы или дни применения октреотида. При длительном применении отмечались случаи панкреатита, связанного с холелитиазом.
Со стороны печени: имеются отдельные сообщения о развитии нарушений функции печени (острый гепатит без холестаза с нормализацией показателей трансаминаз после отмены октреотида); медленное развитие гипербилирубинемии, сопровождающееся повышением показателей щелочной фосфатазы, гамма-глютамилтрасферазы и, в меньшей степени, других трансаминаз.
Со стороны сердечно- сосудистой системы: в отдельных случаях — брадикардия.
Со стороны обмена веществ: поскольку октреотид оказывает подавляющее влияние на образование ГР, глюкагона и инсулина, он может влиять на обмен глюкозы. Возможно, снижение толерантности к глюкозе после приема пищи. При длительном применении октреотида п/к в некоторых случаях может развиться стойкая гипергликемия. Наблюдались также состояния гипогликемии.
Прочие: в редких случаях сообщалось о временном выпадении волос после введения октреотида. Имеются отдельные сообщения о развитии реакций повышенной чувствительности: редко -кожные аллергические реакции; в отдельных случаях - анафилактические реакции.
Октреотид уменьшает всасывание циклоспорина, замедляет всасывание циметидина.
При одновременном применении октреотида и бромокриптина биодоступность последнего повышается.
Есть данные, что аналоги соматостатина могут уменьшать метаболизм лекарственных средств, метаболизирующихся ферментами цитохрома Р450 (может быть обусловлено супрессией гормона роста). Поскольку невозможно исключить подобные эффекты окреотида, ЛС, метаболизирующиеся ферментами системы цитохрома Р450 и имеющие узкий терапевтический диапазон доз, следует назначать с осторожностью.
Известно, что введение октреотида в дозе до 2000 мкг в виде п/к инъекции 3 раза в течение нескольких месяцев переносилось хорошо.
Максимальная разовая доза при в/в болюсном введении взрослому пациенту составляла 1000 мкг. При этом отмечались такие симптомы, как снижение частоты сердечных
сокращений, "приливы" крови к лицу, абдоминальная боль спастического характера, диарея, тошнота, ощущение пустоты в желудке. Все эти симптомы разрешились в
течение 24 часов с момента введения препарата. Одному пациенту по ошибке методом длительной инфузии была введена избыточная доза октреотида 250 мкг/ч (вместо
25 мкг/ч), что не сопровождалось побочными эффектами. При острой передозировке не было отмечено каких-либо опасных для жизни реакций.
Читайте также:

