Оборудование для лечения опухолей

Технология declipseSPECT, представленная компанией SurgicEye, основана на применении трехмерной визуализации и навигации в радиохирургии. Данная технология объединяет трехмерную визуализацию и просмотр изображений как инструмент проведения резекции маркированных структур, таких как опухоли, метастазы и сторожевые лимфоузлы. Возможно определение местонахождения и точная дифференциация даже малых и глубоких патологических очагов. DeclipseSPECT — это новый инструмент, обеспечивающий проведение хирургических операций по удалению опухолей с минимальным вмешательством и в полном объеме.
Биопсия сторожевого лимфоузла. Молочная железа
Обзор распространения активности в 3D обеспечивает обнаружение скрытых сторожевых лимфоузлов, которые расположены вблизи опухоли или за ней, что позволяет осуществлять минимальное, но при этом полное удаление всех сторожевых лимфоузлов. Кроме этого, возможно документирование необходимых данных с изображениями.
Биопсия сторожевого лимфоузла. Меланома
Получение трехмерных изображений позволяет точно определить локализацию и выполнить разрез под визуальным контролем, а также получить оптимальный результат с эстетической точки зрения благодаря операции с минимальной инвазивностью.
Биопсия сторожевого лимфоузла. Голова и шея
Измерение глубины позволяет осуществлять прямой, наименее инвазивный доступ с анатомической точки зрения, благодаря чему снижается болезненность и, в то же время, упрощается процедура полного удаления узлов.
Радиоуправляемая локализация скрытого опухолевого узла. Молочная железа
Интраоперационная визуализация позволяет осуществлять исследование образца после резекции и контролировать границы на основании прямой визуальной оценки, что способствует снижению частоты возникновения рецидивов и проведения повторных операций.

Медицинский мобильный линейный ускоритель электронов Mobetron2000 предназначен для проведения облучения онкологических больных во время операционного вмешательства непосредственно в операционной. Он позволяет подводить высокую дозу электронного излучения с энергией от 4 до 12 МэВ непосредственно к ложу опухоли после ее удаления. Подготовка к облучению занимает несколько минут, а время облучения составляет, к примеру, около 20 секунд для получения дозы в 10 Грэй на поле облучение диаметром 6 см.
Ускоритель представляет собой мобильную консоль с подвижной излучающей головкой. Перемещение ускорителя и движение всех его частей осуществляется с помощью встроенных прецизионных электродвигателей. Управление ускорителем производится с помощью ручного пульта дистанционного управления, и с помощью основного пульта управления, который располагается в соседнем с операционной помещении. Электронное излучение подводится непосредственно к полю облучения с помощью металлических цилиндрических коллиматоров, называемых аппликаторами. В комплект ускорителя, кроме основного излучающего блока и пульта управления, входят набор аппликаторов различного диаметра, с различными углами скоса на концах, защитные диски для защиты пациента и комплект дозиметрического оборудования для настройки и контроля качества работы ускорителя.
Во многие клиники техника уже поступила. Это - одно из направлений нацпроекта "Здоровье". В основе работы аппаратуры - использование радиоактивных препаратов, которые медики окрестили "умными пулями".
Несколько минут в гамма-камере и вот она, радиоизотопная диагностика в действии, точнее на экране врачебного монитора. Это две проекции тела пациента: вид спереди и сзади. Красные области - повышенное накопление радиоактивного фармпрепарата. На этом снимке - в телах позвонков, грудине и костях таза, то есть злокачественные образования там.
Еще полгода назад в институте Герцена такое исследование проводили в два этапа. У врачей на него уходило гораздо больше времени, у больных - сил. И то, и другое иногда играет решающую роль в выздоровлении.
Валерий Чисов, главный онколог Минздрава РФ: "Цель программы - добиться раннего выявления онкологических заболеваний. Если мы этого добьемся, то значительная часть больных будет подвергнута местному хирургическому лечению и только небольшая часть будет подвергнута лучевому лечению, химиотерапии".
Не всякая радиация убивает, здесь та, которая лечит, с порога заявляют впервые попавшим в так называемые чистые помещения завода. За свинцовыми стенами в спецлаборатории спецруки производят чудодейственные пилюли. На языке ученых-разработчиков – радиофармперпараты или умные пули.
Олег Егоров научный консультант ФГУП "Завод медрадиопрепарат" ФМБА России: "Это те препараты, которые позволяют доставлять источник радиации, изотоп, непосредственно к очагу заболевания".
Радиоактивная глюкоза для диагностики распространения опухолей, радиоактивный йод для лечения. Например, опухоли щитовидной железы. Это совместный проект Минздрава и Росатома по созданию фармацевтических препаратов нового поколения. Чем активнее разработки ядерной физики будут использоваться в онкомедицине, полагают врачи, тем быстрее онкодиагностика достигнет уровня западноевропейских стран.
Линейный ускоритель электронов - комплекс, используемый в лучевой терапии. Аппарат такого класса единственный в России, их всего 2 в Европе. За последние 20 лет медицина не просто шагнула вперед, она взлетела, признаются медики.
С одной стороны, это облегчает их работу, но с другой - неимоверно осложняет: на этой научной высоте им необходимо задержаться ненадолго, чтобы осмыслить всю эту науку.
Лечение с помощью этого аппарата - это почти радиохирургия, когда важна каждая десятая миллиметра. В облучении опухолей головного мозга или, например, глаза, где малейшая неточность может просто лишить пациента зрения. Раньше при таких показаниях врачи вообще за это не брались.
Сегодня такое лечение доступно пациентам в столице, второй комплекс совсем недавно заработал в Хабаровске. До 2015 года онкологическая программа в рамках нацпроекта "Здоровье" должна встать на европейские рельсы, заявляют в Минздраве.
Подобное суперсовременное медицинское оборудование появится в 38 онкоцентрах в разных регионах России. В этом году в Челябинске открылся первый региональный ПЭТ-центр. Позитронно-эмиссионная томография - самая передовая и сложная диагностическая процедура. До этого ее можно было пройти только в Москве и Санкт-Петербурге.
Андрей Важенин главный врач Челябинского онкологического центра: "Это поиск микрометастазов, это оценка ответа на химиолучевое лечение в течение первой недели".
В области возможностей ранней диагностики и контроля лечения Южноуральский регион уже назвали лидером. Но помощь здесь будет оказываться и пациентам из других округов и даже гражданам других государств. Кроме того, в ближайшие годы в России появятся три центра протонной терапии: в Обнинске, Томске и Димитровграде. Где будут лечить больных, которым противопоказано или не подходит хирургическое вмешательство.
По прогнозам ученых, все это ежегодно позволит спасать около 4 с половиной тысяч жизней. И результат уже есть - за три месяца этого года медики впервые отмечают снижение - почти на процент - смертности от рака.
HIFU — ТЕРАПИЯ
HIFU — терапия расшифровывается как High Intensive Focused Ultrasound — высокоинтенсивный сфокусированный ультразвук, или ее еще называют ультразвуковая абляция .
Ультразвуковая абляция (HIFU) — самый современный в мире неинвазивный (дистанционный) метод локальной деструкции опухолей. Метод HIFU основан нана генерации ультразвуковых лучей которые безвредно распространяются через здоровые ткани и фокусируются в заданной фокальной области для достижения лечебных целей. Энергия в фокальной области достаточно высока чтобы вызвать немедленную термическую абляцию при температуре выше 56С, что в свою очередь вызывает коагуляционный некроз. Лечение осуществляется без повреждения кожных покровов, окружающих здоровые ткани и органы.

Метод ультразвуковой абляции является передовой технологией и применяется для лечения в сфере гинекологии (миома матки, аденомиоз), онкологии (первичные и вторичные опухолевые поражения печени, рак поджелудочной железы) и урологии (рак почки).
УЛЬТРАЗВУКОВАЯ АБЛЯЦИЯ ХАЙФУ
МЕЖДУНАРОДНЫЙ ПАТЕНТ
ПРЕИМУЩЕСТВА HIFU АБЛЯЦИИ ПОД ВИДЕОКОНТРОЛЕМ:
| ВИД | УЛЬРАЗВУКОВОЙ КОНТРОЛЬ (US) | ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС (MR) |
|---|---|---|
| Индуктивное изображение | В реальном времени | Требуется реконструкция изображения |
| Точность процедуры | За счет реального изображения повышается точность процедуры | Точность процедуры не высокая |
| Количество процедур | Для лечения достаточно 1-й процедуры | В обычной практике требуется от 2 до 5 процедур. |
ПРИНЦИП УЛЬТРАЗВУКОВОЙ АБЛЯЦИИ

ЛЕЧЕНИЕ ЗА 1 ПРОЦЕДУРУ
- Уникальное оборудование HIFU терапии модели Haifu JC для безоперационного лечения рака позволяет всего за 1 неивазивную процедуру полностью уничтожить злокачественное или доброкачественное опухолевое образование.(некоторые виды опухолей требуют повторное лечение).
УНИКАЛЬНЫЙ НЕИНВАЗИВНОЙ МЕТОД ЛЕЧЕНИЯ ОПУХОЛЕЙ
ПРЕИМУЩЕСТВА МЕТОДА HIFU ( Хайфу):
- Отсутствие опасности в инфекционном заражения;
- Отсутствие раны или операционного разреза;
- Отсутствие кровотечения;
- Отсутствие боли;
- Абляция нескольких опухолей за одну процедуру;
- Опухоли размером от 1 до 10 см. (время процедуры зависит от размера и месторасположения опухоли).

ОСОБЫЕ ПРЕМУЩЕСТВА ХАЙФУ АБЛЯЦИИ
НЕИНВАЗИВНЫЙ МЕТОД ЛЕЧЕНИЯ
- Экстракорпоральный неинвазивный метод лечения
- Без единой капли крови или нарушения целостности кожного покрова опухоль сжигается высокоинтенсивной, сфокусированной, ультразвуковой волной. Поэтому у пациента снижается стресс от предстоящей процедуры а ее проведение возможно за короткий период времени.
- Так как Хайфу Нож воздействует только на опухоль окружающие опухоль ткани или органы остаются нетронутыми. Например, при удалении миомы матки ни сама матка, ни детородные органы не затрагиваются.
МГНОВЕННОЕ ПОЛУЧЕНИЕ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ:
- Мониторинг и лечение в реальном времени;
- Отмечены случаи возникновения антиопухолевого иммунитета в процессе поглощения телом остаточного материала после некроза (уничтожения) опухоли.
БЕЗОПАСНОСТЬ ПОВТОРНОГО ЛЕЧЕНИЯ:
- В лечении НЕ применяется радиация, поэтому отсутствует опасность радиоактивного заражения;
- Воздействие ультразвуком безопасно для организма, поэтому вторичное лечение на других участках или другие опухолевые образования безопасно;
- Безопасная абляция злокачественных опухолей, прилегающих к основным кровеносным сосудам.
МЕХАНИЗМ УЛЬТРАЗВУКОВОЙ АБЛЯЦИИ
Несколько механизмов непосредственно вовлечены в повреждение ткани, вызванное Ультразвуковой абляцией (UA). Первый — это тепловой эффект от преобразования механической энергии в тепло в целевой ткани, тепловой эффект зависит от температуры, достигнутой во время ультразвуковой абляции (UA). Если повышение температуры выше порога 56 ℃, а время экспозиции составляет одну секунду, необратимая гибель клеток будет вызвана некрозом коагуляции. Фактически, температура в фокальном объеме может быстро повышаться выше 80 ℃ во время ультразвуковой абляции (UA).
Вторая — акустическая кавитация, наличие небольших газообразных ядер, существующих в субклеточных органеллах, и жидкость в ткани — источник кавитации, который может расширяться и сжиматься под воздействием акустического давления, составляет более нескольких тысяч Паскалей, а температуры достигают нескольких тысяч Градусов Цельсия, что приводит к повреждению тканей.
Повреждение сосудистой сети опухоли, вызванное Ультразвуковой аблацией (UA), может объяснять третий механизм целевого некроза тканей. Он может непосредственно прекратить кровоснабжение опухоли путем разрушения сосудов, питающихся опухолью, что вызывает лишение пищи и кислорода для опухолевых клеток, что косвенно приводит к некрозу коагуляции.
Фактически, невозможно отличить тепловые эффекты от акустической кавитации или повреждения сосудов при ультразвуковой абляции (UA), и они могут происходить одновременно в пределах целевой ткани. Поэтому некроз коагуляции, индуцированный ультразвуковой аблацией (UA), можно рассматривать как результат биологических эффектов от сочетания тепла, кавитации и разрушения сосудов на ткани.
Показания к применению:
• Солидные опухоли мягких тканей;
• Таких как опухоли печени;
• Миомы матки;
• Рак молочной железы;
• Опухоли почек;
• Опухоли поджелудочной железы;
• Опухоли кости.
Противопоказания:
• Опухоли в воздухосодержащих внутренних органах, такие как лёгкие, желудок и кишечник;
• Опухоли средостения;
• Опухоли позвоночника.
Клинические преимущества:
• Неинвазивное лечение для сохранения органов и структур без переливания крови и отсутствия излучения;
• Конформная и точная абляция;
• Одноразовая обработка без ограничения размера и формы опухоли;
• Ультразвуковая терапия в режиме реального времени с цифровым количественным анализом;
• Активация иммунной системы.

Рак печени
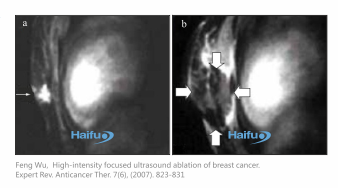
Рак молочной железы
МРТ с контрастным усилением показывает полный некроз рака молочной железы, обработанного HIFU. (а) до лечения, повреждение груди ограничено, и контрастное поглощение обнаруживается в опухоли (стрелка) и нормальной ткани, окружающей опухоль; (b) через 7 дней после HIFU, отсутствие поглощения контрастной в абляционном объёме (стрелка), включая опухоль и запас с обработанной нормальной ткани груди около 1,5-2,0 см вокруг опухоли.
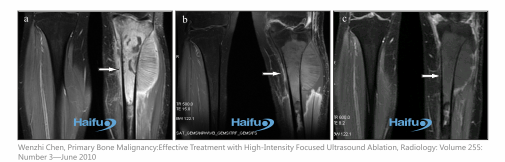
Опухоль кости
Увеличение изображения МР полученные у 18-летней женщины, которая была абляция HIFU для большеберцовой остеосаркомы. (а) изображения перед HIFU показывают одно гиперваскулярное поражение (стрелка) в левой большеберцовой кости. Изображение (b) 2 недели и (с) через 36 месяцев после HIFU не показывают никакое доказательство повышения в обработанной области (стрелки). 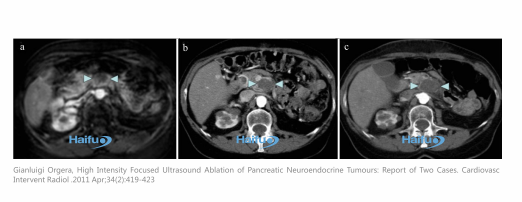
Рак поджелудочной железы
43-летняя женщина с опухолью поджелудочной железы. (а) МРТ до HIFU показывает 2,4-см поражения (наконечники стрел). (b) МДКТ проводится после HIFU через 24 часа, показывает абляцию всего поражения (наконечники стрел). (с) сканирование MDCT через 9 месяцев после лечения показывает, что поражение кажется немного уменьшенным по размерам, но широко гипотензивным и без остаточной усиливающей области (наконечники стрел).
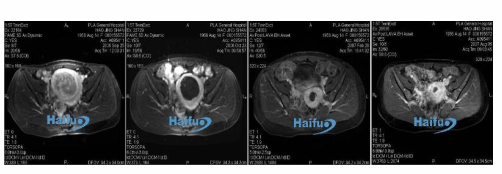
Миома матки
Улучшенные изображения МРТ 37-летних женщин с миомой матки. До лечения миомы имела обильное и активное кровоснабжение. Через 14 дней после лечения, фибромы показывает очевидную атрофию и теряет активность. МРТ-исследование 4,5 месяца и 10 месяцев после лечения HIFU показали, что у обработанных миомы очевидную атрофию.

Главный внештатный радиолог Минздрава РФ, руководитель отдела лучевой терапии МНИОИ имени Герцена — филиала ФГБУ "НМИЦ радиологии" Минздрава РФ профессор Евгений Хмелевский в интервью РИА Новости рассказал о последних достижениях в лечении онкологии с помощью лучевой терапии, о том, когда чаще всего сегодня выявляется рак, и почему за отказ от прохождения медосмотра нужно лишать медицинской страховки. Беседовала Людмила Белоножко.
— Евгений Витальевич, насколько успешно сегодня лечится рак с помощью лучевой терапии?
— Современные методы лучевой терапии позволяют добиваться эффекта даже в сложнейших ситуациях, например, при метастатическом поражении скелета в более чем 90% случаев. При этом мы можем получать полный эффект более чем у 60-70% больных. Полный эффект означает, что в зоне воздействия у нас никогда больше не возникнет никакая неприятная ситуация, связанная с опухолевым ростом.
При тяжелейшей ситуации — метастатических поражениях головного мозга современная лучевая терапия тоже нередко позволяет получать очень стойкие многолетние эффекты благодаря как новым знаниям в области онкологии и радиобиологии, так и развитию радиотерапевтической техники. И этот прогресс особенно ощутим в течение последнего десятилетия, когда массово стали производиться аппараты, позволяющие подводить очень высокие дозы к очагам поражения без заметных рисков повреждения здоровых тканей. А это и является одной из основных задач при проведении лучевой терапии. Эти же методы мы сегодня используем при так называемой радикальной лучевой терапии, когда она является тем самым единственным методом, позволяющим полностью подавить рост какого-либо злокачественного новообразования.
Есть ситуации, когда лучевая терапия выступает и в качестве единственного метода, причем нередко речь идет о доброкачественных процессах. Доброкачественных по форме, но не по сути. Например, если доброкачественная опухоль расположена на каком-нибудь из нервных стволиков, вызывает массу неприятных ощущений и пусть медленно, но растет, а хирургическое лечение при этом невозможно. Единственный способ, позволяющий полностью излечить человека в такой ситуации — это современная лучевая терапия.
— А какие методы сегодня доступны в современной лучевой терапии?
— К примеру, методы так называемого стереотаксического облучения, когда очень высокие уровни очаговых доз можно подводить к очень маленьким, например, несколько десятков кубических миллиметров или несколько кубических сантиметров с очень высокой точностью. А точность эта сегодня измеряется миллиметрами, иногда даже десятыми миллиметра, и именно это позволяет нам рассчитывать на то, что соседние здоровые структуры останутся абсолютно целыми.
— То есть луч направляется точно на опухоль и не задевает здоровые ткани?
— Оптимальный вариант — когда мы, во-первых, точно знаем, где расположена опухоль, и, во-вторых, какая это опухоль — тогда, соответственно, можем действительно эффективно воздействовать только на опухолевые ткани.
Следующий этап — реализация этой самой программы, когда тот план, который наши коллеги-физики рассчитали, мы воплощаем в жизнь с помощью конкретной установки — сегодня чаще — с помощью медицинских ускорителей электронов. Это тоже очень сложный процесс, требующий большого внимания и контроля. Постоянный контроль за поведением сеансов лучевой терапии сегодня является непременным условием качественной реализации сложных методик лучевого лечения.
— В каждой ситуации индивидуальный подход?
— Абсолютно точно. Каждая программа индивидуальна. Строится только с учетом особенностей конкретного пациента. У нас есть, конечно, методики, которые очень похожи одна на другую, но тем не менее все детали, касающиеся конкретного человека, обязательно учитываются — анатомические, биологические особенности и, естественно, особенности течения его заболевания. Это и есть наша основная работа — учесть индивидуальные особенности в каждом конкретном случае.
— Какие еще методы лечения лучевой терапии сегодня распространены?

— Еще один вариант — системная лучевая терапия. Как правило, говоря о лучевой терапии, мы почти всегда подразумеваем локальные методы воздействия. Однако мы можем вводить изотопы системно — непосредственно в организм: либо практически в чистом виде, как, например, радиоактивный йод при раке щитовидной железы, либо как составную часть комплексных препаратов. Обычно эти препараты, являясь таргетными, то есть нацеленными на определенную мишень, позволяют доставить изотоп непосредственно в зоны опухолевого роста, создавая очень высокую дозу ионизирующего излучения в участках накопления. Такие методы сегодня очень активно развиваются, и они очень перспективны с точки зрения их использования в онкологии.
Вообще, лучевая терапия развивается по нескольким направлениям: в первую очередь это, конечно, совершенствование радиотерапевтической техники, второе — это радиобиология, наше представление о том, как и где работает тот или иной вид ионизирующих излучений, ну и в конце концов это гораздо более глубокое понимание биологии опухолевого роста, более глубокое понимание того, что такое инвазия, что такое метастазирование, как эти процессы протекают, когда ждать бед от этих процессов и, наконец, когда необходимо вмешиваться, а когда за ними можно просто наблюдать.
— А сегодня и такое бывает?
— Мы действительно сегодня при целом ряде онкологических ситуаций можем себе позволить активное наблюдение. Например, при раке предстательной железы. В ряде случаев мы знаем, что этот процесс не перейдет в клинически значимую стадию даже через много лет, потому что биологические особенности опухоли очень различные. Есть опухоли, которые, с одной стороны, очень медленно растут, неплохо контролируются самим организмом и, соответственно, не требуют никаких дополнительных вмешательств. Нам остается выделить эти состояния среди прочих и сформировать индивидуальный прогноз, опираясь на данные каждого конкретного человека.
Иногда мы можем посчитать, что побочные эффекты, связанные с лечением, имеют гораздо больше негативных последствий, чем результаты роста опухоли. И мы вполне можем, даже при растущей опухоли, а уж что говорить про опухоли, которые практически не развиваются, а иногда и подвергаются саморегрессии, отказаться от активных действий. Онкологические заболевания очень многообразны. К сожалению, по большей части мы сталкиваемся с ситуациями, когда опухоли прогрессируют, но и здесь очень важно выделить те случаи, когда нам следует проявить здоровый консерватизм, активно не вмешиваясь в этот процесс, и обеспечить больному комфортное существование с помощью обычной симптоматической терапии без лишних побочных эффектов, связанных с противоопухолевым лечением.
— На какой стадии чаще всего встречается рак сегодня?

— На любой. Начиная от начальных форм, от предраковых процессов, которые иногда тоже лечатся с помощью лучевой терапии, и заканчивая последними стадиями.
Мне не очень нравится определение "некурабельный" пациент, которое иногда используют. Нет некурабельных пациентов. Да, не всегда возможно применение противоопухолевой терапии, но это не значит, что нет возможности для использования методов вспомогательной терапии. Вот и лучевую терапию не всегда можно и нужно применять. Но она показана примерно 50% онкологических больных как при ранних, так и при запущенных процессах.
— В каком возрасте на сегодняшний день чаще всего выявляется рак?

— Вообще, для разных опухолевых заболеваний он разный. Но и при одних и тех же опухолях в отдельных странах он отличается из-за не одинаковой средней продолжительности жизни. Там, где средняя продолжительность жизни приближается к 80 годам, средний возраст выявления рака приходится на возраст 60-65 лет. Однако у мужчин и у женщин эта ситуация отличается. Средний возраст женщин при выявлении рака молочной железы — около 55 лет, мужчины страдают раком предстательной железы или раком легкого — их средний возраст 60-65 лет.
Чем старше становится наше население, чем дольше оно живет, тем большим будет средний возраст онкологических пациентов. Будет расти продолжительность жизни, будет увеличиваться и количество онкологических заболеваний. Пока тенденция именно такова.
— В лучевой терапии большое значение играет оборудование. Производится ли оно у нас в стране?
— К сожалению, в течение последних 25-30 лет качественное оборудование для лучевой терапии у нас в стране не производится. Но я начинал работать в те времена, когда ускорители для лучевой терапии делались в России, и хорошие ускорители делались.
По ряду объективных и субъективных причин производство такого рода медицинской техники у нас прекратилось, но, к счастью, прекратилось не полностью. Я могу привести пример в том числе из области радиотерапии, когда на хорошем уровне изготавливается оборудование, например, для протонной лучевой терапии. В том числе под руководством члена-корреспондента РАН В. Е. Балакина создан прекрасный ускорительный комплекс для протонной лучевой терапии, который успешно используют сейчас наши коллеги в медицинском радиологическом научном центре в Обнинске. Такие комплексы — это заметный вклад в будущее нашей лучевой терапии.
Сегодня целая группа специалистов очень высокого уровня под руководством академика В. П. Смирнова готовится к серийному производству современного отечественного медицинского ускорителя электронов. Надеюсь, этот ускорительный комплекс сможет очень серьезно помочь в обеспечении массовости высококачественной лучевой терапии в стране. Да, мы можем сегодня проводить лучевую терапию на очень высоком уровне, а в отдельных учреждениях и на уникальном уровне, но важнейший признак действительно высокоразвитой онкорадиологии и онкологии в целом — массовость. И мы должны добиться того, чтобы качественный уровень характеризовал работу практически любого онкологического учреждения. Для этого нам действительно нужно очень много оборудования высокого класса. Надежда на то, что удастся обеспечить страну подобным, в том числе отечественным оборудованием, сегодня есть.
— В какие сроки это может произойти?
— К концу 2019 года первый образец такого ускорителя должен быть готов, и если не случится ничего экстраординарного, то к концу 2021-началу 2022 года можно будет говорить об успешности или не успешности создания нового отечественного ускорителя.
— Чем он отличается от тех, что производят за рубежом?
— Там есть элементы, которые, без сомнения, в лучшую сторону отличают этот ускоритель, в том числе от зарубежных аналогов. У нас блестящая школа физиков, инженеров, это и позволяет внедрять собственные разработки в создание такой техники.
— А где производится?
— Этот опытный образец создается в структуре Росатома — на базе НИИТФА, при непосредственном участии МГУ, МИФИ и других известных организаций.
— В лечении рака Россия отстает от Запада?

— Если мы говорим вообще о возможности использования в России каких-либо методик, в том числе уникальных, то почти нет. Если мы говорим о возможности массового использования очень многих методов, то да, отстаем. У нас не всегда хватает современного радиотерапевтического оборудования. Вернее, у нас редко когда в достатке современное радиотерапевтическое оборудование. Но тем не менее уникальные образцы этого оборудования у нас в стране есть.
У нас нет сейчас комплекса для ионной лучевой терапии и пока еще в стадии разработки оборудование для нейтронзахватной лучевой терапии, но нигде в мире эти технологии пока не стали стандартом. Поэтому не могу считать, что каких-то полностью отработанных уникальных технологий, за исключением, может быть, отдельных вариантов протонотерапии и таргетной радионуклидной терапии, мы сегодня лишены. Но вот в массовости мы отличаемся не в лучшую сторону: у нас есть диспансеры, которые оснащены крайне бедно.
При этом у нас есть хорошо оснащенные диспансеры, и это далеко не всегда московские клиники. В целом ситуация в стране достаточно пестрая. Но я не могу сказать, как раньше, что мы отстали на 20, на 30 лет. Сейчас этого нет. Еще лет 8-10 назад, когда формировалась программа переоснащения лучевой терапии, это отставание было гораздо более заметным. Но в то время правительство предприняло очень серьезные усилия для переоснащения радиотерапевтической службы. Эти усилия даром не пропали, хотя, к сожалению, это переоснащение полным не было. Но тем не менее есть диспансеры, которые сегодня успешно работают только благодаря реализации этой программы.
— А в каких регионах наиболее сложная ситуация с лечением онкологии?
— В среднем по стране потребность в лучевой терапии реализуется примерно на 60 с небольшим процентов. Это не значит, что везде в мире этот показатель намного выше. На самом деле в очень многих развитых странах этот процент колеблется между 70-80%, так что мы отстаем в этом смысле, но не катастрофически. Но вот в гораздо большей степени мы отстаем по качеству массово используемых технологий. Высококачественные технологии облучения, реализуемые только на современных аппаратах, мы сегодня можем использовать далеко не во всех регионах.
— Планируется ли строительство крупных онкологических центров в России в ближайшее время?
— Планируется. Большой центр планируется в Калининграде, необходим гораздо более современный диспансер в Калмыкии. Собираются серьезно модернизировать онкологический центр в Саратове, где и так, в общем, неплохо онкологическая служба функционирует, но тем не менее в таких крупных и серьезных регионах России нужно иметь действительно многофункциональные онкологические центры в том числе с развитой службой лучевой терапии.
Регионам, как правило, необходимо самим определяться с возможностями реализации таких проектов. Далеко не всегда федеральные органы должны полностью обеспечивать этот процесс. С другой стороны, федеральные центры могут активнее помогать регионам с более реалистичной оценкой потребностей региона в лучевой терапии, с определением будущих возможных потоков пациентов, с выбором технологий, которые завтра будут наиболее востребованы. Все это позволяет формировать оптимальные конфигурации таких центров — и онкологических, и радиотерапевтических.
— Есть ли кадровый дефицит радиотерапевтов на сегодняшний день?
— Большого дефицита радиотерапевтов у нас в стране нет. У нас есть большой дефицит так называемых радиоционных технологов — среднего медицинского персонала, который принимает самое непосредственное участие в реализации лучевой терапии. А количество радиотерапевтов у нас близко к оптимальному и не очень сильно отличается от развитых европейских стран.
— Какие меры профилактики рака должен знать каждый?
— Первое то, что сегодня мы называем здоровым образом жизни. Никуда не деться от банальностей и никуда не деться от рекомендации не курить, употреблять алкоголь в очень умеренных дозах, не злоупотребляя этим. Не злоупотреблять жирной и некачестванной пищей, в том числе фаст-фудами. Заниматься спортом, давать организму физические нагрузки, тренировать свой мозг с возрастом, заставляя его работать, это бывает очень важно. Это способствует сохранению хорошего эмоционального статуса, соответственно, может уберечь нас, по крайней мере, от целого ряда негативных процессов в том числе опухолевых.
Обязательны профилактические осмотры. Восстановление этой практики на государственном уровне — непременное условие раннего выявления многих новообразований. В последующем, может быть, стоит подумать в числе прочего и о более жестких мерах в отношении людей, которые не соблюдают режимы наблюдения, подвергая свой организм опасности более позднего выявления заболеваний. Среди таких мер может рассматриваться, например, полное или частичное лишение медицинской страховки. Мы не были бы новаторами в этом смысле. В целом ряде стран существуют подобные механизмы, заставляющие человека внимательнее относиться к собственному здоровью. Я не хочу сейчас сказать, что эти мероприятия всегда будут обеспечивать спокойствие, но тем не менее никому пока не удалось оспорить правило: рано выявленный опухолевый процесс лечится лучше.
Читайте также:

