Новый метод лечения рака в академгородке


Что такое химиоэмболизация?
Ким: Эмболы — изготовленные из медицинского пластика микросферы ультрамалого диаметра. При попадании в воду или лекарственный раствор они набухают. Благодаря этому свойству их можно использовать как транспорт, проводник лекарственных препаратов: по кровеносным сосудам доставить нужное средство точно к пораженному органу. В онкологии с помощью эмбол в опухоль вводят препараты для химиотерапии — цитостатики или другие, назначенные врачом.
Для каких пациентов показана химиоэмболизация?
Басс: На сегодняшний день в России по статистике мы успешно лечим 65% онкологических заболеваний, диагностированных на ранней стадии. Однако четверть пациентов обращаются к врачам, уже когда болезнь распространилась. Тогда для эффективности борьбы с опухолью в онкологии используют комбинированное сочетание многих методов — хирургического, лекарственного, используют химиотерапию и лучевую терапию.
Основная категория пациентов — люди с 2-4 стадией онкологических заболеваний. Есть категория пациентов, которым могла бы помочь химиотерапия или хирургический метод, но по сопутствующему статусу и набору заболеваний или по возрасту у доктора есть опасения, что их организм эти методы может просто не вынести. В этом случае химиоэмболизация также показана и высокоэффективна. Иногда даже этот метод позволяет вернуться к обсуждению хирургического лечения.
Справка. В России на 100 тыс. населения приходится 380-420 случаев онкологических заболеваний. Старт заболеваемости приходится на 45 лет, пик на 55-63 года. Самые распространенные типы онкологии — рак толстой и прямой кишки, молочной железы, желудка.
Для ряда онкологических заболеваний характерно бессимптомное течение на ранних стадиях, что затрудняет диагностику. В целях ранней выявляемости онкологических заболеваний показаны эндоскопические методы исследования внутренних органов (фиброгастроскопия, колоноскопия), УЗИ, анализы крови на онкомаркеры.
Как проводится процедура?
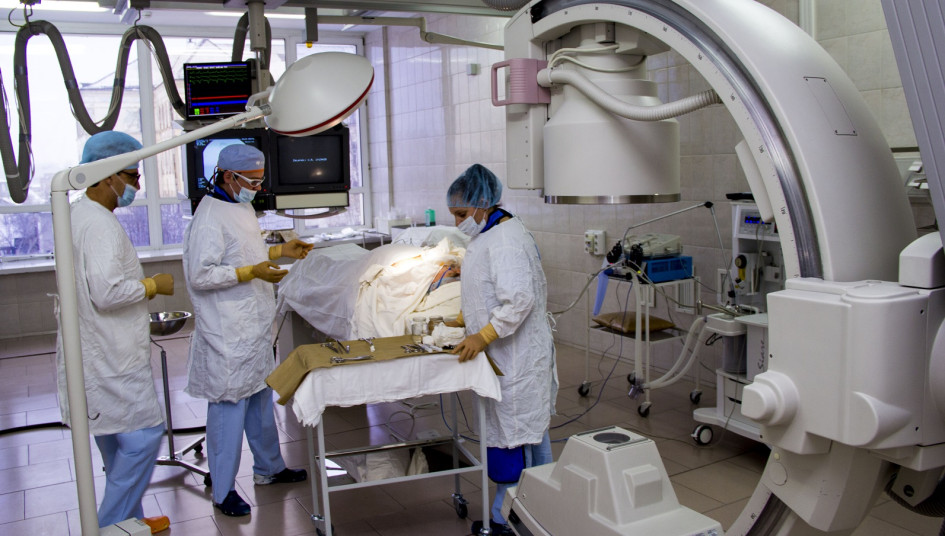
В чем уникальность процедуры, как она переносится?
Ким: Большой плюс в том, что при проведении общей химиотерапии невозможно создать такую концентрацию в пределах опухоли, организм просто может не выдержать. Цитостатики — довольно токсичные препараты. При химиоэмболизации мы не отравляем побочно весь организм, а несем заряд именно к новообразованию. Отсюда — действие препарата пролонгировано во времени, а побочные эффекты сведены к минимуму, в отличие от обычной химиотерапии.
Басс: Химиоэмболизация лучше переносится пациентами, имеет менее протяженный по времени восстановительный период после процедуры. После химиоэмболизации человек день-два наблюдается в отделении, и, если жалоб нет, выписывается домой.
Есть ситуации, когда химиоэмболизация может оказать особенную помощь. Многие операции при онкологии могут повлечь изменение работы систем внутренних органов, что не лучшим образом отражается на последующем качестве жизни, — я говорю, например, о новообразованиях органов пищеварительной системы. Пациенты теряют вес, испытывают большие неудобства. Химиоэмболизация позволяет добиться многого менее травматичными способами.
Химиоэмболизация может заменить собой химиотерапию или хирургический метод?
Куда обращаться за консультацией по химиоэмболизации в Новосибирске?

Имеются противопоказания, необходима консультация специалиста
Лицензия ЛО-54-01-004-388 от 6 июня 2017 года
Так выглядит центр ядерной медицины, который построили за два года. Это филиал петербургского Медицинского института имени Сергея Березина (МИБС)
Фото: Александр Ощепков
В середине декабря в Новосибирске открылся центр ядерной медицины МИБС (Медицинский центр имени Сергея Березина), в котором есть установка Гамма-нож — она позволяет удалить опухоль головного мозга пациентам за пару часов без оперативного вмешательства, и на следующий день они могут пойти на работу. Журналист НГС посмотрел, как работает центр, как совместно трудятся медики, физики и химики и как производятся радиофармпрепараты.
Владимир Краснюк показывает, где и как проходит подготовка к лечению с помощью Гамма-ножа
Фото: Александр Ощепков
Это сама установка Гамма-нож последней модели
Фото: Александр Ощепков
— Пациент по каким-то причинам сделал МРТ головного мозга — ему на исследовании сказали, что есть подозрение на какое-либо образование, ввели контраст и увидели, что действительно есть предполагаемая опухоль. Неважно: доброкачественное или злокачественное образование выявлено, тем не менее пациент будет проконсультирован нейрохирургом и рассмотрит вариант открытого вмешательства, удаления — как один из возможных. Удаление образования в головном мозге само по себе травматично и не подходит для ряда пациентов. И тут появляемся мы с возможностью радиохирургии, — объясняет врач-радиохирург Владимир Краснюк.
Фиксирующая рамка, которая крепится на голову пациента — в ней голова становится неподвижной, при этом все остальные части тела могут двигаться
Фото: Александр Ощепков
Во время лечения врачи видят и слышат пациента, могут даже прервать процесс, если пациенту нужно попить или сходить в туалет
Фото: Александр Ощепков
Он добавил, что сама по себе радиохирургия — это однократное высокодозное высокоточное облучение очага в головном мозге. Для того чтобы эти нюансы были учтены, используется фиксирующая система.
— Рамка фиксируется на голове: две точки фиксации на затылке, две — на лбу. Внутри неё голова неподвижна. Она фиксируется к надкостнице. Делается это под местной анестезией, поэтому человек особого дискомфорта не испытывает. Во время процедуры установки рамки пациент сидит в кресле. Всё, что есть в этой рамке, оказывается у нас в системе координат. Каждую точку в голове мы можем определить по трём осям. В этой рамке мы выполняем снимки — это тонкосрезовое, высокоточное МРТ с контрастным усилением, дополнительно мы можем использовать компьютерный томограф, — показывает рамку Краснюк.
Это палата для пациентов, в которой они лежат в фиксирующей рамке, пока врачи разрабатывают план лечения, и после окончания процедуры
Фото: Александр Ощепков
После этого пациент какое-то время находится в палате: в этой рамке можно прилечь, смотреть телевизор, есть, заниматься своими делами — особо на качество жизни это не влияет.
— Пока пациент отдыхает в палате, мы занимаемся планированием самой радиохирургии — разрабатываем план лечения. У нас есть планирующие станции, куда загружаются данные МРТ и КТ. И мы можем, зная точные координаты мишени, планировать всё таким образом, чтобы распределение дозы на лечение не превышало погрешность 0,3 миллиметра. Когда план лечения готов, пациент проходит непосредственно в сам Гамма-нож. Самому маленькому моему пациенту — шесть лет, самому пожилому — 90 лет. Все спокойно перенесли, — говорит Владимир Краснюк.
В центре много отделений, которые полностью изолированы от других — с отдельными входами
Фото: Александр Ощепков
Человек занимает удобное для него положение: голова неподвижна, а руки и ноги двигаются. Он находится в сознании и не испытывает дискомфорта. Некоторые пациенты любят поспать на процедуре, некоторые — слушают музыку.
— Самое короткое лечение, которое у меня происходило, — 14 минут, самое длительное — более трёх часов. Не принято проводить сеансы более двух часов. Но в исключительных случаях по медицинским показаниям может быть и три часа. Врачи видят и слышат пациента в процессе, разговаривают с ним. Он может кашлять, чихать, говорить. Если нужно в туалет или, к примеру, попить, то можно прервать лечение, а потом продолжить с момента остановки. После лечения, когда снимаем рамку с головы, из негативного у нас остаются четыре точки фиксации в виде ранок, как порез на пальце. Они обрабатываются, накладывается повязка на голову, но на следующий день беспокойства эти места не вызывают. Всё затягивается через 7–10 дней, — говорит врач.
Кабинет, в котором делают томографию
Фото: Александр Ощепков
Пациенту назначается соответствующая терапия и даются рекомендации — в зависимости от того, какое конкретно образование было. Через час-два после наблюдения пациент может идти домой.
— В принципе получается достаточно интенсивный для человека день, но за этот день мы полностью проводим лечение. На следующий день человек, как правило, может приступить к своим повседневным делам, — заверяет Владимир Краснюк.
Это лаборатория химиков, которые занимаются радиофармпрепаратом для ПЭТ/КТ
Фото: Александр Ощепков
Только этот центр — негосударственное учреждение, поэтому операции платные — от 200 до 285 тысяч рублей. Но, по словам директора Медицинского центра имени Сергея Березина Анны Беспаловой, вести переговоры о них с региональным минздравом они будут. По крайней мере квоты возможны на другие важные процедуры, которые тоже делаются в этом центре. Например, на ПЭТ/КТ — позитронно-эмиссионную томографию (гибридный метод ядерной медицины, который позволяет оценить метаболизм в тканях. Он необходим для оценки распространения опухолевого процесса, эффективности от проведённого лечения, оценки динамики развития опухолевого процесса. — Прим. ред.). Раньше пациентам из Новосибирска приходилось ездить на ПЭТ/КТ в другие города, как правило, в Красноярск.
Сам циклотрон, в котором создаются радиофармпрепараты, находится в подвале, а это пульт управления
Фото: Александр Ощепков
Это лифт, в который химики ставят препарат. Он попадает на второй этаж, где медсестра вводит его пациентам
Фото: Александр Ощепков
Анна Беспалова показала лабораторию, в которой работают радиохимики, синтезирующие радиофармпрепарат и проверяющие его качество. Циклотрон нарабатывает радиоактивный изотоп, который доставляется в специальные защищённые камеры, где проходит химическая реакция. Результатом этой реакции и является сам радиофармпрепарат.
Здесь пациентам вводят препарат перед ПЭТ/КТ
Фото: Александр Ощепков
Защита от радиации
Фото: Александр Ощепков
Фото: Александр Ощепков
После процедуры пациенты отдыхают в специальной комнате и уходят через отдельный выход, чтобы избежать контакта с другими пациентами и сотрудниками центра, потому что они ещё какое-то время являются источником незначительно повышенного радиоактивного фона. Пациентам даются рекомендации в этот день — по возможности находиться на свежем воздухе и избегать взаимодействия с людьми, особенно с маленькими детьми и беременными женщинами.
Так выглядит вход в МИБС
Фото: Александр Ощепков
Это специальная кухня для сотрудников, скоро для них начнёт готовить повар
Фото: Александр Ощепков
Все эти нюансы продумывались на этапе строительства. Сейчас большое внимание уделяется поиску сотрудников. Например в данный момент Анна Беспалова ищет специалиста по химиотерапии, но не хочет брать любого, чтобы быстрее запустить отделение, а ищет сотрудника, который сможет влиться в коллектив.
В центре пока много пустующих кабинетов, но Анна Беспалова не переживает на этот счёт
Фото: Александр Ощепков
— Я выбираю по степени нестандартности: здесь нет обычных людей. Многие кабинеты пока ещё пустуют: я могла бы набрать кого угодно — и невролога, и терапевта, и химиотерапевта, но я должна встретить своего человека. Гинеколога уже нашли. Врачи у нас все — звёзды, но никого с задранными носами нет, — смеётся Анна Беспалова.
Здание проектировали в Санкт-Петербурге
Фото: Александр Ощепков
В октябре в Новосибирске появился крутой томограф, который избавит некоторых пациентов от ужасной процедуры.
Если у вас есть интересная история о своём лечении, пишите журналисту НГС Марии Тищенко.

- Карты вирусной угрозы
- Анкетный онкоскрининг
- Достаточно капли крови
Продолжаем публиковать интервью с молодыми новосибирскими учеными, получившими в этом году премию от мэрии. Наша очередная собеседница – аспирант лаборатории биохимии нуклеиновых кислот Института химической биологии и фундаментальной медицины СО РАН Светлана Гапонова. А премией ее наградили за разработку миРНК-направленных противоопухолевых препаратов на основе терапевтических нуклеиновых кислот.
– Светлана Константиновна, расскажите вкратце, в чем заключается суть работы, отмеченной премией?
– Научная группа, в состав которой я вхожу, создает искусственные ферменты – рибонуклеазы, которые расщепляют молекулы РНК, а точнее короткие последовательности, которые называют микроРНК или миРНК. Именно эти молекулы регулируют такие важные процессы в жизни клетки, как рост, деление, запрограммированная клеточная смерть и т.п.
– Каким образом это связано с противоопухолевой терапией?
– Исследования показали, что в ходе развития онкологических заболеваний происходит резкое увеличение уровня активности части миРНК. Наши препараты расщепляют эти мРНК, что, в свою очередь, замедляет процессы роста и деления клеток опухоли.
– А как этот препарат отличает раковые клетки от нормальных?
– На сегодня одна из главных проблем, которую приходится решать разработчикам противоопухолевых препаратов – это создание эффективных средств доставки действующего вещества внутрь клетки. Мы используем в качестве доставщиков маленькие частицы на основе липидов – липосомы, на поверхность которых добавляем фолиевую кислоту. Некоторые раковые клетки, в отличие от здоровых, обладают большим количеством рецепторов к фолиевой кислоте, и поэтому они поглощают липосомы, начиненные лекарственным препаратом, а обычные их игнорируют.
– Зачем вообще искать новые способы терапии вместо того, чтобы усовершенствовать имеющиеся – химиотерапию, радиотерапию?
– На данный момент химиотерапия является наиболее эффективным подходом для лечения онкобольных, однако данный способ крайне токсичен для здоровых тканей организма. И, хотя сочетание хирургии, радиационного облучения и химиотерапии остается золотым стандартом лечения онкологических больных, очень часто даже эта комбинация, увы, остается бессильной помочь пациенту. Поэтому, кроме усовершенствования традиционных способов терапии есть настоятельная необходимость разработки новых подходов к лечению злокачественных заболеваний. А направление, в котором мы работаем сегодня считается одним из наиболее перспективных.
– На какой стадии находятся исследования, которые проводит Ваша группа?
– Мы провели исследования на клеточных культурах и даже первые эксперименты на животных, показали, что наши препараты эффективно подавляют опухолевый рост.
– Речь идет о каких-то конкретных видах онкологических заболеваний?
– Дело в том, что нашими мишенями являются миРНК, уровень которых нарушен в очень многих типах раковых опухолей. Поэтому, в целом, наш подход к лечению онкологии можно назвать универсальным, хотя, конечно, в зависимости от заболевания, могут требоваться свои протоколы лечения.
– А играет роль, насколько рано удалось диагностировать заболевание?
– Безусловно, чем раньше диагностируется заболевание, тем выше эффективность терапии. Однако особенности лечения на каждом этапе развития онкопатологий ещё только предстоит изучить. Равно как и ряд других важных моментов. Например, сейчас мы намерены исследовать, насколько эффективно применение наших препаратов на опухолевых моделях, когда опухолевый узел удаляется хирургическим путём и стоит задача – не допустить рецидивов заболевания.
– У Вас уже есть потенциальные партнеры для проведения клинических исследований?
– Наша работа поддерживается грантами РНФ, и для одного из грантов обязательным условием является наличие таких партнеров, способных в дальнейшем инициировать клинические испытания разработанных препаратов. Поэтому мы сейчас, как говорится, открыты для такого рода предложений.
– Вы несколько раз подчеркнули, что эту работу проводите в составе группы Ваших коллег. Расскажите, кто в нее входит, помимо Вас.
– Прежде всего, это заведующая лаборатории Биохимии нуклеиновых кислот ИХБФМ СО РАН д.б.н., проф. Зенкова Марина Аркадьевна; мой научный руководитель к.б.н. Патутина Ольга Александровна и наши коллеги из Университета Манчестера (Манчестер, Великобритания) во главе с проф. Биченковой Еленой Владимировной. Также неоценимую помощь в проведении исследований оказывают сотрудники лаборатории биохимии нуклеиновых кислот ИХБФМ СО РАН: к.б.н. Сенькова А.В., д.б.н. Миронова Н.Л., к.б.н. Марков О.В., к.б.н. Марков А.В., и Гладких Д.В.


Хотя спазер, изготовленный учеными Института автоматики и электрометрии СО РАН, имеет размер всего 22 нанометра, но это довольно сложная конструкция. В центре - наночастицы золота, они окружены оболочкой со специальным красителем. Кроме того, к спазеру "пришили" молекулы фолиевой кислоты, которые должны обеспечить доставку наноконструкции точно по адресу - в раковую клетку. Дело в том, что опухоль жадно поглощает необходимую им для роста фолиевую кислоту, а вот у обычных клеток аппетит намного скромнее. По данным приведенным в статье, опубликованной авторами в Nature Communications, если около 75 процентов спазеров проникают внутрь раковых клеток уже через полчаса инкубации, то в здоровые за это же время проникает лишь 5-11 процентов частиц.
Когда опухоль "заглотит" наживку, раковые клетки облучают лазером. Спазеры вспыхивают как самый настоящий мини-лазер, с высочайшей точностью указывая ученым координаты опухоли. В опытах с клеточными культурами и экспериментах на мышах помеченные раковые клетки были хорошо видны через живую ткань. По словам ученых, "они светились как звездное небо". Чем точнее удается определить расположение опухоли, тем выше шанс успешной операции. Но спазеры могут не только успешно выявлять раковые клетки, но и убивать их. Для этого, по словам авторов разработки, нужно увеличить мощность лазерного излучения.
- Когда врач удаляет опухоль, ему нужно четко видеть ее границы, и наша диагностическая методика решает эту проблему, - поясняет доктор физико-математических наук Александр Плеханов. - Но даже если опухоль удалена на все сто процентов, в организме все равно остаются так называемые блуждающие раковые клетки, они плавают в кровотоке и постепенно накапливаются в лимфоузлах, где и возникают метастазы. Если мы обнаруживаем такую блуждающую клетку, то увеличиваем мощность излучения. Под действием работы спазера внутри онкоклетки возникает нанопузырек пара, который разрушает сначала цитоплазму, а затем и мембрану. Раковая клетка буквально вскипает и гибнет. Причем все это работает при энергиях существенно ниже, чем разрешают стандарты лазерной безопасности в медицине.
Пока исследователи используют лазер в видимой области спектра, луч которого не слишком хорошо проникает сквозь ткани организма. Для диагностики этого достаточно, но для терапии на глубине маловато. Поэтому ученые намерены разработать наноконструкцию, которая работала бы в ближней части инфракрасного спектра (до 1000 нм). Это обеспечит глубину проникновения луча в ткани до 1 сантиметра, что и требуется для эффективного лечения онкобольных. Еще одно перспективное направление работы - повышение адресности препарата. Вместо фолиевой кислоты на поверхности частицы можно прикрепить антитела - тогда попадание в опухоль будет максимально точным.
На прошлой неделе в Научно-исследовательском институте патологии кровообращения (НИИПК) им. Мешалкина открылся центр радиохирургии и лучевой терапии, где будут проходить лечение онкологические больные из Сибири и других регионов страны.
Оборудование, установленное в радиологическом корпусе, в России представлено единичными экземплярами. Оно позволяет обойтись без повторных облучений и не повреждает ткани рядом с оперируемой зоной. Первые процедуры уже начались – госпитализировано 30 больных. В следующем году здесь получат бесплатное лечение более тысячи пациентов.
– Базовые знания по медицинской физике мы получили в Институте им. Герцена и Российском онкологическом научном центре, где научились работать с пациентами, – рассказал сотрудник ИЯФ СО РАН Игорь Бедный. – Подвидов рака существует огромное количество, и в каждом случае методы лечения различаются. Большую часть времени занимает подготовительная работа: расчет дозы облучения и аппаратное тестирование с помощью дозиметрической техники. По итогам подготовки мы получили все сертификаты для обслуживания аппаратуры и проведения лечения.
На вопрос, почему в НИИПК выбрали дорогостоящее импортное оборудование, а не аналогичную технику Института ядерной физики СО РАН, Игорь Бедный пояснил, что в институте пока не хватает организационных структур, которые бы эффективно продвигали на рынке многочисленные разработки.
– ИЯФ в последние годы много внимания уделяет медицинскому направлению. Это крупнейший институт в России подобного профиля, причем с собственной производственной базой, – сообщил он. – Но для активного участия в реализации таких проектов совместно с медицинскими организациями институту требуется серьезная господдержка. Технологии, которые используются для научных изысканий, могут быть использованы и в медицине, и в других областях. Но выводить товар на мировой рынок должны не институтские структуры, а профильные высокотехнологичные компании.
Решение о необходимости организовать радиологическое отделение назрело давно, поскольку не менее 15% пациентов с онкологическими заболеваниями имеют сердечно-сосудистые патологии. Две болезни, которые нужно лечить одновременно, требуют двух типов специалистов в одной клинике – кардиолога и онколога. Проводить операции на сердце, не учитывая наличие опухоли, небезопасно. То же самое касается и лечения онкологических больных с сердечными патологиями, которых теперь смогут направлять в новое отделение НИИПК имени Мешалкина другие онкологические клиники.
На открытии корпуса замдиректора департамента высокотехнологичной неотложной медицинской помощи Министерства здравоохранения РФ Елена Окунькова назвала НИИПК им. Мешалкина форпостом страны, поскольку в нем проводится самое большое в России количество сердечно-сосудистых операций. Новый губернатор области Василий Юрченко и представитель Минздрава внимательно изучили все оборудование нового корпуса и даже заглянули в палаты. Экскурсия по радиологическому корпусу доставила им удовольствие, а представителям СМИ облегчила работу – любознательный губернатор задал врачам все интересующие его вопросы о подробностях лечения и возможностях нового оборудования.
– Мы должны посодействовать, чтобы эта техника работала круглосуточно, и обеспечить вам дополнительные ставки для третьей смены врачей! – заявил Василий Юрченко, узнав, что в отделении будет проходить 4-5 операций в течение двенадцати часов.
– Такие потоки мы не осилим, – вежливо отказались медики.
Руководитель центра радиологии и лучевой терапии Ольга Аникеева пояснила, что вся диагностическая база по-прежнему остается за онкологами города и области, которые остаются отправной точкой таких пациентов. Лечение оплачивается из квот федерального бюджета. После успешного проведения операции на линейном ускорителе пациента можно в тот же день выписывать либо направлять в отделение, где он проходит основное лечение, поскольку это малоинвазивный (не требующий полостного хирургического вмешательства) метод. Впрочем, главное требование успеха остается неизменным – своевременное обращение на ранних стадиях заболевания.
- Записи сообщества
- Поиск


Стартовали клинические испытания революционного препарата BCD-100, созданного специалистами российской компании BIOCAD. Расходы только на ранние этапы разработки составили более 100 млн руб.
Результаты доклинических исследований, которые проводились на животных, доказали эффективность нового препарата в терапии самого агрессивного онкологического заболевания — меланомы. В нашей стране эта патология приводит к летальному исходу в 80% случаях. Однако проведенные испытания лекарства нового поколения позволяют дать надежду на излечение уже не 20% больных, как прежде, а вдвое большему количеству пациентов.
Особенность этой разработки – в прицельном уничтожении раковых клеток собственной иммунной системой организма без повреждения здоровых тканей. Препаратов с подобным механизмом действия в мире только два, но в России они не зарегистрированы и поэтому недоступны. В лечении неоперабельных форм меланомы современная онкология использует преимущественно химиотерапию, что позволяет задержать рост метастазов лишь в 10–20% случаев.
Введение в клиническую практику BCD-100, созданного биотехнологической компанией BIOCAD, означает выход российской медицины на принципиально новый уровень лечения метастатической меланомы и других видов раковых опухолей.
Меланома — не единственная онкологическая патология, против которой потенциально эффективен препарат BCD-100. По оценкам специалистов, он способен обеспечить положительные результаты в терапии рака легкого, почки, других локализаций. Причем BCD-100 не только не уступает зарубежным аналогам, но и во многом их превосходит. Во-первых, в препарате, созданном компанией BIOCAD, нет аминокислотных последовательностей животного происхождения, что гарантирует большую безопасность для человека. Во-вторых, вводить его требуется реже, чем импортные лекарства с подобным действием. А главное, биологическая активность российского BCD-100 выше зарубежных аналогов, поэтому и его лечебный потенциал эксперты считают более высоким.
Начавшиеся испытания будут проводиться на пациентах с распространенными формами злокачественных новообразований различных локализаций. Ближайшая задача исследователей — в клинических условиях подтвердить безопасность различных доз препарата моноклонального антитела к PD-1.
Успех первого этапа клинических испытаний позволит команде специалистов BIOCAD приступить к решению следующих задач и начать исследования эффективности и безопасности препарата у пациентов с определенными видами злокачественных опухолей. Его запуск в производство запланирован уже на 2018 год, а первыми доступ к революционному лекарству получат именно россияне.
Тем временем в лабораториях биотехнологической компании BIOCAD продолжаются разработки ряда других препаратов на основе моноклональных антител, которые будут применяться в комплексе с BCD-100 и должны многократно усилить его терапевтическое действие.
Повелители генома: в новосибирском Академгородке создают лекарство от рака и компоненты для теста на COVID-19

Фото Михаила Докукина/Сиб.фм
Далеко не все знают, что в новосибирском Академгородке ведутся передовые разработки для большой медицины. Корреспондент Сиб.фм отправился в лаборатории научного института и увидел, в каких условиях научные умы трудятся над созданием лекарства от рака молочной железы и компонентов тест-систем для диагностики коронавируса.
Институт химической биологии и фундаментальной медицины (ИХБФМ СО РАН) своё нынешнее название получил 8 апреля 2003 года. До этого он был известен, как Новосибирский институт биоорганической химии. В его стенах ежедневно проводятся исследования и рождаются разработки мирового уровня.

Обстановка в лабораториях похожа на декорации из фантастического фильма. Повсюду колбы, пробирки, дорогостоящие приборы для исследований. В научные разработки вкладываются огромные деньги.

Учёные признаются, что полученных денег всё равно не хватает для технического перевооружения.


Ровно год назад сотрудники института были удостоены Государственной премии Новосибирской области за разработку и внедрение в производство компонентов тест-систем, используемых для диагностики вирусных и бактериальных инфекций, сейчас в том числе и COVID-19.

В стенах института свой, особый мир. Учёные с блеском в глазах рассказывают о достижениях последних лет и делятся полученными результатами.
Заместитель директора института по научной работе Владимир Рихтер рассказал, что сотрудники института завершили доклинические испытания противоопухолевого препарата от рака молочной железы.

При создании лекарства разработчики взяли вирус осповакцины, которым привита значительная часть населения России, вырезали из его генома два гена, которые отвечают за способность вызывать заболевание или гибель организма, и встроили туда два других гена, усиливающих онколитическую активность.
Осенью 2020 года разработку новосибирских учёных планируют начать испытывать на людях.
В соседней лаборатории синтетической биологии ИХБФМ СО РАН разрабатывают, оптимизируют и совершенствуют технологию создания протяжённых и не только протяжённых последовательностей нуклеиновых кислот, в частности ДНК.

По словам заведующего лабораторией Георгия Шевелёва, эта технология востребована в широком спектре областей, в частности, в биотехнологии, молекулярной медицине, фундаментальных исследованиях.



Руководит лабораторией и исследованиями, которые здесь происходят, академик РАН, доктор химических наук Ольга Лаврик.

Она пояснила, что репарация ДНК чрезвычайно важна для создания онкопрепаратов.
Учёными было замечено, что восприимчивость пациентов к химиотерапии очень разная. Последовательные исследования показали, что это зависит от того, каким образом у конкретного пациента работает система репарации ДНК. Когда клинический препарат создал повреждение в ДНК, то начинает работать система репарации и эти повреждения удаляются, структура восстанавливается и раковая клетка оживает.

Она отмечает, что проведены уже доклинические испытания препарата на мышах. Они показали, что метод новосибирских учёных значительно уменьшает рост основной опухоли и понижает количество метастазов.

Также, по её словам, на этапе начала клинических испытаний всегда происходит торможение внедрения препарата, потому что это совсем другой масштаб финансирования и другой масштаб испытаний, который не может быть организован в научных лабораториях, и в этой ситуации учёным нужна господдержка.

Системами репарации ДНК также занимается лаборатория геномной и белковой инженерии. Ей заведует член-корреспондент РАН, доктор биологических наук Дмитрий Жарков.


Лаборатория также занимается поиском мишеней среди генов репарации в бактериях. Эти гены могут позволить, подавляя эту мишень, увеличивать чувствительность бактерий к антибиотикам, то есть повышать эффективность антибактериальных лекарств.
Учёные уверены в том, что пандемия приходит и уходит, а фундаментальная наука останется решать глобальные задачи, лишь бы была поддержка.
Напомним, 22 июня стало известно о том, что учёные Федерального исследовательского центра фундаментальной и трансляционной медицины проверяют новый метод борьбы с коронавирусом, который предполагает использование радикалов кислорода и света.
Читайте также:


