Новые методы лечения гистиоцитоза
Этиология заболевания не определена. Начало паталогоанатомических изменений появляется инфильтрацией эозинофильных гранулоцитов и прогрессирующей пролиферации гистиоцитов. Конечная фаза — фиброзирование с незначительной клеточной инфильтрацией. В легких обнаруживаются фиброз, гранулематоз, сотовидная перестройка разной степени выраженности.
Посредством электронно-микроскопического исследования смывов, которые получают, используя альвеолярный лаваж, выявляются тельца Х внутри альвеолярных макрофагов и гистиоцитов.
Типы гистиоцита
Выделают разные заболевания, отнесенные к группе гистиоцитозов:
- Болезнь Леттера-Сивее. Обычно возникает у детей до трехлетнего возраста, всегда летальна без своевременного лечения. Поражению подвергается кожа, кости, лимфоузлы, печень, селезенка. Частое осложнение — пневмоторакс.
![]()
Синдром Хенда-Шюллера-Крисчена. Заболевание, обычно встречающееся в раннем детстве, но бывает и у взрослых, даже пожилых людей. Поражаются в основном кости и легкие, реже — другие органы. В отдельных случаях возникает триада из костных дефектов, несахарного диабета и экзофтальма.- Эозинофильная гранулема. Это заболевание чаще всего встречается у молодых людей в 20−40-летнем возрасте. Чаще всего поражается костная система, у 20% пациентов обнаруживается легочная инфильтрация, в некоторых случаях болезнь затрагивает только легкие. Как и при синдроме Хенда-Шюллера-Крисчена, в этом случае также возможно спонтанное выздоровление. Летальный исход наступает от сердечной или дыхательной недостаточности.
Методы лечения
Поражение кожи, лимфоидных тканей, слизистых оболочек макрофаги представлены клетками Лангерганса. Лечение лангергансоклеточногогистиоцитоза в возрасте до двух лет имеет обычно хороший прогноз. Молодые больные при мультиорганном поражении находятся в повышенной зоне риска летального исхода. Из всех больных гистиоцитозом четверть имеют хороший прогноз лечения. Низкий риск определяется критериями: возраст от двух лет. Отсутствие поражения легких, печени, гемопоэтической системы, селезенки. При возрасте от двух лет и поражении этих органов пациент относится к группе высокого риска.
В лечении заболевания большое значение имеет общая поддерживающая терапия, соблюдение личной гигиены для ограничения поражения полости рта, ушей, кожи. Резекции и хирургическое вмешательство при тяжелых поражениях тканей десен позволяет уменьшить поражение полости рта, для снижения поражения кожи головы применяют селеносодержащие шампуни. Локально в зонах поражения применяются глюкокортикоиды.

Многим больным показана заместительная гормональная терапия несахарного диабета. При системных появлениях болезни больные нуждаются в наблюдении для выявления ортопедических, кожных, косметических нарушений, психологических проблем, нейротоксичности.
Химиотерапия применяется при мультиорганном поражении. В том методе используются рекомендованные Обществом гистиоцитозов протоколы, которые делятся по группам риска. При хорошем отклике на терапию практически у любого больного лечение можно останавливать.
Лучевая терапия, локальное хирургическое вмешательство показаны при заболевании с поражением кости — множественном или одной кости. Если очаги доступны в некритических зонах, рекомендуется хирургическое выскабливание. При риске нарушения функции органа, осложнений ортопедического или косметического характера, следует избегать хирургических методов.
Лучевая терапия применяется при риске деформации скелета, патологических переломов, потери зрения, разрушения позвоночников.
Гистиоцитоз у взрослых и детей с наличием мультиорганного поражения с явным прогрессированием лечится методом агрессивной химиотерапии, при плохом отклике может понадобиться трансплантация костного мозга.
Выбор терапии при гистиоцитозах определяется прежде всего распространенностью процесса. В современных терапевтических программах рекомендуется применение системной химиотерапии во всех случаях полиорганного поражения. В отношении локализованных форм существует значительное разнообразие подходов — от выжидательной тактики до проведения системной химиотерапии.
Несмотря на большие различия в стадировании болезни, различные подходы к лечению и оценке его эффективности, все клинические исследования, касающиеся гистиоцитоза из клеток Лангерганса (ГКЛ) (даже самые ранние), однозначно свидетельствуют об исключительно благоприятном прогнозе при изолированном поражении костей. В связи с этим показания к лечению этой формы гистиоцитоза из клеток Лангерганса (ГКЛ) значительно сузились.
В настоящее время назначают лечение только при наличии болевого синдрома, нарушении двигательных функций, повышенном риске инвалидизации. Вид терапевтического воздействия зависит от локализации дефекта и возраста больного. Выскабливание является методом выбора при небольших очагах деструкции в костях, не несущих большой нагрузки, и обычно сочетается с биопсией на диагностическом этапе. При более обширных очагах, а также в местах, где выскабливание может привести к недопустимому ослаблению кости, рекомендуется тре-панобиопсия с введением в очаг депо-метилпреднизолона в дозе 100—150 мг.
При неэффективности первых двух способов или в случаях поражения с труднодоступной для хирургического вмешательства локализацией рекомендуется у-облучение, за исключением детей раннего возраста. Суммарная очаговая доза облучения не должна превышать 5—8 Гр в связи с высокой чувствительностью участков поражения к облучению. При мультифокальном поражении костной системы рекомендуется проведение монотерапии кортикостероидами, например преднизолоном в дозе 1 мг/кг в сутки в течение 14 дней, или препаратами из группы растительных алкалоидов (винкристин, винбластин). Дальнейшая терапия зависит от полученного эффекта.
Имеются сообщения об успешном применении ИФН-а у взрослых, но в педиатрической практике пока нет достаточно убедительных данных о его эффективности.
При изолированном поражении кожи у новорожденных с синдромом Хашимото—Притцкера (врожденный самовылечивающийся гистиоцитоз) терапии не требуется.
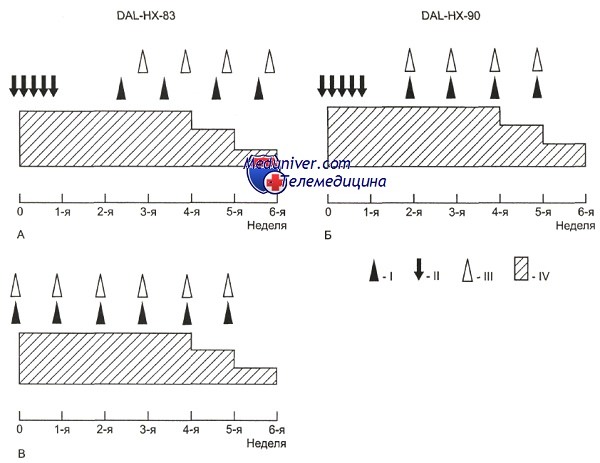
Протокол DAL-HX 83/90, интенсивная фаза.
А — все пациенты с мультисистемным ГКЛ: I — вепезид по 150 мг/м2 в сутки, дни введения: 18, 25, 32 и 39-й; II — вепезид по 60 мг/м2 в сутки, дни введения: с 1-го по 5-й; III — винбластин по 6 мг/м2 в сутки, дни введения: с 1-го по 28-й; IV — преднизолон по 40 мг/м2 в сутки, дни введения: с 1-го по 28-й.
Б — группа В — пациенты с мультисистемным ГКЛ без органной дисфункции: I — вепезид по 150 мг/м2 в сутки, дни введения: 15, 22, 29, 36-й; II — вепезид по 60 мг/м2 в сутки, дни введения: с 1-го по 5-й; III — винбластин по 6 мг/м2 в сутки, дни введения: 15, 22, 29, 36-й; IV — преднизолон по 40 мг/м2 в сутки, дни введения: с 1-го по 28-й.
В — группа С — пациенты с мультисистемным ГКЛ с органной дисфункцией: I — вепезид по 150 мг/м2 в сутки, дни введения: 1, 8, 15, 22, 29, 36-й; III — винбластин по 6 мг/м2 в сутки, дни введения: 1, 8, 15, 22, 29, 36-й; IV — преднизолон по 40 мг/м2 в сутки, дни введения: с 1-го по 28-й.
Полисистемная форма гистиоцитоза из клеток Лангерганса составляет около 25 % от всех случаев заболевания. Значительное улучшение результатов лечения при этой форме гистиоцитоза было отмечено с началом применения полихимиотерапии.
В свое время большим шагом вперед явилось лечение по схемам ЦОП/ЦОПП, однако уровень общей выживаемости составлял около 60 %, а безрецидивной — 40 %, что диктовало необходимость дальнейшей интенсификации терапии.
С начала 80-х годов XX в. начали применять немецкий протокол DAL-HX—83. Основной концепцией протокола явилось проведение интенсивной индукционной терапии кортикостероидами и химиопрепаратами, наиболее активными в отношении клеток гистиоцитарного ряда (винбластин, этопозид). Протокол не предполагал разделение пациентов на группы риска. В модификации протокола DAL-HX—90 все пациенты получали интенсивную индукционную терапию, поддерживающая терапия проводилась согласно разделению на группы риска. Общая и безрецидивная выживаемость больных по протоколам DAL-HX—83 и DAL-HX—90 составила соответственно 80 и 60 %. Данные результаты оказались значительно лучше тех, которые наблюдали после ранее применявшихся схем терапии.
С 1991 г. началось международное мультицентровое клиническое исследование протокола LCH-I. В этом протоколе выделение групп риска основывалось на стандартных принципах. Базовыми препаратами оставались кортикостероиды, а также винбластин и этопозид, сравнительную эффективность которых исследовали в рандомизированных группах. Все пациенты получали короткий курс кортикостероидной терапии, целью которой являлось купирование системной воспалитеьной реакции, затем пациенты получали монотерапию этопо-зидом либо винбластином согласно рандомизации.
Была отмечена равная эффективность обоих препаратов, однако общие результаты протокола, особенно у пациентов с мультисистемной формой существенно уступали результатам протокола DAL: так, безрецидивная выживаемость составила только 43 %. С 1994 г. предложена иная версия протокола LCH-II, в котором пациенты высокого риска получают интенсивную индукционную химиотерапию с использованием комбинации этопозида и винбластина с кортикостероидами. Результаты данного протокола к настоящему времени не опубликованы. Дизайн протокола LCH-II представлен на рис. 45.7.
Следует отметить, что одним из важнейших прогностических факторов, определяющих исход гистиоцитоза из клеток Лангерганса (ГКЛ) независимо от используемого протокола, является ответ на индукционную терапию. Показано, что смертность пациентов, не имеющих какого-либо ответа через 6 нед лечения, составляет от 66 до 100 % по данным разных авторов.
Ответ на начальную терапию является самостоятельным прогностическим фактором с высокой значимостью и может использоваться для коррекции тактики лечения на раннем этапе терапии и для своевременого перевода пациентов с плохим прогнозом на альтернативную терапию.
Таким образом, основными факторами неблагоприятного прогноза при полисистемном гистиоцитозе из клеток Лангерганса (ГКЛ) являются: мультисистемный вариант заболевания, наличие дисфункции печени и гемопоэза, отсутствие ответа на начальную терапию.
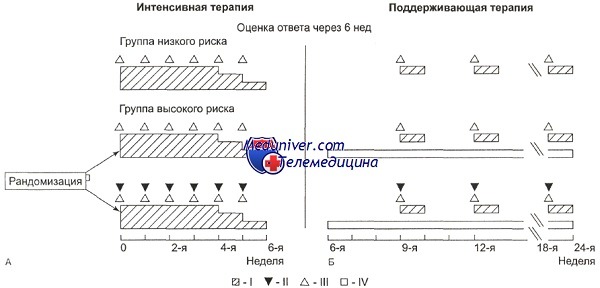
Протокол LCH-II (стратификация по группам риска).
А: I — преднизолон по 40 мг/м2 в сутки внутрь, дни введения: с 1-го по 28-й с последующим еженедельным снижением дозы; II — вепезид по 150 мг/м2 в сутки внутривенно капельно, дни введения: 1, 8, 15, 22, 29, 36-й; III — винбластин по 6 мг/м2 в сутки внутривенно струйно, дни введения: 1,8, 15, 22, 29, 36-й.
Б: I — преднизолон по 40 мг/м2 в сутки внутрь с 1-го по 5-й день недель: 9, 12, 15, 18, 21, 24-й;
II — вепезид по 150 мг/м2 в сутки внутривенно капельно в 1-й день недель: 9, 12, 15, 18, 21, 24-й;
III — винбластин по 6 мг/м2 внутривенно струйно в 1-й день недель: 9, 12, 15, 18, 21, 24-й; IV — 6-меркаптопурин по 50 мг/м2 в сутки внутрь с 6-й по 24-ю неделю.
В качестве терапии второй линии у пациентов, не ответивших на стандартные лечебные схемы, в разное время применяли комбинированную иммуносупрессивную терапию, альтернативные химиотерапевтические программы и пересадку костного мозга. Эффективность комбинированной иммуносупрессивной терапии антитимоцитарным глобулином и циклоспорином А у пациентов (протокол LCH-S), рефрактерных к терапии по протоколу LCH-II, оказалась крайне низкой. Из 13 больных, включенных в исследование LCH-S, только у одного достигнута полная ремиссия заболевания. Наиболее перспективными в лечении рефрактерных форм гистиоцитоза из клеток Лангерганса (ГКЛ) являются нуклеозидные аналоги нового поколения.
В частности, за последние годы появилось несколько сообщений об успешном применении 2-хлордеоксиаденозина (кладрибин). Первое сообщение об эффективности кладрибина у двух взрослых пациентов с распространенным кожным гистиоцитозом появилось в 1994 г. В последующем было показано, что кладрибин эффективен как у взрослых, так и у детей, причем с самыми тяжелыми, рефрактерными к стандартной терапии гистиоцитозами.
2-CdA является пуриновым аналогом, который подвергается метаболической активации в клетках под действием фермента дезокситицитидин-киназы. Активные метаболиты 2-CdA нарушают процессы репликации и репарации ДНК и в отличие от классических антиметаболитов оказывают токсическое действие как на делящиеся, так и на зрелые, находящиеся в покое клетки. По нашему опыту, из 5 детей с мультисистемным гистиоцитозом из клеток Лангерганса (ГКЛ), рефрактерным к терапии по протоколу LCH-II, у трех получена полная ремиссия болезни, у одного достигнуто клиническое улучшение и одна пациентка умерла от прогрессирования гистиоцитоза и развившегося на его фоне грибкового сепсиса.
Трансплантация костного мозга при гистиоцитозах из клеток Лангерганса (ГКЛ) остается экспериментальным методом терапии, ее эффективность не доказана.
Рецидивы болезни, возникающие после достижения полных ремиссий, не оказывают влияния на показатель общей выживаемости, так как пациенты, как правило, оказываются чувствительными к первоначальной терапии.
Непосредственной причиной летального исхода в большинстве случаев являются септические осложнения на фоне прогрессирования основного заболевания и цитостатического угнетения миелопоэза. Наиболее значимым осложнением, влияющим на качество жизни пациентов в ремиссии, остается несахарный диабет, развивающийся у 22 % пациентов с мультисистемной формой заболевания и требующий пожизненной заместительной терапии.
Гистиоцитарные опухоли — это гетерогенная группа заболеваний, связанная с аномальными изменениями макрофагов (гистиоцитов). Характерной чертой гистиоцитозов являются мутации в сигнальных путях митоген-активируемых протеинкиназ (MAPK). В настоящее время эффективная терапия разработана только для пациентов — носителей мутации BRAF V600 , что составляет лишь 50% всех зарегистрированных случаев гистиоцитарных опухолей. Для остальных 50%, у которых мутация BRAF V600 отсутствует, нет стандартных протоколов лечения. Однако существует гипотеза, согласно которой общей чертой всех гистиоцитозов является зависимость от внеклеточной сигнал-регулируемой киназы (ERK) — центральной МАР-киназы сигнального пути MAPK. Группа ученых из США провела клиническое испытание кобиметиниба — ингибитора ферментов MEK, отвечающих за фосфорилирование и активирование MAPK, и обнаружила отклик на этот препарат у пациентов с различными типами гистиоцитарных новообразований, подтвердив таким образом гипотезу о ERK-зависимости гистиоцитозов.
В исследовании приняли участие 18 взрослых пациентов с различными вариантами гистиоцитозов, среди которых были синдром Эрдгейма-Честера (12 пациентов), лангергансоклеточный гистиоцитоз (2 пациента), болезнь Розаи-Дорфмана (2 пациента) и смешанные гистиоцитозы (2 пациента). Шестнадцать испытуемых проходили как минимум один курс терапии до начала исследования. Первичная оценка эффективности лечения кобиметинибом проводилась с помощью позитронно-эмиссионной томографии (ПЭТ) с использованием фтордезоксиглюкозы. По данным ПЭТ, полный отклик на лечение был зарегистрирован у 13 из 18 пациентов, частичный отклик — у троих, состояние одного пациента оставалось неизменным, и один испытуемый выбыл на ранней стадии эксперимента в связи с клиническим ухудшением. Заболевание не прогрессировало ни в одном из случаев. Для десяти пациентов доза кобиметиниба была снижена из-за различных побочных эффектов, среди которых были снижение фракции выброса сердца, сыпь, диарея, утомляемость и тромбоцитопения. Один из испытуемых прекратил прием препарата из-за окклюзии центральной вены сетчатки. Один пациент c обширным гистиоцитарным поражением легких скончался от пневмонии, не связанной с приемом кобиметиниба.
Для оценки изменений в сигнальных путях MAPK, связанных с гистиоцитозом, было проведено секвенирование ДНК из биоптатов опухолевых тканей пациентов. У 15 из 18 пациентов присутствовали мутации как минимум в одном гене MAPK-каскада. У трех испытуемых определить мутационный статус не удалось. При этом отклик на кобиметиниб регистрировался как у известных опухолевых генотипов, так и у двух из трех неизвестных. Наряду с типичными для гистиоцитарных новообразований изменениями в генах BRAF, ARAF и MEK1 были зарегистрированы специфические, не охарактеризованные ранее мутации RAF1 K 106 N , MEK2 Y 134 H и BRAF N 486_ T 491 delinsK . Для оценки роли этих мутаций в развитии гистиоцитозов измененные гены были клонированы и экспрессированы в клетках Ba/F3 — популярной клеточной линии, удобной для изучения регуляции киназной активности. Было обнаружено, что каждая из мутаций приводит к активации сигнального пути ERK, и клетки — носители измененных генов приобретают чувствительность к кобиметинибу, чего не наблюдается для RAF1, MEK2 и BRAF дикого типа. Отклики на препарат, полученные in vitro у клеток Ba/F3, экспрессирующих RAF1 K 106 N , MEK2 Y 134 H и BRAF N 486_ T 491 delinsK , хорошо согласуются с результатами клинического исследования для пациентов — носителей соответствующих мутаций.
Отклики на кобиметиниб были не только универсальными, но и продолжительными. Показано, что препарат может в значительной степени менять течение гистиоцитозов. Стоит отметить, что похожий эффект оказал вемурафениб для гистиоцитарных опухолей, несущих мутации BRAFV600.
В целом, полученные данные показывают, что терапия с использованием кобиметиниба приводит к устойчивому и продолжительному отклику всех клинических и генетических подтипов гистиоцитарных новообразований. Вероятно, гистиоцитарные опухоли не могут адаптироваться к постоянному ингибированию MEK1 и MEK2. Однако стоит иметь в виду, что критерии выборки — взрослые пациенты с рефрактерными и мультиорганными заболеваниями — предопределили преобладание в исследовании больных с синдромом Эрдгейма-Честера. Авторы рекомендуют соблюдать осторожность при применении разработанной ими терапии для других подтипов гистиоцитозов.

Гистиоцитоз из клеток Лангерганса — это редкое заболевание в детском возрасте, при котором пик заболевания приходится на возраст от 1 до 3 лет. Причина болезни не была полностью понята. Неизвестно, являются ли прямыми стимулами развития гистиоцитоза как заболевания иммунной системы врожденные внутриклеточные дефекты или реакция на вредные внешние факторы. Симптомами гистиоцитоза являются: кожные изменения (фолликулярная, зудящая или геморрагическая кожная сыпь) и ряд более серьезных — боль в костях, нарушения развития.
Что такое Х гистиоцитоз?
Гистиоцитоз из клеток Лангерганса ( гистиоцитоз клеток Лангерганса, LCH ) — редкое заболевание со сложной этиологией. В настоящее время этот термин используется в педиатрической практике чаще всего применительно к гематологическим расстройствам детского возраста.
В каком возрасте он развивается и какова заболеваемость?
Гистиоцитоз из клеток Лангерганса можно наблюдать в любом возрасте, однако характерный пик заболеваемости составляет от 1 до 3 лет. Гистиоцитоз у детей чаще поражает мальчиков, и общая заболеваемость составляет 2 случая на 1 000 000 в год. LCH может быть ограниченной, доброкачественной формой, не требующей лечения, но, к сожалению, также смертельной детской болезнью, поражающей многие органы и системы.
Причины гистиоцитоза
Присутствие клеток ЖК естественно обнаруживается в эпидермисе, дерме, слизистых оболочках дыхательных путей, мочеполового тракта и желудочно-кишечного тракта, а также в интерстиции большинства твердых органов, включая легкие. В ходе X гистиоцитоза клетки Лангерганса подвергаются неспецифической, неадекватной иммунологической стимуляции. Они начинают продуцировать чрезмерное количество провоспалительных веществ (цитокины и простагландины), что приводит к образованию опухолей или разрушительной инфильтрации на близлежащих тканях.
Однако остается необъяснимым, являются ли прямые стимулы для развития гистиоцитоза как заболевания иммунной системы врожденными внутриклеточными дефектами или реакцией на вредные внешние факторы (на что указывает тот факт, что 90% взрослых пациентов с легочным гистиоцитозом являются курильщиками).
Гистиоцитоз у детей
Гистиоцитоз был наиболее точно известен и описан как болезнь детей. У младенцев и детей в возрасте до 5 лет чаще всего диагностируется гистиоцитоз клеток Лангерганса, который соответствует классу 1 ВОЗ. Этот класс включает: эозинофильную гранулему, болезнь Ханда-Шуллера-Христиана и болезнь Абт-Леттерера-Сиви. Христианская болезнь рук-Шуллера обычно состоит из триады симптомов: несахарный диабет, экзофтальм и изменения костей. Болезнь Абт-Леттерера-Грея является альтернативным названием для острой многоорганной формы ЛХ, которая чаще всего развивается у детей в возрасте до двух лет. Кислотно-глоточная гранулемавстречается у детей более старшего возраста, обычно в виде единичных гранулематозных поражений костей.
Гистиоцитоз класса II ВОЗ описывается как гистиоцитоз мононуклеарных фагоцитов, отличных от клеток Лангерганса, — гистиоцитоз пазух (болезнь Розаи-Дорфмана) или лимфогистиоцитоз с гемофагоцитозом.
Последний, наиболее тяжелый класс III означает острый моноцитарный лейкоз — злокачественный гистиоцитоз или гистиоцитарную лимфому. В самой молодой возрастной группе гистиоцитоз обычно генерализованный, многоорганный с широким клиническим спектром. У младенцев и детей младшего возраста инфильтрационно-узловые изменения локализуются в печени, селезенке, лимфатических узлах, костном мозге, тимусе, кости или коже. Изолированный гистиоцитоз легких из клеток Лангерганса встречается немного реже .
Гистиоцитоз — симптомы
Развитие генерализованного заболевания может быть быстрым и может привести к смерти. Наиболее часто наблюдаемыми признаками гистиоцитоза у детей и младенцев являются:
- фолликулярная, зудящая или геморрагическая кожная сыпь с типичным расположением на коже головы, вдоль грудины, по бокам туловища и в паху ( гистиоцитоз кожного типа );
- повторяющиеся красно-коричневые кожные узелки, которые могут быть источником боли, кровотечения и рубцевания центральной полости (известный как прогрессирующий узелковый гистиоцитоз );
- боль в костях, патологические компрессионные переломы позвонков;
- выпуклость крышки черепа, соответствующая дефектам в костях свода;
- смотреть глазное яблоко;
- хронические выделения из уха, хроническое воспаление наружного слухового прохода;
- узловые изменения на деснах у младенцев, расшатывание зубов у детей старшего возраста;
- нарушения развития, дефицит роста, задержка полового созревания;
- увеличение лимфатических узлов, печени, селезенки;
- общие симптомы — сильная жажда и мочеиспускание (простой несахарный диабет в результате поражения центральной нервной системы), лихорадка, одышка, кровохарканье, геморрагический диатез, потеря веса.
При односторонних формах гистиоцитоза поражаются главным образом скелетная система (60%), кожа (50-55%), центральная нервная система (24%) или височная кость с сопутствующими ушными симптомами (15-61%). Диагностика легочной формы, поражения печени или костного мозга может свидетельствовать о наличии диссеминированного полиорганного процесса.
Легочный гистиоцитоз
Легочная форма гистиоцитоза клеток Лангерганса является интерстициальным заболеванием легких, которое развивается у привычных курильщиков. Около 25 процентов случаи протекают бессимптомно, и поражения часто обнаруживаются на рентгенограмме случайной рентгенографии. Пациенты с симптомами сообщают о неспецифических общих заболеваниях, таких как усталость, сухой кашель, одышка и внезапная потеря веса.
Иногда первым симптомом легочного гистиоцитоза является пневмоторакс, возникающий в результате разрыва поврежденного фрагмента легочной ткани. Около 6-10 процентов. пациенты имеют кровохарканье, требующее, особенно у курильщиков, срочной дифференциальной диагностики, в том числе туберкулез и рак легких.
Диагностика гистиоцитоза, исследование
Из-за разнообразного расположения и сложного, неспецифического клинического течения, диагностика гистиоцитоза из клеток Лангерганса требует нескольких дополнительных тестов. Основными методами диагностики являются: визуализация, лабораторная и биопсия.
- морфология периферической крови — анемия, лейкопения или тромбоцитопения, подтверждающие вовлечение костного мозга,
- тестирование билирубина, ферментов печени, альбумина и общего белка в крови пациента, что позволяет подтвердить или исключить дисфункцию печени,
- анализ удельного веса мочи на несахарный диабет, вызванный гистиоцитозом центральной нервной системы.
Биопсия и иммуногистохимическая оценка сегмента пораженной ткани:
Условием для окончательного диагноза LCH является наличие так называемого Бирбекские клетки или экспрессия белка S100 и маркеры лимфоцитов CD1a и CD56.
Лечение гистиоцитоза
В случаях ограниченного гистиоцитоза в форме кости показана биопсия со стероидным введением — ацетатом метилпреднизолона.
Лечение длительное и состоит из 1-2 циклов химиотерапии по 6 недель, с последующим поддерживающим лечением до 12 месяцев. Пациенты, которые не отвечают на стандартную химиотерапию, являются кандидатами на аллогенную трансплантацию гемопоэтических клеток (костный мозг).
Прогноз при гистиоцитозе из клеток Лангерганса
У детей старше двух лет с локализованным гистиоцитозом Х прогноз является успешным. Предполагается, что смертность в ходе гистиоцитоза без захвата так называемого Риск органов (органов высокого риска — костного мозга, печени, селезенки или легких) составляет около 10 процентов. Значительно более высокий процент случаев смерти и резистентности к лечению отмечается в случаях гистиоцитоза многих органов, злокачественного и синусового гистиоцитоза.
Прогноз также хуже у взрослых курильщиков с признаками легочного фиброза, обструкции или с рецидивирующими плевральными рефлексами. Долгосрочное наблюдение за пациентами показывает, что гистиоцитоз из клеток Лангерганса может предрасполагать пациентов к раку легких, а также к лимфатическому (гематома) и гемопоэтическому (лейкоз) раку.
Гистиоцитоз Х, лангергансоклеточный гистиоцитоз, болезнь Хенда-Шюллера-Крисчена, эозинофильная гранулема — все эти медицинские термины являются синонимами, и означают одно и то же заболевание. При развитии гистиоцитоза в организме накапливается избыток незрелых клеток Лангерганса.
Что такое гистиоцитоз Х, его формы, причины возникновения
Клетки Лангерганса — это клетки, содержащиеся в тканях эпителия, они являются подвидом крупного семейства клеток, известных под названием гистиоциты. Эозинофильная гранулема — это легочная форма гистиоцитоза Х, вызванная скоплением клеток Лангерганса в легких. Представляет собой редкое интерстициальное заболевание, нередко провоцируемое курением. Поражает в основном людей молодого возраста (третья или четвертая декада жизни).
Морфологически клетки Лангерганса представляют собой подвид белых кровяных клеток, которые обычно организм использует, чтобы бороться с инфекциями.
При гистиоцитозе клетки Лангерганса производятся и накапливаются в определенных частях тела, где могут приводить к образованию опухолей и повреждать структуру других органов.
Гистиоцитоз Х встречается у одного из 200 тысяч новорожденных, но не исключены случаи возникновения этого заболевания и в других возрастных группах: с раннего детства до зрелого возраста. Пациенты, преимущественно, не имеют симптомов заболевания, однако иногда течение болезни ошибочно принимают за последствия травм или других заболеваний.
Когда проявляется гистиоцитоз? Чаще всего в возрасте от года до трех лет. Заболевание может проявиться в поражении костей, кожи, лимфатических узлов, печени, селезенки, головного мозга, костного мозга или гипофиза.
Причины возникновения гистиоцитоза Х
Основной причиной развития гистиоцитоза Х или эозинофильной гранулемы является курение. Кроме того, важную роль играет воздействие окружающей среды. Факторами риска являются:
- проживание в экологически неблагоприятных зонах;
- плохое питание;
- слабый иммунитет;
- ревматизм детский или взрослый;
- легочные заболевания;
- хронические воспалительные процессы.
Симптомы гистиоцитоза у детей и взрослых
Симптомы гистиоцитоза у взрослых:
- продуктивный кашель;
- одышка;
- усталость;
- потеря веса;
- боль в груди;
- спонтанный пневмоторакс;
- лихорадка;
- поражения костной ткани;
- увеличение объема мочи;
- сыпь;
- жажда;
- потеря веса.
Поражения костей нередко болезненны, способствуют возникновению патологических переломов. Опухоли крупных костей, например, позвоночника, бедренной кости, приводят к быстрому разрушению костей. Отсутствие своевременной диагностики часто способствует развитию заболевания, и когда больные обращаются за помощью, опухоль разрушает большую часть кости.
Симптомы гистиоцитоза у детей:
- боли в животе;
- боли в костях;
- задержка полового созревания;
- раздражительность;
- лихорадка;
- частое мочеиспускание;
- желтуха;
- головные боли, головокружение;
- себорейный дерматит волосистой части головы;
- судороги, рвота;
- потеря веса, жажда;
- увеличение лимфоузлов;
- задержка роста и умственного развития.
Примечание: дети старше 5 лет, больные гистиоцитозом Лангерганса, часто имеют только симптомы поражения костей, а прочие симптомы отсутствуют.
Методы лечения гистиоцитоза Х
Гистиоцитоз Х лечат кортикостероидами, которые подавляют иммунную функцию (в том числе и функцию опасных клеток). Курение может ухудшить ответ на лечение, и должно быть исключено как в период лечения, так и после окончания курса. В идеале от курения необходимо отказаться совсем.
Детям назначают такие препараты, как:
- циклофосфамид;
- этопозид;
- метотрексат;
- винбластин.
Для лечения пораженных костей проводится лучевая терапия или операция, во время которой пораженный участок кости удаляют.
Другие лечебные процедуры:
- антибиотики для борьбы с инфекциями;
- поддержка легких (искусственная вентиляция);
- заместительная гормональная терапия;
- физиотерапия;
- специальные шампуни для лечения себореи;
- поддерживающий уход (для облегчения симптомов);
- обезболивающие препараты.
Пациентам с респираторными инфекциями, развивающимися на фоне эозинофильной гранулемы, а также больным со спонтанным пневмотораксом требуется стационарное лечение. Иногда рекомендуется хирургическое вмешательство, например, механический плевродез, теменная плеврэктомия или вдувание талька, чтобы предотвратить дальнейшее развитие заболеваний. В терминальной стадии заболевания у больных иногда развивается дыхательная недостаточность.
Читайте также:


