Безоперационное лечение рака лечение рак
16 марта 2020 11:30

Мануэль Руис-Эчарри, онколог:
Еще один новый метод в онкологии — иммунная терапия. Разработке этого вида лекарственного лечения способствовало недавнее раскрытие механизма иммунного ответа при онкологических заболеваниях, за что в 2018 году американец Джеймс Эллисон и японец Тасуку Хондзе получили Нобелевскую премию. Иммунная терапия активизирует собственные защитные силы организма для борьбы со злокачественными клетками. Ее эффективность высока, переносится она удовлетворительно, а побочные эффекты легче, чем у химиотерапии. Иммунотерапевтические препараты стали важной частью противоопухолевого лечения меланомы, рака почки, рака печени, разных подтипов рака легкого, опухолей ЖКТ и других онкозаболеваний. При лимфоме Ходжкина иммунотерапия показывает высокую эффективность даже после трансплантации костного мозга. К сожалению, эффективно применять эту терапию ко всем видам рака невозможно, поскольку иммунная система человека может справиться не со всеми типами опухолей. Поэтому она изначально показана не всем пациентам.

Нидаль Салим, радиационный онколог:
Еще одна область радиационной онкологии — стереотаксическая радиохирургия. Роль скальпеля здесь выполняет пучок радиационных лучей, которые называют гамма- или киберножами. Существует и еще более новое оборудование — аппарат Varian EDGE, отличающийся максимально высокой точностью. Его можно сравнить с острейшим лезвием. Таких установок пока очень мало — единицы во всем мире. Одна из них установлена в EMC.
Дозы облучения при применении стереотаксиса в несколько десятков раз превышают дозы при лучевой терапии, но это позволяет практически избавиться от опухоли или единичных метастазов всего за один-три сеанса. При этом часть клеток может оказаться устойчивой даже к очень высоким дозам облучения, поэтому такая терапия тоже подходит не для всех случаев.

Фото: Saph Photography/Pexels

Алексей Кривошапкин, нейрохирург:
Почему с глиобластомой так трудно бороться? Потому что она развивается чрезвычайно быстро. Если выполняется лишь частичное удаление такой опухоли, операция может подстегнуть ее рост и даже сократить продолжительность жизни пациента. В настоящее время разработанные алгоритмы компьютерного зрения помогают врачам рассчитать риски математически. Благодаря этой возможности выяснилось, что если оставить опухоль после ее хирургического удаления объемом менее 2,5 кубических сантиметров, то больной достоверно проживет дольше. Остаток опухоли большего размера очень быстро перестраивается и превращается в еще более агрессивную опухоль.
Радикальное удаление опухоли — наилучший шанс для больного стать долгожителем среди людей с аналогичным диагнозом. Для максимально полного удаления новообразования нужны современные технологии. Это операционные микроскопы, оснащенные флуоресцентными блоками для определения границ злокачественной опухоли, методы нейронавигации и интраоперационной визуализации (магнитный резонанс, позитронно-эмиссионная томография).
Около двух лет назад специалисты нашей клиники запатентовали новый метод лечения пациентов с рецидивом глиобластомы. Сейчас его начинают применять нейрохирурги Европы и Америки. Суть заключается в том, что после хирургической резекции опухоли в образовавшейся полости размещают мягкий пластиковый баллон, который раздувают в соответствии с границами опухоли. Затем после контроля его позиции с помощью ультразвукового сканирования в баллон вводится источник электронного облучения. Медицинские физики могут быстро и точно рассчитать необходимую лечебную дозу. Этот метод называется баллонная электронная брахитерапия. Он не требует значительного операционного времени, безопасен для больного и медицинского персонала. Метод используется в общей онкологии. Усовершенствование технологии для нейроонкологии и внедрение методики в процесс лечения рецидива глиобластомы в рамках клинического исследования показали впечатляющие результаты, которые дают надежду пациентам на значительную прибавку в продолжительности и качестве жизни после операции.

Владимир Носов, хирург-онкогинеколог:
Среди последних достижений онкогинекологии стоит отметить прогресс онкогенетического тестирования. Большие надежды возлагаются на персонализированную медицину, а также на выявление конкретных молекулярных поломок и таргетную терапию.

Фото: Saph Photography/Pexels
Искра Даскалова, хирург-маммолог:
В последние десятилетия проблема рака молочной железы все реже решается объемным хирургическим вмешательством. Многие пациентки имеют возможность сохранить и грудь, и качество жизни без ухудшения прогноза заболевания. Уже давно доказано, что для пациенток с ранней стадией болезни щадящие (органосохраняющие) операции и последующая лучевая терапия ничем не уступают радикальной мастэктомии. Данные последних лет показывают, что онкологический прогноз у таких пациенток даже лучше.
В радикальном удалении молочной железы нуждаются около 30 процентов заболевших женщин, часто это связано с неблагоприятным соотношением размера груди к размеру опухоли, поскольку удалить новообразование нужно в пределах здоровых тканей. Даже когда речь идет об удалении груди, остаются возможности для последующей реконструкции с хорошими косметическими результатами.
Институт онкологии Европейского медицинского центра EMC — экспертная клиника международного уровня. Здесь пациенты могут получить весь комплекс услуг в одном здании: диагностику, таргетную терапию, иммуно- и химиотерапию, хирургию любой сложности, лучевую терапию, реабилитацию, психологическую поддержку пациента и его семьи. Лечение проводится по современным международным протоколам. Клиника оборудована по последнему слову техники: диагностическое оборудование экспертного уровня, 12 операционных блоков, хирургический робот последнего поколения da Vinci Si HD, отделение ПЭТ/ ОФЭКТ-диагностики с собственной лабораторией по производству радиофармпрепаратов, единственная в России сверхточная система для радиохирургии и лучевой терапии Varian EDGE, система для проведения интраоперационной лучевой терапии. Для каждого пациента разрабатывается индивидуальный план лечения, согласованный несколькими специалистами в области онкологии, радиологии, лучевой терапии, онкохирургии из США, Европы, Израиля и России.
Прогрессивные методы лучевой терапии мало известны в нашей стране, но они приобретают все большее значение в лечении рака. С каждым днем растет число диагнозов рака, которые ставятся на ранних стадиях, а это удаляет нас от классических операций. Эти методы выполняются передовыми радиологами, которые специализируются именно в данной области. В лечении рака операция практически уже несколько веков занимает место среди основных методов лечения, от которых до сих пор не могут отказаться хирурги. Особенно был достигнут прогресс в сфере технологии и в медикаментозном (фармакологическом) лечении рака за последние 20-30 лет. После выявления чувствительности рака к химиотерапии и к лучевой терапии врачи отказываются от проведения операции, или проводятся только некоторым избранным больным. Примером таких видов рака может служить рак верхнего зева, который еще принято называть (рак назофарингитной области). Место операции при раке гортани на ранней и продвинутой стадии также заняла лучевая терапия и радио-химиотерапия. Наряду с увеличением значения лучевой терапии в лечении рака, и с возможностью применения радиотерапии при большом количестве разновидностей рака, благодаря технологическому развитию, был достигнут успех, близкий к результатам операции, в случаях, когда выявлено локальное возобновление заболевания или когда невозможно проведение операции. Со временем, благодаря полученному успеху, метод лучевой терапии, который применяется в качестве стреотактики, получил название лучевой операции SRS (radiosurgery) . Лучевая операция сегодня стала чрезвычайно популярной при лечении многих видах рака, опухолях мозга, опухолях с ограниченной зоной и размерами, при раке легких на ранней стадии, при раке предстательной железы.
Параллельно новшествам в технологии лучевой терапии, в области лечения рака были разработаны такие методы, как радиочастоты, лазер, микроволны, HIFU (высокочастотные ультразвуковые волны), Нанонож (безвозвратная электротерапия) и многие другие методы; лучевая терапия стала занимать место операции при очень многих видах онкологических заболеваний. В этих методах, применяемых передовыми радиологами, которые стараются не повредить здоровые ткани в зоне лечения лучевой терапией, объем повреждения здоровых тканей максимально снижается, и можно выполнять повторные процедуры. В этих методах, известных также под названием чрезкожной абляции опухоли, вводится игла и размещается через кожу внутри опухоли. В зависимости от характеристики метода, посредством различных приборов, которые подсоединяются к иголкам, которые также принято называть электродом, больному вводится охлаждающий газ, ультразвуковые волны, радиочастотные или электрические токи. Таким образом, выполняется полное разрушение ткани, при этом захватывается вся опухоль. Такие методы лечения принято называть минимальным инвазивным лечением онкологии. При применении таких методов используется также МРГ и томография, чтобы можно было оценить опухоль в трехмерном изображении. После введения иглы внутрь опухоли и выполнения абляции, в зависимости от типа процедуры, поврежденную ткань можно оценить во время и после процедуры, при помощи методов визуализации.
Для проведения чрезкожной абляции сначала изучаются полученные ранее снимки томографии, ультразвука, магнитно-резонансной томографии (МРТ) И ПЭТ-КТ. Необходимо произвести оценку типа, количества, размера и расположения опухоли, для которой планируется проведение абляции. Затем, согласно имеющимся данным, выполняется планирование для того, чтобы принять решение, какой метод абляции следует использовать для какого конкретно больного и для какой опухоли, какой метод визуализации следует использовать во время процедуры, в какой части кожи следует вводить иглу и какой тип анестезии следует применять.
В большинстве случаев абляция выполняется, пока больной находится в сознании, под местной анестезией или под воздействием седатации
Каковы методы абляции, которые используются при лечении рака?
Для выполнения чрезкожной абляции при раке сегодня используется 3 группы методов:
- Химическая абляция
- Термальная абляция (нагревание/замораживание)
- Необратимая электропорация (нанонож).
Химическая абляция: во время данной процедуры внутрь опухоли вводятся такие химические вещества, как спирт, углекислота, в результате чего она разрушается. Во всем мире этот метод используется уже на протяжении более, чем 20 лет, данный метод считается эффективным и безопасным. Самым важным преимуществом здесь служит низкая стоимость процедуры и малое количество побочных явлений. Однако для того, чтобы полностью уничтожить опухоль, как правило, требуется провести более одной процедуры (иногда много раз). Чаще всего химическая абляция применяется при первичных опухолях печени (гепатоцеллюлярная карцинома). Кроме того, она также используется при опухолях щитовидной железы и метастазах в лимфатических узлах.
Термальная абляция: посредством электрода, который вводится в центр опухоли, она нагревается или замораживается, в результате чего происходит ее разрушение. Методы нагрева:
- радиочастоты
- микроволны
- лазер и
- ультразвук
Необратимая (постоянная) электропорация (нано-нож)
Во время необратимой электропорации больному направляется краткосрочный электрический ток под очень высоким напряжением, что повышает постоянную проводимость стенок клеток, и ткань опухоли разрушается навсегда. Классический метод необратимой электротерапии используется уже на протяжении почти что 100 лет, но успех данного метода остается на довольно невысоком уровне. Поэтому распространенность его применения имеет тенденцию к уменьшению. Во время процедуры больному подается электрический ток высокого напряжения (несколько тысяч вольт), в результате чего необратимо повышается проводимость стен клеток. Проводимость, которая достигается такого рода электропорацией, не исчезает, и клетки начинают гибнуть.
В результате проведенных испытаний был обнаружен положительный эффект от применения метода наноножа при раке поджелудочной железы, желчных путей и раке предстательной железы, после чего использование данного метода во всем мире стал стремительно расти. Однако из-за того, что метод является сложным и требует общей анестезии больного, он сопровождается определенными ограничениями, среди которых обязательное наличие большого опыта у бригады врачей и высокая стоимость самой процедуры. Сегодня данный метод чаще всего используется при раке поджелудочной железы и желчных протоков, а также при раке предстательной железы. При раке поджелудочной железы, когда ставится диагноз, в большинстве случаев опухоль уже успевает локально распространиться. То есть речь идет о распространении опухоли в основные сосуды, окружающие поджелудочную железу, что делает выполнение операции такому больному невозможным.
Нанонож способен уничтожить опухолевую ткань, не нарушив соседние сосуды поджелудочной железы
Кроме того, было установлено, что данная процедура не повреждает другие сосуды в окружении и не наносит вред двенадцатиперстной кишке. Однако для того, чтобы можно было безопасно выполнить абляцию наноножом при раке поджелудочной железы, необходимо, чтобы 3-4 иглы параллельно друг другу, и не проходя через двенадцатиперстную кишку были размещены с края опухоли. Для этого очень важно, чтобы были максимально использованы визуализационные методы и чтобы бригада врачей, которая выполняет процедуру, имела большой опыт в данной сфере. В последние годы появились обнадеживающие результаты использования наноножа в сопровождении хирурга, который делает разрез на животе и видит опухоль поджелудочной железы и сосудистые строения. Необходимо, чтобы бригада, выполняющая данный метод лечения, обладала большим опытом.
При каких опухолях используются методы абляции?
Химическая абляция используется при первичных опухолях печени, которые принято называть гепатоцеллюлярной карциномой. Для этой опухоли на протяжении многих лет успешно проводится абляция, в ходе которой внутрь опухоли вводится углекислота и спирт. Кроме того, данный метод также используется при раке щитовидной железы и некоторых лимфатических узлов. Химическая абляция используется в зонах, где рискованно или технически сложно использовать метод термальной абляции, иногда химическую абляцию также используются в комбинации с термальной абляцией для того, чтобы повысить эффективность метода термальной абляции. Сегодня термальная абляция является самым широко распространенным методом абляции, особенно, радиочастотная абляция примерно на протяжении 15 лет уже активно используется по всему миру. Как и при других методах абляции, чаще всего данную технику использовали при раке печени. Однако ее также широко используются при раке легких, почек, селезенки, лимфатических желез, костей и мягких тканей. Благодаря тому, что техника выполнения термальной абляции довольно проста, контролируема и может быть запланирована, а также благодаря малым побочным проявлениям, она имеет определенное превосходство. Целью термальной абляции служит выжигание опухоли вместе со слоем здоровой ткани толщиной примерно 1 см вокруг нее. В ходе многих проведенных исследований было доказано, что опухолевая ткань может быть полностью уничтожена в месте, где проводилась термальная абляция. Благодаря этой особенности, если раньше больным, которые не могли пройти операцию, то сегодня данный метод способен занять место хирургической операции для некоторых больных с опухолью печени.
Наряду с указанными преимуществами существуют и некоторые недостатки термальной абляции:
- В связи с тем, что тепло, вырабатываемое во время термальной абляции, выводится через кровоток, опухолевая ткань, расположенная вокруг кровеносных сосудов, может не достаточно прогреваться. С одной стороны, это действие, которое принято называть "Heat Sink", оказывает защитное действие на стенки сосудов от воздействия абляции, но с другой стороны это может помешать полному уничтожению опухолевой ткани вокруг сосудов.
- В каналах, в которых находится жидкость, которая не обладает такой сильной текучестью, как кровь – например, желчь или моча - будет оказано меньшее воздействие от heat sink, поэтому опухолевая ткань вокруг этих каналов может быть легко уничтожена, но теперь из-за того, что будет отсутствовать защитное действие heat sink, термальная абляция может негативно отразиться на желчных протоках и мочевыводящих путях.
- Термальная абляция, наряду с сосудами и каналами, может также повредить и нервные окончания. Поэтому если такая процедура будет применяться на таких органах, как предстательная железа, это может привести к недержанию мочи (inkontinans) и к половому бессилию (импотенции).
- Если термальная абляция будет выполняться в зонах по соседству с пищеварительной системой (например, желудок, кишечник), то процедура может повредить эти органы. Для того, чтобы это предотвратить, посредством различных методов во время проведения термальной абляции необходимо максимально удалить опухолевую зону от этих органов.
В результате можно сказать, что по указанным выше причинам методы термальной абляции могут оказаться не достаточно эффективными и безопасными при опухолях, соседствующих с полыми органами пищеварительной системы (желудок, кишечник), с важными нервными окончаниями, с желчевыводящими путями и мочевыводящими путями, с крупными сосудами. Рак головки поджелудочной железы стоит первым в ряду опухолей, при которых чаще всего используется необратимая электропорация (нанонож). Головка поджелудочной железы очень близко расположена с сосудами печени, сосудами тонкого кишечника, с венами и с двенадцатиперстной кишкой. Поэтому при опухолях поджелудочной железы не часто используются такие методы термальной абляции, как радиочастоты. Необратимая электропорация способна уничтожить опухолевую ткань, не нанося при этом вред сосудам, расположенным в этой зоне, и тонкому кишечнику. Безопасность и эффективность метода при раке поджелудочной железы была доказана в ходе испытаний, которые проводились за последние годы на большом количестве больных. Другой областью применения необратимой электропорации являются опухоли, соседствующие с крупными сосудами в печени и с желчевыводящими путями. В такого рода опухолях радиочастота и другие термальные методы могут оказать разрушительное воздействие на желчные протоки, и могут не привести к ожидаемому успеху в связи с уничтожением опухолевой ткани вокруг крупных сосудов. Необратимая электропорация может быть более эффективной и безопасной процедурой для такого рода опухолей. Но у необратимой электропорации есть и свои недостатки: это технически более сложная процедура, по сравнению с такими термальными методами абляции, как радиочастоты и микроволны, кроме того, данная процедура проводится в течение долгого времени, она стоит дороже и требует применения общего наркоза. В заключение следует отметить, что у каждого чрескожного метода абляции есть свои отличительные преимущества и недостатки. Прогрессивные радиологи, обладающие достаточными знаниями и опытом в области чрескожной абляции, должны принять решение о том, при каких опухолях какой метод чрескожной абляции следует выбрать.
Каковы преимущества и недостатки чрескожной абляции?
Чрескожная абляция представляет собой метод, способный лечить некоторые виды рака, как и хирургическая операция или высокодозная лучевая терапия. Превосходство над хирургической операцией заключается в том, что процедуру можно проводить под местной анестезией, путем ввода под кожу иглы, отсутствие необходимости оставаться в стационаре, меньшее количество рисков. Превосходство над лучевой терапией заключается в том, что нет зависимости от конкретного вида опухоли, и при необходимости процедуру можно повторять несколько раз.
Чрескожная абляция у многих больных используется не в качестве альтернативы этих методов, а в качестве поддержки
Например, в одного больного некоторые опухоли может уничтожить посредством операции, некоторые опухоли посредством лучевой терапии или чрескожной абляции. У чрескожной абляции существуют и определенные недостатки. Риск возобновления опухоли, то есть рецидива в том же месте несколько выше, по сравнению с хирургическим способом и лучевой терапией. Но в случае развития рецидива в той же зоне можно снова будет применить метод абляции. Кроме того, другими недостатками чрескожной абляции, как и при хирургическом вмешательстве, служит необходимость того, чтобы врач, проводящий процедуру, обладал большим опытом и достаточными знаниями в области абляции, чтобы в наличии было техническое оборудование для проведения абляции, и чтобы на месте было небольшое количество персонала.
Радиочастотная абляция
После размещения внутри опухоли, посредством иглы в виде зонта в ткань опухоли направляется альтернативный ток. Этот ток приводится в действие (вперед-назад) ионы, заряженные (+) и (-) в раковых клетках, и вокруг иглы начинает вырабатываться тепло примерно 80-100 градусов. Вырабатываемое тепло приводит к гибели ткани в зоне примерно 3-5см в диаметре вокруг иглы. Размер зоны разрушения может отличаться, в зависимости от типа используемой иглы и от количества игл. Радиочастотная абляция используется уже на протяжении более, чем 25 лет в сфере онкологии. Впервые данный метод начал использоваться при раке печени и метастазах, затем он также стал широко использоваться и при раке легких, почек, щитовидной железы и костей.
Криоабляция
Микроволновая абляция
Разработка микроволновой абляции шла параллельно с развитием микроволновых нагревателей и печей, которые мы используем на кухне в быту. Эти волны, образованные посредством иголок (антенн), приводят в волнообразное действие (осцилляция) водные молекулы, расположенные в ткани, и в результате трения этих молекул в опухолевой ткани начинает вырабатываться тепло до 80-100 градусов. Образованное тепло приводит к гибели раковой ткани в зоне диаметром примерно 3 см вокруг иглы. Зона абляции может быть увеличена или уменьшена, в зависимости от продолжительности воздействия, от типа используемой иглы и от количества игл. При микроволновой абляции в ткань направляется не электричество, а электромагнитные волны. Иглы, которые используются в данном методе, применение которого началось с 2000-х годов, принято называть антеннами. Их можно использовать при раке печени и метастазах легких, при опухолях, расположенных в мягких тканях. Чтобы получить более подробную информацию, вы можете посетить интернет сайт профессора доктора Саима Йилмаза, специалиста в области лучевой терапии.
— Доктор Нэеман, расскажите, пожалуйста, чем Вы занимаетесь? Что такое интервенционная радиология и интервенционная онкология?
— А как можно уничтожить раковую опухоль?
— Есть и другие способы?
Криоабляция — лишь один из инструментов интервенционной онкологии. Чтобы воздействовать на опухоль, можно использовать не только жидкий азот, но и радиоволны или микроволновое излучение. Также существует методика химиоэмболизации — инъекция вещества, которое вызывает закупорку артерий, питающих опухоль, и тем самым останавливает ее рост.
— Если интервенционная онкология настолько эффективна, возможно, скоро она заменит собой хирургические операции, лучевую и химиотерапию?
— Методы интервенционной онкологии подходят не всем, и каждый клинический случай нужно рассматривать индивидуально. Но люди должны знать, что сегодня имеется альтернатива традиционному лечению. Наши процедуры не только крайне эффективны. Они гораздо менее травматичны, если сравнивать их, например, с хирургической операцией. Большинство из них не требуют общего наркоза, они практически безболезненны и проводятся в дневном стационаре, без госпитализации. Израиль — одна из первых стран в мире, которая их внедрила и успешно применяет на практике.
В качестве примера могу привести ситуацию, когда у больного диагностирован рак почки. Допустим, опухоль имеет диметр два-три сантиметра, располагается на верхнем или нижнем полюсе почки, то есть к ней легко осуществить доступ. В таком случае интервенционная онкология позволяет обойтись без операции и всего, что с ней связано: общего наркоза, реанимации, приема наркотических препаратов для обезболивания. Вместо этого мы выполняем абляцию опухоли: под контролем ультразвука или рентгена вводим в нее иглу и разрушаем, используя жидкий азот, радиоволны или микроволновое излучение. В тот же день наш пациент уходит домой, несколько дней принимает легкие анальгетики, и не страдает от побочных эффектов.
— То есть интервенционная онкология избавляет человека от боли и лишних страданий?
— Да, наши манипуляции менее болезненны, чем хирургическая операция. Но еще интервенционная онкология занимается паллиативными, то есть поддерживающими процедурами. Она облегчает симптомы, когда полное излечение рака уже невозможно. Я упоминал больных с метастазами в костях. Представьте себе человека, который испытывает настолько сильные боли, что ему уже не помогают наркотики. А после абляции метастазов боль моментально проходит.
— Вы упоминали, что интервенционная онкология успешно справляется с метастазами в печени. Ваш интерес к опухолям печени не случаен?
— Печень представляет особую важность для онколога. Если рак не был диагностирован на ранней стадии, то именно в печени мы обнаруживаем его метастазы. В первую очередь опухоль, как правило, метастазирует в лимфоузлы, а на втором месте находится печень.
Мы говорили об абляции опухолей, но интервенционная онкология сегодняшнего дня располагает и другими средствами. Например, эмболизация опухолей печени при помощи наночастиц.
— Расскажите, пожалуйста, поподробнее.
— Цитостатики это препараты для химиотерапии? То есть речь идет замене химиотерапии?
— Вместо того, чтобы вводить препараты внутривенно, мы доставляем их непосредственно к опухоли. Таким образом, мы не подвергаем весь организм воздействию химиотерапии. С одной стороны, это дает возможность использовать высокие дозы лекарств, не опасаясь токсического эффекта. С другой, мы избавляем человека от побочных действий химиотерапии: выпадения волос, диареи, нарушений кроветворения. Почти сразу после окончания процедуры химиоэмболизации больной может уйти домой. Ему требуется симптоматическая терапия: небольшие дозы обезболивающих, препараты от тошноты. Но в конечном итоге процедура переносится хорошо и не сопровождается тяжелыми побочными эффектами.
— Кому подходит химиоэмболизация?
— Ее назначают, когда речь идет не о единичном очаге, а о распространенном процессе. Например, при гепатоме, это первичная злокачественная опухоль печени. Или при множественных печеночных метастазах, когда технически невозможно произвести абляцию каждого. Такое лечение показано и пациентам со специфическим видом рака почки — почечно-клеточным раком.
В целом, я считаю, что если количество опухолевых очагов больше трех, а диаметр каждого превышает 3-4 сантиметра, то криоабляция неэффективна, и лучше использовать химиоэмболизацию.
— Химиоэмболизация — это последнее достижение интервенционной онкологии или есть еще новшества?
— Безусловно, есть. Несколько лет назад была изобретена радиоэмболизация, когда опухоль уничтожается при помощи крошечных бета-частиц. Их размер также варьирует в пределах нескольких десятков микрон. В Европе эта технология известна как SIRT. Частицы вводятся непосредственно в артерию, питающую опухоль. В данном случае необходимо соблюдать большую осторожность, потому что радиоактивные частицы могут нанести вред и здоровым тканям, если попадут в них по ошибке. Поэтому до того, как приступать к радиоэмболизации, радиологи проводят подготовительную процедуру — ангиографию сосудов в области опухоли. Нужно убедиться, что опухоль не имеет общего кровоснабжения, например, с легкими, желудком или другими органами. Радиоэмболизация применяется при гепатоме, холангиокарциноме (раке желчевыводящих путей), при метастазах меланомы или раковых опухолей молочной железы.
— Доктор Нэеман, как долго Вы занимаетесь интервенционной онкологией?
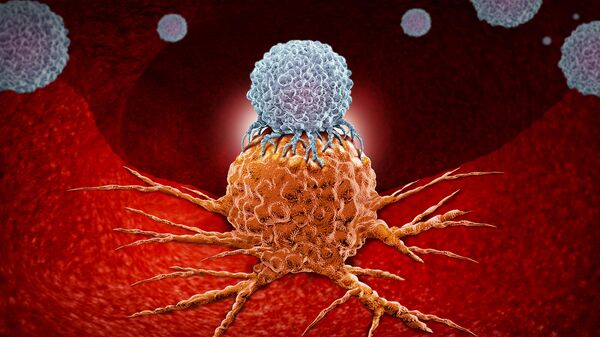

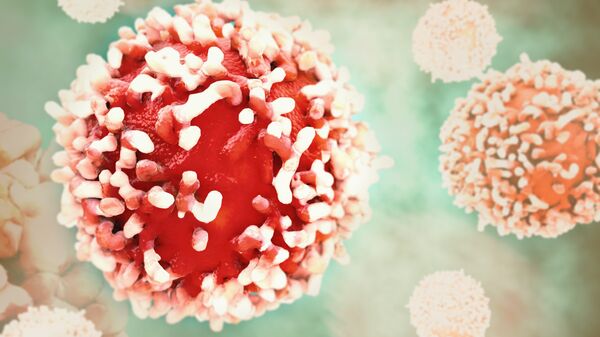
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Читайте также:

