Некоторые аспекты диагностики и лечения острых лейкозов
Виды лейкозов - острые и хронические
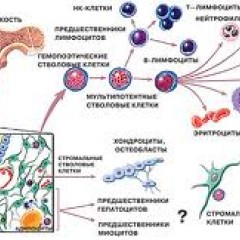
Анатомия и физиология костного мозга
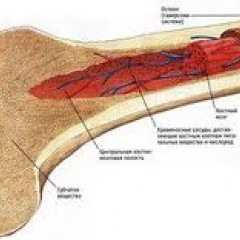
Костный мозг – это ткань находящаяся внутри костей, преимущественно в костях таза. Это самый главный орган, участвующий в процессе кроветворения (рождение новых клеток крови: эритроцитов, лейкоцитов, тромбоцитов). Этот процесс необходим организму, для того чтобы, заменить погибающие клетки крови, новыми. Костный мозг состоит из фиброзной ткани (она образует основу) и кроветворной ткани (клетки крови на разных этапах созревания). Кроветворная ткань включает 3 клеточные линии (эритроцитарный, лейкоцитарный и тромбоцитарный), по которым образуются соответственно 3 группы клеток (эритроциты, лейкоциты и тромбоциты). Общим предком этих клеток, является стволовая клетка, которая запускает процесс кроветворения. Если нарушается процесс образования стволовых клеток или их мутация, то нарушается процесс образования клеток по всем 3 клеточным линиям.
Эритроциты – это красные кровяные клетки, содержат гемоглобин, на нём фиксируется кислород, при помощи которого питаются клетки организма. При недостатке эритроцитов происходит недостаточное насыщение клеток и тканей организма кислородом, в результате чего проявляется различными клиническими симптомами.
Лейкоциты к ним относятся: лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы. Представляют собой белые клетки крови, они играют роль в защите организма и выработке иммунитета. Их недостаток вызывает снижение иммунитета и развитие различных инфекционных заболеваний.
Тромбоциты – это кровяные пластинки, которые участвуют в образовании тромба. Недостаток тромбоцитов приводит к различным кровотечениям.
Подробнее о видах кровяных клеток читайте в отдельной статье пройдя по ссылке.
Причины лейкоза, факторы риска
Симптомы различных видов лейкозов
- При острых лейкозахотмечаются 4 клинических синдрома:
- Анемический синдром: развивается из-за недостатка выработки эритроцитов, могут присутствовать множество симптомов или некоторые из них. Проявляется в виде усталости, бледности кожи и склер, головокружение, тошнота, быстрое сердцебиение, ломкость ногтей, выпадение волос, патологическое восприятие запаха;
- Геморрагический синдром: развивается в результате недостатка тромбоцитов. Проявляется следующими симптомами: вначале кровотечения из десен, образование синяков, кровоизлияния в слизистые оболочки (язык и другие) или в кожу, в виде мелких точек или пятен. В дальнейшем при прогрессировании лейкоза, развиваются и массивные кровотечения, в результате ДВС синдрома (диссеминированное внутрисосудистое свёртывания крови);
- Синдром инфекционных осложнений с симптомами интоксикации: развивается в результате недостатка лейкоцитов и с последующим снижением иммунитета, повышение температуры тела до 39 0 С, тошнота, рвота, потеря аппетита, резкое снижение веса, головная боль, общая слабость. У больного присоединяются различные инфекции: грипп, пневмония, пиелонефрит, абсцессы, и другие;
- Метастазы - по току крови или лимфы опухолевые клетки попадают в здоровые органы, нарушая их структуру, функции и увеличивая их в размере. В первую очередь метастазы попадают в лимфатические узлы, селезёнку, печень, а потом и в другие органы.
Эритробластный острый лейкоз, поражаются клетки предшественницы, из которых в дальнейшем должны развиться эритроциты. Чаще встречается в пожилом возрасте, характеризуется выраженным анемическим синдромом, не наблюдается увеличение селезёнки, лимфатических узлов. В периферической крови снижено количество эритроцитов, лейкоцитов и тромбоцитов, наличие молодых клеток (эритробластов).
Монобластный острый лейкоз, нарушается выработка лимфоцитов и моноцитов, соответственно они будут снижены в периферической крови. Клинически, проявляется, повышением температуры и присоединением различных инфекций.
Мегакариобластный острый лейкоз, нарушается выработка тромбоцитов. В костном мозге при электронной микроскопии обнаруживают мегакариобласты (молодые клетки, из которых образуются тромбоциты) и увеличенное содержание тромбоцитов. Редкий вариант, но чаще встречается в детском возрасте и обладает неблагоприятным прогнозом.
Хронический миелолейкоз, усиленное образование миелоидных клеток, из которых образуются лейкоциты (нейтрофилы, эозинофилы, базофилы), в результате чего, уровень этих групп клеток будет повышен. Долгое время может протекать бессимптомно. Позже появляются симптомы интоксикации (повышение температуры, общая слабость, головокружение, тошнота), и присоединение симптомов анемии, увеличение селезёнки и печени.
Хронический лимфолейкоз, усиленное образование клеток - предшественниц лимфоцитов, в результате уровень лимфоцитов в крови повышается. Такие лимфоциты не могут выполнять свою функцию (выработка иммунитета), поэтому у больных присоединяются различные виды инфекций, с симптомами интоксикации.
Диагностика лейкоза
- Повышение уровня лактатдегидрогеназы (норма 250 Ед/л);
- Высокий АСАТ (норма до 39 Ед/л);
- Высокая мочевина (норма 7,5 ммоль/л);
- Повышение мочевой кислоты (норма до 400 мкмоль/л);
- Повышение билирубина ˃20мкмоль/л;
- Снижение фибриногена 30%;
- Низкий уровень эритроцитов, лейкоцитов, тромбоцитов.
- Трепанобиопсия (гистологическое исследование биоптата из повздошной кости): не позволяет точно поставить диагноз, а лишь определяет разрастание опухолевых клеток, с вытеснением нормальных клеток.
- Цитохимическое исследование пунктата костного мозга: выявляет специфические ферменты бластов (реакция на пероксидазу, липиды, гликоген, неспецифическую эстеразу), определяет вариант острого лейкоза.
- Иммунологический метод исследования: выявляет специфические поверхностные антигены на клетках, определяет вариант острого лейкоза.
- УЗИ внутренних органов: неспецифический метод, выявляет увеличенные печень, селезёнку и другие внутренние органы с метастазами опухолевых клеток.
- Рентген грудной клетки: является, неспецифическим метом, обнаруживает наличие воспаления в лёгких при присоединении инфекции и увеличенные лимфатические узлы.
Лечение лейкозов
- Полихимиотерапия, применяется с целью противоопухолевого действия:
- Трансфузионная терапия: эритроцитарная масса, тромбоцитарная масса, изотонические растворы, с целью коррекции выраженного анемического синдрома, геморагического синдрома и дезинтоксикации;
- Общеукрепляющая терапия:
- применяется с целью укрепления иммунитета. Дуовит по 1 таблетке 1 раз в день.
- Препараты железа, для коррекции недостатка железа. Сорбифер по 1 таблетке 2 раза в день.
- Иммуномодуляторы повышают реактивность организма. Тималин, внутримышечно по 10-20 мг 1 раз в день, 5 дней, Т-активин, внутримышечно по 100 мкг 1 раз в день, 5 дней;
- Гормонотерапия: Преднизолон в дозе по 50 г в день.
- Антибиотики широкого спектра действия назначаются для лечения присоединяющих инфекций. Имипенем по 1-2 г в сутки.
- Радиотерапия применяется для лечения хронического лейкоза. Облучение увеличенной селезёнки, лимфатических узлов.
Использование солевых повязок с 10% солевым раствором (100 г соли на 1 литр воды). Намочить льняную ткань в горячем растворе, ткань немного сжимать, сложить в четверо, и накладывать на больное место или опухоль, закрепить лейкопластырем.
Настой из измельчённых игл сосны, сухая кожа лука, плоды шиповника, все ингредиенты смешать, залить водой, и довести до кипения. Настоять сутки, процедить и пить вместо воды.
Употреблять соки из красной свеклы, граната, моркови. Кушать тыкву.
Настой из цветков каштана: взять 1 столовую ложку цветков каштана, залить в них 200 г воды, вскипятить и оставить настаиваться на несколько часов. Пить по одному глотку на один приём, необходимо выпить 1 литр в день.
Хорошо помогает в укреплении организма, отвар из листьев и плодов черники. Кипятком примерно 1 литр, залить 5 ложек листьев и плодов черники, настоять несколько часов, выпивать всё за один день, принимать около 3 месяцев.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Острый лейкоз - заболевание, в основе которого лежит образование клона злокачественных (бластных) клеток, имеющих общую клетку-предшественницу. Бласты инфильтрируют костный мозг, вытесняя постепенно нормальные гемопоэтические клетки, что приводит к резкому угнетению кроветворения. Для многих типов лейкозов характерна также бластная инфильтрация внутренних органов.
Острый лейкоз подразделяют на лимфобластный (ОЛЛ) и миелобластный (ОМЛ). Считается, что возникновение острого лейкоза могут обусловить следующие факторы:
- неустановленные (чаще всего);
- наследственные:
- синдром Дауна
- синдром Блума
- анемия Фанкони
- атаксия-телеангиэктазия
- синдром Клайнфелтера
- несовершенный остеогенез
- синдром Вискотта - Олдрича
- лейкоз у близнецов
- химические:
- бензол
- алкилирующие агенты (хлорамбуцил, мельфалан)
- радиоактивное облучение
- предрасполагающие гематологические расстройства (миелодисплазия, апластическая анемия)
- вирусы HTLV-I, вызывающие Т-клеточный лейкоз и лимфому у взрослых.
В последние десятилетия достигнуты значительные успехи в лечении острых лейкозов. Пятилетняя выживаемость зависит от типа лейкоза и возраста пациентов:
- ОЛЛ у детей - 65 - 75%;
- ОЛЛ у взрослых - 20 - 35%;
- ОМЛ у пациентов моложе 55 лет - 40 - 60%;
- ОМЛ у пациентов старше 55 лет - 20%.
Классификация
Различия между ОЛЛ и ОМЛ базируются на морфологических, цитохимических и иммунологических особенностях названных типов лейкозов. Точное определение типа лейкоза имеет первостепенное значение для терапии и прогноза.
Как ОЛЛ, так и ОМЛ в свою очередь подразделяются на несколько вариантов согласно FAB- классификации (French-American-British). Так, существуют три варианта ОЛЛ - L1, L2, L3 и семь вариантов ОМЛ:
- М0 - недифференцированный ОМЛ;
- М1 - миелобластный лейкоз без созревания клеток;
- М2 - миелобластный лейкоз с неполным созреванием клеток;
- М3 - промиелоцитарный лейкоз;
- М4 - миеломоноцитарный лейкоз;
- М5 - монобластный лейкоз;
- М6 - эритролейкоз;
- М7 - мегакариобластный лейкоз.
В соответствии с экспрессируемыми антигенами ОЛЛ делится на Т-клеточный и В-клеточный типы, включающие в себя в зависимости от степени зрелости несколько подтипов (пре-Т-клеточный, Т-клеточный, ранний пре-В-клеточный, пре-В-клеточный, В-клеточный). Четкая корреляция между морфологическими и иммунофенотипическими вариантами отсутствует, за исключением того, что морфология L3 характерна для В-клеточного лейкоза.
Что касается ОМЛ, иммунофенотипирование (т.е. определение экспрессируемых антигенов) не всегда помогает различить варианты М0 - М5. С этой целью дополнительно используют специальное цитохимическое окрашивание. Для постановки диагноза эритролейкоза (М6) и мегакариобластного лейкоза (М7) бывает достаточно иммунофенотипирования.
Распространенность
ОЛЛ наиболее часто возникает в возрасте 2 - 10 лет (пик в 3 - 4 года), затем распространенность заболевания снижается, однако после 40 лет отмечается повторный подъем. ОЛЛ составляет около 85% лейкозов, встречающихся у детей. ОМЛ, напротив, наиболее часто встречается у взрослых, причем частота его увеличивается с возрастом.
Клинические проявления
Клинические проявления при лейкозах обусловлены бластной инфильтрацией костного мозга и внутренних органов. Анемия проявляется бледностью, вялостью, одышкой. Нейтропения приводит к различным инфекционным осложнениям. Основные проявления тромбоцитопении - спонтанное образование гематом, кровотечения из носа, матки, мест инъекций, десен. Характерны также боли в костях, лимфаденопатия, гепатоспленомегалия. Возможны затруднение дыхания в связи с наличием медиастинальных масс, увеличение яичек, менингеальные симптомы. При ОМЛ встречается гипертрофия десен.
Обследование пациентов
Общий анализ крови: возможно снижение уровня гемоглобина и числа тромбоцитов; содержание лейкоцитов - от менее 1,0 • 10 9 /л до 200 • 10 9 /л, дифференцировка их нарушена, присутствуют бласты.
Коагулограмма может быть изменена, особенно при промиелоцитарном лейкозе, когда в бластных клетках имеются гранулы, содержащие прокоагулянты.
Биохимический анализ крови при высоком лейкоцитозе может свидетельствовать о почечной недостаточности.
Рентгенограмма органов грудной клетки позволяет выявить медиастинальные массы, которые встречаются у 70% больных с Т-клеточным лейкозом.
Костномозговая пункция: гиперклеточность с преобладанием бластов.
Иммунофенотипирование - определяющий метод в разграничении ОЛЛ и ОМЛ.
Цитогенетические и молекулярные исследования позволяют выявлять хромосомные аномалии, например филадельфийскую хромосому (продукт транслокации части 9-й хромосомы на 22-ю; определяет плохой прогноз при ОЛЛ).
Люмбальная пункция используется для выявления поражения центральной нервной системы (нейролейкоз).
Все пациенты с подозреваемым или установленным лейкозом должны быть как можно быстрее направлены для обследования и лечения в специализированные стационары.
Поддерживающая терапия предусматривает трансфузии тромбоцитов, эритроцитов, свежезамороженной плазмы, антибиотикотерапию инфекционных осложнений.
| Факторы | ОЛЛ | ОМЛ |
| Возраст | Менее 1 года или более10 лет | Более 60 лет |
| Пол | Мужской | Мужской или женский |
| Лейкоцитоз | Более 50 • 10 9 /л | Более 50 • 10 9 /л |
| Поражение ЦНС | Бласты в ликворе | Бласты в ликворе |
| Ремиссия | Не достигнута после индукционной терапии | Более 20% бластов в костном мозге после 1-го курса лечения |
| Цитогенетика | Филадельфийская хромосома | Делеции или моносомия по 5 или 7 хромосомам; множественные хромосомные аномалии |
Цель химиотерапии - индукция ремиссии (менее 5% бластов в костном мозге) и последующая элиминация резидуальных бластных клеток посредством консолидирующей терапии. Химиопрепараты нарушают способность злокачественных клеток к делению, а комбинирование двух или трех препаратов повышает эффективность терапии и снижает риск развития резистентности бластов к терапии. Для профилактики и лечения нейролейкоза используются эндолюмбальные введения метотрексата и краниальное облучение.
Трансплантация костного мозга (ТКМ). Аллогенная ТКМ может применяться в случае плохого прогноза при ОЛЛ, при ОМЛ в первую ремиссию, при рецидивах лейкозов. Однако в связи с дефицитом совместимых доноров эта возможность доступна далеко не всем пациентам.
Факторы,обусловливающие плохой прогноз при острых лейкозах, представлены в таблице.
Токсичность терапии
Ранняя токсичность включает тошноту, рвоту, мукозиты, выпадение волос, нейропатии, печеночную и почечную недостаточность, выраженное угнетение кроветворения.
Поздняя токсичность может проявляться поражениями различных органов:
- сердце - аритмии, кардиомиопатии;
- легкие - фиброз;
- эндокринная система - задержка роста, гипотиреоидизм, бесплодие;
- почки - снижение гломерулярной фильтрации;
- психика - эмоциональные и интеллектуальные нарушения;
- вторичные опухоли;
- катаракта.
Все пациенты с острым лейкозом должны наблюдаться не менее 10 лет по завершении лечения. Особого внимания требуют к себе такие проблемы, как задержка роста и эндокринные дисфункции у детей.
Liesner RJ, Goldstone AH. The acute leukaemias. BMJ 1997;314:733-6.
Острый лейкоз – опухолевое поражение кроветворной системы, морфологической основой которого выступают незрелые (бластные) клетки, вытесняющие нормальные гемопоэтические ростки. Клиническая симптоматика острого лейкоза представлена прогрессирующей слабостью, немотивированным подъемом температуры, артралгиями и оссалгиями, кровотечениями различных локализаций, лимфаденопатией, гепатоспленомегалией, гингивитами, стоматитами, ангинами. Для подтверждения диагноза необходимо исследование гемограммы, пунктата костного мозга, биоптата подвздошной кости и лимфоузлов. Основу лечения острых лейкозов составляют химиотерапевтические курсы и сопроводительная терапия.


- Причины острого лейкоза
- Классификация острого лейкоза
- Симптомы острого лейкоза
- Диагностика острого лейкоза
- Лечение острого лейкоза
- Цены на лечение
Общие сведения
Причины острого лейкоза
Первопричиной острого лейкоза является мутация гемопоэтической клетки, дающей начало опухолевому клону. Мутация кроветворной клетки приводит к нарушению ее дифференцировки на ранней стадии незрелых (бластных) форм с дальнейшей пролиферацией последних. Образующиеся опухолевые клетки замещают нормальные ростки гемопоэза в костном мозге, а в дальнейшем выходят в кровь и разносятся в различные ткани и органы, вызывая их лейкемическую инфильтрацию. Все бластные клетки несут в себе одинаковые морфологические и цитохимические признаки, что свидетельствует в пользу их клонального происхождения от одной клетки-родоначальницы.
Причины, запускающие мутационный процесс, не известны. В гематологии принято говорить о факторах риска, повышающих вероятность развития острого лейкоза. В первую очередь, это генетическая предрасположенность: наличие в семье больных с острым лейкозом практически утраивает риск заболевания у близких родственников. Риск возникновения острого лейкоза повышается при некоторых хромосомных аномалиях и генетических патологиях - болезни Дауна, синдроме Клайнфельтера, Вискотта-Олдрича и Луи-Барра, анемии Фанкони и др.
Вероятно, что активация генетической предрасположенности происходит под действием различных экзогенных факторов. В числе последних могут выступать ионизирующая радиация, химические канцерогены (бензол, мышьяк, толуол и др.), цитостатические препараты, используемые в онкологии. Нередко острый лейкоз становится следствием противоопухолевой терапии других гемобластозов – лимфогранулематоза, неходжкинских лимфом, миеломной болезни. Подмечена связь острых лейкозов с предшествующими вирусными инфекциями, угнетающими иммунную систему; сопутствующими гематологическими заболеваниями (некоторыми формами анемий, миелодисплазиями, пароксизмальной ночной гемоглобинурией и др.).
Классификация острого лейкоза
В онкогематологии общепринята международная FAB-классификация острых лейкозов, дифференцирующая различные формы заболевания в зависимости от морфологии опухолевых клеток на лимфобластные (вызываемые низкодифференцированными предшественниками лимфоцитов) и нелимфобластные (объединяющие остальные формы).
1. Острые лимфобластные лейкозы взрослых и детей:
- пре-В-форма
- В-форма
- пре-Т-форма
- Т-форма
- ни Т ни В-форма
2. Острые нелимфобластные (миелоидные) лейкозы:
- о. миелобластный (вызван неконтрорлируемой пролиферацией предшественников гранулоцитов)
- о. моно- и о. миеломонобластный (характеризуются усиленным размножением монобластов)
- о. мегакариобластный (связан с преобладанием недифференцированных мегакариоцитов – предшественников тромбоцитов)
- о. эритробластный (обусловлен пролиферацией эритробластов)
3. Острый недифференцированный лейкоз.
Течение острых лейкозов проходит ряд стадий:

Симптомы острого лейкоза
В развернутом периоде острого лейкоза развиваются анемический, геморрагический, интоксикационный и гиперпластический синдромы.
Анемические проявления обусловлены нарушением синтеза эритроцитов, с одной стороны, и повышенной кровоточивостью – с другой. Они включают бледность кожных покровов и слизистых, постоянную усталость, головокружение, сердцебиение, повышенное выпадение волос и ломкость ногтей и др. Усиливается выраженность опухолевой интоксикации. В условиях абсолютной лейкопении и упадка иммунитета легко присоединяются различные инфекции: пневмонии, кандидоз, пиелонефрит и т. д.
В основе геморрагического синдрома лежит выраженная тромбоцитопения. Диапазон геморрагических проявлений колеблется от мелких единичных петехий и синяков до гематурии, десневых, носовых, маточных, желудочно-кишечных кровотечений и пр. По мере прогрессирования острого лейкоза кровотечения могут становиться все массивнее вследствие развития ДВС-синдрома.
Гиперпластический синдром связан с лейкемической инфильтрацией как костного мозга, так и других органов. У больных острым лейкозом наблюдается увеличение лимфоузлов (периферических, медиастинальных, внутрибрюшных), гипертрофия миндалин, гепатоспленомегалия. Могут возникать лейкозные инфильтраты кожи (лейкемиды), оболочек мозга (нейролейкоз), поражение легких, миокарда, почек, яичников, яичек и др. органов.
Полная клинико-гематологическая ремиссия характеризуется отсутствием внекостномозговых лейкемических очагов и содержанием бластов в миелограмме менее 5% (неполная ремиссия – менее 20%). Отсутствие клинико-гематологических проявлений в течение 5 лет расценивается как выздоровление. В случае увеличения бластных клеток в костном мозге более 20%, их появления в периферической крови, а также выявления внекостномозговых метастатических очагов диагностируется рецидив острого лейкоза.
Терминальная стадия острого лейкоза констатируется при неэффективности химиотерапевтического лечения и невозможности достижения клинико-гематологической ремиссии. Признаками данной стадии служат прогрессирование опухолевого роста, развитие несовместимых с жизнью нарушений функции внутренних органов. К описанным клиническим проявлениям присоединяются гемолитическая анемия, повторные пневмонии, пиодермии, абсцессы и флегмоны мягких тканей, сепсис, прогрессирующая интоксикация. Причиной смерти больных становятся некупируемые кровотечения, кровоизлияния в мозг, инфекционно-септические осложнения.
Диагностика острого лейкоза
С целью подтверждения и идентификации разновидности острого лейкоза выполняется стернальная пункция с морфологическим, цитохимическим и иммунофенотипическим исследованием костного мозга. При исследовании миелограммы обращает внимание увеличение процента бластных клеток (от 5% и выше), лимфоцитоз, угнетение красного ростка кроветворения (кроме случаев о. эритромиелоза) и абсолютное снижение или отсутствие мегакариоцитов (кроме случаев о. мегакариобластного лейкоза). Цитохимические маркерные реакции и иммунофенотипирование бластных клеток позволяют точно установить форму острого лейкоза. При неоднозначности трактовки анализа костного мозга прибегают к проведению трепанобиопсии.
С целью исключения лейкемической инфильтрации внутренних органов производится спинномозговая пункция с исследованием ликвора, рентгенография черепа и органов грудной клетки, УЗИ лимфатических узлов, печени и селезенки. Кроме гематолога, больные острым лейкозом должны быть осмотрены неврологом, офтальмологом, отоларингологом, стоматологом. Для оценки тяжести системных нарушений может потребоваться исследование коагулограммы, биохимического анализа крови, проведение электрокардиографии, ЭхоКГ и др.
Дифференциально-диагностические мероприятия направлены на исключение ВИЧ-инфекции, инфекционного мононуклеоза, цитомегаловирусной инфекции, коллагенозов, тромбоцитопенической пурпуры, агранулоцитоза; панцитопении при апластической анемии, В12 и фолиеводефицитной анемии; лейкемоидных реакций при коклюше, туберкулезе, сепсисе и др. заболеваниях.

Лечение острого лейкоза
Пациентов с острым лейкозом лечат в стационарах онкогематологического профиля. В палатах организуется усиленный санитарно-дезинфекционный режим. Больные с острым лейкозом нуждаются в проведении гигиенической обработки полости рта, профилактики пролежней, туалета половых органов после физиологических отправлений; организации высококалорийного и витаминизированного питания.
Непосредственно лечение острых лейкозов проводится последовательно; основные этапы терапии включают достижение (индукцию) ремиссии, ее закрепление (консолидацию) и поддержание, профилактику осложнений. Для этого разработаны и используются стандартизированные схемы полихимиотерапии, которые подбираются гематологом с учетом морфологической и цитохимической формы острого лейкоза.
При благоприятной ситуации ремиссия обычно достигается в течение 4-6 недель усиленной терапии. Затем, в рамках консолидации ремиссии проводится еще 2-3 курса полихимиотерапии. Поддерживающая противорецидивная терапия осуществляется еще в течение не менее 3-х лет. Наряду с химиотерапией при остром лейкозе необходимо проведение сопроводительного лечения, направленного на предупреждение агранулоцитоза, тромбоцитопении, ДВС-синдрома, инфекционных осложнений, нейролейкемии (антибиотикотерапия, переливание эритроцитарной, тромбоцитарной массы и свежезамороженной плазмы, эндолюмбальное введение цитостатиков). При лейкемической инфильтрации глотки, средостения, яичек и др. органов проводится рентгенотерапия очагов поражения.
В случае успешного лечения достигается уничтожение клона лейкозных клеток, нормализация кроветворения, что способствует индукции длительного безрецидивного периода и выздоровления. Для предупреждения рецидивов острого лейкоза может быть проведена трансплантация костного мозга после предварительного кондиционирования путем химиотерапии и тотального облучения.
По имеющимся статистическим сведениям, использование современных цитостатических средств приводит к переходу острого лейкоза в фазу ремиссии у 60-80% больных; из них у 20-30% удается добиться полного выздоровления. В целом прогноз при острых лимфобластных лейкозах более благоприятен, чем при миелобластных.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

