Нейтронозахватная терапия при раке
Первый пучок нейтронов на нашей установке для бор-нейтронозахватной терапии рака (БНЗТ, BNCT) был получен в 2008 г. Главное достижение последних лет в том, что мы не только привели установку в рабочее состояние, но и поняли процессы, которые в ней происходят, и внесли соответствующие изменения в конструкцию. Это важно, потому что мы имеем дело с абсолютно новым типом ускорителя заряженных частиц.
Из России – с идеей
Все наши открытия и разработки запатентованы – российских патентов у нас более десятка. Пример наших разработок – нейтроногенерирующая мишень. Когда мы только начали заниматься созданием нашей установки, в одной научной статье уважаемых специалистов было сказано, что лучшей является литиевая мишень, но сделать ее не представляется возможным. У нас такая мишень прекрасно работает уже почти десять лет.
Недавно произошел примечательный казус, когда меня пригласили в Институт науки и технологий Окинавы – японский аналог нашего Сколково, в который были вложены безумные средства. Одна из задач лаборатории, которую возглавил бывший директор КЕКа (знаменитого японского ускорительного комплекса), – создание нейтроногенерирующей мишени. Изучив этот вопрос, японский руководитель также пришел к мысли, что такую мишень сделать невозможно, но мои друзья и его коллеги из КЕКа убедили его, что еще как можно! И я на их лабораторном семинаре рассказал, что есть совсем простая альтернативная идея, как ее сделать. До сих пор помню потрясенное выражение их лиц… Сейчас подобные мишени делаются во всем мире: в первой статье обычно ссылаются на наши работы, потом забывают. Это нормально: чтобы защитить свои идеи, надо не топтаться на месте, а придумывать что-то новое.
В октябре 2016 г. в г. Колумбия американского штата Миссури состоялся Конгресс по нейтрон-захватной терапии, который проводится раз в два года. Там собираются все – химики, биологи и физики, всего около 200 человек. В этот раз от России было два представителя – я и В. И. Брегадзе из Института элементоорганических соединений им. А. Н. Несмеянова РАН (Москва), который занимается созданием соединений адресной доставки бора. Это показывает, какие отечественные команды достигли реальных успехов в этой области.
Я знаю в мире еще лишь две группы, которые, как говорят, получили пучок с нужными параметрами на ускорителях другого типа, одна бельгийско-японская, другая американская, но только наши результаты на сегодняшний день опубликованы. На том же конгрессе от российской стороны было представлено 7 докладов, три из которых докладывали японцы. И на первом же выступлении прозвучал вопрос: зачем они вообще поехали в Сибирь? Ответ был прост: там единственный источник нейтронов, который реально работает.
Из российских специалистов я бы хотел отметить еще В. Н. Митина, руководителя ветеринарной клиники при Российском онкологическом научном центре им. Н. Н. Блохина, который с помощью БНЗТ довольно успешно лечил собак на учебном ядерном реакторе соседнего МИФИ. После его смерти 11 лет тому назад эти работы прекратились.
Кстати сказать, подобное лечение очень недешевое: стоимость препаратов адресной доставки бора довольно высока, так как при достаточно сложном производстве спрос невелик. Сегодня доза препарата, необходимая для лечения одного больного, обойдется в случае борфенилаланина примерно в 0,25 млн рублей, боркаптата – раза в 4 больше. Но 15 лет назад эти препараты стоили еще на порядок дороже, а сейчас на каждой конференции по БНЗТ предлагаются и обсуждаются сотни новых препаратов адресной доставки бора. Правда, каждый раз новые… В России таких соединений вообще не выпускают, мы используем препараты, произведенные чешской компанией Katchem.

Физики свое дело сделали
Когда мы еще только планировали свой ускоритель, мы поставили задачу достичь тока протонного пучка 10 мA, а получили поначалу в 100 раз меньше. Такая же история год назад приключилась с нашими японскими коллегами из Университета Цукубы, которым компания Mitsubishi делает подобную машину, но на другом типе ускорителя: при той же плановой цифре они вообще получили 0,1 % от желаемого.
Главная моя мечта тогда была – достичь хотя бы 3 мA, чтобы можно было начать лечить людей. И вот к началу 2015 г. мы получили сразу 5 мA, в 50 раз увеличив ток! Фактически сегодня уже не конструкция ускорителя лимитирует возможность дальнейшего увеличения тока. К тому же, по моему мнению, этих характеристик более чем достаточно для медицинских целей. Тем не менее в следующем году мы планируем достичь заявленной цифры – это уже дело принципа.

Следующей мечтой стало доказать пригодность нашей машины с точки зрения не только физики, но и потребителя. Для этого нужно было поработать с клеточными культурами и лабораторными животными. Чтобы решить первую задачу, мы завели дружбу с японским Университетом Цукуба, при котором есть известная медицинская клиника. О ней могу лишь сказать, что протонная терапия рака, которая в прошлом году заработала в подмосковном наукограде Протвино, о чем было гордо доложено В. В. Путину, в прайсе этой клиники появилась еще в 1983 г., т. е. 33 года назад! А в 2001 г. японцы заменили протонную установку на более современную.
И вот в июне 2015 г. я встретился с директором клиники Акиро Мацумура, который в числе прочего рассказал, что Mitsubishi никак не может запустить ускоритель для БНЗТ. Так мы договорились о совместной работе. Это сотрудничество – взаимовыгодное. У нас – установка, у японцев – большой опыт проведения подобных исследований и, более того, лечения людей методом БНЗТ на реакторе JRR-4 (Токай), который впоследствии закрыли.



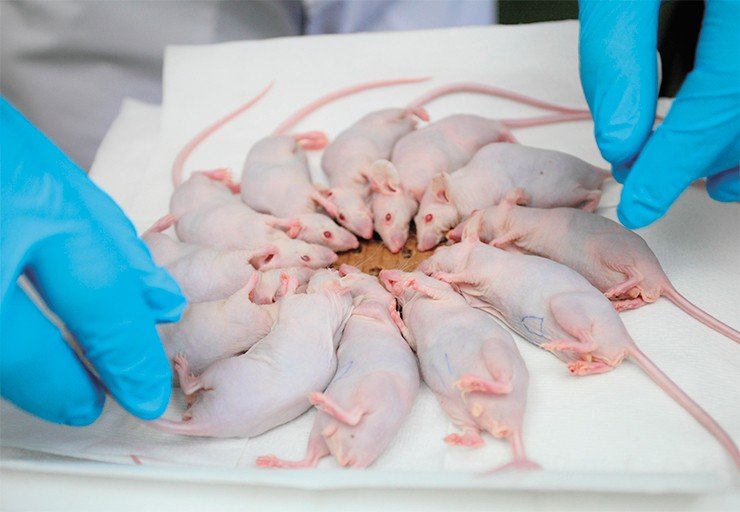
СТАДИЯ – ДОКЛИНИЧЕСКАЯ На ускорителе ИЯФ проводятся доклинические исследования влияния как нейтронного облучения, так и собственно бор-нейтронозахватной терапии на опухолевые клеточные культуры, а также на лабораторных животных (мышей с врожденным иммунодефицитом).
В исследованиях на клеточных культурах используются различные линии как здоровых, так и опухолевых клеток, которые представлены преимущественно опухолями головного мозга. Клетки инкубируют в среде, обогащенной изотопом бор-10, а после этого облучают на ускорителе. После облучения проводят клоногенный анализ: проверяется жизнеспособность клеток, в частности, их способность делиться и образовывать новые колонии.
На основе экспериментов по облучению животных уже дана оценка последствий воздействия бор-нейтронозахватной терапии в зависимости от дозы облучения. Задача измерения дозы, которую получает пациент при проведении БНЗТ, является одной из самых сложных, поскольку суммарная доза состоит из нескольких компонент, измерение каждой из которых затруднено: от сопутствующих гамма-квантов из литиевой мишени и ускорителя, от быстрых нейтронов, от тепловых нейтронов и от захвата нейтрона бором. Каждая из этих компонент зависит от текущей геометрии литиевой мишени, а также от параметров протонного пучка. Плюс к этому доза от захвата нейтрона бором также зависит еще и от типа, формы и расположения опухоли, а также от распределения бора в ней и в окружающих тканях.
Расчет всех четырех дозовых компонент и предсказание воздействия на здоровые и опухолевые ткани при проведении БНЗТ являются значительно более сложными задачами, чем определение доз в традиционной лучевой терапии, которое обычно опирается на полуэмпирические алгоритмы и измерения в водном фантоме. Одним из вариантов создания эмпирического алгоритма планирования терапии являются эксперименты на лабораторных животных, для которых хорошо известны кривые доза–эффект. То есть по биологическим последствиям облучения в тканях животных можно более точно определять полученную дозу, чем с помощью расчетов.
Все животные без опухоли после облучения остались живы, признаков патологического воздействия на здоровые ткани не обнаружено. Сейчас более углубленно изучается влияние облучения на клеточном уровне, включая процессы кроветворения, состояние тканей жизненно-важных органов и воздействия борсодержащих препаратов на организм животного, чтобы подобрать оптимальную дозу.
После окончательной отработки технологии на животных планируется перейти к клиническим испытаниям, т. е. терапии на пациентах, больных раком.
В самом удачном испытании у трех из пяти животных опухоль рассосалась полностью, что было подтверждено результатами томографии, и животные стали здоровыми – они прожили в виварии еще два месяца и были усыплены просто потому, что результат эксперимента был достигнут. Это поистине фантастический результат. Ведь борфенилаланин, который мы вкалываем, накапливается не только в опухоли, но и в печени и почках. При этом мышь – животное маленькое, поэтому, в отличие от человека, ее облучают целиком, из-за чего больше страдают здоровые ткани. Нужно еще учитывать, что на поздних стадиях развития опухоли в результате гибели раковых клеток может возникнуть масштабный некроз. Но даже при всех этих отягчающих обстоятельствах мы вылечили животных!
Пора внедрять!
БНЗТ на сегодня является новой для нашей страны, перспективной и, главное, проверенной методикой лечения раковых опухолей, так что со стороны государства и крупного бизнеса будет большой глупостью ее не поддержать. Та же Япония сейчас развивает пять вполне успешных проектов по БНЗТ на разных типах ускорителей в рамках сотрудничества государства и таких индустриальных гигантов, как Mitsubishi и Toshiba. Фактически, все это государственные вложения.

Самый короткий и простой для нас путь обеспечить финансирование строительства терапевтической установки БНЗТ – получить грант в рамках прорывного научного проекта на базе программы САЕ (стратегических академических единиц) Новосибирского государственного университета. Согласно проекту, в течение очень небольшого срока (государственное софинансирование рассчитано на 4 года) мы должны будем построить установку непосредственно для медицинского использования и пролечить не менее 10 пациентов. Это достаточно амбициозный план, который будет непросто выполнить, но нам не привыкать ставить перед собой цели, на первый взгляд кажущиеся невыполнимыми. Фактически подготовительная работа по реализации этого проекта уже началась.
В рамках проекта также планируется разработка улучшенного препарата адресной доставки бора – российского аналога борфенилаланина. Этим будет заниматься Институт органической химии СО РАН (Новосибирск), у которого есть свое опытное производство, совместно с Институтом элементоорганических соединений им. А. Н. Несмеянова РАН (Москва).
В беседах с нашими японскими коллегами родилась абсолютно новая идея дозиметрии для БНЗТ, на которую уже тоже получен патент. А однажды на лыжне мы разговорились с коллегой по институту Андреем Соколовым, в результате чего появился патент на генерацию монохроматических нейтронов для поиска темной материи. Сейчас вместе с Александром Шмаковым из Института катализа СО РАН и Сергеем Громиловым из Института неорганической химии СО РАН обсуждаем возможность приспособить нашу машину для нейтронной дифрактометрии, которая позволит определять структуру легких элементов вещества.
Все эти идеи, которые мы патентуем, по большому счету очень тривиальны, но почему-то они приходят в голову лишь тому, кто не обогащен грузом опыта, т. е. дилетанту. Как я уже упоминал, именно так была создана наша установка, и я, будучи изначально специалистом по плазме, а не ускорительщиком, честно говоря, до сих пор удивляюсь, как у нас все это получилось.
За последние пять лет мы из специалистов, потенциально привлекательных в области БНЗТ, превратились в реальных игроков на этом поле деятельности. Последний же год мы фактически работали на потребителя. И это очень важно, ведь физики часто думают: вот, мы сделали что-то очень хорошее, почему же пользователи не бегут и не отхватывают это с руками? С таким подходом ничего не получится: надо самому прикладывать много усилий, чтобы работа по внедрению в практику твоих идей и разработок принесла конкретные плоды.

На сегодня в мире с помощью БНЗТ пролечено около двух тыс. человек, для чего использовались уже существующие исследовательские и учебные ядерные реакторы, многие из которых уже не работают. Важность же подобной терапии не нужно объяснять: с ее помощью можно лечить такие практически неизлечимые на сегодня опухоли, как глиобластомы и раковые метастазы. Но до сих пор эта методика остается, по сути, экспериментальной, и специалисты должны приложить еще немало усилий по разработке адекватных стратегий и методик лечения.
Наша установка на сегодня является единственным в мире работающим компактным источником пучка нейтронов, пригодного для БНЗТ. Мы готовы создать действующий медицинский ускоритель, на котором можно будет лечить пациентов уже в ближайшие годы. Но оба наших гранта – от Минобрнауки России на усовершенствование установки и от РНФ для проведения биологических исследований – заканчиваются в декабре этого года. Что будет завтра?
Neutron Capture Therapy: Principles and Applications. Eds.: W. Sauerwein, A. Wittig, R. Moss, Y. Nakagawa. Springer, 2012. 533 p.
Таскаев С. Ю., Каныгин В. В. Бор-нейтронозахватная терапия. Новосибирск: Изд-во СО РАН, 2016. 216 с.
В публикации использованы фото Александра Макарова
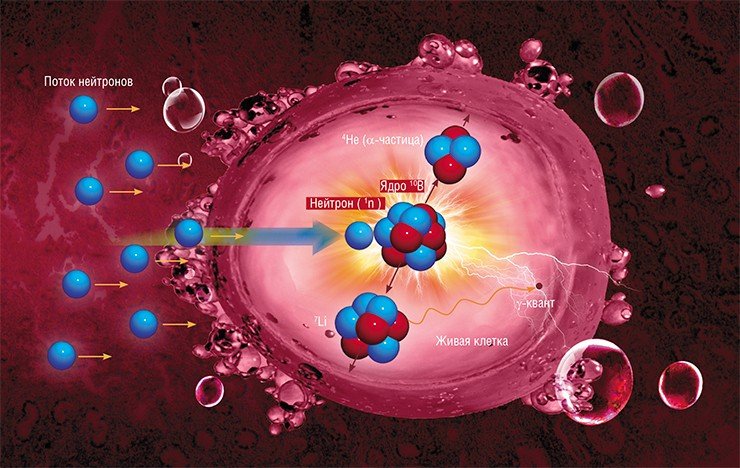
Бор-нейтронозахватная терапия (БНЗТ) — перспективная методика лечения злокачественных опухолей: пациенту вводится препарат, содержащий нетоксичный стабильный изотоп бора — бор-10. Раковые клетки интенсивно накапливают этот препарат, так что его концентрация становится гораздо больше, чем в окружающих здоровых тканях. После этого пациент облучается потоком нейтронов. Ядра атомов бора обладают свойством поглощать нейтроны очень интенсивно в отличие от других ядер атомов, из которых состоит тело человека. При поглощении нейтрона ядром бора-10 происходит ядерная реакция с большим выделением энергии. Этот атомный микровзрыв, энергия которого выделяется практически внутри клетки размером около 10 мкм, уничтожает ее, но не оказывает существенного влияния на окружающие клетки.
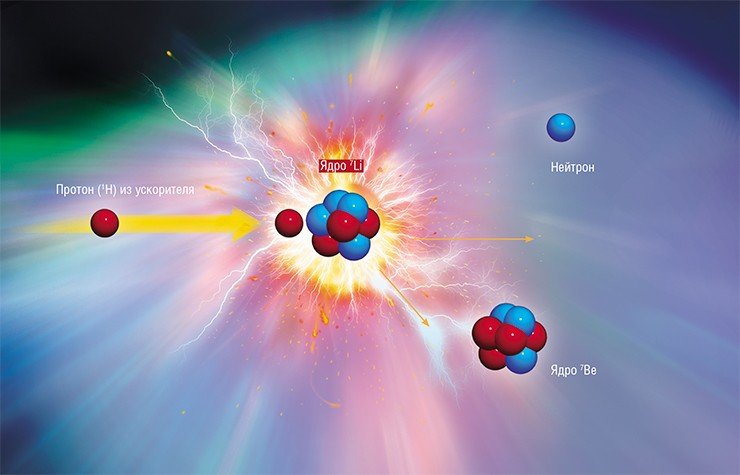
Основная идея БНЗТ была сформулирована американским рентгенологом Гордоном Лочером в 1936 году, вскоре после открытия сэром Джеймсом Чадвиком нейтрона и исследования Гордоном Тэйлором и Морисом Голдхабером ядерной реакции поглощения нейтрона бором-10. Схематически эта реакция показана на рис. 1.

В развитии методики БНЗТ выделяют четыре периода.
Первый период связан с ранними клиническими испытаниями, проведенными в США в 1950-х годах на специально построенных двух ядерных реакторах. Испытания не продемонстрировали терапевтическую эффективность метода из-за слабой селективности и низкой концентрации бора.
Второй период определили пионерские работы японского доктора Хироши Хатанаки в 1970–1980-е годы. Он добился впечатляющих результатов: проводя в зале ядерного реактора хирургическую операцию, а затем облучая открытую опухоль нейтронами, он вылечивал больных с глиобластомами мозга, которым без терапии оставалось жить не более года.
Эти результаты дали толчок третьему периоду развития БНЗТ — клиническим испытаниям методики на ядерных реакторах уже без проведения предварительной хирургической операции. Были получены положительные результаты при лечении глиобластомы, меланомы, опухоли шеи, менингиомы, мезотелиомы плевры и гепатоцеллюлярной карциномы. Можно было внедрять методику в клиническую практику еще 30 лет тому назад, но из-за фобии после Чернобыльской аварии на реакторах для медицинских клиник был поставлен крест. Все взоры устремились к ускорителям заряженных частиц, на которых также можно получать нейтроны, но которые не так опасны, как реакторы, и которые, конечно, можно ставить в клиники. Как раз 30 лет тому назад была сформулирована задача получить нейтроны высокой интенсивности в узком энергетическом диапазоне — не быстрые и не медленные, а промежуточные, так называемые эпитепловые, наиболее удобные для лечения методом БНЗТ.
Было предложено множество разнообразных проектов. Предлагалось использовать различные типы ускорителей для получения протонов или дейтронов и различные мишени, в основном бериллиевые и литиевые, которые при попадании пучка из ускорителя генерируют нейтроны. В любом случае энергия генерируемых нейтронов оказывается выше, чем нужно для терапии. При этом требуется их замедлить, несильно потеряв в интенсивности нейтронного потока и не сильно уширить диапазон, в котором лежат их энергии. Лучше всего для БНЗТ генерировать нейтроны с как можно меньшей энергией, тогда в основном это будут нейтроны нужной энергии, а быстрых или медленных будет приемлемо мало.
Эта задача оказалась настолько сложной, что огромное большинство проектов закончились безрезультатно. Лишь десять лет тому назад компании Sumitomo удалось запустить циклотрон с высокой энергией протонов, но низким током и на бериллиевой мишени получить требуемый пучок нейтронов. Это было самое плохое решение с точки зрения качества пучка нейтронов — использовать ускоритель на высокую энергию, но зато реализуемое — величина тока ускоренных протонов была не заоблачная. За прошедшее десятилетие на этом ускорительном источнике нейтронов в Куматори (Япония) проведены необходимые исследования для получения лицензии, и новый источник, пригодный для клиники, сделан недавно для клиники Южный Тохоку в японской префектуре Фукусима — в этом или в следующем году на нем начнут лечить пациентов.
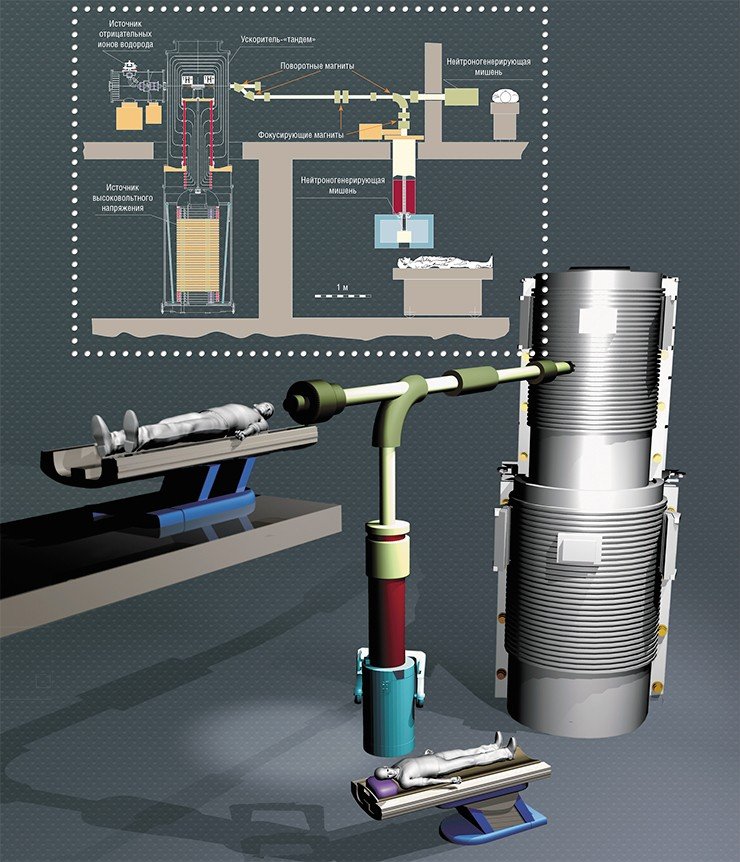
Для получения сильноточного пучка протонов низкой энергии был предложен новый тип ускорителя заряженных частиц, который стал называться ускоритель-тандем с вакуумной изоляцией (VITA). Идеи, заложенные в основу конструкции ускорителя, оправдались, хотя и не сразу. Так, после того как 12 лет тому назад ускоритель был сделан, в нем был получен пучок с током, в 100 раз меньшим ожидаемого. В этом нет ничего удивительного, особенно для нового типа ускорителя. Удивительно другое, что после тщательного изучения процессов, происходящих в нем, и проведенной модернизации удалось увеличить ток протонов в эти самые 100 раз и первыми в мире сгенерировать пучок нейтронов, идеальный по качеству и достаточный по интенсивности.
Следует отметить, что все эти исследования проводились в инициативном порядке за счет средств более 20 грантов. Жаль, что, когда нам первыми удалось наконец решить эту сложную задачу, никто в России не рискнул вложить средства и построить клинику БНЗТ. Прорыв случился три года назад, когда с нашей разработкой познакомились в американской частной компании в солнечной Калифорнии и предложили совместно сделать установку для БНЗТ. И вот сейчас в бункере, соседнем с экспериментальной установкой, сотрудники института и американской компании собирают источник нейтронов, который после проверки уедет в Китай в одну из первых в мире клиник БНЗТ. Две клиники БНЗТ, в Хельсинки и в Токио, оснащаются источниками нейтронов с такими же параметрами, как наш, и также с литиевой мишенью, но с использованием других типов ускорителей, сделанных двумя другими командами исследователей, одной из США, другой из Японии. Так что нас ждет светлое будущее: в следующем году должны заработать все эти первые пять клиник БНЗТ.
Весной этого года Российский научный фонд поддержал заявку на модернизацию существующей экспериментальной установки, чтобы приспособить ее для проведения терапии к 2022 году. Целью не является сделать из экспериментальной установки в физическом институте Академии наук место для лечения больных — больных должны лечить в клинике, для которой институт может сделать такой источник, фактически прибор — сложный, уникальный, но прибор. Экспериментальная установка в институте должна остаться экспериментальной, чтобы на ней можно было проводить исследования для улучшения источника нейтронов, для тестирования новых препаратов адресной доставки бора, для отработки методики БНЗТ и для разработки средств дозиметрии. Помимо БНЗТ установка используется и будет использоваться для проведения исследований в других областях физики и техники. Так, она была уже использована для тестирования под потоком нейтронов специальной керамики, сделанной для международного термоядерного реактора ИТЭР в Кадараше (Франция). В следующем году, предполагается, на ней будут тестироваться оптические кабели для модернизации Большого адронного коллайдера в ЦЕРНе (Швейцария).
Работы по БНЗТ в России не ограничиваются только исследованиями ИЯФ СО РАН, а потому в конце октября в Новосибирске состоятся 1-я Всероссийская конференция и Школа молодых ученых по БНЗТ, на которой согласились прочитать лекции десяток ученых с мировыми именами. Важное событие произошло в конце июля — Международное сообщество нейтрон-захватной терапии приняло решение провести 11-ю Международную школу молодых исследователей в области БНЗТ в 2021 году в Новосибирске. Это решение, конечно, факт признания заслуг ИЯФ, и будем надеяться на то, что оно ускорит появление в России клиник для БНЗТ, необходимых для лечения больных самой современной, высокотехнологичной методикой.
Заместитель директора по научной работе ИЯФ СО РАН Александр Иванов, научный сотрудник ИЯФ СО РАН Сергей Таскаев
В ответ на пост [как же так?] ("https://pikabu.ru/story/kak_zhe_tak_5704480") я посчитал необходимым рассказать о том, что же такое это БНЗТ, поскольку, как я понял из комментариев, мало кто вообще отличает БНЗТ от нейтронной терапии, а некоторые и вовсе предлагают заниматься сыроедением и прочей уринотерапией.
Итак, в 1936 году, спустя 4 года после открытия Чадвиком нейтрона, господин Лочер сформулировал идею использования большого сечения взаимодействия нейтрона с бором для терапии рака. Идея заключается в селективном накоплении нерадиоактивных ядер бор-10 в клетках опухоли и последующем облучении пациента нейтронами. Поглощение нейтрона ядром бора приводит к ядерной реакции, в результате которой рождается ядро лития-7, альфа-частица и гамма-квант. Продукты этой реакции характеризуются высоким темпом торможения и малым пробегом этих частиц в тканях организма - менее 10 микрометров, следовательно, выделение основной части энергии ядерной реакции ограничивается размером одной клетки. Таким образом, селективное накопление бора-10 внутри клеток опухоли и последующее облучение нейтронами должны приводить к разрушению клеток опухоли с относительно малыми повреждениями окружающих здоровых клеток.
Первые клинические испытания этой методики проводились в США с 1951 по 1961 гг. В качестве источника нейтронов использовались ядерные реакторы. Эти испытания не продемонстрировали терапевтическую эффективность метода. Причина заключалась в слабой селективности и низкой концентрации бора, из-за чего "фоновое" облучение протонами отдачи и гамма-квантами было достаточно велико.
С 1968 по конец 80-х годов в Японии доктор Хатанака проводил терапию с применением внутриартериальной инжекции синтезированного боркаптата натрия, используя открытое облучение опухоли после хирургии и добился впечатляющих результатов - 5-летняя выживаемость составила 58% для группы пациентов со злокачественными глиомами 3 и 4 градаций.
Эти результаты дали толчок третьему периоду развития нейтронозахватной терапии – клиническим испытаниям глубинных внутримозговых опухолей с применением пучков эпитепловых нейтронов от ядерных реакторов. Терапия пациентов была проведена в США, в Голландии, Финляндии, Швеции, Чехии, Японии, Аргентине и Тайване. БНЗТ была распространена и на другие заболевания, такие как опухоль шеи, менингиома, мезотелиома плевры и гепатоцеллюлярная карцинома. Несмотря на положительные результаты клинических исследований проведение терапии было прекращено на всех установках, за исключением реактора Института реакторных исследований Университета Киото Япония. Вероятнее всего, основная причина закрытия ядерных реакторов была связана с фобией после аварий на Чернобыльской атомной электростанции и на атомной электростанции Фукусима, а также как результат проведенных в ряде стран референдумов за отказ от атомной энергетики. Возможно, дополнительными факторами закрытия ядерных реакторов для БНЗТ послужили два обстоятельства: 1) с применением ускорителей заряженных частиц можно сформировать пучок эпитепловых нейтронов лучше удовлетворяющий требованиям БНЗТ, чем тот, что можно получить на ядерных реакторах, 2) ускорительный источник нейтронов можно поставить в клинику, а реактор нет.
В настоящее время исследования по БНЗТ переходят в следующий период, связанный с использованием ускорителей заряженных частиц для получения пучков эпитепловых нейтронов. На сегодняшний день 6 проектов, 4 в Японии, один Европейского Союза и один в России, выглядят успешными, пригодными для начала проведения клинических испытаний БНЗТ. Эти проекты следующие:
1. C-BENS. Это проект компании Сумитомо (Sumitomo Heavy Industries, Ltd., Япония), изготавливающий циклотрон HM-30 для получения 30 МэВ протонного пучка с током 1 мА и бериллиевую мишень. C-BENS – это сокращение от “Cyclotron Based Epithermal Neutron Source”, что означает “источник эпитепловых нейтронов на основе циклотрона”. Первый такой источник нейтронов был установлен и запущен в Институте реакторных исследований Университета Киото. На ускорителе получен протонный пучок с током 1,1 мА, превышающий проектный на 10 %, осуществлена генерация нейтронов на бериллиевой мишени, специальной системой формирования пучка подготовлен терапевтический пучок нейтронов и с 2012 года проведена терапия нескольким пациентам, возможно 9-ти. Детали этих клинических испытаний не разглашаются, что, возможно, связано с желанием компании Сумитомо получить лицензию на терапию и осуществлять БНЗТ в клинике Южного Тохоку в городе Кориями префектуры Фукусима. В этой клинике за счет средств фонда восстановления территории восточной Японии, разрушенной Великим землетрясением 2011 г., создан Центр БНЗТ, оснащенный циклотроном компании Сумитомо и двумя облучательными комнатами.
2. iBNCT. Это проект Университета Цукубы (Япония), реализуемый при поддержке Организации по изучению высокоэнергетичных ускорителей, известной как KEK, Японского научно-исследовательского института по атомной энергии JAERI, расположенного в городе Токай, и компании Мицубиси (Mitsubishi Heavy Industry Co.). В названии проекта буква “i” соответствует первой букве в слове Ibaraki – префектуры, в которой расположены города Цукуба и Токай; последующие буквы “BNCT” являются сокращением от “Boron Neutron Capture Therapy”, что означает “бор-нейтронозахватная терапия”. Создаваемый радиочастотный ускоритель линак, сочетающий в себе RFQ и дрейфовую трубку DTL, предназначен для получения протонного пучка с энергией 8 МэВ и средним током 5 мА.
После запуска ускорителя в конце 2015 г. на нем был получен протонный пучок с током 1 мА. В сентябре 2017 г. достигнуто значение тока протонов в 1 мА, что со слов участников проекта достаточно для начала проведения клинических испытаний методики БНЗТ с применением бериллиевой мишени.
3. NUANS. NUANS означает ускорительный источник нейтронов Университета Нагоя (Nagoya University Accelerator-driven-Neutron Source). В Университет Нагоя (Япония) бельгийская компания Ion Beam Apllication (IBA), известный производитель циклотронов для протонной терапии и наработки короткоживущих изотопов для позитронно-эмиссионной томографии, поставила в 2015 г. электростатический ускоритель прямого действия Динамитрон, специально разрабатываемый ими с 2005 г. для получения 2,8 МэВ 15 мА протонного пучка. Сообщалось, что при сдаче ускорителя в январе 2016 г. был получен 2,8 МэВ 11 мА протонный пучок. Однако в рабочем режиме работы установки ток протонного пучка был значительно ниже и только в августе 2017 г. достиг значения 2 мА. Для генерации нейтронов предполагается использовать литиевую мишень, но пока командой исследователей еще не получено разрешение на генерацию нейтронов.
4. nuBeam. Это проект Европейского Союза, предусматривающий изготовление для клиники Университета Хельсинки (Финляндия) высоковольтного электростатического ускорителя прямого действия с энергией 2,6 МэВ и током протонов 30 мА. Изготовить ускоритель, называемый HyperionTM, взялась компания Neutron Therapeutics (США), основанная в ноябре 2015 г. Во вновь созданной компании предполагается использовать технологии, отработанные ранее в обанкротившихся компаниях GT Advanced Technology и Twin Creeks Technologies.
5. NCC-CICS. Это проект компании CICS (Cancer Intelligence Care Systems) для Национального онкологического центра (National Cancer Center). В самом центре Токио на территории онкологического центра было разрушено здание и на его месте возведено новое, в котором предполагается проведение БНЗТ. Радиочастотный ускоритель линак на энергии 2,5 МэВ и ток 20 мА изготовила и установила компания AccSys Technology, Inc. (Калифорния, США), дочернее предприятие компании Hitachi, В конце 2016 г. ускоритель был запущен и на нем получен пучок протонов с током 12 мА. В течение 2017 г. смонтировали систему формирования пучка нейтронов и проводили испытания нейтроногенерирующей литиевой мишени. Несмотря на то, что ток протонов не удалось довести до проектного и то, что время эксплуатации литиевой мишени оказалось меньше проектного, коллектив исследователей и врачей намерен приступить к лечению больных в 2018 г., устанавливая для каждого больного новую мишень.
6. i-BNCT. Это проект Института ядерной физики СО РАН. В проекте, предложенном в 1998 г., были предложены решения, которые позволят получить терапевтический пучок нейтронов, в наибольшей степени удовлетворяющий требованиям БНЗТ. Для получения протонного пучка был предложен новый тип ускорителя заряженных частиц – ускоритель-тандем с вакуумной изоляцией, для генерации нейтронов было предложено применить литиевую мишень, создание которой в то время казалось проблематичным. За 20 лет реализации проекта в институте было проведено множество научных исследований, осуществлена модернизация ускорителя и мишени. На ускорителе получен протонный пучок с энергией 2 МэВ и током более 6 мА, что достаточно для проведения терапии.
Маловероятно, что кто-то дочитает это до конца, но все равно спасибо за внимание.
Читайте также:

