Мукоэпидермоидный рак легкого лечение
Мукоэпидермоидный рак бронха — редкая опухоль, подобная аналогу сиалоцитарного происхождения и характеризующаяся наличием клеток, вырабатывающих слизь и кератин, а также клеток промежуточного типа. Нередко встречается у лиц моложе 30 лет. Клинические признаки включают в себя симптомы раздражения или обструкции дыхательных путей (кашель, кровохарканье, лихорадка), а также пневмонии или ателектаза. Примерно 1/4 пациентов не имеют симптоматики. Макроскопически мукоэпилермоидный рак бронха представляет собой полиповидный сероватый, желтоватый или розовый узелок диаметром 0,3—6 см, растущий в просвет главного, долевого, реже сегментарного бронха, крайне редко на периферии легких. Опухоль имеет блестящую слизистую поверхность разреза, на которой иногда определяются кисты. У небольшого количества больных мукоэпилермоидный рак способен к метастазированию, что ухудшает прогноз.
До 80 % случаев наблюдений представлены низкодифференцированной формой мукоэпидермоидного рака, при которой описанные выше признаки двухфазной специализации опухолевой паренхимы сглажены. Кроме того, у такой формы клеточный полиморфизм и митотическая активность опухолевой паренхимы выражены сильнее. Примерно у половины больных определяются признаки инвазии в легочную паренхиму.
Дифференциальный диагноз должен проводиться в отношении слизистой аденомы бронхиальных желез и других опухолей сиалоцитарного типа.
Аденоид-кистозный рак легкого
Аденоид-кистозный рак (син.: цилиндрома, аденокистозная карцинома) — редкая инвазивная злокачественная опухоль, подобная аналогу сиалоцитарного происхождения с характерными криброзными или солидно-железистыми структурами. Поражаются обычно нижняя часть трахеи, а также главные или долевые бронхи. Вовлечение в процесс периферических или сегментарных бронхов отмечается у 10 % больных. В симптоматике преобладают явления хронической обструкции и раздражения бронхов. Макроскопически аденоид-кистозный рак имеет центральную локализацию, выступает в просвет бронха и представляет собой полиповидный или циркулярно растущий узел диаметром 0,9—4 см серовато-белого или желтоватого цвета, мягкой консистенции. Эта опухоль склонна к обширной инвазии. В некоторых случаях аденоид-кистозный рак прорастает плевру и распространяется в средостение. Он способен к рецидивам и нередко метастазирует в регионарные лимфатические узлы. Отдаленные метастазы менее характерны, но иногда они обнаруживаются в печени, селезенке, почках, костях и надпочечниках.
Под микроскопом опухоль напоминает свой аналог в слюнных железах. Бронхиальный эпителий, лежащий над опухолью, обычно не поврежден, но может иметь признаки изъязвления или плоскоклеточной метаплазии. В опухолевой паренхиме небольшие и темные, цитокератин- и виментин-позитивные эпителиоциты окружают цилиндрические и/или криброзные отверстия, реже формируют трабекулярные или солидные структуры. Встречаются кисты, которые могут содержать слизистый или гиалиноподобный материал, хорошо воспринимающий альциановый синий. Наиболее типичен цилиндроматозный вариант опухоли. Указанные отверстия выстланы одним слоем эпителиоцитов протокового типа и одним или несколькими слоями миоэпителиальных клеток. Солидные и трабекулярные структуры могут быть сформированы из вытянутых и овальных веретеновидных клеток, напоминающих миоэпителиальные элементы. При аденоид-кистозном раке часто выявляется перине врал ьная инвазия. Опухоль обычно прорастает окружающую ткань легких и может поражать регионарные лимфатические узлы. Внелегочные метастазы распознаются по сходству с первичной опухолью и, особенно, по криброзным структурам.
Дифференциальный диагноз, как правило, затруднений не вызывает.
Мукоэпидермоидные опухоли составляют около 2% злокачественных опухолей нижних дыхательных путей и 6% (3–9%) опухолей трахеобронхиальных желез.
Патология встречается у лиц от девяти до 78 лет. Средний возраст больных – 34,8 года. Однако около 50% пациентов моложе 30 лет. Соотношение заболевших мужчин и женщин оценивается как 9:1.
К 1980 г. описано более 80 случаев мукоэпидермоидного рака дыхательных путей (пять на 1000 случаев бронхогенного рака), 51 из них у детей [3].
Мукоэпидермоидный рак трахеи впервые был описан P.E. Larson и соавт. (1965), затем G.P. Trentini и соавт. (1970) и H. Said и соавт. (1988). Анализируя собственные наблюдения, исследователи отметили, что в трахее элементы данной опухоли чаще встречаются в сочетании с другими гистологическими структурами. Мукоэпидермоидный рак трахеи в чистом виде описали N.K. Leonardi и соавт. (1978).
В настоящее время известны 12 задокументированных случаев мукоэпидермоидного рака трахеи, в том числе три случая у детей [9]. Среди отечественных исследователей впервые об этой локализации опухоли упомянул К.Ф. Юдаев [4].
Мукоэпидермоидная опухоль имеет вид эндофитного или экзофитного образования диаметром от 0,8 до 6,0 см. Располагается, как правило, на задней/боковой стенке бронха или на границе с главным бронхом и покрыта слизистой оболочкой [5]. Микроскопически паренхима опухоли с высокой степенью дифференцировки состоит из железистых структур, трубочек, кист и солидных комплексов. Железистый компонент доминирует более чем в половине случаев. Призматические муцинозные элементы, бокаловидные клетки или светлые кубические онкоцитарные клетки выстилают железы или кисты. Кисты могут разрываться, в результате слизь попадает в окружающую строму и создаются условия для гранулематозного процесса. Кроме того, выявляются базальные и промежуточные (транзиторные) клетки, реже – кератиноциты, формирующие солидные очаги, гнезда и тяжи. Полигональные клетки промежуточного типа имеют центрально расположенные ядра и амфофильную или слабоэозинофильную цитоплазму. Ороговевающие клетки с эозинофильной или прозрачной цитоплазмой обладают межклеточными мостиками, однако роговых жемчужин не формируют. Строма обычно гиалинизирована и может напоминать амилоид. В ней отмечаются очаги обызвествления или окостенения.
До 80% случаев наблюдений представлены низкодифференцированной формой мукоэпидермоидного рака, при которой описанные выше признаки двухфазной специализации опухолевой паренхимы сглажены. Кроме того, при данной форме рака клеточный полиморфизм и митотическая активность опухолевой паренхимы выражены сильнее. Примерно у половины больных отмечаются признаки инвазии в легочной паренхиме [5–7].
По цитологической картине отличить мукоэпидермоидный рак от умеренно дифференцированной аденокарциномы практически невозможно. Опухоль можно распознать при исследовании отпечатков с биоптата. В данном случае цитологическая картина будет иметь следующие особенности: элементы базального, реже – шиповатого слоя эпидермиса образуют массивные скопления, присутствуют секретирующие слизь опухолевые клетки, встречаются также элементы с железистой дифференцировкой в виде отдельных клеток, клеточных групп и железистоподобных структур. Размеры и форма железистых клеток варьируются в зависимости от количества слизи в цитоплазме. В мазках иногда обнаруживаются группы опухолевых клеток с вакуолизированной или пенистой цитоплазмой. Их наличие особенно характерно для мукоэпидермоидного рака.
К клиническим признакам относятся раздражение или обструкции дыхательных путей (кашель, кровохарканье, лихорадка), а также пневмония или ателектаз. Примерно у четверти пациентов клиническая симптоматика отсутствует [7–9].
Клинический случай
Из анамнеза известно, что в течение месяца пациент жаловался на сухой кашель, усиливающийся в положении лежа на спине и на правом боку, повышение температуры тела – максимально до 38,5 ºС в вечернее время.
При поступлении выполнена компьютерная томография органов грудной клетки и головного мозга: двусторонний гидроторакс, справа осумкованный, в перикарде выпот, объемные образования головного мозга и отек головного мозга в стадии компенсации. Осложнение основного заболевания – угроза тампонады сердца.
В тот же день проведены пункция плевральной полости слева, перикарда и дренирование перикарда. Из плевральной полости эвакуировано около 800 мл экссудата, из перикарда – 300 мл.
При цитологическом исследовании осадка выпотной жидкости обнаружены элементы злокачественной опухоли, имеющие сходство с аденокарциномой. Поэтому были взяты мокрота, мазки-отпечатки и браш-биопсия правого легкого (бронх первого порядка, нижний и средний долевой бронх). В материалах выявлены злокачественные клетки с центрально расположенными ядрами и эозинофильной цитоплазмой, некоторые с признаками секреции (рис. 1–4).
Гистогенез опухоли был неясен, поэтому было проведено иммуноцитохимическое (ИЦХ) исследование с использованием панели антител: TTF-1, СК7, СК5/6, р63, р53, MUC-1. В клетках опухоли не наблюдалось экспрессии TTF-1, однако окраска на CK5/6, p63, р53, MUC-1 дала резко положительный результат, в 40% клеток опухоли положительная реакция на СК7 (рис. 5–8).
Исходя из клинических проявлений заболевания и результатов цитологического и ИЦХ-исследований, сделано заключение: иммунофенотип опухоли соответствует мукоэпидермоидному раку легкого.
Результаты гистологического исследования материала биопсии: в стенке бронха множественные очаги опухолевого роста, состоящие из гнезд и тяжей атипичных крупных клеток с полиморфными гиперхромными ядрами, множественными патологическими митозами.
Результаты иммуногистохимического исследования: СК7, p63, Ki67 – экспрессия положительная, TTF-1, CD56, CgA – реакция отрицательная. Иммунофенотип опухоли соответствует плоскоклеточному раку. Индекс пролиферации 50%.
Заключение: низкодифференцированный плоскоклеточный рак (G3).
В описанном клиническом случае имела место сложная в диагностическом плане морфологическая картина. В экссудате, полученном из полости перикарда, обнаружены клетки злокачественной опухоли эпителиальной природы. Морфологический диагноз цитопатологом установлен с помощью дополнительного метода исследования – иммунофенотипирования опухоли. На основании результатов ИЦХ-исследования предоперационно установлен диагноз – мукоэпидермоидный рак, метастатическое поражение перикардиальной и плевральной полостей.
При наличии железистого и плоскоклеточного компонентов в традиционных цитологических препаратах, приготовленных из биологического материала, необходимо проводить комплексное морфологическое исследование с использованием жидкостной цитологии, клеточных блоков и иммунофенотипирование. Определение гистогенеза опухоли и ее органной принадлежности позволяет значительно повысить точность цитологической диагностики.

Рис. 7.20. Низкодифференцированная мукоэпидермоидная карцинома: а — плотная, несмещаемая опухоль в околоушно-жевательной области; б — опухоль, локализованная в позадичелюстной области
Различная степень выраженности опухоли определялась размерами инфильтрата, степенью вовлечения окружающих тканей, локализацией в околоушной слюнной железы (СЖ) длительностью существования. В 90,3% случаев опухоль исходила из задненижнего края околоушной СЖ, в 7,3% — локализовалась впереди ушной раковины и в 2,4% случаев исходила из добавочной доли околоушной слюнной железы и локализовалась в толще щеки (рис. 7.21).

Рис. 7.21. Мукоэпидермоидная карцинома добавочной доли правой околоушной слюнной железы
Опухоль, исходящая из задненижнего отдела железы, имела вид плотного инфильтрата без четких границ, уходящего вглубь позадичелюстной ямки, прорастающего жевательные мышцы, ткани в области сосцевидного отростка у 65,8% пациентов. Опухолевый инфильтрат поверхностной части околоушной СЖ у 9,7% пациентов прорастал подкожную жировую клетчатку, слуховой проход, височно-нижнечелюстной сустав.
Опухолевый инфильтрат из добавочной доли околоушной СЖ локализовался в толще щеки, распространялся под скуловую кость и на передний край околоушной слюнной железы. Многоузловая опухоль с бугристой поверхностью была у 12,2% пациентов (рис. 7.22). Деструктивные процессы в опухоли приводили к некрозу и образованию глубоких язв. Опухоль в виде изъязвившегося инфильтрата позадичелюстной области отмечена в клинической картине у 2,6% пациентов.

Рис. 7.22. Многоузловая форма мукоэпидермоидного рака у девочки 16 лет
Еще один характер роста опухоли в виде инфильтрата с выраженным экзофитным компонентом мы наблюдали у 9,7% пациентов. Экзофитная часть опухоли была изъязвлена, с распадом в центре и кровоточащей поверхностью. В ряде случаев вокруг экзофитной части опухоли определялись мелкие, плотные внутрикожные узлы размером от 0,3 до 0,8 см.
Боль в опухоли имела место у 31,7% пациентов. Возникновение болезненных ощущений в опухоли не зависело от локализации ее в железе. Размеры опухоли также не отражались на частоте и интенсивности болезненных проявлений. Следует отметить, что болевые ощущения в опухоли имели место во всех случаях изъязвлений, как инфильтрата, так и экзофитного компонента опухоли, и увеличивались в случае распада и усиления воспалительных проявлений в тканях.
При просьбе же сдвинуть брови, зажмурить глаза, улыбнуться эта симметрия нарушалось незначительно. У 14,3% пациентов имел место паралич только мышцы, поднимающей угол рта, у 7% — была нарушена функция глазничной ветви лицевого нерва. Полный паралич мышц соответствующей половины лица был у 78,7% пациентов с этим симптомом. Это происходило в случае прорастания ствола лицевого нерва или всех его ветвей.
У пациентки 46 лет клиническая картина характеризовалась нарастающими в течение 3 лет парестезиями в левой половине лица. По поводу неврита лицевого нерва проводилось лечение с использованием физиотерапии без эффекта, пока в левой позадичелюстной области не появился плотный опухолевый инфильтрат, сопровождаемый болями и полным параличом мимических мышц слева. Опухоль исходила из глоточного отростка, инфильтрировала основной ствол лицевого нерва, проникая в костный канал, инфильтрировала жевательные мышцы, мягкие ткани в области сосцевидного отростка.
Через 9 мес. констатирован летальный исход от продолженного роста опухоли. Так, длительность клинического периода от момента появления первых симптомов до летального исхода составила 3,9 года. В этом случае клиническому проявлению опухоли предшествовали признаки нарушения функции лицевого нерва, что объясняется локализацией опухоли под стволом лицевого нерва, который первым подвергся повреждающему действию опухоли.
Болезненный опухолевый инфильтрат занимает околоушную слюнную железу, позадичелюстную область, прорастает верхнюю треть грудино-ключично-сосцевидной мышцы, заднее брюшко двубрюшной мышцы. Кожа над инфильтратом гиперемирована, имеется выраженный паралич мимических мышц на соответствующей поражению половине лица. Клинические симптомы, такие как опухоль, боль, нарастающий паралич мимических мышц, появляются одновременно.
Характерным симптомом в клиническом течении является наличие метастатических узлов. Метастазы в лимфатических узлах шеи выявлены у 22% пациентов, причем у 22,2% из них метастатические узлы клинически не определялись, а были обнаружены при морфологическом исследовании операционного материала. Анализ сведений о пациентах с метастазами в лимфатических узлах шеи показал, что длительность анамнеза у них до момента обращения к врачу составляла от 1 мес. до 3 лет, в среднем — 1,2 года.
Наружные размеры опухоли были от 4 до 11 см в наибольшем измерении. Инфильтративный характер опухоли не позволял точно оценить размеры опухолевого поражения. Сравнивая размеры опухоли у больных с метастазами и без таковых, мы не нашли зависимости метастазирования ни от длительности предшествующего анамнеза, ни от размеров первичной опухоли.
Метастазы редко наблюдались в глубоких лимфатических узлах самой околоушной СЖ (11 %). Обычно метастазами поражались лимфатические узлы у нижнего полюса околоушной СЖ верхней, средней и нижней яремных групп, лимфатические узлы по ходу наружной яремной вены, поднижнечелюстные. Сроки от момента обнаружения первичной опухоли до появления метастатических узлов и их клинические проявления оказались различными.
Иногда клинические проявления опухоли имитируют острый паротит, в связи с чем проводится неадекватное лечение. Процесс быстро прогрессирует в виде появления большого числа метастазов на шее от угла нижней челюсти до ключицы. В среднем через 1,3 мес. после обнаружения безболезненного уплотнения в околоушной слюнной железе опухоль имеет вид плотного, бугристого, неподвижного инфильтрата размерами 11 х 8 х 6 см в околоушно-жевательной области, без нарушения функции лицевого нерва. На шее вдоль сосудисто-нервного пучка, во всех трех группах глубокой яремной цепи обнаруживаются метастатические узлы, круглые, плотные, безболезненные, смещаемые, размерами 3x4 см.
Биопсия узла и первичной опухоли показывает идентичные морфологические структуры низкодифференцированного типа мукоэпидермоидной карциномы; солидные структуры из крупных светлых клеток с пузырьковидным ядром и четкими ядрышками, отдельные поля резко полиморфных, анаплазированных клеток с крупными множественными нуклеолами. Через 3 года от первого клинического проявления опухоли наступает летальный исход.
В ряде наблюдений длительность существования плотной, безболезненной опухоли в позади челюстной области не превышает одного года, а опухолевый инфильтрат имеет большие размеры (8 х 7,5 х 6,5 см), спаян с наружным слуховым проходом. Клинически метастазы рака не определяются, однако во время операции в клетчатке верхней трети шеи, в области впадения лицевой вены во внутреннюю яремную вену выявляются лимфатические узлы размерами 1,5 х 1 см, серого цвета, метастатического характера. Процесс метастазирования одновременно с появлением рецидива продолжается в течение 3 лет.
Метастатические узлы обнаруживают в зоне добавочного нерва, в области развилки общей сонной артерии, в надключичной зоне. Метастатические узлы в капсуле, имеют тесную связь с сосудами и нервом, но не прорастают их. Операция Крайла и иссечение рецидива рака не останавливают прогрессирование. Примерно через 1,8 года после последней операции регистрируется летальный исход. Весь период болезни составляет 6 лет. Метастазирование идет по яремной лимфатической цепочке.
Метастазы, выявленные во время операции, были у 40% пациентов. Реже других поражались лимфатические узлы поднижнечелюстной области (20%). Среди первичных пациентов с метастазами рака в регионарных лимфатических узлах, отдаленные метастазы выявлены у 20%. В качестве примера клинического проявления отдаленного метастазирования приводим следующее наблюдение.
По поводу МК низкодифференцированного типа 75-летнему пациенту провели комбинированное лечение: дистанционную гамма-терапию в СОД 40 Гр и операцию в объеме паротидэктомии и фасциальнофутлярного иссечения клетчатки шеи. Метастатические узлы локализовались в акцессорной зоне (зоне добавочного нерва) и лимфатических узлах яремной цепи. Через 1,7 года в левой подмышечной впадине появился метастатический узел, который в течение месяца превратился в плотный, безболезненный, смещаемый конгломерат узлов размерами 7x5 см. Рецидива первичной опухоли и метастазов на шее не обнаружено. Через 4 мес. констатирован летальный исход.
22% пациентов обратились в клинику с рецидивами низкодифференцированного рака околоушных СЖ. Все пациенты были в возрасте от 32 до 55 лет, женщин было в 2 раза больше, чем мужчин.
Клиническая симптоматика и течение рецидивного низкодифференцированного типа МК в определенной степени зависят от предшествующего лечения, особенно если оно не было адекватным. Опухолевый инфильтрат обычно появляется под рубцом, прорастает кожу и выступает над ее поверхностью в виде экзофитного новообразования различных размеров (рис. 7.23).

Рис. 7.23. Рецидив низкодифференцированного мукоэпидермоидного рака. Экзофитные разрастания опухоли выступают из области изъязвления кожи
Поверхность экзофитных узлов изъязвляется, ослизняется, легко травмируется и кровоточит. Вокруг основного узла опухоли могут быть опухолевые диссеминаты в виде внутрикожных узелков.
Продолженный рост низкодифференцированной мукоэпидермоидной карциномы в одних случаях выявляется сразу после нерадикальной операции, в других — через несколько месяцев после повторного удаления опухоли. В наших наблюдениях после нерадикальной операции, которую можно охарактеризовать как биопсию, опухоль под рубцом определялась сразу после операции. Попытка применения лучевой терапии после нерадикальной операции заканчивалась неудачей: через 2 мес. опухоль начинала активно расти. После повторного удаления в ряде случаев опухоль выявлялась через 5 мес.
Рецидивирующее течение низкодифференцированной МК, выявленное у 22% пациентов с опухолью этого типа, характеризовалось неоднократным появлением опухолевых узлов через различные промежутки времени в зоне предыдущей операции.
Сроки развития рецидива рака колеблются от 4 мес. до 1,5-2 лет. За время дальнейшего наблюдения число рецидивов доходит до 3-4, с каждым новым ростом опухоли временной промежуток между рецидивами сокращается. Например, первый рецидив — через 10 мес. после хирургического или комбинированного лечения, затем — через 6 мес., следующий — через 4 мес.
Рецидивная опухоль представляет собой инфильтрат без границ, спаянный с операционным рубцом (рис. 7.24).

Рис. 7.24. Рецидив мукоэпидермоидной карциномы левой околоушной слюнной железы, возникший через 2 года после комбинированного лечения. Опухолевый инфильтрат без границ, спаян с рубцом, занимает околоушно-жевательную, позадичелюстную, сосцевидную области, распространяется под основание черепа. В рубце имеется свищевой ход: а — вид анфас; б — вид в профиль
Опухолевая инфильтрация распространяется на ткани в области сосцевидного отростка, верхней трети шеи, ушной раковины, прорастая в наружный слуховой проход, уходя под основание черепа. Внутренняя яремная вена, наружная и внутренняя сонные артерии вовлекаются в опухолевый конгломерат. Иногда в рубцах имеются свищевые ходы с выделениями из них слизистого характера, впоследствии появляются быстро растущие экзофитные компоненты опухоли с изъязвленной и кровоточащей поверхностью.
У 44% пациентов диагностированы метастазы в регионарных лимфатических узлах яремной группы, акцессорной зоны, бокового треугольника шеи. Размеры метастатических узлов колеблются от 1,5-2 см до конгломератов 4 х 6 см (рис. 7.25). Однако клинически увеличенные лимфатические узлы, выявляемые во время операции, не всегда являлись метастатическими. Отдаленные метастазы (в периферические лимфатические узлы, легкие, молочные железы, кожу передней брюшной стенки) обнаружены у 11 % пациентов.

Рис. 7.25. Рецидив низкодифференцированной мукоэпидермоидной карциномы после комбинированного лечения. Рецидивная опухоль локализуется в позадичелюстной ямке. Конгломерат метастатических узлов прорастает мышцы и сосуды шеи
Метастазирование носит характер обширной диссеминации в виде множественных внутрикожных опухолевых узлов в области лица, затылка, молочных желез, передней брюшной стенки и метастазов в периферических лимфатических узлах. Морфологическая картина представляет собой солидные комплексы мелких округлых клеток, среди которых встречаются группы более крупных клеток со светлой цитоплазмой.
Прогрессирование опухолевого процесса протекает в форме обширного рецидивирования и метастазирования в зональные и отдаленные лимфатические узлы и ткани.
Мукоэпидермоидную опухоль с двойным метапластическим потенциалом P.Masson и L.Berger (1924) первоначально обнаpужили в слюнной железе. Сразу было отмечено, что наряду с доброкачественным вариантом опухоли, существуют формы, склонные к рецидивированию и метастазированию. H. Smetana и соавт.(1952) описали такие же опухоли, исходящие из клеточных элементов бронхиальных желез. Эти образования длительный период относили к “аденомам” бронхов. Однако, довольно скоро стало ясно, что эти опухоли ведут себя как злокачественные новообразования (A.Turnbull и соавт., 1979; S.
Опухоль составляет около 2% онкологических поражений нижних дыхательных путей и 6% (3-9%) случаев опухолей трахео-бронхиальных желез. Встречается в возрасте 9 - 78 лет (в среднем 34,8 года). Около 50% больных - моложе 30 лет. Преобладают мужчины (9:1). Связи опухоли с табакокурением не отмечено.
К 1980 г. описаны более 80 наблюдений мукоэпидермоидного рака дыхательных путей (5 на 1000 случаев бронхогенного рака), в том числе 51 у детей (Granata C., Battisini E., Toma P. et al.,1997).
В 1963 г. G.Arccidiacono, G. Lomeo описали первый случай мукоэпидермоидного рака гортани. С тех пор известно уже о 81 больном с этой патологией. Наибольшее число наблюдений представлили в 1981 г.A Ferlito и J.M.Domiani. Эта локализация составляет 1-6% случаев (в слюнной железе - 60%).
Мукоэпидермоидный рак трахеи впервые описали P.E.Larson et al. в 1965 г. G.P.Trentini et al.(1970) и H.Said et al.(1988), анализируя собственные наблюдения, подчеркивали, что элементы этой опухоли в трахее чаще всего встречаются в сочетании с другими гистологическими структурами. Кроме этих авторов, мукоэпидермоидный рак трахеи “в чистом виде” описали также Leonardi N.K. et al.(1978). Обычно опухоль располагается на задней или задне-боковой стенках шейного или надбифуркационного отделов трахеи. К настоящему времени известно о 12 документрованных наблюдениях мукоэпидермоидного рака трахеи, в том числе 3 у детей (Granata C., Battisini E., Toma P. et al.,1997). В России об этой локализации опухоли впервые упоминает К.Ф.Юдаев (..). Большинство больных оперированы.
Опухоль имеет вид эндофитного или экзофитного образования, размерами 0,8-6,0 см в диаметре. Опухоль располагается чаще на задней или боковой стенке или на границе с главным бронхом и покрыта гладкой слизистой оболочкой.
Цитологическая характеристика. Цитологически дифференцировать мукоэпидермоидный рак от умеренно дифференцированного бронхогенного рака практически невозможно.
При исследовании отпечатков с биоптата опухоль можно распознать, если цитологическая картина имеет следующие особенности: элементы базального и реже шиповатого слоя эпидермиса формируют довольно массивные скопления, присутствуют слизьсекретирующие опухолевые клетки типа цилиндрических, элементы с железистой дифференцировкой встречаются также в виде отдельных клеток, клеточных групп и железистоподобных структур. Размеры и форма железистых клеток существенно варьирует в зависимости от количества слизи в цитоплазме. В мазках иногда обнаруживаются группы своеобразных опухолевых клеток с вакуолизированной или пенистой цитоплазмой, наличие которых чрезвычайно характерно для мукоэпидермоидного рака (рис.34).
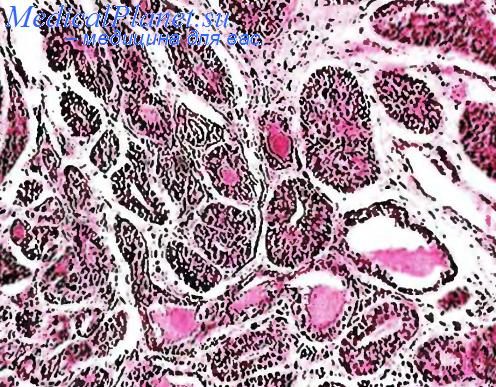
Гистологическая характеристика. Мукоэпидермоидный рак представлен тремя типами клеток: 1) эпидермоидные элементы (без ороговения и межклеточных мостиков) образуют солидные поля или выстилают кисты; 2) железистые элементы (иногда типа бокаловидных) могут выстилать кисты или образовывать папиллярные выросты (в просвете-слизистые массы); 3) промежуточные элементы типа базальных клеток с пустой светлой цитоплазмой (рис.35).
Опухоль характеризуется пестрым микроскопическим строением за счет сочетания двух эпителиальных компонентов, эпидермоидного и железистого, различной степени дифференцировки клеток в каждом из компонентов и разнообразия клеточных группировок и формируемых ими структур.
Железистый компонент представлен то однородным уплощенным эпителием ( без продукции слизи), то кубическим или цилиндрическим типа бокаловидных клеток со светлой слизесодержащей цитоплазмой. Эти клетки образуют железистоподобные структуры и кисты, выполненные слизью. Некоторые железы образованы мелкими со скудной цитоплазмой и гиперхромными ядрами клетками, в которых не выявляется продукция слизи. Эти клетки, возможно, являются менее дифференцированными элементами железистого компонента. Следует подчеркнуть, что в участках, где преобладает железистый компонент, всегда можно видеть скопления элементов плоского эпителия в виде гнезд, ячеек или окаймляющих мелкие кисточки.
Эпидермоидный компонент также разнообразен. Наиболее характерны в плане диагностики скопления крупных плоскоэпителиальных клеток с отчетливой цитоплазмой. Эти клетки образуют небольшие ячейки, располагающиеся в фиброзной строме, или выстилают кисты с наличием в них слизи. Обращают на себя внимание скопления среди плоского эпителия клеточных элементов, содержащих в цитоплазме слизь. В отдельных участках крупные мономорфные клетки плоского эпителия образуют солидные разрастания, однако ни в одной опухоли мы не обнаружили признаков ороговения. Вместе с тем, в опухоли можно встретить солидно-альвеолярные скопления из мелких эпителиальных клеток типа базалоидных. Клетки опухоли иногда располагаются по периферии солидных разрастаний из крупных плоскоэпителиальных клеток.
В пластах из эпидермоидных клеток также обнаруживается слизь. Нередко морфологи принимают опухоль за плеоморфную аденому. Следует учитывать, что в мукоэпидермоидных новообразованиях в строме отсутствуют миксоидные и хондроидные (остеоидные) изменения.
Много споров вызывает вопрос: является ли мукоэпидермоидная опухоль трахеи и бронхов доброкачественным или злокачественным новообразованием? Еще F.W.Stewart и F.W.Foot (1945) различали 3 степени гистологической злокачественности этой опухоли в зависимости от содержания железистого компонента и уровня дифференцировки клеток. Высокую злокачественность связывают с появлением солидных структур в виде гнезд промежуточных и плоскоэпителиальных клеток, выраженной атипией всех элементов, высоким митотическим индексом. В этом случае микрокисты встречаются относительно редко.
С другой стороны, важно помнить, что некоторые морфологи предпочитают относить подобные случаи к аденосквамозному раку. Прогностическое значение светлоклеточного компонента опухоли пока с определенностью не выяснено [Gerughty R.M.,1968; Seo S.Tomichi C.E.,1980; Damiani J.M.,1981; Ferlito A., 1981; Gomes V., Costarelli L.,1990].
Высокодифференцированная мукоэпидермоидная опухоль бронхов, по мнению И.Г.Ольховской (1982); J. Mullins и соавт.(1979); H. Wellons и соавт.(1976)-доброкачественное новообразование. Другие исследователи считают, что высокодифференцированная мукоэпидермоидная опухоль иногда может давать метастазы не только в региональные лимфатические узлы, но и в отдаленные органы, то есть является высокодифференцированным раком (И.В.Двораковская, 1979; H.Spencer, 1979).В последнее время мукоэпидермоидную опухоль большинство исследователей обозначают как мукоэпидермоидный рак, подразделяя его на две группы опухолей: с низкой и высокой степенью злокачественности (H.
Интерес представляет попытка некоторых исследователей (И.В. Двораковская, 1979; P.Klacsmann и соавт., 1979) выявить макро- и микроскопические различия между высоко- и низкодифференцированными вариантами этой опухоли. Высокодифференцированный мукоэпидермоидный рак обычно pастет в виде экзофита (в просвет трахеи) с выраженным слизеобразованием, с преобладанием железистых (бокаловидных) клеток. Низкодифференцированный вариант характеризуется чаще эндофитным ростом, отчетливым преобладанием эпидермоидного компонента за счет большого количества базалоидных клеток.
В метастазах выявляют и эпидермоидный, и железистый компоненты, однако некоторые исследователи отмечают, что метастазирует в основном плоскоклеточный компонент различной степени дифференцировки.
Ультраструктура. Первый тип клеток мукоэпидермоидной опухоли представлен группами слизеобразующих клеток, формирующих железистые щели, в просвет которых обращены микроворсинки. В цитоплазме содержится большое количество секреторных вакуолей, отграниченных мембраной и заполненных светлым однородным веществом. Вакуоли как бы ориентированы в направлении просвета. Слизьсекретирующие клетки имеют хорошо выраженный комплекс Гольджи и профили шероховатого эндоплазматического ретикулума, но тонофибриллы отсутствуют.
Второй тип клеток характеризуется признаками плоскоэпителиальной дифференцировки: клетки крупные, с отчетливой цитоплазмой и многочисленными тонофибриллами в виде пучков; видны также межклеточные мостики и десмосомы. Признаки кератинизации в этих элементах не обнаруживаются.
Иногда встречаются небольшие компактные скопления мелких непродуцирующих слизь клеток, формирующих узкие щели. В просвете щелей выбухают единичные мелкие цитоплазматические выросты. В цитоплазме много митохондрий, лизосом и крупных, окруженных мембраной гранул до 200 нм в диаметре с гомогенной сердцевиной. Между мембраной и сердцевиной виден пояс просветления. В цитоплазме рассеяны мелкие пучки тонофибрилл, а между клетками, в зоне их контакта, обнаруживаются десмосомы. Клетки миоэпителия обычно отсутствуют.
Возможно, опухоль возникает из низкодифференцированного эпителия бронхов, способного формировать и плоскоклеточные и слизепродуцирующие элементы (И.В.Двораковская, 1979). Но, более вероятно, гистогенез связан с клеточными элементами протоков секреторных желез или эпителием междольковых протоков, в которых отсутствует миоэпителий (Н.Т.Райхлин и соавт.,1981; Т.А.Белоус, 1982).
Выбор метода лечения обычно основывается на индивидуальных прогностических факторах. При низкой степени гистологической злокачественности опухоли, небольших ее размерах, при относительно продолжительном анамнезе, отсутствии метастазов в лимфатических узлах обычно достаточно экономной резекции. Это обычно трахеофиссура с иссечением в пределах здоровых тканей или эндоскопическое удаление.
Опухоль высокой степени злокачественности требует более радикального подхода к лечению. В этом случае следует предпочесть циркулярную резекцию трахеи с регионарной лимфаденэктомией, особенно если имеются признаки поражения лимфатических узлов.
При наличии выраженного эпидермоидного компонента мукоэпидермоидный рак обладает довольно большой радиочувствительностью. Это оправдывает проведение адъювантной лучевой терапии. Более того, известны хорошо документрированные случаи полного излечения мукоэпидермоидного рака гортани только лучевым методом [Fernandez Perez A. et al.,1993].
Читайте также:

