Малоинвазивное лечение рака печени
Среди первичных злокачественных новообразований печени наиболее часто встречается гепатоцеллюлярная карцинома, или печеночно-клеточный рак, который, как видно из названия, берет свой рост в гепатоцитах — клетках печени. Значительно реже регистрируют злокачественные опухоли, растущие из эпителия внутрипеченочных желчных протоков — холангиокарциномы, а также смешанные новообразования — гепатохолангиокарциномы.
Рак печени занимает третье место в структуре смертности от онкологических заболеваний в мире, и каждый год уносит жизни около миллиона человек. Наиболее часто патология регистрируется в возрасте 40-50 лет, при этом мужчины страдают от заболевания в 4-9 раз чаще, чем женщины.
Факторы риска
Менее 10% рака развивается в исходно здоровой печени. В остальных случаях ему предшествуют различные патологические состояния:
- цирроз печени;
- вирусные гепатиты В и С;
- алкогольная болезнь печени;
- аутоиммунное воспаление;
- токсическое повреждение, в частности афлатоксинами и винилхлоридом;
- наследственная патология, сопровождающаяся дефицитом α1- антитрипсина.
Показательно, что наиболее высока заболеваемость раком печени в регионах с высоким уровнем вирусных гепатитов. Установлено, что у носителей гепатита В гепатоцеллюлярная карцинома встречается почти в 100 раз чаще, чем у остальных пациентов.
Знание факторов риска позволяет определить группы риска для проведения скрининговых исследований. Пациентам с циррозом печени, носителям вируса гепатита В, людям с семейным анамнезом по раку печени рекомендовано регулярная ультразвуковая томография печени с определением уровня альфа-фетопротеина (АФП) в крови, повышенное содержание которого является основанием для более глубокого исследования.
Клиническая картина
Симптомы заболевания и жалобы пациента, как правило, не отличаются специфичностью, поэтому на ранних стадиях выявить рак печени можно практически исключительно в ходе скрининга. На более поздних стадиях у еще достаточно стабильных пациентов появляются:
- неопределенные боли в животе;
- потеря веса;
- ухудшение общего состояния;
- лихорадка (не всегда);
- пальпируемое образование в правом подреберье;
- асцит;
- перитонит (при кровотечении).
Следует заметить, что и в этом случае, симптомы рака практически не отличаются от симптомов тяжелого поражения печени, например, вследствие цирроза, поэтому также не могут служить основанием для постановки диагноза.
Помимо этого, у части пациентов могут развиваться различные метаболические нарушения, в частности: повышение уровня глюкозы, жиров и кальция в крови, что также иногда сопровождается соответствующими клиническими проявлениями.
Стадирование рака печени
Первичный гепатоцеллюлярный рак стадируется согласно международной системе ТNМ, где:
Т — размеры опухоли и степень ее инвазии;
N — метастазы в лимфоузлы;
М — отдаленные метастазы;
0 — отсутствие признака.
Т1 — новообразование до 2 см без инвазии в сосуды.
Т2 — опухоль менее 2 см с инвазией в сосуд, или множественные опухоли в одной доле менее 2 см без инвазии, или новообразование более 2 см без инвазии.
Т3 — более 2 см с инвазией, или множественные в одной доле менее 2 см с инвазией, или множественные одной доле размером более 2 см.
N1— метастазы в регионарных лимфоузлах.
Т4 — множественные новообразования в обеих долях, или опухоль, распространяющаяся на соседние органы или прорастающая в брюшину.
М1 — имеются отдаленные метастазы
Поскольку рак печени очень часто развивается на фоне ее цирроза, для объективной оценки состояния пациента и предполагаемой эффективности лечения применяется также BCLC, или Барселонская система стадирования, в которой присутствует 5 стадий от 0 (очень ранняя) до D (терминальная).
Диагностика рака печени
Диагностические процедуры при раке печени могут носить скрининговый и уточняющий характер. К их числу относятся:
- Исследование крови на АФП, который считается опухолевым маркером, хотя его уровень может быть повышен и при некоторых других заболеваниях печени, а также при опухолях другой локализации.
- Ультразвуковая КТ применяется как метод скрининга, а также в качестве средства навигации при проведении чрезкожной биопсии и некоторых интервенционных вмешательствах. При всех достоинствах, метод недостаточно чувствителен в отношении мелких новообразований.
- КТ и МРТ с контрастированием позволяют обнаружить типичные для гепатокарциномы изменения локального кровообращения.
Биопсия печени — надежный метод диагностики, требующий интервенционного вмешательства, которое, впрочем, при должном опыте врача достаточно безопасно. Биопсия просто необходима при небольших опухолях, в ситуациях, когда заключения, полученные иными методами, расходятся, а также при обнаружении любой опухоли в нецирротической печени. Вместе с тем биопсия может быть и не показана. Так, например, в следующих ситуациях проведение исследования нецелесообразно:
- декомпенсированный цирроз или другие тяжелые заболевания, которые делают лечение заведомо неэффективным;
- при запланированной резекции печени;
- наличие специфичной картины при проведении мультифазной КТ или МРТ.
С учетом того, что рак печени чаще всего появляется на фоне цирроза и другой патологии, требующей собственных диагностических мероприятий, в каждом случае необходима оценка выраженности фонового процесса.
Методы лечения
Лечение гепатоцеллюлярного рака — сложная задача, требующая индивидуального подхода, который учитывает наличие и степень цирроза, функциональные возможности печени, распространение опухоли. В разработке плана лечебных мероприятий принимает участие целая команда специалистов, в том числе онколога, радиолога, химиотерапевта, трансплантолога и других.
Удаление части печени
Резекция (удаление части) печени является методом выбора при раннем гепатоцеллюлярном раке. Операцию возможно провести при сохраненных функциях органа и в отсутствие портальной гипертензии. Наилучшие результаты лечения были получены у пациентов с новообразованием размерами менее 5 см.
Трансплантация
Пересадка печени показана в ситуациях, когда резекция не рекомендована, например, при множественных узлах или выраженном циррозе. При отборе пациентов для трансплантации печени используют так называемые “миланские” критерии, следуя которым удается обеспечить 5-летнюю выживаемость на уровне 70%.
Радиочастотная аблация
Метод термодеструкции, который предпочтительно применять на ранних стадиях новообразования, если невозможно выполнить резекцию и трансплантацию. Такой вариант лечения не оправдан при множественных опухолях, при большом размере узлов (более 3 см), а также у пациентов с декомпенсированным циррозом.
Трансартериальная химиоэмболизация
Введение цитостатиков в артерию, которая питает опухоль. Метод используется в паллиативном лечении неоперабельных пациентов, но не применяется при выраженном циррозе.
Лучевая терапия
Дистанционная лучевая терапия в классическом виде применяется редко, поскольку наносит существенный ущерб неповрежденным тканям печени. Хорошие перспективы имеет стереотаксическая лучевая терапия, которая позволяет минимизировать воздействие на интактные ткани.
Химиотерапия
Назначается с целью увеличить продолжительность жизни пациента. Показаниями к ней являются отдаленные метастазы и прогрессирование заболевания после лечения другими методами, а также наличие противопоказаний к другим вариантам терапии.
Какой бы способ лечения не применялся, прогноз жизни пациента зачастую определяется не только новообразованием, но и циррозом печени.
Томотерапия в лечении рака печени
В лечении рака печени, а также других опухолей, хирургическое лечение которых подчас затруднительно, а химиолучевая терапия недостаточно эффективна и безопасна, популярность приобретают стереотаксические радиологические методы, позволяющие обеспечить подачу высокой дозы радиации в границах новообразования.
Именно такой системой является TomoTherapy HD, которая представляет собой
КТ-сканер, совмещенный с устройством для облучения, что позволяет добиться точного позиционирования пациента во время каждого сеанса лечения. Основные преимущества томотерапии:
- лечение опухолей разных форм и размеров;
- одновременное лечение сразу нескольких новообразований;
- избирательное излучение, не затрагивающее здоровые ткани;
- минимум побочных эффектов;
- возможность повторного применения.
Использование TomoTherapy HD открывает новые возможности в лечении пациентов с неоперабельным раком печени, позволяя значительно улучшить их прогноз выживаемости.
Стоимость лечения рака печени лучевой терапией
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Адрес: г. Ростов-на-Дону, ул. Варфоломеева, 92 А
Запись на консультативный
прием по телефону:
+7 (904) 503-00-03 ,
+7 (863) 298-00-09

- Малая травматичность.
- Низкий процент осложнений;
- Низкая послеоперационная летальность;
- Уменьшение сроков пребывания в стационаре;
- Возможность повторных вмешательств;
- Этапное воздействие при множественных очагах.
- Разрушение опухоли в пределах здоровой ткани.
- Неоперабельные больные
- Кандидаты на трансплантацию
- Предшествующая гепатэктомия
- Неэффективное лечение.
Отбор пациентов:
- Наличие 4-5 очагов и менее.
- Диаметр очага 5 см и менее.
- Расположение узлов не ближе 1 см от крупных печеночных сосудов.
- Отсутствие внепеченочных опухолей.
Противопоказания:
- Некорригируемая коагулопатия
- Выраженная астения
- Сепсис
Относительные противопоказания
- Опухолевая инфильтрация печени > 50 % или печеночная недостаточность
- Более 5 очагов в печени или большие опухоли (размером более 5 см)
- Гилюсные или крайне поверхностные опухоли
- Нарушения свертываемости крови




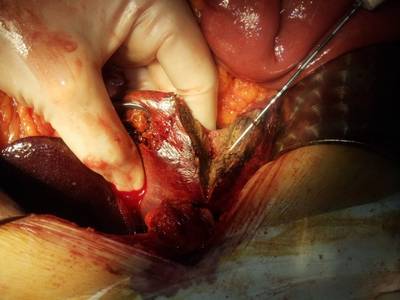
- Неоперабельные первичные злокачественные опухоли печени (из-за внутриорганного распространения или сопутствующих заболеваний)
- Неоперабельные рецидивы после резекции печени по поводу первичных злокачественных опухолей
- Старческий возраст больного
- Отказ от хирургического вмешательства
Противопоказания:
- Диссеминация опухолевого поражения
- Объем поражения печени более 70%
- Тромбоз воротной вены (за исключением Y-90)
- Значительные нарушения функции печени и почек
- Наличие в анамнезе химиоэмболизации
- Атеросклероз сосудов которые мешают проведению химиоэмболизации
- Сниженные резервные возможности печени по данным лабораторных исследовании
- О клинике
- Услуги
- Контакты
- Отзывы
- Патенты и сертификаты
- Статьи
- Литература
- Документы

При использовании материалов сайта в электронном виде необходимо размещение активной гиперссылки на главную страницу сайта или на страницу размещения соответствующего материала.

Под персональными данными подразумевается любая информация личного характера, позволяющая установить личность Пользователя/Покупателя такая как:
- Фамилия, Имя, Отчество
- Адрес электронной почты
Персональные данные Пользователей хранятся исключительно на электронных носителях и обрабатываются с использованием автоматизированных систем, за исключением случаев, когда неавтоматизированная обработка персональных данных необходима в связи с исполнением требований законодательства.
Клиника обязуется не передавать полученные персональные данные третьим лицам, за исключением следующих случаев:
- По запросам уполномоченных органов государственной власти РФ только по основаниям и в порядке, установленным законодательством РФ
- Стратегическим партнерам, которые работают с Клиникой для предоставления продуктов и услуг, или тем из них, которые помогают Клинике реализовывать продукты и услуги потребителям. Мы предоставляем третьим лицам минимальный объем персональных данных, необходимый только для оказания требуемой услуги или проведения необходимой транзакции.
Клиника оставляет за собой право вносить изменения в одностороннем порядке в настоящие правила, при условии, что изменения не противоречат действующему законодательству РФ. Изменения условий настоящих правил вступают в силу после их публикации на Сайте.
Если Вы хотите отписаться от рассылки, вам достаточно нажать на ссылку "отписаться" указанную в конце содержимого любого из рассылаемых нами писем.
Мы обязуемся не передавать ваши данные (Имя и Электронный адрес) третьим лицам, а использовать исключительно для рассылки больничной электронной корреспонденции.

Выбор метода лечения обусловлен размерами и локализацией первичной опухоли, наличием метастазов в печени и других органах, состоянием ткани печени и самого пациента. Поэтому терапия подразделяется на две линии: при наличии цирроза печени и при отсутствии цирроза.
Профилактической терапии, способной снизить риск рецидива печёночно-клеточного рака и продлить жизнь, к сожалению, не существует.
- Хирургическое лечение рака печени
- Клинический случай
- Современные методы локального воздействия на рак печени
- Радиочастотная аблация печени (РЧА)
- Криодеструкция опухоли
- Трансартериальная химиоэмболизация (ТАХЭ)
- Трансартериальная радиоэмболизация (ТАРЭ)
- Химиотерапия при раке печени
- Цены в Европейской онкологической клинике на лечение рака печени
Хирургическое лечение рака печени
Даже при современном развитии медицины без хирургического воздействия невозможно вылечить злокачественную опухоль, и рак печени не исключение.
Операцию делают невозможной:
- метастазы в печень;
- метастазы в другие органы и ткани;
- низкие функциональные возможности печени и почек;
- тромбоз воротной вены.
Объём вмешательства зависим от распространения поражения печени. Без сопутствующего цирроза при раннем раке – небольшой опухоли до 5 см - методом выбора считается резекция печени.
При вовлечении в опухоль участков обеих долей печени на стороне максимального поражения выполняется гемигепатэктомия, в доле с меньшим повреждением предпочтительно локальное воздействие: экономная резекция, радиочастотная аблация или криодеструкция.
Большой объём опухоли на фоне цирроза поставит вопрос о трансплантации печени. При ожидании трансплантации возможно локальное воздействие на опухоль, в том числе аблация, эмболизация и парциальная резекция печени.
Клинический случай
В Европейскую онкологическую клинику обратился за помощью пациент 46 лет с диагнозом рак прямой кишки, метастатическое поражение печени. Осложнения: кишечная непроходимость. 27 апреля 2016 года пациенту была проведена паллиативная лапароскопическая передняя резекция прямой кишки, удаление метастаза левой доли печени, резекция 2 сегмента печени с опухолевым узлом. Гистологическое исследование показало низко- и умеренно-дифференцированную аденокарциному прямой кишки.
Учитывая изолированное метастатическое поражение печени, гипоплазированную левую долю печени, решено выполнить ALPPS резекцию. 3 сентября 2016 выполнен первый этап ALPPS — резекции печени in situ. 10 сентября 2016 проведён второй этап операции — расширенная правосторонняя гемигепатэктомия (+SIVа) после ALPPS, атипичная резекция SIVb. Пациент выписан через 5 суток, запланировано проведение химиотерапии. Читайте подробнее об уникальной операции по резекции печени.
Современные методы локального воздействия на рак печени
При единственной опухоли или единичных узлах опухоли не более 3 см, не подлежащих оперативному лечению, выполняют локальную деструкцию: радиочастотную или микроволновую аблацию, криодеструкцию.
Радиочастотная аблация печени (РЧА)
Предпочтительным и наиболее часто используемым методом считается радиочастотная аблация. Этот вариант термической деструкции применяется при:
- раннем гепатоцеллюлярном раке до 3см;
- рецидиве опухоли;
- с паллиативной целью при узле до 5 см;
- единичных опухолевых узлах, числом не более 5.
Противопоказания почти такие же, как и для хирургического вмешательства, но менее жёсткие: отдалённые метастазы, декомпенсированный цирроз печени, не купируемый асцит, энцефалопатия, наличие кардиостимулятора, выраженные нарушение свёртываемости крови и активное желудочное кровотечение, и конечно, прилежание опухоли к другим органам и крупным желчным протокам.
Наилучший результат достигается при небольших опухолях, особенно, при возможности термического воздействия на окружающую ткань, хорошем доступе к узлу во время РЧА. Лечение эффективно, когда удаётся добиться 100% некроза опухоли. Пятилетняя выживаемость пациентов с компенсированным циррозом и ГЦР менее 5 см в диаметре достигает 60%.
Вероятность осложнений есть, но она менее 10%, главное – они не фатальны для больного и устранимы. Нередко РЧА комбинируют с другими методами локального воздействия, в частности, с трансартериальной химиоэмболизацией.
Выполняется также микроволновая аблация - манипуляция аналогична РЧА, но с другой частотой волны. Показания и противопоказания схожи.
Криодеструкция опухоли
Криодеструкция - прямое воздействие жидкого азота, охлаждающего ткани до температуры минус 180°С. Непосредственное охлаждение опухоли с помощью специального устройства вызывает гибель клеток, а в окружении опухоли формируются микрососудистые тромбы, которые усугубляют повреждение за счёт дополнительного нарушения её питания.
Во время манипуляции, которую могут выполнять через кожу или во время операции, к опухоли подводится специальный аппликатор, охлаждаемый до минус 180°С. Криодеструкция позволяет лечить опухоли больших размеров.
О комплексном подходе в лечении рака печени рассказывают врачи Европейской онкологической клиники Бурдюков М.С. и Бобров Б.Ю.

Трансартериальная химиоэмболизация (ТАХЭ)
Химиоэмболизация - ведущий метод локорегиональной терапии ГЦР, применяемый в первой линии паллиативной терапии не подлежащего операции опухолевого процесса без признаков вовлечения сосудов и внепечёночных проявлений заболевания - метастазов.
Наилучший эффект ТАХЭ достигается при невыраженном циррозе и сохранной функцией печени, но при тромбозе воротной вены и выраженном циррозе эмболизация не выполняется.
Микросферы блокируют кровоток в питающих опухоль сосудах, не вовлекая крупных ветвей печёночной артерии, поэтому оказывают максимальный терапевтический эффект при минимизации нежелательных последствий эмболии.
Трансартериальная радиоэмболизация (ТАРЭ)
Почти аналогичная ТАХЭ манипуляция, но на поверхности микросфер располагается радиоактивный изотоп иттрия-90. При ТАРЭ эмболизирующее действие микросфер сочетается с локальным облучением опухоли печени.
Лучевая терапия рака печени в клинической практике, вне научных исследований, почти не применяется
Химиотерапия при раке печени
Современные возможности лекарственной терапии рака печени ограничены, поскольку опухоль устойчива к цитостатикам. Как правило, химиотерапия печени используется при противопоказаниях к локальным методам воздействия, метастазах внепечёночной локализации и при прогрессировании после локального воздействия.
Основная цель лечения - увеличение продолжительности жизни, а достоверно её увеличивает только сорафениб. Иные химиопрепараты и их комбинации демонстрируют эффективность в 20% случаев, но не влияют на длительность жизни больных.
При циррозе печени переносимость химиотерапии ухудшается, что ограничивает возможности активного лечения. При хроническом гепатите В или носительстве вируса к химиотерапии присоединяют противовирусные препараты. Но при хроническом гепатите С нет нужды в противовирусной терапии, зато вероятность гепатотоксичности и развития лекарственного гепатита очень высоки, поэтому проводят их профилактику. В рекомендациях отмечена неэффективность эссенциальных фосфолипидов - широко распространённого в России Эссенциале®.
В научной литературе не доказали, что применение аналогов соматостатина увеличивает продолжительности жизни, но на нём могут регистрировать уменьшение опухоли. Интерферон-2α в стандартных дозах бесполезен, но оказывает небольшой эффект в сочетании с химиотерапией.
При наличии противопоказаний к химиотерапии при раке печени мы проводим симптоматическую терапию, направленная на повышение качества жизни и улучшение самочувствия пациента.
Внутреннее излучение: рак будут лечить радиоактивными капсулами

У пациентов с неоперабельным гепатоцеллюлярным раком печени появился шанс на хирургическое удаление злокачественной опухоли и, как следствие, на излечение. В Медицинском радиологическом научном центре им. А.Ф.
Цыба, филиале НМИЦ радиологии Минздрава РФ прошел первый этап нового для России метода лечения — радиоэмболизации печени. Он признан самым эффективным при этом заболевании и позволяет значительно увеличить продолжительность жизни пациентов по сравнению с теми, кто получил традиционную терапию.
В мире радиоэмболизация входит в стандарт лечения, но у нас этот метод до сих пор не внедрен.
Цыба Валерий Кучеров, рак печени наиболее распространен в северо-кавказском, дальневосточном и сибирском регионах страны. Факторы риска — вирусные гепатиты В и С, циррозы печени вирусного и алкогольного характера.
Основной метод лечения этого вида рака — радикальная операция. Но проблема в том, что только 20% от общего числа таких пациентов могут быть излечены хирургическим способом. Для всех остальных (у кого опухоль больше 5 см) приходится применять менее эффективные методы лечения, и продолжительность жизни в таком случае составляет 6–18 месяцев.
На сегодня в распоряжении врачей помимо хирургического метода есть еще пять способов лечения, среди которых системная химиотерапия, радиочастотная деструкция и дистанционная лучевая терапия. Все они имеют определенные противопоказания.
Суть радиоэмболизации в том, что в сосуды опухоли вводят радиофармпрепарат Иттрий 90, являющийся источником бета-излучения. Он блокирует кровоснабжение опухоли и разрушает ее изнутри. Такая операция высокоэффективна и малотравматична, а окружающие здоровые ткани практически не страдают.
— С помощью радиоэмболизации при лечении рака печени 2–3-й стадии чаще получается добиться стабилизации процесса и уменьшить объем опухолевой ткани. Это позволяет увеличить продолжительность жизни пациента, понизить стадию заболевания.
После возможны традиционная операция и излечение, — сказал Валерий Кучеров. — Метастатические поражения печени тоже достаточно успешно лечатся с помощью радиоэмболизации.
А их дают 70–75% всех онкологических заболеваний, ведь печень — это самый уязвимый при раке орган человека.
В России до сих пор радиоэмболизация печени, как стандарт лечения гепатоцеллюлярного рака, не выполнялась по нескольким причинам.
Необходимые для нее микроисточники радиоактивного излучения (микросферы) производятся в Канаде и Австралии, а короткий период полураспада препарата осложняет их доставку. К тому же стоимость импортных микросфер очень высока.
Кроме того, медучреждениям нужна специальная лицензия на такие операции и высококвалифицированный персонал.
Процедура радиоэмболизации состоит из двух частей. Сначала проводится диагностическая операция. Во время нее пациенту вместо микросфер с радионуклидами Иттрия-90 вводится технеций. При этом оценивается состояние печени и проводится проверка структуры сосудов. Операция позволяет определить, подходит ли пациент для радиоэмболизации, нет ли опасности повредить здоровые ткани или другие органы.
15 марта в МРНЦ им. А.Ф. Цыба провели именно такую подготовительную операцию в форме мастер-класса. На него пригласили ведущих хирургов центра, а также заведующего отделением интервенционной радиологии Anadolu Medical Center In Affilation with Johns Hopkins Medicine (Турция) доктора Ахмета Мурата Докдока. По его словам, процедура радиоэмболизации была одобрена комиссией FDA в 1999 году.
Цыба — один из лучших лечебных центров, в которых мне удалось побывать. Мне есть с чем сравнивать, ведь я был в большом количестве медицинских учреждений в разных странах.
Уровень подготовки врачей здесь очень высокий, они обладают всеми необходимыми компетенциями для применения методики радиоэмболизации.
Второй этап операции — собственно введение микросферы с Иттрием 90 — проведут точно таким же образом, как и первый, через две недели.
Президиум РАН: Медицина против неоперабельного гепатоцеллюлярного рака

Член.-корр. РАН Борис Долгушин рассказал об интервенционных радиологических внутриартериальных технологиях и о росте средней продолжительности жизни до 23 месяцев при неоперабельном гепатоцеллюлярном раке
Возможности сегодняшнего высокотехнологичного лечения неоперабельного гепатоцеллюлярного рака были рассмотрены на заседании Президиума РАН в июне 2015 г.
в связи с научным сообщением члена-корреспондентаБориса Ивановича Долгушина:«Малоинвазивные интервенционные радиологические внутриартериальные технологии в лечении неоперабельного гепатоцеллюлярного рака.
Первичный рак печени занимает шестое место в мире в структуре онкологических заболеваний, из всех злокачественных опухолей печени 90% составляет гепатоцеллюлярный рак (ГЦР). К основным факторам риска развития ГЦР относят вирусный гепатит В и С (с исходом в цирроз), алкогольный и первичный билиарный цирроз.
Ежегодно в мире регистрируется 620 тыс. первичных больных с ГЦР, умирает почти 600 тыс., т.е. болезнь и диагноз практически смертельны, и радикальному лечению подлежат не более 10% больных.
Россия по распространенности заболевания среди стран мира относится к средней категории, по регионам нашей страны тоже имеются различия.
Хирургическое лечение остается сегодня приоритетным методом лечения ГЦР, однако, увы, подавляющее большинство пациентов на момент выявления злокачественного поражения печени признаются уже неоперабельными.
Неудовлетворительная функция печени, объем опухолевого поражения, наличие внепеченочных проявлений и сопутствующие заболевания лишь менее чем в трети случаев позволяют выполнить радикальное лечение.
И более чем у половины прооперированных больных в ближайшие пять лет выявляется рецидив заболевания.
Выполнение трансплантации органа возможно менее чем у пятой части больных ГЦР, при этом частота рецидивов после трансплантации — до 40%, после резекции печени — до 70%.
Это означает, что 90% больных не могут получить радикальное лечение при гепатоцеллюлярном раке печени и трем из четырех пациентов требуется нехирургический подход к лечению.
И, тем не менее, есть ли предпосылки для улучшения эффективности лечения гепатоцеллюлярного рака? На сегодняшний день — да, в первую очередь благодаря ранней диагностике, поскольку чем меньше опухоль, тем больше вариантов лечения мы можем предложить пациенту и тем лучше прогноз.
Также продолжают совершенствоваться и хирургические технологии, технологии трансплантации печени. Наконец, развиваются и совершенствуются интервенционные радиологические технологии, о которых мы сегодня говорим. Что это такое? В русскоязычном варианте — это рентгенохирургия. Т.е.
метод, который включает в себя хирургические малоинвазивные технологии, и выполняются они под одним из методов интроскопии внутри организма человека. В качестве методов визуализации используются рентгеноскопия, ультразвук, рентгеновская компьютерная томография и магнитный резонанс.
Малоинвазивные вмешательства делятся на две категории: пункционную, когда подводится либо игла, либо электрод; и внутрисосудистую (трансартериальную) — химиоэмболизация и радиоэмболизация.
Кстати, на последнем европейском конгрессе интервенционных радиологов в 2014 году 83 доклада (более четверти сообщений) были посвящены онкологии, и более чем в половине из них были представлены результаты эмболизации при различных заболеваниях печени. Это говорит о том, что данная проблема актуальна, и в современную классификацию (на которую опираются все гепатологи в Европе) интервенционные радиологические технологии уже вписаны как стандарт.
Надо сказать про обоснованность и предпосылки трансартериальной химиоэмболизации при раке печени. Это уникальное кровоснабжение печени, где имеются два кровяных притока — артериальный и портальный. Более 90% опухолей печени снабжается кровью из артериального бассейна, что создает техническую возможность для воздействия на опухоль через ее артериальную систему.
И это позволяет также реализовать щадящее отношение к непораженным участкам печени. Суперселективная возможность эффективного воздействия основана на следующем — можно по артериям целенаправленно дойти до сосуда, который питает опухоль, и ввести в него очень высокие дозы лекарства.
При таком способе введения цитостатиков значительно снижается системное токсическое воздействие на весь организм.
Показания к проведению трансартериальной химиоэмболизации — это, в первую очередь, неоперабельный гепатоцеллюлярный рак при отсутствии внепеченочного проявления заболевания. Среди противопоказаний следует указать тяжелое состояние больного и различные виды сопутствующих заболеваний, которые технически не позволяют выполнить эту процедуру.
Эти катетеры телескопически, один через другой, можно направлять чресбедренным, либо кубитальным доступом в артериальное русло и дойти до тех артерий в печени, которые непосредственно питают опухоль. Микрокатетер проникает непосредственно в сосуд, питающий опухоль.
При этом, важно то, что можно доставить эмболизирующий материал не повреждая печеночные артерии, которые кровоснабжают нормальную ткань печени.
Так появляется возможность целенаправленно доставлять в опухоль цитостатик в лечебных дозах. Вот яркий пример эмболизации. Массивная опухоль в правой доле печени имеет идеальный вариант кровоснабжения — один сосуд.
На контрольных компьютерных томограммах, выполненных через месяц после эмболизации, мы видим, что опухоль некротизирована, — т.е. ткани умирают, — а это, в свою очередь, означает, что опухоль полностью ишемизирована (т.е. лишена питающего кровоснабжения).
А через год мы видим рубцовые изменения на месте опухоли, пункция которых не дала опухолевого морфологического материала. Пациент в течение трех лет жив и находится под наблюдением.
Алгоритм лечения неоперабельных больных ГЦР в Онкологическом научном центре таков. Если у пациента опухоль меньше 3 см и количество опухолевых узлов меньше трех — применяются пункционные технологии. Это радио-термоаблация, микроволновая аблация или инъекции этанола. Если же эти показатели превышены, то используются те технологии, о которых мы сейчас говорим.
Об особенностях проведения трансартериальной химиоэмболизации. Это — паллиативное вмешательство и оно позволяет поэтапно выполнять процедуру, при этом, соблюдая максимальную селективность, не нагружать не поврежденную ткань печени излишним токсическим воздействием.
Следует избегать эмболизации артерий, которые питают нормальную печень и учитывать анатомические особенности кровоснабжения.
А также следует учитывать паразитарное кровоснабжение, поскольку по мере своего роста опухоль привлекает для своего питания сосуды из других тканей, органов и структур. В норме кровоснабжение печени осуществляется из системы чревного ствола.
На ангиограммах мы это четко видим: часть опухоли питается из печеночных артерий, а часть опухоли питается из диафрагмальной артерии. Поэтому введение лекарства осуществляется как в печеночные, так и в диафрагмальные артерии.
Как и все хирургические технологии, представленная также имеет свои осложнения. Это, в первую очередь — постэмболизационный синдром, который встречается практически у всех больных (болевые ощущения, тошнота, рвота, подъем температуры).
К счастью, тяжелые осложнения, вроде абцессирования печени и острой печеночной недостаточности, встречаются лишь в небольшом проценте случаев — 2-3%.
Есть и еще одно потенциальное осложнение: после многих сеансов химиоэмболизации (в данном случае после седьмого раза) интима сосуда, питающего опухоль, не выдерживает такого длительного раздражающего воздействия цитостатика и разрушается — наступает стойкая стриктура сосуда, которая не позволяет в дальнейшем провести в него микрокатетер для выполнения очередных сеансов лечения.
Тем не менее, мы добились определенных результатов. Тотальный некроз опухоли, который считается прогностически важным элементом при лечении ГЦР, встретился практически у половины пациентов.
Такой маркер, как альфа-фето-протеин, который специфичен для гепатоцеллюлярного рака, почти в 80% случаев значительно снизился, а у части больных отмечено его снижение в десятки раз. И, наконец — выживаемость. Однолетняя выживаемость — почти 80%, двухлетняя — почти 50%, трехлетняя — 30%, четырехлетняя — 17% и пятилетняя выживаемость также, хотя небольшая, но есть.
Итак, интервенционные радиологические технологии сегодня позволяют эффективно осуществлять локальный контроль опухоли и увеличить выживаемость неоперабельных больных гепатоцеллюлярным раком — в ряде случаев до значений, сопоставимых с результатами хирургического лечения. Европейцы рассчитывают, что в 2020 г.
радикальное лечение будет получать половина больных. Но следует отметить, что основной прирост этой группы будет не за счет хирургических технологий, а за счет ранней диагностики.
То есть, в этом залог успеха: ранние небольшие опухоли позволяют применить весь спектр противоопухолевого лечения, включая и тот о котором мы сегодня говорим.
Ее суть сводится не к термическому воздействию на опухолевую клетку, как при радиотермоаблации, а к нетермическому повреждению оболочки клетки высокочастотными электрическими разрядами.
В оболочке опухолевой клетки возникают крупные отверстия, клетка не может самостоятельно восстановить повреждение такого размера и уходит в апоптоз, причем это происходит медленно и без нарушения окружающих тканей и анатомических структур.
3D-навигация в реальном масштабе времени позволяет позиционировать рабочую часть инструмента внутри организма в любой точке. Сочетанное применение пункционных и внутрисосудистых вмешательств резко повышает эффективность этих технологий.
Важны и ингибиторы ангиогенеза — в сочетании с малоинвазивными технологиями они позволяют контролировать новообразование не только в печени, но опухолевый процесс и во всем организме.
Мы надеемся, что разработка отечественных инструментов для рентгенохирургии и микросфер для таргетной доставки лекарства все-таки будет доведена до конца.
Чтобы было понятно, какое внимание в мире уделяется этому направлению (рентгенохирургическим методам воздействия на опухоль), мы сравнили данные по различным странам, где используется эти технологии и где имеется коечный фонд исключительно для применения интервенционных технологий. В Китае — более 60% больниц, в Японии — более 50%, в европейских странах — 17%, в Канаде — 11%. А в нашей стране? Мы можем на пальцах одной руки пересчитать эти центры.
Сейчас в Российском онкологическом научном центре им Н.Н. Блохина совместно работает большая группа специалистов, в которую входят хирурги, занимающиеся лечением рака печени, химиотерапевты, лучевые диагносты, интервенционные радиологи, морфологи, поликлинические врачи.
То есть — это та схема, которая сейчас уже отработана, и мы готовы ее предлагать другим клиникам. За последние 15 лет такой подход позволил увеличить востребованность этой технологии в пять раз.
Имея такую возможность, как увеличение жизни в три раза у этой неоперабельной группы больных, мы считаем возможным и необходимым, учитывая авторитет Академии наук, получить поддержку, для продвижения в этом направлении: создать реестр пациентов гепатоцеллюлярным раком, разрабатывать лечебно-диагностические алгоритмы, издать методические рекомендации.
Необходимо всесторонне взаимодействовать с врачами других специальностей, в частности — гепатологами и трансплантологами — задачи которых напрямую могут зависеть от представленной нами сегодня технологии, а также иметь кооперацию с европейскими центрами. Необходимо также осуществить создание национальной кооперативной программы по диагностике и лечению гепатоцеллюлярного рака и создать учебно-методический центр — центр компетенции по радиологии в онкологии.
Читайте также:

