Лимфобластным лейкозом как вылечить
Медицинский эксперт статьи

Теоретически терапия должна длиться до тех пор, пока не будет разрушена вся популяция лейкемических клеток, но не дольше. К сожалению, до настоящего времени нет надёжного метода определения остаточной опухоли, однако в рандомизированных клинических исследованиях показано, что оптимальная длительность терапии - 2-3 года. Как правило, лечение состоит из ежедневного приёма меркаптопурина и еженедельного введения метотрексата, дозы модифицируют в зависимости от количества лейкоцитов.
К концу 1970-х годов стало ясно, что подобная терапия позволяет вылечить лишь половину детей с острым лимфобластным лейкозом. Дальнейший прогресс связан с определением биологической гетерогенности лимфобластного лейкоза, введением международной цитологической классификации (FAB) и системы прогностических факторов, разделением больных на группы риска и разработкой дифференцированных программ лечения, организацией мультицентровых исследований и кооперативных клинических групп, развитием исследований в области фармакокинетики различных цитостатических препаратов (с целью создания более эффективных режимов химиотерапии) и интенсивным развитием сопроводительной терапии.
Всё это привело к созданию следующего поколения программ химиотерапии острого лимфобластного лейкоза. Большинство современных протоколов построено на принципах интенсивной инициальной полихимиотерапии для максимального разрушения пула лейкемических клеток. Их основа - использование цитостатических препаратов в виде сменяющих друг друга комбинаций (ротация), применение высокодозных режимов химиотерапии, а также интенсивная профилактика нейролейкемии с применением в большинстве случаев краниального облучения. Эти достижения позволили в США и странах Западной Европы к концу 1980-х годов преодолеть 70% барьер 5-летней безрецидивной выживаемости при остром лимфобластном лейкозе. К лучшим протоколам, применяемым в настоящее время, относят программы групп BFM и COALL (Германия), а также целый ряд протоколов американских исследовательских групп - DFCI 8.1-01. POG. CCSG.
На основании результатов лечения по данным протоколам, а также на опыте, накопленном группой BFM, была разработана новая программа лечения острого лимфобластного лейкоза у детей, названная Москва-Берлин 91 (ALL-MB-91). Основная идея данной программы химиотерапии - представление о ключевой роли оккультной (скрытой) нейролейкемии в происхождении рецидивов и, следовательно, неудач в лечении острого лимфолейкоза у детей. В данном протоколе преднизолон заменён на дексаметазон, введён режим длительного (в течение нескольких месяцев) применения аспарагиназы. Локальную химиопрофилактику нейролейкемии проводят в течение первого года лечения тремя препаратами. Специальные требования нового протокола - отказ от применения высокодозной интенсивной химиотерапии и лечение пациентов в амбулаторных условиях, уменьшение потребности в сопроводительной терапии и трансфузиях компонентов крови, а также отказ от краниального облучения у большей части пациентов.
Результаты лечения оказались полностью сопоставимы с программой ALL-BFM-90.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
Лейкозы, или гемобластозы, в быту известные под названием белокровие – это злокачественные новообразования, формирующиеся из клеток крови и их предшественников. Все лейкозные клетки – клоны одной исходно изменившейся. Острый лимфобластный лейкоз – это патология лимфоидного ростка кроветворения.
Заболевание преимущественно детское – 60% всех пациентов моложе 20 лет. Чаще всего страдают дети в период с 3 до 4 лет, преимущественно мальчики. Второй пик заболеваемости приходится на период 50-60 лет. Тем не менее, болезнь может развиться в любом возрасте, включая младенческий.
Причины и механизмы развития
В основе патофизиологии опухолевого роста при лейкозах – мутации одной кроветворной клетки, которая перестает реагировать на регуляторные сигналы организма, теряет способность к созреванию (дифференцировке), ограничение числа делений (в норме клетки прекращают существование после примерно 50 митозов) и начинает бесконтрольно размножаться.
Как правило, назвать одну — единственную причину мутации бывает невозможно, особенно с учетом того, что большинство пациентов – дети. Но существуют предрасполагающие факторы развития лейкоза:
- воздействие химических агентов (бензол, некоторые лекарства);
- биологические факторы (типичный пример – вирус Эпштейна-Барр, вирус HLTV);
- врожденные хромосомные аберрации;
- некоторые наследственные заболевания (синдромы Дауна, Блума, Кляйнфельтера, Вискотта-Олдрича, анемия Фалькони);
- физические факторы: ионизирующее , рентгеновское излучение (работники рентгенологических кабинетов болеют лейкозом чаще среднего в популяции).
Всё потомство – клоны исходной атипичной лимфоцитарной клетки, неконтролируемо размножаясь, подавляют деление и созревание нормальных ростков кроветворных клеток. Сначала они делятся в пределах костного мозга, потом выходят в кровь, селезенку, печень, внутренние органы – и это становится началом клинических проявлений.
Симптомы
Жалобы и симптомы при остром лимфобластном лейкозе вызваны такими факторами, как:
- интоксикация организма продуктами распада злокачественных клеток;
- угнетение кроветворения и его последствия;
- инфильтрация органов лейкозными клетками.
Собственно, три этих фактора и лежат в основе патогенеза лейкоза.
Клиника интоксикационного синдрома обычно ярко не проявляется, и хоть и бывает зачастую первым симптомом лейкоза, не привлекает к себе внимания. Слабость, потливость, субфебрилитет (температура чуть выше 37) обычно связываются с какими-то другими причинами.
- Анемией. Недостаток красных кровяных клеток, а, следовательно гемоглобина, приводит к нехватке кислорода в организме. Основные симптомы: общая слабость, бледность кожи и слизистых, одышка при физической нагрузке.
- Тромбоцитопенией. Недостаток тромбоцитов проявляется кровотечениями. Они могут быть различной интенсивности, от петехий – кожной сыпи – до обильных желудочных, маточных кровотечений и внутричерепных кровоизлияний.
- Развитием иммунодефицита. За защиту от инфекций отвечают лимфоциты, нейтрофильные лейкоциты. Нормальные лимфоциты не вызревают, заменяясь бластами, которые в силу незрелости неспособны защищать от инфекций, а количество лейкоцитов снижено из-за угнетения нормального кроветворения. Тяжесть инфекций может быть различна, вплоть до обширных флегмон и сепсиса. Такие осложнения возникают в 10-20% случаев острого лимфатического лейкоза.
Злокачественные клетки, проникая во внутренние органы, образуют отдалённые очаги — лейкозные инфильтраты. В отличие от метастазов других злокачественных опухолей, лейкозные инфильтраты не разрушают ткани, а раздвигают их. У 75% больных увеличиваются лимфоузлы, печень, селезенка . Появляются лейкозные бляшки на коже. Инфильтрация мозговых оболочек (нейролейкоз) вызывает проявления, сходные с симптомами менингита: тошноту, нарушения координации, головную боль, сонливость. Такие признаки отмечаются у 50% пациентов.
Диагностика
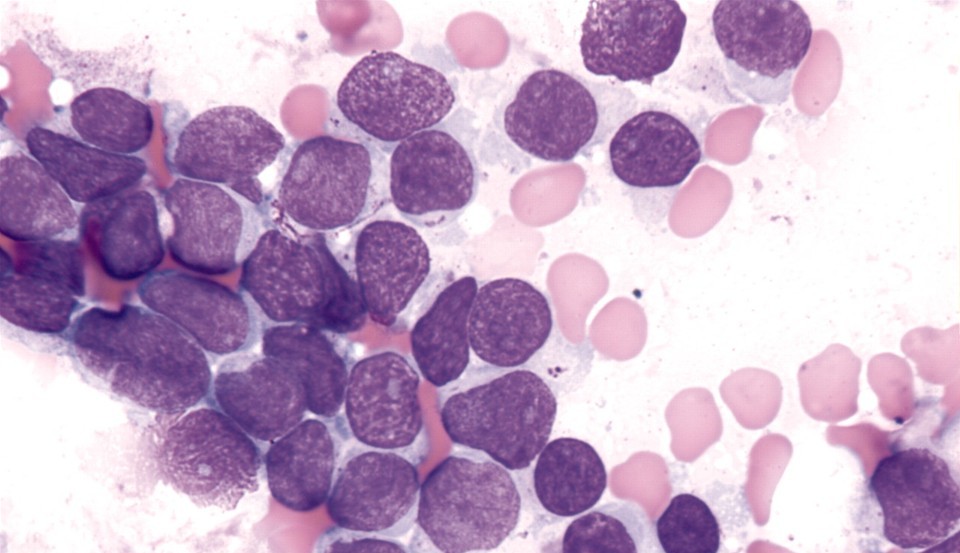
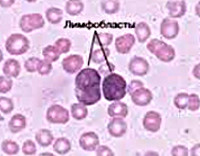
Обычно первым привлекает внимание измененный анализ крови, с количеством лейкоцитов более 15х10 9 /л. Для острых лейкозов характерен так называемый лейкозный провал – в крови огромное количество бластных клеток, немного зрелых лимфоцитов и полностью отсутствуют промежуточные, созревающие клетки.

Для окончательного подтверждения диагноза выполняют анализ костного мозга, полученного при пункции, и исследуют количество бластных клеток. Для большей части острых лейкозов главный онкомаркер – более 20% бластных клеток в костном мозге, но для острого лимфобластного лейкоза диагностический критерий – 25% бластов. Если этот показатель ниже, или бластных клеток нет в костном мозге, но есть лейкозные инфильтраты в других органах и тканях, говорят о лимфобластной лимфоме, лечение которой, впрочем, не отличается от лечения острого лейкоза.
Морфоцитохимическое исследование костного мозга, иммунофенотипирование, цитогенетическое исследование (которое лежит в основе современной классификации лейкозов, рекомендованной ВОЗ), позволяющие определить все особенности клеток лейкозного клона, оговорены в клинических рекомендациях, но на практике возможны только в некоторых крупных медицинских центрах.
Обязательно выполняется люмбальная пункция, чтобы подтвердить или опровергнуть нейролейкоз. Это состояние требует специальной терапии, потому что обычные химиопрепараты не проникают через гематоэнцефалический барьер.
Клинический анализ крови и изучения состояния свертывающей системы позволяют выявить и скорректировать анемию, тромбоцитопению.
КТ грудной клетки и брюшной полости позволяет определить поражение печени, селезенки, лимфоузлов. Особенно опасно увеличение лимфоузлов средостения, расположенных рядом с сердцем, трахеей и крупными бронхами.
Лечение и прогноз острого лимфобластного лейкоза у детей
Современные протоколы терапии превратили острый лимфобластный лейкоз у детей из абсолютно летального в потенциально излечимое заболевание.
Исходя из индивидуальных особенностей, возможно три варианта прогноза.
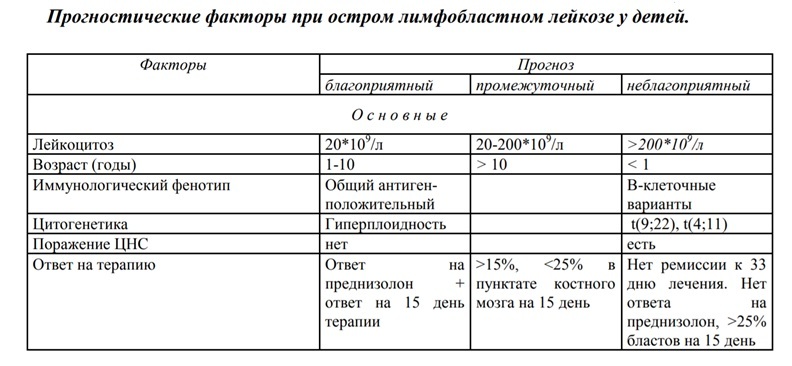
Дело в том, что химиотерапия лейкоза, как, впрочем, и любой другой злокачественной опухоли, очень тяжело переносится. Любой протокол химиотерапии – это нечто вроде золотой середины между эффективностью лечения и его безопасностью. Поэтому для групп благоприятного, промежуточного и неблагоприятного прогноза применяются разные схемы лечения, цель которого – полностью уничтожить лейкозный клеточный клон. В любой из схем используется комбинация цитостатиков и гормонов (преднизолона), разница в количестве препаратов и дозировках.
Во время химиотерапии очень важен тщательный уход за полостью рта и кожей, дезинфекция палаты, личная гигиена родителей, ухаживающих за ребенком.
Химиотерапия состоит из нескольких этапов:
- Индукция ремиссии – первая атака на атипичные клетки. Продолжительность 64 дня.
- Консолидация – самый токсичный этап. 56 дней.
- Поздняя интенсификация – 49 дней.
- Если предыдущие этапы позволили достигнуть ремиссии, далее проводится поддерживающая химиотерапия на протяжении минимум 2 лет.

Это программа для пациентов стандартного и среднего риска с благоприятным или промежуточным прогнозом. В случае высокого риска или неблагоприятного прогноза:
- Индукция ремиссии – 72 дня.
- Консолидация – три блока химиотерапии по 6 дней каждый повторяются дважды (всего 6 блоков).
- Поддерживающая химиотерапия в ремиссии минимум 104 недели.
Именно пациентам этой группы показана трансплантация костного мозга. Если она проходит успешно, рецидивов не случается, но в нашей стране реестр доноров костного мозга находится в стадии разработки, поэтому если среди родственников не находится подходящего донора, вероятность проведения пересадки резко уменьшается.
- К 33 дню терапии не наступила ремиссия;
- Лейкоцитоз более 100 в сочетании с некоторыми генетическими и молекулярно-биохимическими характеристиками опухоли и клинически невыраженный ответ на преднизолон;
- Более 25% бластов в костном мозге к 15 дню индукции ремиссии.
- Ранние и очень ранние рецидивы;
- Все рецидивы Т-клеточного ОЛЛ.
Если ремиссия сохраняется 5 лет и более, пациент считается излеченным. Но иногда лейкозные клетки мутируют, теряя восприимчивость к терапии и тогда возможен рецидив. В этом случае пациента продолжают лечить, но протоколы меняют. Если вывести в стойкую ремиссию пациента не получается, периоды ремиссия-рецидив повторяются вплоть до полного истощения организма, либо до гибели от осложнений лейкоза (кровотечение, инфекция).
Цитостатическая терапия обязательно сопровождается поддерживающей, которая направлена на нормализацию гемоглобина, свертывающей системы, устранение интоксикации, уменьшения побочных эффектов основного лечения.
При остром лимфобластном лейкозе прогноз у детей благоприятный – пятилетняя безрецидивная выживаемость составляет 60 – 80%.
Лечение и прогноз: взрослые
Принципы лечения лейкемии у взрослых не слишком отличаются от таковых у детей – многие схемы были заимствованы или адаптированы из педиатрической практики. Основные этапы лечения – индукция ремиссии, консолидация и поддерживающая химиотерапия.
- Индукция ремиссии: 2 фазы по 4 недели каждая;
- Консолидация ремиссии: 5 этапов по 3 – 4 недели;
- Поддерживающая терапия.
Точно так же как и у детей, схемы различаются в зависимости от генетических особенностей лейкозного клона. Прогностические факторы риска изучаются, но их использование относится к рекомендательным,, так как практика показывает – у 40 – 50% пациентов не имеющих факторов риска рецидива острый лимфолейкоз все равно рецидивирует.
Показания к трансплантации костного мозга у взрослых группы высокого риска зависят от конкретного протокола лечения. Но во всех случаях учитывают состояние пациента и сопутствующие патологии, ухудшающие восстановление после пересадки.
Точно так же, как и при лечении детей, обязательна поддерживающая терапия.
Прогноз у взрослых в целом хуже, чем у детей: пятилетняя общая выживаемость – от 40 до 60%, в зависимости от возраста пациента и генетических особенностей лейкозного клона.
Хронический лимфолейкоз – злокачественное опухолевидное новообразование, которое характеризуется неконтролируемым делением зрелых атипичных лимфоцитов, поражающих костный мозг, лимфатические узлы, селезёнку, печень, а также и другие органы.В 95-98% случаев данная болезнь характеризуется В-лимфоцитарной природой, в 2-5% - Т-лимфоцитарной.В норме В-лимфоциты проходят несколько стадий развития, конечной из которых считается образование плазматической клетки, отвечающей за гуморальный иммунитет. Атипичные лимфоциты, образующиеся при хроническом лимфолейкозе, не достигают данной стадии, накапливаясь в органах кроветворной системы и вызывая серьёзные отклонения в работе иммунной системы.Эта болезнь развивается очень медленно, а также может прогрессировать на протяжении многих лет бессимптомно.
Данное заболевание крови считается одним из самых распространённых видов онкологических поражений кроветворной системы. На его долю приходится по различным данным от 30 до 35% всех лейкозов. Ежегодно заболеваемость хроническимлимфолейкозомварьирует в пределах 3-4 случаев на 100 000 населения. Это число резко возрастает среди пожилого населения старше 65-70 лет, составляя от 20 до 50 случаев на 100 000 человек.
Что такое лимфоциты?
Продолжительность жизни лимфоцитов варьирует от нескольких часов до десятков лет.
Процесс образования лимфоцитов обеспечивается несколькими органами, называемыми лимфоидными органами или органами лимфопоэза. Они делятся на центральные и периферические.
К центральным органам относятся красный костный мозг и тимус (вилочковая железа).
Костный мозг расположен преимущественно в телах позвонков, костях таза и черепа, грудине, рёбрах и в трубчатых костях организма человека и является главным органом кроветворения на протяжении всей жизни. Гемопоэтическая ткань представляет собой желеобразную материю, постоянно вырабатывающую молодые клетки, попадающие затем в кровеносное русло. В отличие от других клеток, лимфоциты не накапливаются в костном мозге. Образуясь, они сразу выходят в кровоток.
Лимфоциты представляют собой уникальную серию клеток организма, отличающуюся своим разнообразием и особенностью функционирования. Это округлые клетки, большую часть которых занимает ядро. Набор ферментов и активных веществ в лимфоцитах меняется в зависимости от их основной функции. Все лимфоциты подразделяются на две большие группы: Т и В.
Т-лимфоциты – клетки, характеризующиеся общим происхождением и похожим строением, но с разными функциями. Среди Т-лимфоцитов выделяют группу клеток, реагирующих на чужеродные вещества (антигены), клетки, осуществляющие аллергическую реакцию, клетки-помощники (хэлперы), атакующие клетки (киллеры), группа клеток, подавляющих иммунный ответ (супрессоры), а также особые клетки, хранящие память об определённом чужеродном веществе, попавшем в своё время в организм человека. Таким образом, при следующем его попадании, данное вещество немедленно распознаётся именно благодаря этим клеткам, что ведёт к появлению иммунного ответа.
В-лимфоциты также отличаются общим происхождением из костного мозга, но огромным разнообразием функций. Как и в случае Т-лимфоцитов, среди этой серии клеток выделают киллеры, супрессоры, клетки памяти. Однако большую часть В-лимфоцитов составляют клетки, производящие иммуноглобулины. Это специфические белки, отвечающие за гуморальный иммунитет, а также участвующие в различных клеточных реакциях.
Что такое хронический лимфолейкоз?
Лимфолейкоз – это лейкоз, поражающий лимфоцитарный ряд клеток. То есть атипичные клетки появляются среди лимфоцитов, они обладают похожим строением, однако утрачивают главную функцию – обеспечение иммунной защиты организма. По мере вытеснения такими клетками нормальных лимфоцитов снижается иммунитет, а значит, организм становится всё более беззащитным перед огромным количеством вредных факторов, инфекций и бактерий, окружающих его каждый день.
Причины хронического лимфолейкоза
На сегодняшний день основной теорией появления хронического лимфолейкоза остаётся генетическая.Учёные выяснили, что по мере развития заболевания в хромосомах лимфоцитов происходят определённые изменения, связанные с их бесконтрольным делением и ростом. По этой же причине при клеточном анализе выявляется разнообразие клеточных вариантов лимфоцитов.
К хроническому лимфолейкозу существует предрасположенность, которая передаётся по наследству. Хотя учёные до сих пор не установили точный набор генов, повреждённых при данном заболевании, статистика показывает, что в семье, где выявлен по крайней мере один случай хронического лимфолейкоза, риск заболевания у родственников возрастает в 7 раз.
Симптомы хронического лимфолейкоза

На начальных стадиях заболевания симптомы практически не проявляются. Болезнь может развиваться годами бессимптомно, лишь с некоторыми изменениями общего анализа крови. Количество лейкоцитов на ранних этапах заболевания колеблется в пределах верхней границы нормы.
Самые первые признаки обычно неспецифичны для хронического лимфолейкоза, они представляют собой общие симптомы, сопровождающие многие заболевания: слабость, утомляемость, общее недомогание, потеря веса, повышенная потливость. С развитием болезни проявляются более характерные для неё признаки.
Диагностика хронического лимфолейкоза
Лечение хроническоголимфолейкоза

К сожалению, хроническийлимфолейкоз не является излечимым заболеванием, однако при своевременной постановке диагноза и правильно подобранной терапии длительность и качество жизни больных можно значительно улучшить. Тем не менее, даже при самом качественном лечении, эта болезнь сохраняет способность к медленному прогрессированию.
Начальные стадии заболевания не требуют специального лечения. На этом этапе состояние больного находится под постоянным наблюдением врача-гематолога. При стабильном медленном течении больной может чувствовать себя хорошо без приёма каких-либо препаратов. Показанием к началу медикаментозной терапии является значительное прогрессирование болезни (рост количества лимфоцитов в крови, увеличение лимфатических узлов или селезёнки), ухудшение состояния больного, появление осложнений.
Удаление селезёнки является малоэффективным, но применяемым методом при наличии выраженной цитопении в общем анализе крови, отсутствии эффективности лечения глюкокортикоидами, а также при увеличении самой селезёнки до значительных размеров.
Прогноз при хроническомлимфолейкозе
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
- Причины острого лимфобластного лейкоза
- Симптомы острого лимфобластного лейкоза
- Диагностика острого лимфобластного лейкоза
- Лечение и прогноз при остром лимфобластном лейкозе
- Цены на лечение
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей. У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Читайте также:

