Лечение рака почки локализованного

В последние годы рак почки занимает одно из ведущих мест по темпам прироста среди онкоурологических заболеваний и составляет 3% от всех злокачественных новообразований. Общий прирост заболеваемости в странах объединенной Европы ежегодно составляет 2%. Стандартизированный показатель заболеваемости населения России злокачественными опухолями составляет 7,54. В структуре смертности населения России от онкологических заболеваний рак почки среди мужчин составляет 2,7%, среди женщин – 2,1%. В США ежегодно регистрируется 30 тыс. новых случаев заболевания, при этом рак почки служит причиной смерти 12 тыс. человек.
Основным методом лечения больных раком почки является хирургический. Наиболее распространенным объемом хирургического лечения во всем мире является радикальная нефрэктомия. Благодаря совершенствованию диагностической техники, внедрению ультразвукового допплеровского картирования, методик тонкоигольной пункционной биопсии под контролем ультразвука, интраоперационной ультразвуковой диагностики, методик компьютерной томографии с 2D и 3D реконструкцией и контрастным усилением с каждым годом растет число больных с локализованным опухолевым процессом, когда возможно выполнение органосохраняющей операции с сохранением части функционирующей паренхимы почки. Локализованные стадии рака почки составляют 85% среди случайно выявленных опухолей почки. Основоположником органосохраняющего хирургического вмешательства при раке почки является Vermooten. С совершенствованием хирургической техники, внедрением в практику различных современных физических факторов воздействия на биологические ткани стало возможным удаление опухолей из любого отдела почечной паренхимы, с локализацией в области ворот почки, с вовлечением чашечно-лоханочной системы, что позволило расширить показания к органосохранному лечению больных локализованным раком почки.
В настоящее время абсолютными показаниями к резекции почки при локализованном раке почки являются:
- Опухолевое поражение единственной почки;
- Опухолевое поражение единственно функционирующей почки;
- Двустороннее опухолевое поражение почек;
- Опухолевое поражение почки при наличии почечной недостаточности.
Относительными показаниями к органосохранному лечению являются:
- Опухолевые образования менее 4 см в диаметре (Т1а) без инвазии чашечно-лоханочной системы;
- Поражение контрлатеральной почки хроническим неопухолевым процессом (пиелонефрит, гломерулонефрит, нефросклероз), который может привести в случае выполнения нефрэктомии по поводу опухолевого процесса на противоположной стороне к развитию почечной недостаточности;
- Мочекаменная болезнь, нарушение пуринового обмена, или другое неопухолевое поражение обеих почек (системное заболевание), которые могут привести к нарушению функции почек впоследствии с развитием почечной недостаточности.
Элективным показанием к резекции почки является:
- Опухолевые образования почки более 4 см в диаметре (Т1б-Т2), без признаков инвазии фасции Героты, при отсутствии данных за наличие метастазов.
Послеоперационные осложнения органосохранного лечения локализованного рака почки возникают в 8-15% случаев. Частыми осложнениями после выполнения органосохранного лечения рака почки являются: кровотечение (2%), формирование мочевого свища (17%), острая почечная недостаточность, развивающаяся после резекции единственной или единственно функционирующей почки (13%), инфекционные осложнения (3%).
5-летняя выживаемость больных локализованным раком почки после проведенного органосохраняющего лечения по данным различных авторов составляет 82 - 100% и соответствует результатам органоуносящего лечения (после нефрэктомии). Частота локальных рецидивов после резекции почки достигает 5,6 - 18%. 5-летняя выживаемость пациентов после резекции единственной почки по поводу локализованного рака - 87,5%.
Причинами развития местного рецидива являются: инвазия паранефральной клетчатки (большая стадия опухолевого процесса, глубина инвазии опухоли соответствует Т3), остаточная опухоль почечной паренхимы в связи с инвазией чашек почки, наличие опухолевого тромбоза интраренальных вен, а также мультицентричное опухолевое поражение почки, что встречается в 10-12% случаев.
Наиболее сложным и дискутабельным в настоящее время остается вопрос о необходимости органосохранного лечения у больных с размерами опухоли более 4 см (уровень инвазии опухоли соответствует Т1b и Т2), с локализацией опухоли в области почечного синуса (ворот почки), интрапаренхиматозными опухолями, каковы те критические расстояния от опухоли, каких должен придерживаться хирург планируя линию резекции почки, а также проблемы хирургического лечения при наличии единственной почки или единственно функционирующей почки.
На этапе предоперационной диагностики в институте хирургии им. А.В.Вишневского для решения вопроса о возможности выполнения резекции почки выполняется трансабдоминальное ультразвуковое исследование, цветовое допплеровское картирование, компьютерная томография почек с использованием 3D реконструкции и контрастным усилением, что позволяет определить локализацию опухолевого образования, отношение его к сосудистым структурам почки и магистральным сосудам, собирательной системе почки, наличие мультицентричного поражения почки.
Динамическая нефросцинтиграфия с непрямой ангиографией почек используется для оценки состояния клубочковой фильтрации. Данный метод исследования основан на определении функционального состояния почек путем регистрации активного поглощения почечной паренхимой меченых нефротропных соединений и выведение их по верхним отделам мочевых путей.
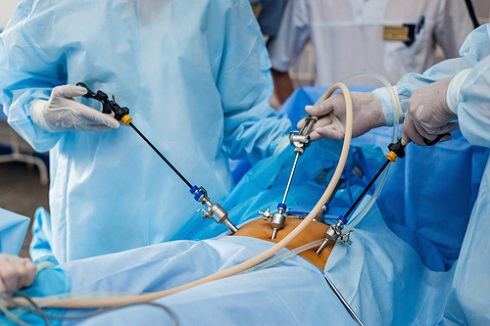
При выполнении резекции почки используется чрезбрюшинный доступ (косая лапаротомия или срединная лапаротомия).
операционных доступов: 1 – виды косой лапаротомии, 2 – проекция почки на боковую брюшную стенку, 3 – валик под спиной больного на уровне реберной дуги.
Положительными сторонами чрезбрюшинного доступа являются:
- Физиологическое положение больного,
- Возможность полной и широкой мобилизации почки и ее ножки,
- Возможность адекватной ревизии органов брюшной полости,
- Возможность выполнения лимфаденэктомии (парааортальной и паракавальной),
- Выделение и раздельная обработка почечных сосудов (почечных артерии и вены, добавочных сосудов почки, сегментарных сосудов).
Основными недостатками чрезбрюшинного доступа являются:
- Возможность развития пареза желудочно-кишечного тракта (по данным литературы риск развития составляет не более 3-5%);
- Риск развития послеоперационной грыжи (в современной литературе отмечена частота развития данного осложнения в 0,7-1,3%, преимущественно при косой лапаротомии и у больных после нефрэктомии);
- Возможность развития в раннем послеоперационном периоде эвентерации (0,5-0,8%), также отмечено у больных после нефрэктомии.
Для уточнения локализации опухоли и наличия инвазии чашечно-лоханочной системы почки выполняется интраоперационное ультразвуковое исследование паренхимы почки. Интраоперационное ультразвуковое исследование, по сравнению с трансабдоминальным, позволяет статистически достоверно определить степень местной распространенности процесса и характер изменений в забрюшинных лимфатических узлах. Чувствительность метода интраоперационной ультразвуковой диагностики составляет 97- 100%.
Для уменьшения кровоточивости тканей во время резекции почки применяются следующие приемы: пальцевое локальное пережатие паренхимы почки в зоне резекции или полная аноксия почки путем наложения сосудистого зажима на сосудистую ножку почки.
Резекция почки выполняется с использованием электроножа, ультразвукового скальпеля или ультразвукового диссектора. Среднее время ишемии почечной паренхимы при использовании сосудистых зажимов составляет не более 27-30 мин.
Во время операции производится ушивание резецированных сосудов почечной паренхимы и резецированных чашек почки с использованием рассасывающейся нити на атравматичной игле (викрил) отдельными узловыми швами с последующим лигированием почечной паренхимы.
Ушивание почечной паренхимы производится рассасывающимися нитями на атравматичной игле (викрил, максон), при этом используется шов, позволяющий не только сблизить края резецированной почки, но и выполнить дополнительное лигирование внутрипаренхиматозных сосудов почки, произвести дополнительный гемостаз паренхимы почки за счет дополнительной петли шва.
Зона резекции почки укрывается гемостатической сеткой или губкой, которая фиксируется отдельными узловыми швами к капсуле почки (монокрил или викрил).
В отдельных случаях требуется дооперационная и интраоперационная постановка мочеточникового стента. Оправданность постановки стента связана со снижением давления мочи в чашечно-лоханочной системе резецированной почки, лучшей эвакуацией мочи из зоны резекции. Однако наличие стента в мочеточнике в отдельных случаях не может предотвратить пузырно-мочеточниковый и соответственно лоханочный рефлюкс мочи, в связи с чем требуется катетеризация мочевого пузыря на время нахождения стента в мочеточнике.
Ниже приводим пример хирургического лечения больного раком почки с расположением опухоли в области ворот почки. Опухоль отдавливала ветвь почечной артерии, лоханку почки и среднюю группу чашек. На операции с учетом данных интраоперационного УЗИ не выявлено прямых признаков прорастания опухоли в вышеперечисленные структуры.
Выполнена резекция почки с резекцией средней группы чашек, парааортальная лимфаденэктомия и удаление клетчатки и лимфоузлов ворот левой почки.
Через 56 мес. после открытой резекции почки не выявлено данных за рецидив и отдаленное метастазирование опухоли, по данным нефросцинтиографии функция резецированной почки в пределах нормы.
Далее приводим пример хирургического лечения больной О., 47 лет по поводу рака левой почки I стадии Т1бN0М0 G2 с размерами опухоли более 5 см в диаметре, вовлекающей среднюю и верхнюю группу чашек.
Выполнена резекция почки с удалением верхней и резекцией средней группы чашек, потребовавшей пересечение и перевязки верхних и задних сегментарных сосудов почки. Через 18 мес. после резекции функция левой почки удовлетворительная, вклад данной почки в общий процесс фильтрации составил 20%. Признаков рецидива и метастазов не выявлено.
Экстракорпоральная резекция почки впервые выполнена в 1973 г. Calne, предложена для резекции почки с центральным расположением опухоли (в области ворот почки). Позволяет выполнить технически сложную резекцию почки в условиях длительной ишемии органа вне организма больного с последующей аутотрансплантацией почки в малый таз или ортотопическую трансплантацию почки. Операция проводится совместной бригадой хирургов: сосудистых хирургов и онкоурологов. Мировой опыт использования данной операции не является большим в связи с ограниченными показаниями к данному методу лечения, преимущественно при единственной почке или единственно функционирующей почке или в случае технически сложной резекции почки (внутрипаренхиматозная опухоль, опухоль с центральным (в области ворот) расположением), что требует применения длительной аноксии почки, а длительность тепловой аноксии почки ограничена 28 мин. (27-30 мин). Опыт нашей клиники позволяет выполнять резекции почки и при длительной тепловой ишемии органа от 50 мин и более, но требует применения специальных приемов оперирования. Для исключения опасности повреждения клубочкового аппарата почки при проведении аноксии разработан метод экстракорпоральной резекции с применением холодовой ишемии органа.

Лечение злокачественных новообразований направлено на то, чтобы полностью удалить или разрушить опухоль и все её метастазы. Такую терапию называют куративной. Если человека полностью вылечить уже нельзя, то предпринимаются меры по сдерживанию роста опухоли и улучшению качества жизни (паллиативная терапия).
Почки отвечают за вывод конечных продуктов обмена из организма.
Рак — это обобщающее название всех злокачественных новообразований (опухолей), которые возникают вследствие изменения генного материала клеток.
Диагностика проводится, чтобы подтвердить подозрение на рак и определить параметры опухоли.
Реабилитация и наблюдение являются важными составляющими лечения онкологических больных.
Раньше единственным методом лечения злокачественной опухоли почки было её полное удаление (радикальная нефрэктомия).
Однако сегодня для лечения этого заболевания зачастую выполняют органосохраняющие вмешательства (резекция почки). Это касается не только небольших опухолей и новообразований, локализующихся в корковом слое почки. Данный метод особенно важен для пациентов с одной почкой, так как им при удалении единственного оставшегося органа будет необходима систематическая фильтрацию крови (диализ).
Возможные доступы к почке во время операции:
- через брюшную полость (трансперитонеальный доступ);
- через грудную клетку (трансторакальный доступ);
- через межреберье (интеркостальный доступ);
- через боковую поверхность поясничной области (люмбальный доступ);
- минимально инвазивным методом (лапароскопически); для этого в брюшную полость через брюшную стенку с помощью несколько тонких пункционных приспособлений (троакаров) вводят инструменты и камеру, отслеживая каждое движение на мониторе;
- лапароскопическое робот-ассистированное вмешательство при помощи системы da Vinci.
Чаще всего используют интеркостальный и люмбальный доступы. Брюшная и грудная полость при этом остаются нетронутыми.
При нефрэктомии удаляют не только поражённую почку, но и окружающую её жировую капсулу, ограниченную фасцией Герота. Надпочечник удаляют в тех случаях, если он вовлечён в опухолевый процесс, поражён метастазами или если речь идёт о крупной опухоли в верхнем полюсе почки. Регионарные лимфатические узлы почки также могут быть удалены в диагностических целях, но этот этап операции не является обязательным и не улучшает прогноз.
При резекции почки часть органа с опухолью удаляют, захватывая прилегающую здоровую почечную ткань, так как в ней могут находиться невидимые глазу опухолевые клетки. В неоднозначных случаях в ходе операции проводят срочное гистологическое исследование удалённой ткани, чтобы выявить опухолевые клетки в линии резекции. Если их наличие подтверждается, хирург проводит повторную резекцию.
В ходе так называемой полюсной резекции намеренно перевязывают артерии и вены, снабжающие опухоль. В исключительных случаях поражённую почку сначала полностью удаляют, а иссечение опухоли затем проводят экстракорпорально, то есть вне организма. Почку промывают стерильным питательным раствором и имплантируют пациенту заново. Однако такие вмешательства проводят крайне редко.
Небольшие опухоли почки при определённых условиях могут быть разрушены при помощи криотерапии (воздействие низкими температурами). В ходе данной процедуры используют криозонды, которыми управляют лапароскопически, или под контролем КТ или МРТ. Риск рецидива после такого лечения составляет 5–10%.

При лечении рака почки используют также лазер, микроволны или фокусированный ультразвук высокой интенсивности. Данные методы лечения в настоящее время применяют только в рамках клинический исследований. Кроме того, к новым неинвазивным щадящим методам лечения относится стереотаксическая лучевая терапия, которую можно применять для лечения неоперабельных опухолей почки.
Если к моменту установления диагноза опухоль образовала метастазы в других органах, всё же может иметь смысл радикальное удаление повреждённой почки, поскольку это поможет продлить жизнь или период до появления новых опухолей в организме пациента.
Операция может предотвратить кровотечения, застой мочи и боли, вследствие чего повышается качество жизни пациента. Паллиативное удаление почки может улучшить результат последующего медикаментозного лечения.
Если обнаружены лишь единичные метастазы, например, в костях или лёгких, то их следует удалять оперативным путём. Это позволит улучшить качество жизни больного. Локальный рецидив опухоли также зачастую требует оперативного вмешательства.
В ходе эмболизации при помощи медицинского клея (гистоакрила), спирта или других препаратов происходит намеренная закупорка (эмболия) почечной артерии или кровеносного сосуда, питающего опухоль.
Данный метод паллиативной терапии в настоящее время применяют для лечения ослабленных пациентов с кровоточащими опухолями и сильными болями, а также в дополнение к радиочастотной абляции. У многих больных, несмотря на данную меру, злокачественный процесс возобновляется в течение 6 месяцев. В редких случаях этот метод может быть необходим перед операцией на крупных опухолях для предотвращения интраоперационного кровотечения. Кроме того, эмболизация используется при операциях по поводу костных метастазов.
Химиотерапия разрушает быстро делящиеся клетки. Медикаменты (цитостатические препараты) вмешиваются в процессы деления клеток и препятствуют их размножению. Кровь распространяет препараты по всему телу. Недостаток состоит в том, что они оказывают влияние и на здоровые быстро делящиеся клетки, в частности, клетки слизистых оболочек и корней волос, что обуславливает побочные эффекты.
Цитостатические препараты применяют по отдельности (монотерапия) или комбинировано по так называемым схемам.
Для изучения эффективности химиотерапии при лечении рака почки проводилось множество исследований, и результаты показывают, что данный метод помогает лишь немногим пациентам (менее 5%). Это объясняется наличием у большинства пациентов с раком почки так называемого гена MDR (Multi-Drug-Resistance), который делает опухолевые клетки невосприимчивыми к цитостатическим препаратам.

Рак почки является иммуногенным видом опухоли, то есть существует вероятность того, что организм справится с новообразованием своими силами: известны случаи, когда у некоторых больных (менее 1%) с прогрессирующей стадией заболевания организм излечился самостоятельно. Кроме того, у пациентов наблюдается ряд защитных реакций, направленных на борьбу с опухолью (иммунные реакции организма). Непосредственно в опухоли можно также найти большое количество клеток иммунной системы (T-лимфоциты).
Однако, данной иммунной защиты в большинстве случаев не хватает. Поэтому несколько лет назад для лечения рака почки была разработана так называемая иммунотерапия.
При создании этого вида лечения было исследовано большое количество различных веществ, и наиболее эффективными из них оказались цитокины (например, интерферон альфа) и интерлейкины (например, интерлейкин-2), которые часто применяют совместно. Данный метод лечения в 15% случаев ведёт к регрессу метастазов, а в некоторых случаях отмечается и полное выздоровление.
Однако такое лечение зачастую приводит к осложнениям и нередко заканчивается летальным исходом. Выраженность побочных эффектов, к которым относятся жар, озноб, боли в мышцах и суставах, потеря аппетита, веса, реже — развитие депрессии, заболевания миокарда, нарушение функции печени, зависит от дозы препарата.

Дендритные клетки выделяют из организма больного, в них помещают белки, свойственные опухоли (антигены), после чего вводят пациенту подкожно.
Ожидается, что в будущем дендритные клетки будут применять в различных целях: для усиления защитной реакции организма или для того, чтобы вызвать у пациента, страдающего аллергией, обратную реакцию, то есть подавить иммунный ответ организма на раздражающие вещества. Также дендритные клетки играют всё большую роль в борьбе со СПИДом.
Первые результаты клинических исследований дали положительные результаты, однако об окончательных выводах говорить пока рано.
Таргетная терапия разрешена к использованию с 2006 года. В рамках этого вида лечения применяют мультикиназные ингибиторы (сунитиниб, сорафениб или пазопаниб), ингибиторы mTOR (темсиролимус и эверолимус) или блокаторы ангиогенеза (бевацизумаб), которые останавливают рост опухолей, а в некоторых случаях даже приводят к уменьшению их размера, что, соответственно, продлевает жизнь пациента.
Побочные эффекты при таргетной терапии значительно слабее, чем при химиотерапии. К ним относят синдром хронической усталости, отслоение кожи на руках и ногах, повышение артериального давления, возможны кровотечения. К серьёзным осложнениям таргетная терапия приводит крайне редко.

В ходе лучевой терапии опухолевые клетки разрушаются под воздействием ионизирующего излучения. Оно вызывает изменения в клетках, и в то время как здоровые клетки в большинстве случаев восстанавливаются после таких воздействий, раковые клетки не могут справиться с лучевыми повреждениями, и поэтому погибают.
Опухоли в самой почке на лучевую терапию практически не реагируют, однако при наличии метастазов в костях этот метод может применяться для обезболивания, сокращения риска перелома или дальнейшего образования костных метастазов. Также лучевая терапия успешно используется в случае образования метастазов в головном мозге. При этом зачастую используют новейший метод — Кибер-нож.
Органосохраняющая операция (резекция опухоли)
Стандартные показания к проведению органпосохраняющего оперативного лечения можно разделить на следующие:
• абсолютные — единственная почка (анатомически или функционально);
• относительные — функционирующая контралатеральная почка, пораженная процессом, который может привести к ухудшению ее функций в будущем;
• элективные — локализованный рак почки при наличии здоровой контралатеральной почки.
Относительные показания включают также наследственные формы почечно-клеточного рака (ПКР), при которых существует высокий риск образования опухоли в контралатеральной почке.
При наличии элективных показаний осуществление органосохраняющего оперативного лечения для опухолей, ограниченных по диаметру (Т1а), приводит к достижению безрецидивных и отдаленных показателей выживаемости, сходных с теми, что наблюдают при выполнении радикального оперативного вмешательства. Проведение резекции почки при более крупных опухолях (Т1b) у тщательно отобранных пациентов оказалось эффективным и онкологически безопасным.
Однако у части больных локализованным ПКР осуществление органосохраняющей операции по ряду причин не представляется возможным.
К этим причинам относят следующие:
• местно-распространенный рост опухоли;
• невозможность выполнения резекции из-за неблагоприятного расположения опухоли;
• выраженные интеркуррентные заболевания.
Проведение адреналэктомии не показано в следующих ситуациях:
• выявление при осуществлении предоперационного стадирования (компьютераная томография (КТ), магнитно-резонансная томография (МРТ)) нормального надпочечника;
• отсутствие обнаруженных в ходе операции признаков узлов в надпочечнике, которые вызвали бы подозрения относительно наличия метастазов;
• отсутствие признаков непосредственной инвазии в надпочечник большой опухоли верхнего сегмента.
Выполнение расширенной или радикальной диссекции лимфатических узлов, как оказалось, не способствует улучшению отдаленной выживаемости после осуществления нефрэктомии по поводу опухоли.
Таким образом, в целях стадирования диссекция лимфатических узлов может быть ограничена областью почечных ворот (регионарные лимфатические узлы). Пациентам с пальпируемыми или увеличенными по данным КТ лимфатическими узлами для осуществления адекватного стадирования опухолевого процесса следует выполнять удаление пораженных лимфатических узлов.
Частота осложнений при выполнении органосохраняющей операции несколько выше, но вес еще вполне допустима по сравнению с таковой, отмеченной при осуществлении радикальной нефрэктомии.
Органосохраняющее оперативное лечение, выполненное по абсолютным, а не по элективным показаниям, сопровождается более высокой частотой развития осложнений и местных рецидивов, что можно объяснить большим размером опухолей.
У больных со спорадической одиночной опухолью почки с максимальным диаметром 4-5 см и здоровой контралатеральной почкой функционирование этого органа в долгосрочном плане лучше поддерживается при проведении органосохраняющего оперативного лечения, нежели радикальной нефрэктомии.
Существуют убедительные указания на то, что вследствие лучшего сохранения функций почек органосохраняющее оперативное лечение в отличие от радикальной нефрэктомии приводит к улучшению выживаемости в целом. При полном удалении опухоли величина отступа от края резекции не влияет на вероятность возникновения местного рецидива.
Проведение расширенной лимфадеиэктомии не способствует улучшению выживаемости пациентов с ПКР, следовательно, она должна быть ограничена необходимой для стадирования диссекцией пальпируемых и увеличенных лимфатических узлов.
При наличии опухолевого тромба рак почки классифицируют как имеющий более высокую стадию, он характеризуется более высокой степенью клеточной анаплазии. Регионарные и отдаленные метастазы у больных с венозной инвазией встречаются в 2 раза чаше. Степень биологической агрессивности опухоли имеет большее прогностическое значение, чем краниальное распространение тромбоза нижней полой вены.
Органосохраняющис операции сопровождаются несколько более высокой частотой развития осложнений по сравнению с радикальным оперативным вмешательством. Однако, с онкологической точки зрения, выполнение органосохраняющих операций служит радикальным методом лечения. Таким образом, при наличии соответствующих технических возможностей органосохраняющее оперативное вмешательство можно рассматривать как стандартный метод лечения при почечно-клеточном раке в стадиях Т1a-b.
В долгосрочном плане проведение органосохраняющего лечения приводит к достижению лучших результатов в области сохранения функций почек, а также к меньшим показателям общей смертности и частоты развития сердечно-сосудистых осложнений.
Радикальная лапароскопическая нефрэктомия
Радикальная лапароскопическая нефрэктомия служит стандартным методом лечения больных с опухолями стадии Т2 и меньшими новообразованиями в почках, которые не могут быть вылечены с помощью органосохраняющей операции. С момента своего внедрения лапароскопическая нефрэктомия стала общепризнанным методом лечения рака почки во всем мире. Вне зависимости от доступа, ретро- или трансперитонеального, лапароскопическое вмешательство должно соответствовать общепринятым принципам выполнения открытой онкологической операции.
Данные по долговременным результатам показывают, что полученные при проведении радикальной лапароскопической нефрэктомии показатели выживаемости без признаков рака эквивалентны тем, которых достигают при осуществлении открытой радикальной нефрэктомии. Выполнение радикальной лапароскопической нефрэктомии сопровождается развитием меньшего количества осложнений по сравнению е таковым, получаемым при осуществлении открытой хирургии, хотя этот вывод основан на небольшом количестве исследований, в которых использовали стандартизованную оценку качества жизни.
Лапароскопическая резекция почки
При наличии у хирурга достаточного опыта выполнение лапароскопической резекции почки служит альтернативой проведению открытой операции у определенной категории больных. Оптимальным показанием к осуществлению органосохраняющей лапароскопической операции считают наличие периферической опухоли относительно малых размеров. При проведении лапароскопической резекции время ишемии в ходе операции больше, чем таковое при открытой операции. Функционирование почек в долгосрочном плане зависит от того, сколько времени длилась ишемия в ходе операции.
Лапароскопическая резекция почки при раке сопровождается несколько более высокой частотой развития осложнений по сравнению с таковой, достигаемой при проведении открытого оперативного вмешательства. Тем не менее полученные онкологические результаты в существующих сериях с ограниченным послеоперационным наблюдением, как выяснилось, сходны с теми, которых достигают при осуществлении открытых органосохраняющих операций. У больных с единственной почкой выполнение лапароскопической резекции приводит к длительной тепловой ишемии и более высокой частоте развития осложнений. Таким больным может потребоваться проведение временного или постоянного диализа.
Чрескожные методы
Предложенные альтернативы оперативному лечению ПКР включают чрескожные малоинвазивные процедуры, выполняемые под контролем средств визуализации, такие как чрескожная радиочастотная абляция, криоабляция, микроволновая и лазерная абляция, а также абляция сфокусированной ультразвуковой волной высокой интенсивности. Плюсы данных методов заключаются в меньшей травматичности, возможности проведения амбулаторного режима лечения и терапии у пациентов группы высокого хирургического риска.
Показания для применения минимально инвазивных методов:
• небольшие случайно обнаруженные новообразования в корковом веществе почек у пожилых пациентов;
• генетическая предрасположенность больных к развитию множественных опухолей;
• выявление у пациента двусторонних опухолей;
• наличие у больного единственной почки и высокий риск полной потери функций почки вследствие оперативного удаления опухоли.
Противопоказания к проведению указанных выше процедур:
• ожидаемый срок жизни 3 см или расположенных в области ворот почки, центральной собирательной системы или проксимального отдела мочеточника.
Абсолютные противопоказания:
• наличие необратимых коагулопатий;
• тяжелое общее состояние, например сепсис.
Перед применением аблятивных методов необходимо выполнить предварительную биопсию для выяснения гистологического характера новообразования почки. По сравнению с радиочастотной абляцией криоабляцию чаще осуществляют лапароскопически. Лапароскопический метод более эффективен, но при нем чаще возникают осложнения.
Проведение повторной абляции в основном требуется при осуществлении радиочастотной абляции. При проведении радиочастотной абляции частота местного рецидива опухоли значительно выше. Показатели специфической выживаемости, полученные при осуществлении криотерапии и радиочастотной абляции, хуже, чем те же показатели, достигнутые в результате выполнения резекции почки.
Существующие данные свидетельствуют о том, что осуществление адъювантной вакцинации антигенами собственной опухоли может способствовать снижению риска возникновения рецидива после выполнения нефрэктомии в подгруппе больных раком почки стадии Т3, однако необходимо проведение дальнейших исследований влияния данной терапии на ОВ.
Применение прогностических алгоритмов, возможно, позволит выявить пациентов, у которых адъювантная вакцинация окажется наиболее эффективным методом лечения. Проведение адъювантной терапии цитокинами пациентам после выполнения у них нефрэктомии не способствует улучшению выживаемости последних. Вне рамок клинических исследований проведение адъювантной терапии после осуществления радикального хирургического лечения рака почки не показано.
Оперативное лечение метастатического рака почки (паллиативная нефрэктомия)
Проведение нефрэктомии в сочетании с назначением интерферона альфа способствует повышению выживаемости у больных метастатическим раком почки, находящихся в удовлетворительном общем состоянии, В настоящее время существуют лишь ограниченные данные относительно ценности использования циторедуктивной нефрэктомии в сочетании с таргетной терапией.
Использование системной терапии при метастатическом почечно-клеточном раке
Интерферон альфа в монорежиме ив сочетании с бевацизумабом
В ходе проведения рандомизированных исследований отмечена более высокая эффективность применения при метастатическом ПКР интерферона альфа. В то же время частота ответа на лечение интерфероном альфа составила 6-15% со снижением риска прогрессирования на 25% и небольшим улучшением спецефической выживаемости на 3-5 мес по сравнению с данными показателями, полученными при использовании плацебо.
Эффективное применение интерферона альфа отмечено у пациентов с метастазирующим светлоклеточным вариантом рака почки, низкими критериями риска и наличием только легочных метастазов. В проведенном недавно исследовании продемонстрировано, что применение интерферона альфа в сочетании с бевацизумабом в первой линии способствует увеличению частоты достижения ответа и времени до прогрессирования по сравнению с показателями, полученными при проведении монотерапии интерфероном альфа.
Во всех проведенных недавно рандомизированных испытаниях таргентых препаратов (сунитиниб, интерферон альфа в сочетании с бевацизумабом, темсиролимус), используемых в качестве терапии первой линии, продемонстрировано их преимущество по сравнению с монотерапией интерфероном альфа.
Таким образом, подводя итог, можно сказать следующее:
• Проведение монотерапии интерфероном альфа более не рекомендовано в качестве лечения первой линии метастатического рака почки.
• Применение монотерапии интерфероном альфа в определенных случаях (хорошее общее состояние, рак светлоклеточного типа, наличие только легочных метастазов) целесообразно и эффективно.
• Применение интерферона альфа в сочетании с бевацизумабом в первой линии терапии способствует увеличению частоты достижения ответов и времени до прогрессирования по сравнению с показателями, полученными при проведении монотерапии интерфероном альфа.
Интерлейкин-2 применяют для лечения рака почки с метастазами с 19S5 г., частота получения ответа при его использовании варьирует от 7 до 27%.
Оптимальная схема лечения интерлейкином-2 на сегодняшний день пока не установлена, однако назначение высоких доз препарата в болюсном режиме способствует достижению длительных (>10 лет) полных ответов у некоторых больных метастатическим раком почки. Побочные эффекты при терапии интерлейкином-2 значительно более выражены, чем при лечении интерфероном альфа.
Ответ на иммунотерапию отмечают только у пациентов со светлоклеточным почечно-клеточным раком:
• Побочные эффекты, возникающие при использовании интерлекина-2, более выражены по сравнению с таковыми, отмечающимися при применении интерферона альфа.
• У ограниченного числа больных использование интерлейкина-2 в высоких дозах позволяет добиться длительного полного ответа.
• Применение интерлейкина-2 возможно в качестве средства монотерапии у ограниченного количества больных с хорошим прогнозом.
Таргетная терапия
Последние достижения в области молекулярной биологии привели к созданию нескольких новых препаратов, используемых для лечения метастатического ПКР.
В процессе канцерогенеза при спорадическом почечно-клеточном раке происходит накопление фактора, индуцируемого гипоксией, вследствие инактивации гена фон Хиппе-ля-Линдау, приводящее к гиперэкспрессии VEGF и тромбоцитарного фактора роста, каждый из которых участвует в активации неоангиогенсза. Данный процесс играет важную роль в развитии и прогрессировании ПКР.
На сегодняшний день в России для лечения метастатического рака почки разрешены к применению следующие таргетные препараты:
• сорафениб (некеавар®);
• сунитиниб (сутент®);
• бевацизумаб (авастин®) в комбинации с интерфероном альфа;
• пазопаниб (вотриент®);
• темсиролимус (торизел®);
• эверолимус (афинитор®).
Продолжаются исследования эффективности и других новых ангиангиогенных препаратов, а также сочетаний их друг с другом и с цитокинами.
Сорафениб — мультикиназный ингибитор для приема внутрь, угнетающий активность серин/треониновой киназы Rafl, BRaf, рецепторов VEGF2 и тромбоцитарного фактора роста, FMS-подобной тирозинкиназы-3 и cKIT. В исследовании III фазы сравнивали эффективность применения сорафениба и плацебо после прогрессирования, отмеченного на фоне проведения предыдущей системной иммунотерапии (или у больных, которым невозможно проводить иммунотерапию).
По результатам исследования было установлено, что выживаемость без прогрессирования в случае применения сорафениба была на 3 мес больше. Выживаемость имела тенденцию к увеличению и в группе больных, получавших сначала плацебо, а затем сорафепиб.
По результатам исследования (Sablin М.Р. et al., 2007) по последовательному применению сорафениба и сунитиниба в первой группе и сунитипиба с последующим применением сорафениба во второй группе показано преимущество последовательного применения сорафениба, а затем сунитиниба.
Сунитиниб — ингибитор оксиндолъной тирозинкиназы. Данный препарат селективно подавляет рецепторы тромбоцитарного фактора роста, VEGF, с-КТТ и FMS-подобной тирозинкиназы-3, обладает противоопухолевой и антиангиогенной активностью. В исследованиях II фазы, проведенных у больных метастатическим раком почки, которые получали моногерапию сунитинибом во второй линии, частичный ответ зарегистрирован в 34-40% случаев, а в 27-29% наблюдений зафиксировано отсутствие прогрессирования в течение >3 мес,
В проведенном недавно исследовании III фазы время до прогрессирования при монотерапии сунитинибом в первой линии было выше, чем при ионотерапии интерфероном альфа (11 против 5 мес соответственно, р
Наиболее часто приходится дифференцировать опухоль от солитарной кисты почки, тем более что оба заболевания иногда сочетаются. В дифференциальной диагностике опухоли и кисты почки может оказать помощь нефротомография, при которой опухоль почки контрастируется, а киста отличается пониженной контрастн.
При осмотре и пальпации выявляются обычно опухоли почки в далеко зашедшей стадии. О большой опухоли почки свидетельствует деформация живота. Осмотр может выявить варикоцеле, а при обструкции нижней полой вены — расширение вен передней брюшной стенки, отечность нижних конечностей.
Поскольку опухоли почечной паренхимы и опухоли лоханки во многом отличаются как по структуре, так и по путям распространения и требуют различных оперативных методов лечения, оправданно их выделение в отдельные группы. В настоящее время принята следующая классификация опухолей почки.
Опухолевые заболевания почки разделяются на доброкачественные и злокачественные. Почечно-клеточный рак возникает из проксимального изогнутого канальца нефрона, является самым частым видом опухоли почки и составляет около 3% в структуре всех злокачественных заболеваний. Частота заболеваемости ежегодн.
Эпителиальные опухоли почечной лоханки и мочеточника представляют собой особую группу новообразований, значительно отличающихся от опухолей паренхимы почки как по клиническому течению, так и по методам лечения. Опухоли лоханки встречаются гораздо реже, чем опухоли почечной паренхимы, составляя приме.
Опухоль Вильмса встречается у детей любого возраста, начиная с новорожденного, но наиболее часто — в возрасте 2—7 лет. Девочки и мальчики заболевают с одинаковой частотой. У 5% больных опухоль Вильмса бывает двусторонней, как правило, у детей раннего возраста. Нередко у ребенка диагностируется.
В диагностике заболеваний почек, предстательной железы, яичка и его придатка, а также семенного пузырька нередко решающее значение приобретает пункционная биопсия. Пункционная биопсия почки может быть открытой и закрытой. Открытую биопсию почки производят при ее обнажении во время операции или специ.
Читайте также:

