Лечение рака мочевого пузыря комбинированное
Цель исследования: Целью исследования явилась оценка эффективности применения фотодинамической терапии вместе с трансуретральной резекцией при лечении 36 больных поверхностным раком мочевого пузыря. В качестве фотосенсибилизатора использовали фотодитазин в средней дозе 0,8 мг/кг массы тела. Время экспозиции составляло от 12 до 48 минут. Рецидивирование опухолевого процесса в первые 12 месяцев после проведенного лечения отмечено только у 4 (11,1 %) больных, что расценено как положительный результат.
Ключевые слова: поверхностный рак мочевого пузыря, фотодинамическая терапия, фотодитазин.
Введение
Рак мочевого пузыря (РМП) является актуальной проблемой онкоурологии. Это связано, прежде всего, с высокими показателями заболеваемости и смертности от данной патологии. Ежегодно в мире регистрируют до 200 тыс. новых случаев РМП. В России в 2009 году выявлено 13 260 новых случаев РМП у мужчин, стандартизованный показатель заболеваемости составил 12,18 на 100 тыс. мужского населения. У женщин в 2009 году отмечено 2828 случаев РМП, стандартизованный показатель заболеваемости составил 1,82 на 100 тыс. женского населения [3].
РМП характеризуют прогрессирующее течение и склонность к рецидивированию. В качестве стандартного опера тивного вмешательства при лечении поверхностного РМП в настоящее время рассматривают транс уретральную резекцию стенки мочевого пузыря (ТУР). Однако вероятность возникновения рецидива опухоли после ТУР достаточно высока и в среднем составляет 50 %, при этом примерно половина рецидивов развиваются в течение первого года после операции [1, 11]. Рецидивы после трансуретральной резекции поверхностного РМП выявляют у 30 % больных при наличии одиночной опухоли и у 90 % пациентов при мультифокальном поражении мочевого пузыря [10]. Прогрессирование заболевания и развитие мышечно-инвазивного РМП отмечено у 15 % больных с опухолями стадии Та и у 33 % больных с опухолями стадии Т1. В зависимости от размера опухоли прогрессирование регистрируют в 10 % случаев при опухолях менее 3 см и в 35 % — при размерах опухоли более 3 см [4, 5]. В связи с высокой частотой возникновения рецидивов и прогрессирования поверхностного РМП полное излечение пациентов представляется весьма трудной задачей. В связи с этим важное значение приобретают мероприятия, направленные на профилактику рецидивов опухолевого процесса после ТУР. Основными направлениями адъювантного лечения являются внутрипузырная химиотерапия, иммунотерапия, фотодинамическая терапия (ФДТ), позволяющие уменьшить вероятность рецидивирования РМП в среднем на 20 % [2, 6].
В настоящее время ФДТ применяют в качестве первичного, противорецидивного, паллиативного лечения, а также в комбинации с традиционными методами лечения. При поверхностных формах опухолей мочевого пузыря ФДТ применяют в качестве основной или адъювантной терапии. Для проведения ФДТ предпочтение отдают фотосенсибилизаторам второго поколения. Последние являются производными хлорина Е6 и обладают мощной полосой поглощения в длинноволновой красной области спектра. К препаратам данной группы относится фотодитазин. Исходным сырьем для производства фотодитазина является микроводоросль Spirulina platensis. Препарат создан на основе производных хлорофилла А и характеризуется свойствами, существенно отличающимися от наиболее известных зарубежных и отечественных аналогов. Фотодитазин хорошо растворяется в воде и не образует агрегированных форм, характерных для производных гематопорфирина. Способность фотодитазина связываться с клеточными мембранами опухолевых клеток обусловливает его высокую фотодинамическую активность. Фотосенсибилизатор более интенсивно накапливается в активно делящихся клетках. Максимум накопления в опухоли наступает через 1,5–2 часа после введения препарата в организм человека. Индекс контрастности по отношению к окружающей нормальной ткани при этом составляет более 10.
Для проведения ФДТ при опухолях мочевого пузыря необходимо следующее оборудование: стандартный цистоскоп с прямым рабочим каналом 6Ch или катетеризационный цистоскоп, фиброоптичес кое волокно, эндоскопическая стойка, источник света. Важными характеристиками лазерных установок являются выходная мощность, время выхода на рабочий режим, гарантированное количество часов работы. В этом отношении не оспоримыми преимуществами обладают диодные лазеры. Они портативны, экономичны, не требуют водяного охлаждения, питаются от обычной электрической сети с напряжением 220 вольт и имеют гарантированный длительный период работы. Для проведения света от лазерной установки к опухоли используют кварцевые моноволоконные световоды длиной от 1,5 до 3 метров и диаметром 6Ch. В зависимости от характера отражения выделяют световоды с прямым и боковым отражением света. В качестве диффузора используют цилиндрический и сферический диффузоры.
Длительность светового воздействия при ФДТ рассчитывается, исходя из заданной, эмпирически подобранной эффективной дозы световой энергии (Е). Для фотодинамической терапии опухолей мочевого пузыря эта величина находится в диапазоне 300–600 Дж/см 2. Выходная мощность на конце световода во время ФДТ составляет 1–2 Вт.
Целью настоящего исследования явилась оценка эффективности применения ФДТ вместе с ТУР при лечении больных с поверхностным РМП.
Пациенты и методы исследования
Под наблюдением в урологической клинике СПбГМУ имени акад. И. П. Павлова находились 36 больных с поверхностным РМП. Среди наблюдаемых больных были 21 мужчина и 15 женщин. Возраст пациентов составил в среднем 60,5 ± 8,5 лет и находился в диапазоне от 42 до 80 лет. Всем больным проводили стандартное урологическое обследование, включавшее в себя сбор анамнеза, физикальное обследование, лабораторные исследования, в том числе цитологический анализ мочи, цистоскопию, УЗИ, КТ или МРТ. Диагноз РМП верифицировали гистологически при исследовании образцов ткани из измененных участков стенки мочевого пузыря. При цистоскопии определяли размеры опухоли, характер роста (экзофитный или стелящийся) и количество опухолевых очагов. При УЗИ КТ или МТР оценивали размер и глубину инвазии опухоли.
За 1,5 часа до начала трансуретральной резекции внутривенно капельно пациентам в условиях полутемного помещения вводили препарат фотодитазин из расчета 0,5–1,5 мг/кг массы тела. Доза фотосенсибилизатора рассчитывалась для каждого больного индивидуально и зависела не только от его массы тела, но и от размера и характера опухоли мочевого пузыря. В среднем доза фотодитазина составляла 0,8 мг/кг массы тела. Непосредственно перед введением раствор фотодитазина разводили в 0,9 % растворе NaCl в соотношении 1 : 4. Инфузию препарата осуществлял врач или медицинская сестра в его присутствии. Под спинальной анестезией проводилась ТУР опухоли мочевого пузыря до глубокого мышечного слоя, а затем под визуальным контролем проводили локальное облучение зоны резекции и окружающих тканей лазером. Доза световой энергии составляла от 300 до 600 Дж/см 2, а мощность излучения — от 1 до 2 Вт. После завершения вмешательства мочевой пузырь дренировали уретральным катетером. Продолжительность сеанса ФДТ находилась в интервале от 12 до 48 минут и находилась в прямой зависимости от площади облучаемой поверхности, что, в свою очередь, определялось размером опухоли.
Время лазерного воздействия на опухолевую ткань рассчитывали по формуле:
t = Е × S/P;
где t — время экспозиции, с; E — эффективная доза световой энергии, Дж/см 2; S — площадь поверхности опухоли, см 2; Р — мощность на конце световода Вт, с.
Поскольку фотодитазин выводится из организма в течение 28 часов после введения, больные после проведения ФДТ из-за возможной реакции кожи на свет в течение этого времени находились в специально оборудованной затемненной палате.
С целью оценки эффективности комбинированного лечения и выявления рецидивов РМП после операции больным каждые 3 месяца выполняли цистоскопию и цитологическое исследование мочи и каждые 6 месяцев — ультразвуковое исследование мочевого пузыря.
Результаты и обсуждение
Результаты дооперационного обследования позволили оценить особенности клинических проявлений РМП у наблюдаемых нами больных. Один опухолевый очаг был выявлен у 23 (63,9 %) больных, от 2 до 4 опухолевых очагов — у 11 (30,5 %) больных, 5 и более опухолевых очагов — у 2 (5,6 %) пациентов. Опухоль размерами 3 см и менее обнаружена у 24 (66,7 %), а более 3 см — у 12 (33,3 %) больных. У всех обследованных больных диагнос тирован поверхностный РМП. При этом папиллярная опухоль, не прорастающая в собственную пластинку (стадия Та), выявлена у 9 (25 %), а наличие опухолевой инвазии в субэпителиальную основу (стадия Т1) — у 27 (75 %) пациентов. Степень дифференцировки опухоли была высокой (G-1) у 23 (63,9 %) больных, умеренной (G-2) — у 10 (27,8 %) больных, низкой (G-3) — у 5 (8,3 %) больных. Чаще всего у наблюдаемых нами пациентов мы выявляли высокодифференцированные одиночные опухоли стадии Т1 и размером до 3 см.
В раннем послеоперационном периоде после удаления уретрального катетера у всех больных отмечено учащенное, болезненное мочеиспускание в течение 1–3 суток. Макрогематурия зафиксирована у 3 больных (8,3 %) в первые сутки после операции. В дальнейшем ни у одного из пациентов макрогематурию не наблюдали. Проявлений системной токсичности фотодитазина в виде гиперемии или фотодерматита также отмечено не было.
Все пациенты находились под наблюдением по крайней мере 12 месяцев после операции, поэтому этот срок взят для анализа частоты рецидивирования РМП. Наибольший срок наблюдения на сегодняшний день составляет 18 месяцев после комбинированного лечения.
Рецидивы РМП отмечены у 4 (11,1 %) из 36 находившихся под наблюдением больных. Рецидивы РМП были выявлены при контрольных обследованиях на сроках 9 и 12 месяцев после операции. Отмечено, что рецидивирование опухолевого процесса после комбинированного лечения РМП происходило у больных с изначально множественными очагами опухоли, умеренной или низкой дифференцировкой опухолевой ткани и при опухолях большого объема. В настоящем исследовании мы не смогли выявить связь между временем экспозиции и дозой фотосенсибилизатора, с одной стороны, и вероятностью рецидива опухоли мочевого пузыря с другой. Это связано, по-видимому, с недостаточно большим количеством наблюдаемых пациентов.
Заключение
Результаты проведенного исследования показали целесообразность применения ФДТ вместе с трансуретральной резекцией при комбинированном лечении поверхностного РМП. В течение 1-го года после операции у 88,9 % пациентов не выявлено рецидивирования опухолевого процесса. Продолжение исследований в данном направлении представляется весьма перспективным.
Список литературы
1. Мартов А. Г., Сысоев П. А., Гущин Б. Я. Сравнительные резуль таты ТУР и электровапоризации при поверхностном раке мо чевого пузыря / Материалы 4й Всероссийской науч.практич. конф. 2001. С. 68–69.
2. Русаков И. Г., Быстров A. A. Хирургическое лечение, химио и иммунотерапия больных поверхностным раком мочевого пузыря // Практическая онкология. 2003. № 4. С. 214–224.
3. Чиссов В. И., Старинский В. В., Петрова Г. В. Состояние он кологической помощи населению России в 2009. М., 2010. 196 c.
4. Botteman M. F., Pashos C. L., Hauser R. S. et al. Quality of life as pects of bladder cancer: a review of the literature // Qual Life Res. 2003. Vol. 12, N 6. P. 675–688.
5. Dalbagni G. The management of superficial bladder cancer // Nat. Clin. Pract. Urol. 2007. Vol. 4, N 5. P. 254–260.
6. Dougherty T. J. Gomer C., Henderson B. et al. Photodynamic therapy [Review] // J. Natl. Cancer Inst. 1998. Vol. 90, N 12. P. 889–905.
7. Henderson B. W., Dougherty T. J. How does photodynam ic therapy work? // Photochem. Photobiol. 1992. N 55. P. 145–157.
8. Kelly J. F., Snell M. E., Berenbaum M. C. Photodynamic de struction of human bladder carcinoma // Br. J. Cancer. 1975. N 31. P. 237.
9. Kelly J. F., Snell M.E. Hematoporphyrin derivative: A possible aid in the diagnosis and therapy of carcinoma of the bladder // J. Urol. 1976. Vol. 115. P. 150–151.
10. Lindemann-Docter K., Knuchel-Clarke R. Histopathology of uro thelial carcinomas: crucial for patient management // Urologe A. 2008. Vol. 47, N 5. P. 627–638.
11. Parekh D. J., Bochner B. H., Dalbagni G. Superficial and mus cleinvasive bladder cancer: principles of management for outcomes assessments // J. Clin. Oncol. 2006. Vol. 24, N 35. P. 5519–5527.
Experience of application of photodynamic therapy in the combined treatment of superficial bladder cancer
Slesarevskaya M. N., Sokolov A. V.
Summary. The aim of the study was to evaluate the efficacy of photodynamic therapy and transurethral resection in the combined treatment of 36 patients with superficial bladder cancer. As a photosensitizer was used Photoditazine in average dose of 0.8 mg/kg body weight. Exposure time was from 12 to 48 minutes. Tumor recurrence in the first 12 months after treatment was observed in 4 (11.1%) patients, which is regarded by us as a perfectly acceptable.
Key words: superficial bladder cancer; photodynamic therapy; Photoditazine.
Высокая послеоперационная летальность (15-50%) после цистэктомии, а также большое количество осложнений различных методов деривации мочи и связанные с этим серьезные проблемы дальнейшей социальной реабилитации пациентов служат стимулом для выполнения органосохраняющих операций при раке мочевого пузыря (РМП).
Основным принципом их применения при мышечно-инвазивной опухоли является то, что эти операции должны выполняться как один из этапов комбинированного лечения, т.е. лечение необходимо дополнить неоадъювантной и/или адъювантной системной химиотерапией и/или лучевой терапией (ЛТ).
Трансуретральная резекция мочевого пузыря
Трансуретральная резекция (ТУР) мочевого пузыря (МП) широко применяется при лечении поверхностного РМП, однако в последнее время используется рядом авторов и при инвазивных новообразованиях. Данное оперативное вмешательство, как правило, является первым этапом в диагностике и лечении этого заболевания и носит лечебно-диагностический характер, его основная цель — максимально радикально удалить имеющуюся опухоль и установить стадию заболевания. Анализ достаточного количества гистологического материала, полученного при ТУР, дает возможность определить дальнейшую тактику лечения больного.
Решающими моментами в выборе тактики ведения пациента и прогнозирования дальнейшего развития заболевания являются прежде всего гистологическое заключение о строении опухоли и степени ее дифференцировки (категория G), а также глубина инвазии в стенку МП (категория Т). Однако существует ряд моментов, сдерживающих применение трансуретральная резекция при инвазивном раке. В первую очередь к ним следует отнести невозможность гарантированно удалить всю опухоль.
При инфильтративном росте всегда существует вероятность оставить резидуальную опухолевую ткань в макроскопически неизмененных участках стенки МП. Если применение ТУР при стадии заболевания T2а, т.е. новообразовании, инфильтрирующем внутреннюю половину мышечного слоя, при отрицательной биопсии из ложа опухоли можно считать радикальным, то при распространении заболевания на всю толщу стенки МП (Т2b), а тем более за ее пределы радикальность выполнения данного оперативного вмешательства представляется сомнительной.
Другим отрицательным моментом является то. что при этой операции не удаляются регионарные лимфатические узлы, довольно часто поражаемые метастазами инвазивного РМП (до 10% при стадии Т2, до 37% случаев при стадии Т3). Нередко использование метода ТУР при мышечно-инвазивной опухоли может быть ограничено локализацией в труднодоступных участках мочевого пузыря и размерами образования, степенью инвазии в стенку органа, мультифокальностью и распространенностью онкологического заболевания, а также зависит от наличия сопутствующей CIS.
В настоящий момент не существует однозначного мнения в отношении показаний к трансуретральной резекции при инвазивном раке мочевого пузыря, Некоторые урологи считают ТУР основным методом лечения при стадии заболевания Т2. Другие исследователи считают возможным выполнять ТУР только при высокой и умеренной степенях дифференцировки (Gr G2) в стадии Т2, предполагая необходимость выполнения цистэктомии при низкодифференцированных опухолях и считая, что трансуретральные оперативные вмешательства при стадии Т3 носят лишь паллиативный характер.
Присутствие рака in situ не считается противопоказанием, но подчеркивается необходимость адъювантной БЦЖ-терапии и более тщательного наблюдения. По данным различных авторов в 40% случаев трансуретральной резекции выявляет первоначально заниженную степень инвазии опухоли в стенку МП.
Техника ТУР при мышечно-инвазивном РМП заключается в следующем (рис. 3.58-3.60).

Рис. 3.58. Цистоскопия. Инвазивная опухоль мочевого пузыря (рТ2в)

Рис. 3.59. ТУР-биопсия мышечного слоя (основание опухоли). Удалена опухоль
Предварительно эндоскопическими щипцами выполняется биопсия экзофитной части и основания опухоли. После этого первым этапом осуществляется трансуретральная резекция экзофитного компонента опухоли путем горизонтальной или вертикальной резекции, затем выполняется полная резекция видимых участков поражения, включая послойную глубокую биопсию основания опухоли.
При ТУР боковых стенок вводятся миорелаксанты короткого действия для предотвращения возможной неконтролируемой перфорации стенки МП в результате синдрома запирательного нерва. В случаях сдавления или прорастания опухолью мочеточникового устья выполняется его резекция с катетеризацией (стентированием) соответствующего мочеточника.
Во всех случаях экзофитную часть удаленной опухоли и резецированные фрагменты стенки МП маркируют для гистологического исследования раздельно. При множественном росте материал от каждого опухолевого образования подлежит раздельной маркировке. После удаления видимых опухолей обязательно выполняется полифокальная биопсия остальных участков стенки МП для возможной верификации CIS. Операция заканчивается визуальным контролем и дренированием мочевого пузыря катетером Фолея, в ряде случаев с применением ирригационной системы.
В течение нескольких лет ведутся дискуссии о целесообразности применения в качестве лечебно-диагностического метода ранней повторной цистоскопии и ТУР-биопсии, широко известной в зарубежной литературе под названием second look TUR. Ранняя повторная цистоскопия и биопсия являются методом, позволяющим установить истинную стадию заболевания путем повторной трансуретральной резекции МП, таким образом она приобретает особое значение при определении дальнейшей тактики лечения инвазивного РМП. Среди ряда зарубежных урологических клиник пациентам с поверхностным раком мочевого пузыря введено в практику выполнение ранней повторной цистоскопии и ТУР-биопсии (second look TUR) в сроки от 2 до 8 нед после первой ТУР.
Хорошо известен тот факт, что переходно-клеточный рак в стадиях T1-T2 со степенью дифференцировки G2 и G3 склонен к прогрессивному течению заболевания. Поэтому многие авторы считают достаточно рискованным удлинять интервал между проведением контрольных цистоскопии у пациентов со степенью дифференцировки G2 и G3, предполагая тем самым выполнение ранней повторной цистоскопии и биопсии.
В одном из последних исследований, проведенном в больнице Memorial Sloan-Kettering, 170 пациентам как с поверхностным, так и с инвазивным РМП после первичного трансуретрального оперативного вмешательства была выполнена ранняя повторная цистоскопия и биопсия. При этом у 114 (76%) больных выявлены резидуальные опухоли.
В группе пациентов с поверхностным РМП (Та, Тis, Тx) рецидивы выявлены у 72 (75%) патентов, из которых у 28 (22%) обнаружены инвазивные опухоли. А у больных с первичным мышечно-инвазивным раком мочевого пузыря (стадия Т2) только у 12 (22%) при ранней повторной цистоскопии и биопсии не выявлено рецидивов заболевания.
Основываясь на результатах данного исследования, можно предположить, что трансуретральная резекция, выполненная в качестве монотерапии у пациентов с мышечно-инвазивным РМП, не может быть рассмотрена как стандартный алгоритм лечения этой категории больных. Таким образом, необходим строго дифференцированный подход у больных с мышечно-инвазивным РМП при выборе органосохраняющей оперативной тактики лечения.
Кроме того, возможно применение ТУР МП с паллиативной целью у неоперабельных больных. ТУР может быть выполнена у пациентов со стадией заболевания Т3a, у которых в результате неоадъювантной химиотерапии или химиолучевой терапии достигнута полная регрессия опухоли, подтвержденная данными повторной цистоскопии и биопсии, а также на основании гистологического исследования. Однако для однозначного решения вопроса о целесообразности трансуретральной резекции при инвазивном раке мочевого пузыря необходимо дальнейшее проведение рандомизированных исследований.
Резекция мочевого пузыря
Резекции МП нередко технически сложны и сопровождаются послеоперационными осложнениями у значительной части больных, но выбор уролога чаще продиктован несовершенством принятых методов деривации мочи и стремлением обеспечить пациенту приемлемое качество жизни, а не отсутствием желания выполнять радикальную цистэктомию.
В зарубежной практике урологи выполняют так называемую парциальную цистэктомию при инвазивном раке в случае первичного, солитарного поражения и при наличии возможности выполнения резекции стенки МП, отступив на 2 см от края опухоли. При этом необходимо выполнить биопсию из различных участков стенки мочевого пузыря.
Отечественные исследователи также считают, что эта операция может быть произведена при первичном поражении МП; при этом опухоль должна быть одиночной, локализованной на подвижных стенках МП и отстоять от шейки не менее чем на 3 см; размеры опухоли не должны превышать 5-6 см в диаметре; в окружающей макроскопически неизмененной слизистой оболочке и простатическом отделе уретры не должно быть рака in situ или тяжелых диспластических изменений.
Следует отметить, что при резекции МП необходимо удаление регионарных лимфатических узлов, так как при инвазивном раке увеличивается риск их поражения. Гистологическое исследование удаленных лимфатических узлов способствует правильному установлению стадии заболевания и решению вопроса о проведении дополнительного лечения после операций.
Только при соблюдении этих условий отдаленные результаты резекции мочевого пузыря не уступают таковым после радикальной цистэктомии. Исследования, основанные на вышеизложенных критериях отбора пациентов для выполнения резекции МП, показывают, что только 6-19% больных в последующем была выполнена радикальная цистэктомия. По данным РОНЦ РАМН, 5-летняя выживаемость больных инвазивным РМП после резекции составила 70,5%.
В зарубежной практике общая 5-летняя выживаемость варьирует от 25 до 60%, при этом уровень общего рецидивирования РМП составляет 40-78%. Рецидивы после выполнения резекции МП выявлены при стадии заболевания Т2 у 29% пациентов, при стадии Т3 в 33% и при стадии Т4 в 20% случаев. По данным М.Э. Ситдыковой и Э.Н. Ситдыкова, частота рецидивов также зависит от стадии рака мочевого пузыря. Она составляет 31,5% при стадии Т2 и 70,1% при опухолевой инвазии Есей толщи стенки МП. Авторы считают, что резекция мочевого пузыря является эффективным методом лечения при стадии Т2 и нерадикальна в стадии Т3.
С другой стороны, некоторые авторы полагают, что вышеперечисленные показания к резекции МП могут быть расширены у больных, получавших неоадъювантную химиотерапию с хорошим эффектом. Органосохраняющие техники могут использованы при центральной локализации опухоли, включая основание МП.
Некоторые урологи считают допустимой резекцию с реимплантацией устья мочеточника при расположении в данной зоне опухоли МП. Кроме того, некоторые авторы не считают противопоказанием наличие рака in situ в оставшейся слизистой оболочке или по краю резекции, так как данным больным после операции может быть проведена внутрипузырная БЦЖ-терапия. Насколько оправданы такие расширенные показания для выполнения резекции у больных с инвазивным РМП, должны показать последующие рандомизированные исследования.
Лучевая терапия
ЛТ — метод лечения злокачественных новообразований при помощи ионизирующего излучения, в основе которого лежит его повреждающее воздействие на злокачественные клетки, приводящее к их гибели. Лучевая терапия как радикальный метод лечения больных инвазивным РМП вызывает противоречивые суждения среди врачей и исследователей как в России, так и за рубежом. Неоднозначны результаты ЛТ и их интерпретация.
В литературе накопилось достаточно данных о положительных результатах — стойкой ремиссии заболевания и сохранности адекватной функции мочевого пузыря. Существующие мнения разнятся и зависят от наличия соответствующей оперативной или радиологической базы. Так, урологи США и Канады больше предпочитают оперативные пособия при мышечно-инвазивном раке мочевого пузыря. В Великобритании, напротив, лучевая терапия является стандартным методом лечения при данной стадии заболевания. Большинство специалистов все-таки предпочитают оперативные пособия ЛТ, которая редко используется в качестве первичного лечения инвазивного РМП.
Многие авторы полагают, что при соответствующих критериях отбора пациентов для ЛТ удается в 60-70% случаев достичь полной регрессии опухоли, сохранить функцию МП и обеспечить высокое качество жизни. При этом результаты лечения коррелируют с дозой облучения: чем выше подведенная доза, тем лучше ожидаемые результаты лечения. Однако следует отметить, что с увеличением дозы облучения возрастает вероятность возникновения как непосредственных, так и отсроченных (поздних) лучевых осложнений лечения.
Эффективность ответа на лучевую терапию выше при низкодифференцированных опухолях (G3). Местные рецидивы чаще развиваются у больных с меньшей степенью злокачественности опухоли В различных зарубежных исследованиях приводятся данные о 5-летней выживаемости практически 40% пациентов с инвазивным РМП после ЛТ. При этом уровень рецидивирования составляет 40-50%.
Отдаленные метастазы выявляются всего у 10% пациентов, 5-летняя выживаемость и уровень рецидивирования зависят от стадии заболевания. Так, при стадии Т 5-летняя выживаемость составляет приблизительно 20%, а уровень рецидивирования рака мочевого пузыря варьирует от 50 до 70%. Соответственно, при стадии заболевания Т4 5-летняя выживаемость больных составляет всего 10%.
Большинство авторов предлагают следующие критерии отбора пациентов для применения ЛТ в качестве первичного лечения инвазивного РМП: наличие папиллярной опухоли высокой степени дифференцировки меньше чем 5 см в диаметре. При этом предварительно выполненная ТУР перед началом облучения позволяет улучшить качество лечения.
Тем не менее результаты исследований ряда авторов о применении лучевой терапии в лечении инвазивного РМП остаются неутешительными. Holmang и соавт. сообщают о 74 пациентах с инвазивным раком мочевого пузыря, которым выполнялась ЛТ, В 84% случаев наблюдалось персистирование опухоли, рецидивирование и сморщивание МП. Средняя выживаемость пациентов со стадиями заболевания Т2 и T3 составила 16 мес, при этом наблюдался высокий уровень непосредственных и отсроченных осложнений лечения.
Из-за осложнений ЛТ, как ранних, так и поздних, умерли 7 (9,5%) больных. Отмечено, что наибольшая смертность была среди пациентов пожилого возраста (70-75 лет), а также при высокой дозе облучения — 65 Гр и выше. Наибольшая выживаемость была в группе больных, которым перед началом лучевой терапии была выполнена ТУР мочевого пузыря. Таким образом, результаты первичного применения ЛТ примерно одинаковы с результатами трансуретральной резекции МП, выполненной в качестве монотерапии инвазивного РМП.
В своем исследовании Montie приводит данные об улучшении результатов ЛТ на 10-20% при применении радиосенсибилизаторов (cisplatin) у больных с инвазивным РМП. Канадские исследователи сообщают о 104 пациентах, которым удалось вызвать клиническую ремиссию заболевания в 90% случаев путем комбинированного использования лучевой терапии и интраартериального введения цисплатина.
8 литературе, также приводятся данные о комбинированном использовании 1921г и экстракорпоральной ЛТ, что приводит к улучшению результатов лечения пациентов с инвазивным раком мочевого пузыря, но при этом значительно увеличивается токсичность и смертность. Так, Wijnmaalen и соавт. сообщают о 66 больных РМП в стадии Т1 с солитарным поражением и размером опухоли менее 5 см, которым первично была выполнена ТУР с последующим комбинированным назначением ЛТ и 1921г. При данном лечении выживаемость пациентов составила 60%, а безрецидивное течение заболевания наблюдалось более чем у 61% больных.
Основываясь на вышеизложенных данных литературы, лучевая терапия, используемая в качестве монометода у пациентов с инвазивным РМП, не дает результатов выживаемости, сравнимых с эффективностью радикальной цистэктомии.
Считается, что ЛТ показана при местно-распространенном раком мочевого пузыря (Т3b, Т4, N+), а также в случаях невозможности выполнения оперативных вмешательств пациентам с выраженными интеркурентными заболеваниями и в пожилом возрасте. В данных случаях лучевая терапия играет паллиативную роль в лечении пациентов с мышечно-инвазивным РМП. Таким образом, этот вид терапии занимает свое место з лечении определенного контингента больных.
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последних поколений с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название — переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа — уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1–2% случаев (по данным Американского онкологического сообщества — American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев — аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев — мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы — злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N — наличие очагов поражения в регионарных лимфоузлах, M — наличие отдаленных метастазов в других органах.
В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 — неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии — это инвазивный рак.
- Стадия I — опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II — опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III — злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1—3), отдаленных метастазов нет (M0).
- Стадия IV — злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент — резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
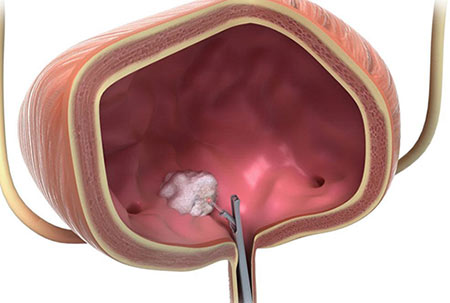
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию — удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
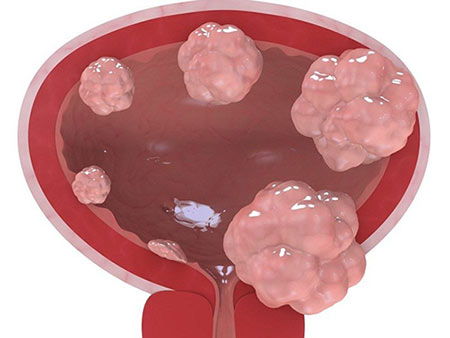
Большинству больных приходится выполнять цистэктомию — полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин — семенные пузырьки и простату, у женщин — матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения — когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция — когда хирург подсоединяет к одному концу кишки мочеточники, а к другому — мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2–3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10–15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса — для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах — протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет — 70%, в течение 15 лет — 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0–98%.
- Стадия I—88%.
- Стадия II—63%.
- Стадия III—46%.
- Стадия IV—15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Читайте также:

