Лечебный патоморфоз при раке желудка это
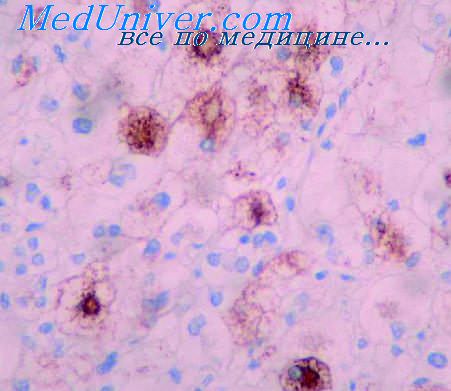
Проблема изучения злокачественных опухолей, несмотря на значительные успехи, достигнутые в последние десятилетия, продолжает оставаться в центре вниманияученых всего мира в связи с постоянным ростом заболеваемости. Лекарственная терапия опухолей в последние гоДы претерпела существенные изменения и в настоящее время стоит в оДном ряду с хирургическим и лучевым методами лечения.
Рак желудка остается одной из главных проблем современной онкологии. Ежегодно в мире регистрируется около 800000 новых случаев заболевания и около 600000 смертей [1]. На рубеже XX-XXI веков не достигнуто удовлетворительных результатов лечения данной нозологии. Показатели 5-летней выживаемости по данным большинства авторов редко превышают 20¿ рубеж. Одной из основных причин неудовлетворительных результатов лечения является поздняя диагностика заболевания и несовершенство имеющихся методов терапии [2]. В настоящее время удельный вес больных раком желудка, выявленных в 1-2 стадии, не превышает 23¿, а в 4 стадии — 28¿. Таким образом, около 50¿ больных выявляется в III стадии опухолевого процесса, когда применение только одного локального метода воздействия оказывается недостаточным [3]. Поэтому весьма оправданным является поиск новых методов и схем лечения местнораспространенного рака желудка.

Цель исследования: оценка непосредственных результатов эффективности неоадъювантной лекарственной терапии рака желудка.
Материалы и методы: Проведено исследование эффективности лечения местнораспространенных форм рака желудка. Проведено 62 больным комбинированное лечение — неоадъювантная полихимиотерапия á операция. Предоперационное лечение проведено по схеме: таксотер- 75 мг/м2 1 день á 5-фторурацил 500 мг/м2 2- 5-ый дни á лейковорин 50 мг/м2 2-5 дни.
Непосредственные результаты предоперационной химиотерапии оценивались по данным объективного и субъективного эффекта лечения.
В соответствии с рекомендациями ВОЗ [4] об эффективности противоопухолевого лечения судят по степени регрессии опухоли:
- — полная регрессия опухоли (резорбция)
характеризуется исчезновением всех признаков заболевания на срок не менее 4 недель;
- — частичная регрессия опухоли — уменьшение измеряемых опухолей и метастазов на 50¿ сроком не менее 4 недель;
- — стабилизация — уменьшение опухоли и метастазов менее чем на 50¿ без появления новых опухолевых очагов;
- — без эффекта — объективного уменьшения опухоли и метастазов не отмечено, прогрессирование процесса.
Лечебный патоморфоз определялся по методике Лавниковой Г.А.(1976 год) [5]:
Таблица 1 — Эффективность неоадъювантной химиотерапии (n=62)
Эффект неоадъювантной терапии (критерии ВОЗ)
Лечебный патоморфоз изучался и в процессе лечения (после проведения курсов полихимиотерапии), а также при окончательном морфологическом исследовании операционного материала.
При морфологическом исследовании операционного материала выявлен лечебный патоморфоз I-II степени у 18 пациентов (29,0¿). В 7 случаях (11,3¿) достигнут лечебный патоморфоз III степени. Кроме того, в 3 случаях (4,8¿) отмечена полная регрессия опухоли. У этих же больных при морфологии выявлены некротические изменения в метастатических лимфоузлах (патоморфоз IIIIV ст.). В 34 (54,9¿) случаях морфологическое исследование послеоперационного материала не выявило эффекта неоадъювантной терапии (см. диаграмму 1).

Диаграмма 1 — Эффективность неоадъювантной терапии на основании лечебного патоморфоза Таким образом, проведение неоадъювантной терапии подтверждается результатами морфологического пациентам местнораспространенной формой рака желудка исследования патоморфозом различной степени приводит к полной или частичной регрессии опухоли, что выраженности.
СПИСОК ЛИТЕРАТУРЫ
- Parkin D.M., Whelan S.L., Ferlay J., Teppo L., Thomas D.B., eds. Cancer Incidence in Five Continents // IARC Scientific Publication. — Lyon, France: IARC Press, 2003. — No. 155. — Vol. VIII. — Р. 85-96.
- Чиссов В.И., Старинский В.В. (ред.) Состояние онкологической помощи населению России в 1999 году. — М.:Медиа-Пресс, 2000. — 132 с.
- Арзыкулов Ж.А., Сейтказина Г.Д., Игисинов С.И., Махатаева А.Ж., Сейсенбаева Г.Т. Показатели онкологической службы Республики Казахстан в 2007 году (статистические материалы). — Алматы: Баспа, 2008. — 252 с.
- МКБ-О: Международная классификация онкологических болезней //2-е издание Перси К., Холтен В.В., Мур К. (ред.). — ВОЗ, Женева: 1995. — С. 108-116.
- Лавникова Г.А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование // Вестник Академии медицинских наук СССР. — 1976. — № 6. — С. 13-19.
Фамилия автора: О.К. ЖАНДОСОВ, Г.К. КАУСОВА
Лечебный патоморфоз опухоли. Оценка патоморфоза опухолевой болезни.
Вопрос о структуре самого лечебного патоморфоза болезни продолжает оставаться дискуссионным. Как известно, этиология н патогенез подавляющего большинства опухолевых болезней точно не установлены, а потому эти элементы не могут служить достоверными показателями патоморфоза. Наиболее значимыми являются изменения клинических и морфологических проявлений болезни.
Именно эти изменения входят в число существенных признаков, раскрывающих содержание понятия. В разряд патоморфоза следует отнести изменчивость н другие элементы болезни, в частности, ее осложнения, неходы н непосредственные причины смерти.
Часто возникает вопрос о том, все ли изменения болезни и опухоли можно отнести к патоморфозу. Отвечая на этот вопрос, следует заметить, что к патоморфозу могут быть отнесены лишь типовые и стойкие изменения болезни (опухоли) Я. Л. Раппопорт (1962) подчеркивал, что нозоморфоз — это не эксцесс, выходящий за рамки клинико-анатомических вариаций, свойственных данной опухоли. Нозоморфоз представляет собой типичное для данной опухоли (либо для данного метода лечения) явление.

Следует отметить, что по мере усовершенствования лучевых методов лечения и увеличения числа лекарственных средств с усилением их лечебных свойств при химиотерапии возрос не только лечебный потенциал врача-онколога, но также возросло и количество повреждений различных органов и тканей. Ятрогенные патологические процессы не только изменяют клинико-анатомические проявления опухолевой болезни, но и могут быть непосредственной причиной смерти. Однако разнообразные неблагоприятные реакции на медикаментозные средства, а также осложнения, вызванные хирургическими и терапевтическими вмешательствами, в проявление патоморфоза включать не следует.
Установление патоморфоза опухолевых болезней представляет интерес с точки зрения практики и теории медицины. Данные о патоморфозе опухолей используют на практике для сравнения разных методов лечения, для оценки эфектквкости проводимого (или уже законченного) лечения для объективного обоснования прогноза и его критериев, для оптимизации сроков диспансерного наблюдения и экспертизы трудоспособности, а также для других целей. Наблюдения патоморфоза в клинике одновременно являются основой для теоретических разработок в различных областях онкологии, патологии, радиобиологии и т. д.
Сюда можно отнести разработку принципов лечения злокачественных новообразований, изучение сущности биологического действия ионизирующих излучений, взаимоотношения опухоли и организма в условиях лечения, восстановления повреждений нуклеиновых кислот и клеточных органелл и т. д.
Менее одной десятой всех больных раком подвергаются химиотерапии, гормонотерапии и другим видам лечения, а около четверти всех больных либо не получают специфического лечения, либо находятся на слишком поздних стадиях заболевания для применения соответствующих методов лечения. Следовательно, знание особенностей патоморфоза болезни и патоморфоза опухоли необходимо для оптимизации лечения. Решение этой проблемы требует решения многих частных вопросов, например, определяет ли гистологическое строение опухоли ее чувствительность к лечебному фактору (излучению, хнмиопрепарату, гормону и т. д.). В широком плане вопрос должен решаться в рамках проблемы взаимоотношения общего и частного с тем, чтобы не уклониться в морфологизм, функционализм и другие крайности.
В зависимости от клинической ситуации и цели исследования для выявления и оценки патоморфоза можно использовать любые доступные методы и подходы клинические, морфологические, радиологические, рентгено логические, биохимические и др. Неуклонно возрастает роль цитологических исследований в оценке патоморфоза. Каждый метод используемся либо самостоятельно, либо в комплексе. Объектом морфологического исследования может быть биопсийныи, операционный и секционный материал. Морфологическое исследование леченых опухолей не отличается от общих правил обработки онкологического материала.
Следует лишь подчеркнуть 3 момента. Во-первых, на всех этапах исследования должно руководствоваться клинико-анатомическнм принципом, который подразумевает тесный контакт патологоанатома и клинициста на практике и в познании. Приступая к исследованию материала, патологоанатом должен располагать необходимыми клиническими сведениями о больном, о цели и об особенностях проведенного лечения (метод лечения, доза облучения или химиопрепарата, вид и сроки оперативного лечения и т. п. ). Без данных о характере лечения производить оценку патоморфоза не рекомендуется ввиду возможных ошибок и дискредитации морфологического метода и самого исследования.
1. Антигены опухоли. Виды антигенов опухоли.
2. Гетероорганные антигены опухоли. Противоопухолевый иммунитет.
3. Факторы противоопухолевого иммунитета. Блокирующие опухоль факторы иммунитета.
4. Иммуносупрессивное действие опухоли. Иммунные реакции на опухоль в органах.
5. Лимфатические узлы при раке. Морфология лимфатических узлов при опухоли.
6. Опухоли лимфоидной ткани. Иммуноморфология миеломной болезни.
7. Болезнь Вальденстрема, Франклина. Опухоли В-клеточной системы.
8. Иммуногистохимические исследования опухоли. Иммуносорбция в диагностике опухоли.
9. Патоморфоз опухолевых болезней. Раковый нозоморфоз.
10. Лечебный патоморфоз опухоли. Оценка патоморфоза опухолевой болезни.
Оценить результат. Лечебный патоморфоз при раке молочной железы – это система оценки терапии, выполненной при инвазивной карциноме в груди. Степень излеченности определяет дальнейшую тактику, прогноз и вероятность выздоровления.
Лечебный патоморфоз при раке груди
Ответ на терапию (лекарственную и лучевую) есть всегда, но далеко не во всех случаях опухоль в груди отвечает на лечение полным исчезновением и значительным регрессом. В некоторых случаях даже умеренно выраженное положительное влияние цитостатиков и лучей может стать хорошим подспорьем на этапе предоперационной подготовки. Лечебный патоморфоз при раке молочной железы позволяет оценить (объективизировать) эффективность по следующим морфологическим критериям:
· Дистрофия опухолевых клеток;
· Некроз в узле (синдром распада опухоли);
· Изменение клеточной структуры (полиморфизм);
· Снижение активности опухолевой тканей (уменьшение и прекращение митозов);
· Ускорение инволютивных процессов в ткани молочной железы (фиброз и гиалиноз).
Лучший вариант – полный лечебный патоморфоз (pCR – pathologic complete response), при котором происходит тотальное исчезновение опухолевых клеток из первичного очага и из ближайших лимфатических узлов. Существует несколько систем подсчета морфологических изменений в опухоли на фоне лечения, из которых чаще всего используют классификации Лушникова-Лавниковой и Мюллера-Пейни. Реже врачи пользуются Ноттингенским индексом, параметрами RBC, степенями Chevallier и Shataloff.
Классификация Лушникова-Лавниковой
Один из вариантов оценки результатов нехирургического лечения рака молочной железы разделяет морфологические исходы терапии на 4 степени:
1. Незначительные дистрофические изменение в небольшом количестве опухолевых клеток;
2. В дополнении к дистрофии есть очаги некротического распада;
3. Выраженный некроз с дистрофией, но при сохранении части раковых клеток;
4. Тотальная гибель опухоли.
Важно понимать – 4 степень (pCR) вовсе не означает, что это полная победа над карциномой. Уничтожение первичного очага не гарантирует отсутствие микрометастазов и возможное возвращение опухоли в виде рецидива.
Лечебный патоморфоз по Миллеру-Пейни
Оценка объема опухолевой ткани. Выделяют 5 степеней терапевтического воздействия на рак молочной железы:
· Незначительное снижение количества или отсутствие каких-либо изменений в опухолевой ткани;
· Карцинома потеряла менее 30% всего объема собственных раковых клеток;
· Утрата значительной части опухолевой массы (30-90%);
· Почти полное исчезновение злокачественного новообразования (более 90%) с обнаружением единичных раковых клеток;
· Полное уничтожение первичного очага с формированием фиброзной ткани в месте опухоли.
Важно учитывать морфологические изменения не только в исходном злокачественном узле, но и в близлежащих лимфатических узлах.
Объективная проверка результатов лекарственной и лучевой терапии нужна для выбора метода хирургического лечения. Можно подумать об использовании органосохраняющих вариантов операции при достижении оптимального эффекта (pCR) от лекарств и облучения на предоперационном этапе. Нельзя даже помышлять о нерадикальном хирургическом вмешательстве, если получен слабый или частичный лечебный патоморфоз при раке молочной железы.
Патоморфоз опухолевых болезней. Раковый нозоморфоз.
Особенно оно заметно в последние годы в связи с использованием большого числа мощных химиопрепаратов и комбинированных методов лечения.
Онкоморфоз, например, выражается в росте контингента больных злокачественными новообразованиями в нашей стране за период с 1970 по 1980 г, в увеличении числа лиц, живущих 5 и более лет после установления диагноза злокачественной опухоли. Имеются изменения в структуре заболеваемости, в частности снижение уровня заболеваемости населения раком нитевода, желудка и шейки матки, но увеличение числа выявленных онкологических больных раком легкого и бронхов, молочной железы, прямой кишки. В основе изучения этого вида патоморфоза лежит эпидемиология опухолей и статистический метод.
Методологической основой исследований онкоморфоза является положение о диалектическом единстве и взаимодействии социальных и биологических факторов в жизни человека. Медицинский аспект проблемы прежде всего связан с вопросами профилактики и организации онкологической помощи населению, включая диагностику и лечение болезни.
1. Антигены опухоли. Виды антигенов опухоли.
2. Гетероорганные антигены опухоли. Противоопухолевый иммунитет.
3. Факторы противоопухолевого иммунитета. Блокирующие опухоль факторы иммунитета.
4. Иммуносупрессивное действие опухоли. Иммунные реакции на опухоль в органах.
5. Лимфатические узлы при раке. Морфология лимфатических узлов при опухоли.
6. Опухоли лимфоидной ткани. Иммуноморфология миеломной болезни.
7. Болезнь Вальденстрема, Франклина. Опухоли В-клеточной системы.
8. Иммуногистохимические исследования опухоли. Иммуносорбция в диагностике опухоли.
9. Патоморфоз опухолевых болезней. Раковый нозоморфоз.
10. Лечебный патоморфоз опухоли. Оценка патоморфоза опухолевой болезни.
На современном уровне развития медицины простого выделения аденокарциномы желудка недостаточно. Это определяет то большое разнообразие морфологических классификаций, которые существуют в литературе. Наиболее полно отражает морфологические детали строения опухоли классификация Японской ассоциации по раку желудка, опубликованная в 1998 году.
Она предполагает выделение следующих гистологических типов опухолей.
Дифференцированные аденокарциномы:
• папиллярные (рар);
• высокодифференцированные (tub 1);
• умереннодифференцированные (tub 2).
Низкодифференцированные аденокарциномы:
• солидный тип (por 1);
• несолидный тип (por 2);
• перстневидноклетогный рак (sig);
• муцинозные аденокарциномы (muc).
Специальные типы опухолей:
• плоскоклеточный рак;
• железисто-плоскоклеточный (диморфный) рак;
• карциноидные опухоли;
• прочие типы (мезенхимальные опухоли, лимфомы и т.д.)
В Европе многие патологи используют более простую, прогностически ориентированную классификацию типов опухолей, предложенную финским морфологом P. Lauren в 1953 году. Согласно этой классификации выделяют интестинальный, диффузный и смешанный типы аденокарцином желудка. Следует отметить, что интестинальный тип соответствует дифференцированным типам в вышеизложенной классификации, тогда как диффузный тип соответствует низкодефференцированным и недифференцированным типам опухоли. Промежуточное положение в данной классификации занимают аденокарциномы смешанного типа. Согласно данным различных авторов, этот тип, несмотря на черты как дифференцированных, так и низкодиффенцированных опухолей, всё же более соответствует последнему, так как наличие в опухоли низкодифференцированных элементов определяет более плохой прогноз.
Морфологические и клинические характеристики рака желудка не исчерпываются только гистологическим типом самой опухоли. Помимо морфологических особенностей большое значение имеют глубина опухолевой инвазии стенки желудка, тип роста опухоли и наиболее важный фактор - распространённость и характеристика лимфогенного метастазирования (рис. 61-1).

Рис. 61-1. Пути распространения рака желудка (схема). Т - инвазия опухолью стенки желудка; N - лимфогенное метастазирование; М - отдалённое органное метастазирование.

Рис. 61-2. Типы роста распространённого рака желудка по Р. Боррманну (1926).
В классификации Японской ассоциации по раку желудка к этим 4 типам роста добавлен 5-й, неклассифицируемый, сочетающий в себе элементы разных типов роста опухоли.
Раку желудка свойственны 4 пути распространения:
• Прямое распространение (прорастание опухоли): в малый и большой сальник, печень, диафрагму, поджелудочную железу, селезёнку, печёночно-двенадцатиперстную связку, поперечно-ободочную кишку (рост на протяжении органа с распространением на смежные отделы желудочно-кишечного тракта - пищевод, двенадцатиперстную кишку - не рассматривают как признак прорастания в окружающие структуры).
• Лимфогенные метастазы: в регионарные лимфатические узлы, отдалённые лимфатические узлы, левую надключичную область (вирховская железа), левый подмышечный лимфатический узел (узел Айриша).
• Гематогенные метастазы: в печень, лёгкие, кости, головной мозг.
• Перитонеальная диссеминация: в пупок, тазовую брюшину, метастазы Крукенберга в яичники, в прямокишечно-маточное углубление.
По данным исследований, отдалённые метастазы выявляют в печени в 2 раза чаще, чем в других областях. Также часто поражаются лёгкие, надпочечники и кости. Однако селезёнка вовлекается в процесс достаточно редко - менее 10%. Ворота селезёнки чаще вовлекаются в процесс за счёт метастатического поражения лимфатических узлов (до 15%), что определяет её обязательное удаление при поражении тела и проксимального отдела желудка.
Наиболее часто встречается рак антрального отдела желудка и пилорического канала - до 50% наблюдений. Далее следуют опухоли тела желудка или антрального отдела с распространением на тело органа - около 30% случаев. Реже всего в клинической практике обнаруживают рак проксимального отдела желудка (часто с распространением инфильтрации на нижнюю треть пищевода) - кардио-эзофагеальные раки. Их частота не превышает 20%. В последние 2 десятилетия отмечают увеличение частоты рака проксимального отдела желудка с распространением на пищевод в сочетании со снижением частоты дистальных раков желудка.
Рак желудка составляет 10,5% всех зарегистрированных случаев злокачественных заболеваний и по-прежнему остаётся одной из основных причин смерти от онкопатологии во всём мире. Ежегодно в России раком желудка заболевают более 46 тыс. человек, а ежегодная летальность превышает 60%. Наша страна занимает 7-е место в мире по уровню заболеваемости раком желудка.
Определённое значение в профилактике рака желудка имеет характер питания. Так, положительно сказывается высокое содержание в рационе молока и молочных продуктов, овощей, фруктов и бобовых. Для предотвращения запущенных форм заболевания необходимо использовать скрининговое эндоскопическое обследование. Только таким путём возможна доклиническая диагностика рака желудка, что существенно улучшает результаты его лечения.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Представлено исследование терапевтического патоморфоза местнораспространенного рака желудка после неоадъювантной пролонгированной химиолучевой терапии с последующей гастрэктомией D2 на основе клинических данных и морфологических изменений опухоли. Исследование проведено у 24 больных, которым провели лучевую терапию в дозе 45 Гр (дневная очаговая доза 2,5 Гр за две фракции (1 + 1,5 Гр) с интервалом между ними 4–5 ч). Параллельно больные получали химиотерапию препаратами кселода в дозе 1850 мг/м2 за два приема с интервалом 12 ч ежедневно и элоксатин в дозе 100 мг/м2 в виде в/в инфузий 1 раз в 3 нед. По окончании химиолучевой терапии следовал перерыв в лечении, после чего проводили контрольное обследование с оценкой результатов лечения и выполняли оперативное вмешательство. Клиническая и морфологическая оценки патоморфоза показали, что у большинства больных имела место выраженная регрессия как первичной опухоли, так и регионарных метастазов. По классификации Г.А. Лавниковой I степень патоморфоза имела место у двух больных, II – у 6 больных, III – у 12 больных, IV – у 4 больных. Таким образом, разработанный метод лечения показал высокую эффективность по критерию терапевтического патоморфоза и требует дальнейшего клинического изучения.
1. Афанасьев С.Г., Августинович А.В., Тузиков С.А. и др. Результаты комбинированных операций при местнораспространенном раке желудка // Онкология. Журнал им. П.А. Герцена. 2013. № 2. С. 12–15.
2. Гаганов Л.Е., Казанцева И.А., Гуревич Л.Е., Корсакова Н.А. Варианты карцином желудка по иммуногистохимической экспрессии муцинов и CD10 // Архив патологии. 2012. № 2. С. 3–6.
3. Данилова И.А. К вопросу о клинико-морфологических вариантах рака желудка // Архив патологии. 2005. № 5. С. 32–34.
4. Данилова И.А., Аничков Н.М. Комплексное изучение основных морфологических форм рака желудка в связи с показателями их прогностической оценки // Архив патологии. 2009. № 5. С. 27–31.
5. Лавникова Г.А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование // Вестник Академии медицинских наук СССР. 1976. № 6. С. 13–19.
6. Лушников Е.Ф. Лучевой патоморфоз опухолей человека. М.: Медицина, 1977.
7. Онкология. Национальное руководство / Под. ред. В.И. Чиссова и М.И. Давыдова. М., 2008.
8. Скоропад В.Ю., Бердов Б.А., Евдокимов Л.В., Неборак Ю.Т. Комбинированное лечение больных раком желудка (пролонгированная неоадъювантная химиолучевая терапия + гастрэктомия D2): непосредственные результаты 2 фазы клинического исследования // Онкохирургия. 2012. № 3. С.10–16.
10. Ajani J.A., Winter K., Okawara G.S. et al. Phase II trial of preoperative chemoradiation in patients with localized gastric adenocarcinoma (RTOG 9904): quality of combined modality therapy and pathologic response // J. Clin. Oncol. 2006. Vol. 24. Р. 3953–3958.
11. Chetty R., Gill P., Govender D. et al. International study group on rectal cancer regression grading: interobserver variability with commonly used regression grading systems // Human Pathology. 2012. Vol. 43. Р. 1917–1923.
12. Dworak О., Keilholz L., Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy // Int. J. Colorectal Dis. 1997. Vol. 12. Р. 19–23.
13. Mandart A., Dalibard F., Mandart J. et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma // Саncer. 1994. Vol. 73. Р. 2680–2686.
14. World Health Organisation. Classification of tumours of the digestive system. 4th ed. Geneva: WHO Press. 2010.
Лушников Е.Ф., Абросимов А.Ю., Бердов Б.А., Неборак Ю.Т., Скоропад В.Ю. ПАТОМОРФОЗ РАКА ЖЕЛУДКА ПРИ НЕОАДЪЮВАНТНОЙ ПРОЛОНГИРОВАННОЙ ХИМИОЛУЧЕВОЙ ТЕРАПИИ С ПОСЛЕДУЮЩЕЙ ГАСТРЭКТОМИЕЙ D2. Сибирский онкологический журнал. 2014;(1):5-10.
Lushnikov Е.F., Abrosimov А.Yu., Berdov B.А., Neborak Y.Т., Skoropad V.Yu. PATHOLOGICAL RESPONSE OF GASTRIC CANCER TO NEOADJUVANT PROLONGED CHEMORADIOTHERAPY FOLLOWED BY D2 GASTRECTOMY. Siberian journal of oncology. 2014;(1):5-10. (In Russ.) (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

Рак желудка - злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения - хирургический, удаление всего желудка или его пораженной части.
- Причины рака желудка
- Классификация рака желудка: каким он бывает?
- Симптомы: как проявляется рак желудка?
- Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
- Какие методы диагностики может назначить врач?
- Современные принципы лечения рака желудка
- Какой прогноз при раке желудка?
- Цены на лечение рака желудка на 1-4 стадиях в Европейской онкологической клинике
Причины рака желудка
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз - заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
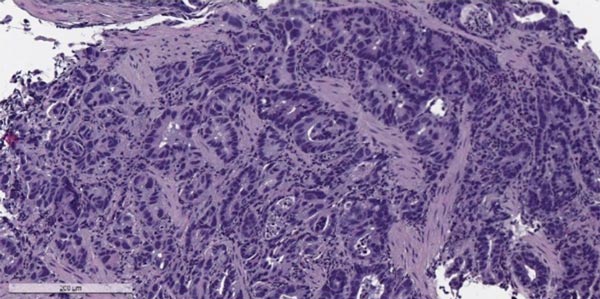
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx - первичную опухоль невозможно оценить;
- T0 - первичная опухоль не обнаруживается;
- T1 - тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки ("рак на месте");
- T2 - опухоль проросла в мышечный слой стенки органа;
- T3 - рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 - опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx - невозможно оценить метастазы в лимфатических узлах;
- N0 - метастазы в регионарных лимфоузлах не обнаружены;
- N1 - поражены 1-2 лимфоузла;
- N2 - опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 - метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 - отдаленные метастазы не обнаружены;
- M1 - обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 - стадия Ia; T1N1M0, T2N0M0 - стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 - стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 - стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 - стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 - стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 - стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В Европейской онкологической клинике существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.

Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака - Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Читайте также:

