Комбинированное лечение рака пищевода
(495) -506 61 01
Хирургия пищевода ¦ Комбинированное лечение рака пищевода
У больных с протяженностью опухоли более 5 см при локализации опухоли в бронхиальном сегменте пищевода и ниже, и при размерах опухоли более 3 см при поражении верхних сегментов пищевода (аортального и трахеального) наиболее оправдано применение комбинированного лечения.
В качестве компонента комбинированного лечения лучевая терапия позволяет расширить показания к радикальному лечению местнораспространенных опухолей пищевода, повысить радикальность операций, снизить частоту местных рецидивов и метастазов.
Использование облучения позволяет воздействовать на саму опухоль, добиваясь снижения ее активности, уменьшения размеров, а также на пути лимфооттока от пищевода, подавляя находдящиеся там опухолевые клетки.
Предоперационная лучевая терапия проводится в различных вариантах в зависимости от общего состояния больного, локализации опухоли, поставленных задач перед началом лечения и распространенности опухолевого процесса.
Оптимальным интервалом между окончанием лучевой терапии при методике укрупненного фракционирования дозы и операцией составляет 5-7 дней, а при методике классического и динамического фракционирования 2-3 недели. Различия в сроках между лучевой терапией и операцией обусловлены разными задачами этих вариантов предоперационного облучения.
Лучевая терапия в традиционном варианте комбинированного лечения используется перед операцией, однако в клинической практике возникают такие ситуации, когда проведение лучевой терапии до операции не осуществлено либо из-за высокого риска развития осложнений, связанных с распадом опухоли, либо в силу гиподиагностики распространенности онкопроцесса. В этих случаях целесообразно использовать послеоперационное облучение.
Облучение после операции направлено на уничтожение рассеянных в ходе операции злокачественных клеток, а так же на повреждение метастазов в неудаленных лимфатических узлах или оставленной части опухоли.
Объем облучения формируется с учетом локо-регионарных путей лимфооттока, на основании данных о распространенности и топографии опухолевого процесса.
Если клетки опухоли вышли за пределы ее видимых границ и локо-регионарной зоны или остались в ее ложе, сохранив биологическую активность целесообразно использование комплексного лечения.
5-летняя выживаемость больных после комбинированного лечения достигает 56,6% при радикальном характере оперативных вмешательств и 7,0% после паллиативных. При комплексном лечении после паллиативных операций выживаемость достигает 30,8%.
(495) 506-61-01 - где лучше оперировать пищевод
.jpg)
Лечение грыжи пищевода по уникальной методике профессора Пучкова К.В. в Москве.
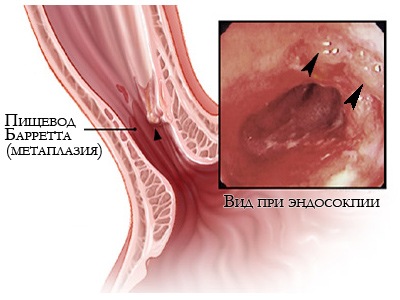
Безоперационное лечение пищевода Баррета в Израиле - метод RFA радиочастотная абляция (radiofrequency ablation).
.jpg)
Кардиомиотомия - эффективный метод лечения ахалазии кардии. Видео-лекция проф. Феденко В.В. об этом методе.
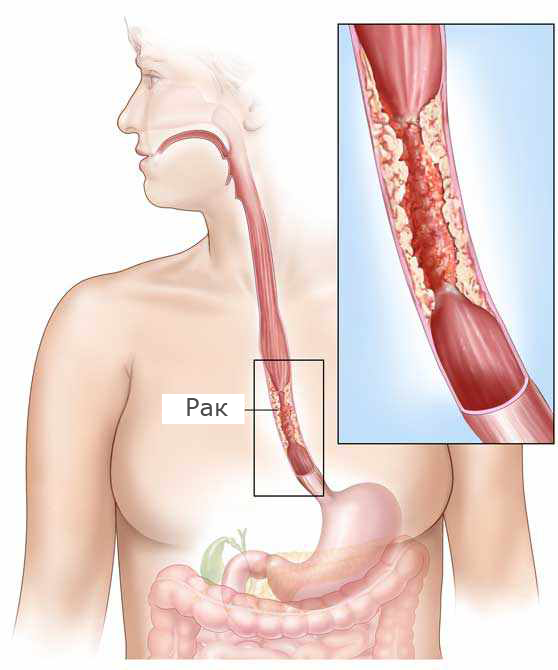
Современная диагностика рака пищевода в Германии - Клиника внутренних заболеваний - г. Дюссельдорф
Поиск и подбор лечения в России и за рубежом
- Заявка на лечение
- Сотрудничество
- Контакты
РАК ПИЩЕВОДА – КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ
Комбинация лучевой терапии с оперативным вмешательством повышает общую эффективность лечения. Это комбинированное лечение.
Наиболее оправдано применение комбинированного лечения у больных с протяженностью опухоли более 5 см при локализации опухоли в бронхиальном сегменте пищевода и ниже, и при размерах опухоли более 3 см при поражении верхних сегментов пищевода (аортального и трахеального).
Использование облучения позволяет воздействовать на саму опухоль, добиваясь снижения ее активности, уменьшения размеров, а также на пути лимфооттока от пищевода, подавляя могущие находиться там опухолевые клетки.
В качестве компонента комбинированного лечения лучевая терапия позволяет расширить показания к радикальному лечению местнораспространенных опухолей пищевода, повысить радикальность операций, снизить частоту местных рецидивов и метастазов.
Предоперационная лучевая терапия проводится в различных вариантах в зависимости от поставленных задач перед началом лечения, общего состояния больного локализации опухоли и распространенности опухолевого процесса.
Применение методики укрупненного фракционирования дозы интенсивным ритмом по 4Гр 5-6 раз в неделю до суммарной очаговой дозы (СОД) 20-24 Гр оправдано при малой протяженности опухоли (Т1-2), при отсутствии глубокого изъязвления опухоли, при дисфагии I-II степени, и отсутствии выраженных нарушений со стороны сердечно-сосудистой системы и биомеханики дыхания и нарушений газообмена. При большей протяженности опухоли более оправдано применение методики классического фракционирования по 2 Гр 5 раз в неделю до СОД 40-45 Гр (66-75 ед ВДФ) или схемы динамического фракционирования дозы-по 4Гр 3дня, затем по 2Гр ежедневно до СОД 36-42 Гр (68-77д ВДФ).
Последняя методика обеспечивает большую регрессию опухоли при менее выраженных лучевых реакциях и сокращении сроков лечения по сравнению с методикой классического фракционирования.
Оптимальным интервалом между окончанием лучевой терапии и операцией при методике укрупненного фракционирования дозы - 5-7 дней, а при методике классического и динамического фракционирования 2-3 недели. Различия в сроках между операцией и лучевой терапией обусловлены разными задачами этих вариантов предоперационного облучения.
Так при укрупненном фракционировании дозы главной задачей облучения является подавление митотической активности опухолевых клеток с целью снижения вероятности имплантационных метастазов после операции, тогда как использование классического и динамического фракционирования преследуют цель уменьшения основной опухоли, околоопухолевого воспалительного компонента и, тем самым, повышения резектабельности процесса.
Лучевая терапия в традиционном варианте комбинированного лечения используется перед операцией, однако в клинической практике возникают такие ситуации, когда проведение лучевой терапии до операции не осуществлено либо из-за высокого риска развития осложнений, связанных с распадом опухоли, либо в силугиподиагностики распространенности онкопроцесса. В этих случаях целесообразно использовать послеоперационное облучение.
Облучение после операции направлено на достижение "стерилизации" операционного поля - уничтожение рассеянных в ходе операции злокачественных клеток и их комплексов, а так же на повреждение метастазов в неудаленных лимфатических узлах или оставленной части опухоли.
Достоинствами этого варианта комбинированного лечения являются: возможность точнее оценить истинную распространенность опухолевого процесса, что позволяет более точно сформулировать показания к послеоперационному облучению, операция выполняется на неизмененных нормальных тканях, что снижает риск развития послеоперационных осложнений и позволяет подвести большие дозы и дифференцированно подойти к выбору объема облучения, сочетать положительные качества обоих компонентов без риска увеличения послеоперационных осложнений.
Объем облучения формируется на основании данных о распространенности и топографии опухолевого процесса с учетом локо-регионарных путей лимфооттока. В этот объем входит ложе пищевода от грудино-ключичного сочленения до диафрагмы и параэзофагеальный лимфатический коллектор. При поражении нижней трети пищевода дополнительно облучалась паракардиальная область, верхней трети - шейно-надключичные зоны.
В случаях, когда клетки опухоли вышли за пределы ее видимых границ и локо-регионарной зоны или остались в ее ложе, сохранив биологическую активность целесообразно использование комплексного (с использованием кроме операции и облучения еще и химиотерапии) лечения.
Следует также отметить большее количество послеоперационных осложнений у больных после комбинированного лечения по сравнению с хирургическим лечением.
5-летняя выживаемость больных после комбинированного лечения достигает 56,6% при радикальном характере оперативных вмешательств и 7,0% после паллиативных. При комплексном лечении после паллиативных операций выживаемость достигает 30,8%.
+7 495 66 44 315 - где и как вылечить рак
Сегодня в Израиле рак молочной железы поддается полному излечению. По данным израильского министерства здравоохранения, в настоящее время в Израиле достигнута 95% выживаемость при данном заболевании. Это - самый высокий показатель в мире. Для сравнения: по данным Национального Канцер Регистра заболеваемость в России в 2000г по сравнению с 1980г увеличилась на 72%, а выживаемость составляет 50%.
На сегодняшний день стандартом лечения клинически локализованного рака предстательной железы (т.е. ограниченного на простате), а значит излечимого, считается либо различные оперативные методы, либо лучевые терапевтические методы (брахитерапия). Стоимость диагностики и лечения рака предстательной железы в Германии составит от 15.000 € до 17.000 €
Данный вид оперативного лечения был разработан американским хирургом Фредериком Мосом и успешно применяется в Израиле на протяжении последних 20 лет. Определение и критерии операции по методу Моса разработаны Американским колледжем операции Моса (ACMS) совместно с Американской академией дерматологии (AAD).
- Рак молочной железы
- Онкогинекология
- Рак легких
- Рак предстательной железы
- Рак мочевого пузыря
- Рак почки
- Рак пищевода
- Анатомия пищевода
- Рак пищевода – причины
- Рак пищевода – симптомы
- Рак пищевода – виды
- Рак пищевода – метастазирование
- Рак пищевода – классификация
- Рак пищевода – диагностика
- Рак пищевода – лечение
- Рак пищевода – операции
- Рак пищевода – объём оперативного вмешательства
- Рак пищевода – лучевая терапия
- Рак пищевода – комбинированное лечение
- Рак пищевода – прогноз
- Лечение рака пищевода в Израиле
- Рак желудка
- Рак печени
- Рак поджелудочной железы
- Колоректальный рак
- Рак щитовидной железы
- Рак кожи
- Рак костей
- Опухоли мозга
- Лечение рака Кибер-ножом
- Нано-нож в лечении рака
- Лечение рака Протонной терапией
- Лечение рака в Израиле
- Лечение рака в Германии
- Радиология в лечении рака
- Рак крови
- Полное обследование организма - Москва
- Таргетная терапия меланомы в Москве
- Таргетная терапия рака поджелудочной железы в Москве
- Таргетная терапия рака почки в Москва
- Кейтруда - лечение в Москве
- Лечение моноклональными антителами в Москве
- Лечение Эрлотинибом в Москве
- Лечение трастузумабом в Москве
- Платная онкологическая помощь в Москве

Нано-Нож (Nano-Knife) - новейшая технология радикального лечения рака поджелудочной железы, печени, почек, легких, простаты, метастазов и рецидивов рака. Нано-Нож убивает опухоль мягких тканей электрическим током, сводя к минимуму риск повреждения близлежащих органов или кровеносных сосудов.

Технология Кибер-Нож была разработана группой врачей, физиков и инженеров Стендфордского Университета. Эта методика была одобрена FDA лечения внутричерепных опухолей в августе 1999 года, и для опухолей в остальных областях тела в августе 2001 года. На начало 2011г. действовали около 250 установок. Система активно распространяется по всему миру.
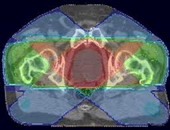
ПРОТОННАЯ ТЕРАПИЯ - радиохирургия протонного пучка или тяжело заряженных частиц. Свободно двигающиеся протоны извлекают из атомов водорода. Для этого служит специальный аппарат, который отделяет отрицательно заряженные электроны. Оставшиеся положительно заряженные частицы и есть протоны. В ускорителе частиц (циклотроне) протоны в сильном электромагнитном поле разгоняются по спиральной траектории до огромной скорости, равной 60% скорости света - 180 000км/сек.
В настоящее время применяют три основных стратегических подхода к лечению рака пищевода: однокомпонентное лечение (только хирургическое или только лучевая терапия), комбинированное лечение и паллиативные эндоскопические процедуры, цель которых состоит только в восстановлении просвета пищевода в месте опухоли.
Что касается лучевой терапии, то ее проводят как при операбельном, так и при неоперабельном раке пищевода, в дополнение -к хирургической операции и самостоятельно. В первом случае курс лучевой терапии проводят и до, и после операции: до операции — для уменьшения размеров опухоли, ее девитализации и подавления регионарных метастазов. В ряде наблюдений такая тактика позволяет перевести, казалось бы, нерезектабельную опухоль в резектабельную. После операции смысл лучевой терапии — в воздействии на возможные пути и зоны метастазирования. Кроме того, при раке шейного отдела пищевода, где хирургическая операция дает, как правило, плохие результаты, лучевая терапия в настоящее время остается методом выбора.
Наибольшее распространение сейчас получает комбинированная радиохимиотерапия. Причем, кроме наружного облучения в дозе 40—60 гР с разделением ее примерно на 20—30 фракций, применяют и внутрипросветное облучение с помощью специальных зондов в дозе 8—10 Гр.
Последняя методика не свободна от специфических осложнений — образования язв и рубцовых стриктур пищевода в месте облучения. Из химиопрепаратов наряду с хорошо известными препаратами — антиметаболитами, токсическими антибиотиками, иммуномодуляторами (5-фторурацил, метотрексат, адриамицин, митомицин, блеомицин, лейковорин), применяют и новые лекарства, например препараты платины (цисплатин). Сведения об эффективности такого лечения противоречивы: сообщаются результаты от хороших [Thum Т. et al., 1999; Tirret E., 1999], сравнимых с эффектом эзофатэктомии 5-летняя выживаемость около 20 %, до плохих [Lehnert Т., 1999].
При неоперабельном раке пищевода лучевая и химиотерапия являются единственной надеждой продлить жизнь больного. Известно, однако, что раковые опухоли отвечают на такое лечение по-разному, а качество жизни больных может сильно страдать. Дело в том, что дисфагия от лучевого отека тканей усиливается, может возникнуть полная непроходимость пищевода. Поэтому перед проведением курса лучевой терапии создание гастростомы обязательно. Кроме того, у подобных пациентов отрицательное воздействие этих видов терапии на иммунную систему и кроветворение бывают выражены в наибольшей степени.
Показания к операции устанавливают с учетом данных обследования, принимая во внимание как локализацию, распространенность опухоли и наличие метастазов и осложнений (свищ), так и общее состояние пациента. Опухоль может быть резектабельной (что определяется в основном только во время вмешательства), но тяжелые сопутствующие заболевания и преклонный возраст больного не позволяют производить радикальную операцию.
Общеизвестно, что рак шейного и верхнегрудного (выше дуги аорты) отделов пищевода протекает особенно злокачественно: опухоль часто прорастает жизненно важные органы (чаще всего трахею) и рано метастазирует. Неудовлетворительные результаты хирургического лечения подобных больных заставили большинство хирургов отказаться от резекции пищевода в пользу лучевой терапии. Понятно, что при выявлении рака такой локализации в ранней стадии можно и нужно делать радикальную операцию. К сожалению, такие решения принимаются очень редко.
В хирургическом лечении рака пищевода применяют два основных типа радикальных вмешательств: двух- и одномоментные. К первым относится широко распространенная до недавнего времени экстирпация пищевода по Добромыслову—Тореку. Пищевод при этом резецируют через правосторонний трансторакальный доступ. Аборальный конец пищевода ушивают наглухо, оральный конец выводят на шею в виде концевой эзофагостомы. Для питания накладывают гастростому. Таким образом, операцию осуществляют из трех доступов. По прошествии нескольких месяцев после улучшения общего состояния больного и при отсутствии признаков метастазирования выполняют второй, восстановительный этап операции.
Обычно искусственный пищевод формируют из сегмента толстой кишки, располагая его в загрудинном тоннеле. Основным недостатком подобного вмешательства наряду с довольно высокой смертностью является низкое качество жизни больных, перенесших операцию. Обычно восстановительный этап операции удается выполнить не более чем у !/3 пациентов — остальные обречены доживать до смерти с пищеводным и желудочным свищами.
Что касается малоинвазивных эндоскопических методик лечения раннего рака пищевода, то они только недавно начали разрабатываться за рубежом [Endo М., 1993; Izumi Y. et al., 1994; Yang G.R. et al., 1994; Yoshida M. et al., 1994; Lambert L., 1996; Soehendra N. et al., 1997]. Мы считаем их неоправданными и опасными процедурами, в корне противоречащими принципам онкологического радикализма, поэтому подробно не рассматриваем. Мы считаем, что показания к таким операциям могут быть лишь специфическими и очень редкими: например, случайное выявление раннего рака пищевода у неоперабельного по другим причинам больного.
Существуют различные точки зрения на выбор оптимальной методики радикальных хирургических операций при раке пищевода. Так, многие хирурги применяют резекцию пищевода с лимфаденэктомией из двух доступов по Льюису (лапаротомия и правосторонняя торакотомия). При этом резецируют кардию и часть малой кривизны желудка, нижнегрудной и среднегрудной отделы пищевода и формируют эзофагогастроанастомоз в правой плевральной полости. Правомочным считается также способ резекции пищевода в сочетании с лимфаденэктомией с внутриплевральным эзофагогастроанастомозом через левосторонний торакофренолапаротомный доступ по Гэрлоку.
Многие применяют также операцию из трех доступов для суб- и тотального удаления пищевода и проведения желудочного трансплантата на шею внутриплевральным путем по Накаяма или ретростернально по Акияма (лапаротомия, правосторонняя торакотомия и разрез на шее). При этом в настоящее время также производят расширенную лимфаденэктомию. Каждой из этих операций присущи свои преимущества и недостатки. Так, операции трансторакальной резекции пищевода с внутриплевральным анастомозом опасны не только из-за частых серьезных сердечно-легочных осложнений, но также из-за возможности смертельного исхода при развитии несостоятельности швов пищеводно-желудочного или пищеводно-кишечного соустья.
Одной из наиболее приемлемых методик радикального вмешательства при раке пищевода является его субтотальная резекция через абдоминоцервикальный (трансхиатальный) доступ с одномоментной заднемедиастинальной эзофагопластикой лзоперистальтической трубкой из большой кривизны желудка с анастомозом на шее. При невозможности использования желудка для пластики искусственный пищевод формируют обычно из сегмента толстой кишки. Специальные инструменты, сшивающие аппараты, особые приемы и приспособления позволяют в большинстве случаев выполнить радикальное вмешательство, которое сравнительно легко переносится больными и после которого отмечаются небольшое число послеоперационных осложнений и низкая смертность (около 4 %).
При этом 5-летняя выживаемость достигает 26—28 %, что является очень хорошим показателем, принимая во внимание тот факт, что больные раком пищевода подвергаются операции, как правило, в запущенной стадии болезни. Необходимо заметить, что подобная операция показана лишь при локализации опухоли ниже уровня бифуркации трахеи. Если опухоль расположена на уровне бифуркации или выше, операцию следует делать из трех доступов — переднебоковая торакотомия справа, лапаротомия и разрез на шее.
В последнее время для мобилизации пищевода и выполнения лимфодиссекции используют также и видеотехнику. Определенное распространение получают также малоинвазивные торакоскопические методики резекции пищевода в сочетании с лимфаденэктомией. Опыт применения подобных новых технологий пока невелик, получены обнадеживающие непосредственные результаты, но необходимо дальнейшее изучение.
Таким образом, радикальная операция при раке пищевода с хирургических и онкологических позиций должна отвечать следующим требованиям:
1. Операция должна быть одномоментной, т.е. включать как радикальный, так и реконструктивный этапы.
2. Принимая во внимание магистральный тип строения лимфатической системы пищевода, инфильтративный рост опухоли, интрамуральное метастазирование, следует выполнять суб- или тотальную резекцию пищевода (с пересечением его на шее).
3. Учитывая широкое регионарное лимфогенное метастазирование рака пищевода, радикальные операции необходимо сочетать с расширенной лимфаденэктомией, т.е. удалять лимфатические коллекторы не только из средостения, но и из живота и на шее.
4. Наиболее подходящим органом для замещения удаленного пищевода является желудок. При этом в целях онкологического радикализма следует удалять кардию и малую кривизну как зоны регионарного метастазирования. Таким образом, оптимальным трансплантатом является изоперистальтический стебель из большой кривизны желудка.
5. Путь проведения трансплантата на шею может быть загрудинным и заднемедиастинальным. Преимущество первого — профилактика сдавления трансплантата в случае рецидива рака в средостении. Основной недостаток — значительно большая длина этого пути по сравнению с заднемедиастинальным.
Отдельного рассмотрения заслуживает расширенная лимфаденэктомия при раке пищевода, выполняемая в сочетании с суб- и тотальной его резекцией. Лимфаденэктомия или лимфодиссекция представляет собой лечебную манипуляцию, состоящую в удалении регионарных для пораженного органа лимфатических коллекторов. Цель лимфаденэктомии — удаление всех выявленных макро- и микроскопических очагов.
Она реализуется путем ликвидации всех фокусов вероятного опухолевого поражения лимфатической системы, т.е. не только уже явно пораженных лимфоузлов, но и тех, которые могли бы быть поражены в настоящий момент. Таким образом, лимфаденэктомия имеет не только лечебный, но и превентивный характер.
В соответствии с анатомическим расположением основных лимфатических коллекторов пищевода выделяют цервикальную, медиастинальную и абдоминальную лимфаденэктомию. Различают также принципиальную (систематическую, последовательную) и расширенную (радикальную, адекватную) лимфаденэктомию.
Под принципиальной лимфаденэктомией понимают удаление заранее определенных групп лимфоузлов независимо от наличия или отсутствия в них видимых изменений. Под расширенной лимфаденэктомией понимают удаление лимфатических коллекторов всех трех регионов метастазирования рака пищевода: шейного, медиастинального и абдоминального.
Лимфаденэктомия закономерно удлиняет время операции, но при тщательном соблюдении адекватной методики и техники, деликатном обращении с тканями и органами под обязательным визуальным контролем эта процедура не увеличивает числа интра- и постоперационных осложнений. Напротив, многочисленными исследованиями доказано, что расширенная лимфаденэктомия значительно улучшает прогноз при раке пищевода.
При нерезектабельной опухоли пищевода оправдано выполнение паллиативных шунтирующих операций, таких как загрудинная субтотальная эзофагопластика толстой кишкой. Обеспечивая значительно более высокое качество жизни по сравнению с простой гастростомией, такие операции дают возможность проведения адьювантного лечения (лучевая или химиотерапия).
Только лучевую терапию проводят в настоящее время в основном неоперабельным больным. У остальных пациентов целым рядом исследователей признается целесообразным комбинировать такое лечение с хирургическим, особенно при запущенньгх стадиях рака пищевода. При этом лечение показано как до, так и после операции; другие схемы включают оба способа адьювантной терапии, которые, по мнению многих исследователей, в состоянии значительно улучшить отдаленные послеоперационные результаты.
При неудалимых опухолях у дряхлых пациентов методом выбора могут стать паллиативные эндоскопические вмешательства, такие как дилатация злокачественного стеноза, лазерная реканализация и электродеструкция опухоли, а также эндопротезирование пищевода. Условием для проведения подобных процедур является отсутствие осложнений в виде распада опухоли, кровотечения, пищеводного свища.
Противопоказанием к проведению эндоскопических методов восстановления проходимости пищевода может явиться общее тяжелое состояние пациента, не позволяющее выполнить исследование и вмешательство, а также ожидаемая очень короткая продолжительность жизни больного [Галлингер Ю.И., Годжелло Э.А., 1999].
Чаще всего при неоперабельном раке, вызывающем дисфагию, выполняют эндопротезирование пищевода. Для этого под эндоскопическим контролем проводят бужирование опухоли пищевода полыми бужами по металлической струне-проводнику, а затем в сформированный канал помещают пластмассовую трубку одной из предложенных конструкций и оставляют ее в пищеводе на долгое время (рис. 53). Если такое паллиативное вмешательство по каким-либо причинам невозможно, последним способом облегчения состояния больного является наложение гастростомы для питания.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
1.1. Определение категорий T, N, M
Для определения стадии рака пищевода (РП) используется классификация TNM (UICC, 8-е издание). При определении стадии РП в классификациях UICC и AJCC используются идентичные критерии TNM (табл. 1).
Патоморфологические категории pT, pN и pM соответствуют клиническим характеристикам cT, cN и cM.
Опухоль пищеводно-желудочного перехода, эпицентр которой находится непосредственно на уровне зубчатой линии (1 см выше и 2 см ниже) или в пределах 5 см ниже с распространением на пищевод, классифицируется как рак пищевода.
Таблица 1. Система стадирования рака пищевода по TNM (UICC, 8-е издание)
Первичная опухоль не может быть оценена
Нет признаков первичной опухоли
Карцинома in situ/дисплазия высокой степени
Прорастание опухоли в собственную пластинку или подслизистый слой
Опухоль вовлекает собственную пластинку или мышечную пластинку слизистой оболочки
Опухоль прорастает подслизистый слой
Прорастание мышечного слоя
Прорастание прилегающих структур
Плевра, брюшина, перикард, диафрагма, вена azygos
Прилежащие анатомические структуры: аорта, позвонки или трахея
Регионарные лимфатические узлы
Регионарные лимфатические узлы не могут быть оценены
Нет метастазов в регионарных лимфатических узлах
Поражение 1-2 регионарных лимфатических узлов
Поражение 3-6 регионарных лимфатических узлов
Поражение 7 и более регионарных лимфатических узлов
Отдалённых метастазов нет
Отдалённые метастазы есть
1.2. Регионарные лимфатические узлы
Регионарными являются следующие группы лимфатических узлов:
• верхние и нижние шейные;
• лимфатические узлы корня лёгкого (билатеральные);
• верхние параэзофагеальные (выше v. azygos);
• нижние параэзофагеальные (ниже v. azygos);
• перигастральные (правые и левые кардиальные, лимфатические узлы вдоль малой кривизны, вдоль большой кривизны, супрапилорические, инфрапилорические, лимфатические узлы вдоль левой желудочной артерии).
Категория pN0 может быть установлена только после лимфодиссекции с патоморфологическим изучением не менее 7 удалённых лимфоузлов (при отсутствии в них метастазов).
1.3. Степень дифференцировки опухоли
Выделяют следующие степени дифференцировки при РП:
• GX — степень дифференцировки опухоли не может быть определена;
• G1 — высокодифференцированная опухоль;
• G2 — умеренно дифференцированная опухоль;
• G3 — низкодифференцированная опухоль;
• G4 — недифференцированная опухоль.
1.4. Отделы пищевода
При оценке локализации верхнего полюса опухоли при помощи ЭГДС используется следующее деление пищевода в зависимости от расстояния от резцов:
• шейный отдел — 2
750 мг/м 2 /сут.
1-й день
с 1-го по 4-й дни
(96-часовая инфузия)
1-й день
1-й день
25 мг/м 2
25 мг/м 2
1-й день
1-й день
Периоперационная химиотерапия при аденокарциномах нижне-грудного отдела пищевода и пищеводно-желудочного перехода
75 мг/м 2
750 мг/м 2 /сут.
с 1-го по 5-й дни (120-часо-
вая инфузия)
75 мг/м 2
2000 мг/м 2 /сут.
с 1-го по 14-й дни
75 мг/м 2
75 мг/м 2
750 мг/м 2 /сут.
1-й день
1-й день
с 1 -го по 5-й дни (120-часовая
инфузия)
Доцетаксел
Оксалиплатин
Кальция фолинат
5-фторурацил
50 мг/м 2
85 мг/м 2
200 мг/м 2
2600 мг/м 2
1-й день
1-й день
1-й день
1 -й день, 24-часовая инфузия
Режимы паллиативной химиотерапии
75мг/м 2
750 мг/м 2 /сут.
с 1-го по 5-й дни (120-часо-
вая инфузия)
1-й день
1-й день
1-й день
с 1-го по14-й дни
130 мг/м 2
2000 мг / м 2 / сут.
1-й день
1-й-14-й дни
75 мг/м 2
75 мг/м 2
750 мг/м 2 /сут.
1-й день
1-й день
с 1 -го по 5-й дни (120-часовая
инфузия)
Доцетаксел
Оксалиплатин
Кальция фолинат
5-фторурацил
50 мг/м 2
85 мг/м 2
200 мг/м 2
2600 мг/м 2
1-й день
1-й день
1-й день
1 -й день, 24-часовая инфузия
3.4. Клиническая стадия IV (M1, за исключением надключичных лимфоузлов)
Основными задачами лечения больных метастатическим РП являются улучшение качества жизни путём устранения симптомов, обусловленных ростом опухоли, и увеличение продолжительности жизни. Оценка эффективности различных режимов ХТ у этой категории больных затруднена в связи с отсутствием рандомизированных исследований, особенно при плоскоклеточном раке. По этой же причине сложно оценить и тот выигрыш, который даёт ХТ по сравнению с симптоматической терапией. Химиотерапия рекомендуется
пациентам в удовлетворительном общем состоянии (по шкале ECOG 0-2 балла) при отсутствии выраженной (III-IV степени) дисфагии, затрудняющей адекватное питание пациента. В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация).
При дисфагии I-II степени ХТ позволяет добиться уменьшения степени её выраженности у ряда больных уже к концу первого курса.
Наиболее эффективными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны. При аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER2).
Лечение IV стадии аденокарцином пищевода и пищеводно-желудочного перехода проводится по принципам лечения рака желудка (см. соответствующую главу).
При плоскоклеточных раках стандартным режимом ХТ остаётся комбинация цисплатина с инфузией 5-фторурацила или капецитабином,частота объективных эффектов при использовании подобных режимов составляется около 35%, а продолжительность жизни не превышает 6-8 мес. Карбоплатин уступает цисплатину по непосредственной эффективности, что ограничивает его применение вне программ ХЛТ.
Применение таксанов возможно в составе двухкомпонентных схем с цисплатином или трёхкомпонентных комбинаций (с цисплатином и фторпиримидинами). В последнем случае ценой большей токсичности удаётся повысить объективный эффект до 48%, однако к удлинению продолжительности жизни это, по-видимому, не приводит.
Оптимальная продолжительность ХТ первой линии неизвестна. При стабилизации процесса на фоне ХТ обычно проводится 4 курса, в случае достижения объективного эффекта — 6 курсов. Стандартной ХТ второй линии не существует.
Её проведение возможно лишь у отдельных пациентов в общем удовлетворительном состоянии, отвечавших на ранее проводимую ХТ. Возможными вариантами являются монотерапия таксанами, гефитиниб. Рекомендуемые
режимы паллиативной ХТ представлены в табл. 4.
3.5. Паллиативное лечение
Наиболее частым симптомом РП является дисфагия. Необходимость в её устранении может возникать на всех этапах лечения и достигается различными методами: эндоскопическими процедурами (баллонная дилатация, электро-,аргонно-плазменная или лазерная деструкция, ФДТ), лучевой терапией (дистанционная или брахитерапия), постановкой внутрипросветных стентов. Эндоскопические процедуры дают быстрый, но кратковременный эффект и подходят в тех случаях, когда в ближайшее время будет начато лечение с предполагаемой высокой эффективностью (хирургическое, лекарственное, лучевое).
В том случаях, когда излечение больного невозможно, оптимальными вариантами коррекции дисфагии является брахитерапия, стентирование пищевода или дистанционная ЛТ. Паллиативная ХЛТ не имеет явных преимуществ по сравнению с ЛТ (без ХТ) и сопряжена с большей токсичностью. По результатам исследования стентирование пищевода позволяет быстрее достичь желаемых эффектов, однако при большем сроке наблюдения в сравнении с брахитерапией частота осложнений (миграция стента, боли, перфорация, желудочно-пищеводный рефлюкс) оказалась выше, а частота полного купирования дисфагии — несколько ниже. При развитии пищеводно-бронхиальных или медиастинальных свищей постановка покрытых стентов позволяет купировать данные осложнения у 70-100% больных.
Активное наблюдение показано больным для раннего выявления рецидива в пищеводе с целью последующего выполнения хирургического вмешательства, либо рецидива в средостении с целью проведения ХЛТ.
• Стадия I (после эндоскопических резекций слизистого/подслизистого слоя) и стадия II-III (после ХЛТ, кандидаты для эзофагэктомии в случае рецидива): ЭГДС — каждые 3-4 мес. в течение первых двух лет, каждые 6 мес. — в течение третьего года, далее ежегодно до общей продолжительности наблюдения 5 лет. КТ органов грудной клетки и органов брюшной полости — каждые 6 мес. в течение первых 2 лет, далее — ежегодно до общей продолжительности наблюдения 5 лет.
• Стадия I-III (после хирургического лечения): КТ органов грудной клетки и органов брюшной полости — каждые 6 мес. в течение первых 2 лет, далее — ежегодно до общей продолжительности 5 лет.
Другие методы обследований у остальных категорий пациентов рекомендуется выполнять при наличии клинических показаний.
Выполнение ПЭТ-КТ и определение маркёров в сыворотке крови для наблюдения за пациентами не рекомендуется.
Коллектив авторов: Трякин А.А., Бесова Н. С., Волков Н. М., Гладков О.А., Давыдов М. М.,
Кононец П. В., Левченко Е. В., Ткачев С. И.
Читайте также:

