Клинический случай лечение рака пищевода
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Актуальность. Рак пищевода (РП) находится в первой десятке опухолей с высокой летальностью. В большинстве случаев на момент постановки диагноза уже имеется III–IV стадия опухолевого процесса. Лечение больных с распространенным опухолевым процессом – чрезвычайно сложная задача, для решения которой используется лучевая терапия в сочетании с химиотерапией. В клинике Медицинского радиологического научного Центра им. А.Ф. Цыба при лечении больных распространенным раком пищевода применяется методика дробления укрупненной дневной дозы (2,5 Гр) на 2 фракции (1–1,5 Гр) с интервалом между фракциями 4 ч. Больные значительно легче переносят лечение, а эффект реканализации пищевода и уменьшение боли при проглатывании пищи наступают значительно раньше, чем при конвенциональном облучении.
Описание клинического случая. Больной обратился в МРНЦ им. А.Ф. Цыба в феврале 2015 г. с жалобами на осиплость голоса и нарушение проходимости пищи. В результате комплексного обследования установлен диагноз рак шейного отдела пищевода с метастазами в лимфатические узлы шеи и в щитовидную железу сТ4N2M1, стеноз пищевода IV степени, протяженность опухоли 7,5 см. Опухоль признана неоперабельной, больному было рекомендовано лучевое лечение с паллиативной целью, выполнена гастростомия. Проведена лучевая терапия опухоли и метастазов в статическом режиме с 3 полей: с двух боковых размером 6×11 см и переднего поля 12×11 см 5 раз в неделю с дроблением дневной дозы. Суммарная очаговая доза составила 60 Гр. Получен полный положительный эффект лечения. Через 2 мес больному проведены 3 курса двухкомпонентной химиотерапии. В январе 2016 г. выполнена тиреоидэктомия с микрохирургическим невролизом гортанных нервов. Больной находится под наблюдением 3 года 7 мес после лечения, жалоб не предъявляет.
Заключение. Применение нестандартных режимов фракционирования лучевой терапии в сочетании с химиотерапией позволяет получить удовлетворительные результаты лечения больных с распространенным раком пищевода.
доктор медицинских наук, радиолог, отделение радиотерапии,
г. Обнинск, 249036, ул. Королева, 4
доктор медицинских наук, ведущий научный сотрудник, отделение радиохирургического лечения закрытыми радионуклидами,
г. Обнинск, 249036, ул. Королева, 4
врач-рентгенолог, рентгенодиагностическое отделение,
г. Обнинск, 249036, ул. Королева, 4
1. Чиссов В.В., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2008 году (заболеваемость и смертность). М., 2010. 250.
2. Мерабишвили В.М. Динамика показателей деятельности онкологической службы Санкт-Петербурга по районам города в 2007–2009 г. СПб., 2010. 35.
3. Мельникова О.А. Рак пищевода: клиническая картина и стадирование заболевания. Практическая онкология. 2003; 4(2): 66–69.
4. Соколов В.В., Павлов П.В., Чиссов В.И., Вашакмадзе Л.А., Бойко А.В. Методы реканализации и стентирования при стенозирующем раке пищевода, желудка и 12-перстной кишки (обзор литературы). Сибирский онкологический журнал. 2012; 5: 64–73.
5. Стилиди И.С., Бохян В.Ю., Тер-Ованесов М.Д. Результаты и перспективы хирургического лечения больных раком грудного отдела пищевода. Практическая онкология. 2003; 4(2); 70–75.
6. Моисеенко В.М. Возможности современного лекарственного лечения больных раком пищевода. Практическая онкология. 2003; 4(2): 83–90.
7. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2016 году. М., 2018. 236.
8. Давыдов М.И., Стилиди И.С., Бохян В.Ю., Сулейманов Э.А., Трякин А.А., Кононец П.В., Тюляндин С.А. Промежуточные результаты применения предоперационной химиотерапии и расширенной субтотальной резекции пищевода при раке. Анналы хирургии. 2005; 3: 27–32.
9. Канаев С.В., Щербаков А.М., Тюряева Е.И., Аванесян А.А. Консервативное лечение местно-распространенного и неоперабельного рака пищевода: возможности и перспективы. Вопросы онкологии. 2012; 58(2): 199–202.
10. Ложков А.А., Важенин А.В., Шарабура Т.М., Кулаев К.И., Зуйков К.С., Юсупов И.М. Результаты сочетанной лучевой терапии рака пищевода с применением брахитерапии высокой мощности. Сибирский онкологический журнал. 2017; 16(1): 71–75. doi: 10.21294/1814-4861.
11. Левченко Е.В., Дворецкий С.Ю., Канаев С.В., Щербаков А.М., Барчук А.С., Тюряева Е.И., Раджабова З.А., Семенова А.И., Комаров И.В., Аванесян А.А. Опыт использования внутрипросветной брахитерапии в комплексном лечении рака пищевода. Злокачественные опухоли. 2012; 2(2): 52–56. doi: 10.18027/2224- 5057-2012-2-52-56.
12. Алиев Д.А., Исаев И.Г., Насирова Г.Г., Кулиева Н.Г., Акперов К.С., Казиева Р.Р. Внутриполостная лучевая терапия рака пищевода с применением источника высокой мощности дозы Ir192. Медицинские новости. 2014; 8 (239): 53–56.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Заболеваемость
В среднем заболеваемость раком пищевода в странах Евросоюза составляет 4,5/100 тыс. населения в год (43700 случаев), с диапазоном 3/100 тыс. в Греции до 10/100 тыс. во Франции. Смертность у мужчин составляет 5,4/100 тыс. (20750 смертей в год) и 1,1/100 тыс. среди женщин (6950 смертей в год).
Главными факторами риска для плоскоклеточного рака в западных странах являются курение и злоупотребление алкоголем, тогда как для аденокарцином это гастроэзофагеальный рефлюкс и ожирение. За последние годы доля аденокарцином пищевода быстро возрастает в западных странах, составляя в настоящее время около половины всех раков пищевода.
Диагноз
Диагноз устанавливается на основании данных эндоскопической биопсии и результатов гистологического заключения в соответствие с критериями ВОЗ. Необходимо отдельно выделять мелкоклеточный рак от плоскоклеточного рака и аденокарциномы для проведения соответствующей терапии.
Стадирование
План обследования включает в себя клинический осмотр, общий и биохимический анализы крови, эндоскопическое исследование (включая эндоскопию верхних дыхательных и пищеварительных путей при плоскоклеточном раке), рентгенографию пищевода с контрастом, компьютерную томографию шеи, органов грудной клетки и брюшной полости.
У больных, кандидатов для оперативного лечения, выполняется эндоскопическая ультрасонография для оценки распространенности процесса по критериям T и N [II, B].
Выполнение бронхоскопии рекомендуется пациентам с опухолью грудного отдела пищевода для исключения прорастания трахеи.
Позитронно-эмиссионная томография (ПЭТ) может быть полезна в выявлении отдаленных метастазов или в диагностике прогрессирования заболевания [II, B]. ПЭТ/КТ предпочтительнее простой ПЭТ.
При местно-распространенных (Т3/Т4) аденокарциномах пищеводно-желудочного перехода для исключения метастазирования по брюшине возможно выполнение лапароскопии [II,А].
В выборе локального метода лечения первостепенное значение имеет локализация опухоли: шейный, внутригрудной отделы или пищеводно-желудочный переход [IV,C].
Стадирование процесса осуществляется в соответствие с системой TNM 2009 года и последующим определением стадии по AJCC (таблица №1).
Лечение
Планирование лечения должно обязательно осуществляться мультидисциплинарной группой.
Операция остается стандартным лечением для операбельных пациентов с локализованными опухолями (Tis-T3 N0-1 M0). Трансторакальная эзофагэктомия с двухзональной лимфодиссекцией рекомендована при плоскоклеточном раке внутригрудной локализации [III,C]. Для опухолей шейного отдела пищевода стандартного лечения не существует. Оптимальный объем хирургического лечения при аденокарциномах также все еще не определен.
Пред- или послеоперационная лучевая терапия не улучшает выживаемости больных в сравнении с одной операцией [I,A]. Такое лечение не может быть рекомендовано в качестве стандартного подхода.
Как было показано в мета-анализах и одном недавнем рандомизированном исследовании, предоперационная химиолучевая терапия улучшает общую выживаемость [I,B]. Тем не менее, учитывая высокую летальность данного подхода, до конца не ясно, какие пациенты (стадия, локализация опухоли, гистология) имеют наибольший выигрыш от ее проведения.
Существующие данные свидетельствуют о пользе предоперационной химиотерапии при всех вариантах рака пищевода, хотя эффект наиболее выражен при аденокарциномах. Больным аденокарциномой нижней трети пищевода или пищеводно-желудочного соустья возможно назначение пред- и послеоперационной химиотерапии [I, B].
Лечение локализованных стадий (TisT2 NO1)
Оперативное лечение является стандартным при ранних стадиях заболевания, несмотря на то, что при поражении регионарных лимфоузлов длительная выживаемость не превышает 25%. Эндоскопическая резекция слизистой может выполняться в опытных центрах [II, B].
При противопоказаниях к операции или отказе пациента от нее показано проведение химиолучевой терапии, эффективность которой превосходит одну лучевую [I,A]. Четыре курса цисплатина с инфузиями 5-фторурацила с одновременной лучевой терапией 50,4Гр является стандартными в США. Увеличение СОД до 60Гр и выше часто используется в Европе и Японии при облучении по радикальной программе совместно с химиотерапией.
При аденокарциномах пищевода периоперационная химиотерапия является стандартным подходом.
Лечение распространенного процесса (ТЗТ4 N01 или Т04 Т01 М1)
Хирургическое лечение в качестве самостоятельного метода не является стандартным подходом при данной распространенности, поскольку радикальная резекция возможна лишь в 70% случаев при рТ3 и 50% при рТ4. Более того, длительная выживаемость после радикального хирургического лечения не превышает 20%.
Как показано в исследованиях III фаз, проведение предоперационной химиотерапии или предоперационной химиолучевой терапии повышает частоту радикальных вмешательств, уменьшает частоту местных рецидивов и, как следствие, улучшает выживаемость [Ia,А]. Однако существует мнение, что предоперационная химиолучевая терапия может повышать послеоперационную летальность.
В случае объективного ответа опухоли на химиолучевую терапию при СОД 45-50Гр дальнейшее продолжение химиолучевого лечения приводит к тем же отдаленным результатам, что и при хирургическом лечении, хотя и частота местных рецидивов при консервативном подходе выше. Это подтверждается результатами французского (FFCD 9102) и немецкого исследований [I,B]. Поэтому химиолучевая терапия с последующим тщательным наблюдением и возможным выполнением операции в случае местного рецидива может рассматриваться как радикальное лечение.
Аденокарцинома:
Периоперационная химиотерапия на основе цисплатина и 5-фторурацила должна рассматриваться как стандарт лечения местнораспространенных аденокарцином. Совместное использование комбинации цисплатин/5фторурацил с лучевой терапией (СОД 40Гр) и последующим хирургическим лечением может рассматриваться как один из вариантов для отдельных больных. Последний подход поддерживают результаты недавнего мета-анализа. А в недавнем рандомизированном исследовании III фазы было показано преимущество предоперационной химиолучевой над одной химиотерапией при аденокарциномах пищевода.
Лечение метастатической болезни (IV стадия)
Пациентам с метастатическим раком пищевода возможно проведение различных вариантов симптоматического лечения в зависимости от клинической ситуации. Брахитерапия (1 фракция 12 Гр) представляется наиболее оптимальным вариантом коррекции дисфагии, обеспечивая лучший контроль при меньшей частоте осложнений по сравнению со стентированием [I,B].
Оценка эффекта
Эффект терапии оценивается по общепринятой методике, включающей сбор жалоб, рентгенографию пищевода, эндоскопическое исследование с биопсией, КТ.
Наблюдение
За исключением больных, являющихся кандидатами для хирургического лечения в случае рецидива, нет данных, что регулярные наблюдения за больными после завершения начальной терапии влияют на выживаемость. Показаниям к визитам должны быть симптомы, вопросы по питанию и психосоциальные проблемы [IV,D].
Общепризнано, что хирургическое лечение лучше всего подходит для лечения аденокарциномы пищевода (почти всегда это поражения нижней трети), в случае если повреждения операбельны. В большинстве других случаев, особенно для поражений в верхней трети и шейной части пищевода, лучшим выбором лечения является сочетание химиотерапии и лучевой терапии. Хирург или радиотерапевт должен определить тип лечения (радикальное или паллиативное) до начала местной терапии.
При продумывании радикальной хирургической операции для пациентов, которые в целом подходят для нее и не имеют признаков отдаленного метастазирования, важно определить степень поражения до проведения окончательной резекции. Для этого рекомендуется пробная лапаротомия, ставшая обычной частью многих операций, когда восстановление достигается путем перемещения (транспозиции) ободочной кишки и создания тем самым жизнеспособного канала между глоткой и желудком.
Радикальное удаление пищевода, проведенное Черни (Czerny) впервые более 100 лет назад, проводится в настоящее время в одну стадию с желудочно-пищеводным анастомозом или перемещением (транспозицией) ободочной кишки. Раньше при проведении операций оставляли постоянную гастростому для обеспечения питания.
Только меньшая часть больных раком пищевода могут быть радикально оперированы, самое частое показание к такой операции — поражения средней или нижней трети пищевода, особенно если по гистологии это поражение представляет собой аденокарциному, при этом подходят больные без явных признаков наличия метастазов. До недавнего времени практически не было указаний на то, что предоперационная лучевая терапия или химиотерапия оказывает влияние на степень радикальности резекции, коэффициенты смертности при операции или суммарного выживания.
Но в недавнем крупномасштабном исследовании в Великобритании показано поразительное улучшение при применении предоперационного сочетания химиотерапии (цисплатином и фторурацилом) с лучевой терапией. Коэффициенты выживаемости за 2 года составили 43% и 34% (с использованием химиотерапии и без нее); медиана коэффициентов выживаемости (с применением химиотерапии) равнялась 16,8 месяца по сравнению с 13,3 месяца (без нее). Данные предыдущих исследований были неутешительны.
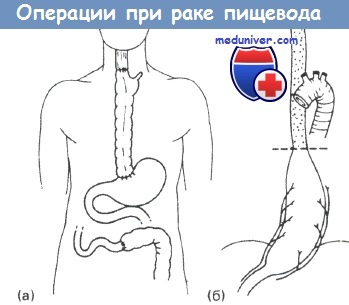
Операция при раке пищевода:
(а) полное удаление пищевода с замещением ободочной кишкой;
(б) мобилизация желудка и низведение в случае карциномы нижней трети пищевода.
Для больных карциномой верхней трети пищевода в качестве лечения обычно выбирают лучевую терапию, однако некоторые врачи склоняются в этом случае к хирургическому лечению. Рандомизированного сравнения этих типов лечения не проводилось. Сочетания химиорадиотерапии сейчас считаются гораздо более эффективными, чем только лучевая терапия.
Лучевая терапия (с сопутствующей химиотерапией или без нее) по сравнению с операцией обладает рядом преимуществ, в том числе более широкой применимостью (ведь большинство больных находятся в пожилом возрасте и плохо питаются), возможностью избежать ларингэктомии, а также значительным облегчением дисфагии для большинства пациентов, с излечиванием, как минимум, 10% пациентов из способных перенести высокие дозы: всего 60 Гр ежедневными порциями в течение 6 недель. К тому же хирургическое лечение характеризуется смертностью приблизительно на уровне 10% (рис. 14.6), оно в отличие от лучевой терапии не подходит для больных с региональным распространением болезни.
И действительно, в классическом обзоре приводится коэффициент смертности, равный 29% по больным во всем мире, получавшим лечение в 1970-е годы, правда, смертность при операциях снизилась с улучшением подбора больных, хирургической техники и поддерживающего лечения. Несмотря на плохие общие результаты, при операции есть преимущество — временное облегчение может быть очень хорошим, а также, как и при лучевой терапии, в некоторых случаях это может привести к излечиванию.
Верхнюю треть пищевода технически сложно подвергнуть облучению из-за длины области обработки и близости спинного мозга. Зоны облучения в идеальном случае должны простираться, как минимум, на 5 см выше и ниже от известных пределов распространения болезни, чтобы адекватно обработать возможное распространение поражения в подслизистом слое стенки. Как и при постперстневидных карциномах, здесь нередко требуется применение сложных технических приемов, с использованием переплетенных, заклиненных, наклонных, множественных полей облучения, часто с компенсаторами (трансформаторами).
Также необходимо тщательное планирование облучения на двух или трех уровнях, чтобы ткань цилиндрической формы получила одинаковую высокую дозу радиации, но при этом чтобы не произошло сверхоблучения прилегающего спинного мозга.
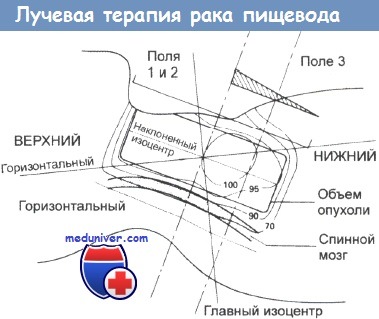
Радикальная лучевая терапия в случае карциномы шейного отдела пищевода.
В связи с несимметричной анатомией необходим план сложного многопольного облучения.
При опухолях средней трети пищевода в качестве основного лечения все больше и больше применяется лучевая терапия, иногда в сочетании с операцией. Некоторые хирурги полагают, что операция протекает легче, и долговременные ее результаты лучше при проведении предоперационного облучения. В техническом плане предоперационную и радикальную лучевую терапию опухолей средней трети пищевода проводить легче, чем опухолей верхней трети пищевода. Как и в отношении опухолей верхней трети пищевода, в настоящее время синхронная химио- и лучевая терапия широко применяются для средней трети пищевода; в нашем центре стандартом лечения является сейчас комбинация митомицина С и 5-ФУ.
В случае рака нижней трети пищевода часто предпочтительна операция, при этом реконструкция, обычно проводимая с мобилизованным желудком, менее сложна.
При раке нижней трети пищевода существует риск того, что желудок будет затронут опухолью и окажется не подходящим для проведения реконструкции. Для неоперабельных опухолей полезной может быть лучевая терапия.
Осложнения при лечении опухолей всех отделов могут быть непростыми или даже тяжелыми как в случае лучевой терапии, так и при операции. Радикальная лучевая терапия часто сопровождается радиационным воспалением пищевода (эзофагитом), требующим лечения щелочными или аспирин-содержащими суспензиями для местного воздействия на воспаленную слизистую пищевода.
Возможные более поздние осложнения включают радиационное повреждение спинного мозга и легких, что ведет к радиационному пульмониту и иногда одышке, кашлю и уменьшению дыхательной емкости, но в повседневной практике такие явления редки. Фиброз и рубцевание пищевода приводят к его стриктуре, из-за чего может потребоваться расширение для сохранения раскрытого состояния пищевода. Несмотря на вышеизложенные факты, большинство больных переносят такое лечение на удивление хорошо, даже при применении химиотерапии.
К хирургическим осложнениям относятся стриктура пищевода и несостоятельность анастомоза, в результате этого — медиастинит, пульмонит и сепсис, иногда приводящие к смерти больного.
У больных с дисплазией высокой степени в пищеводе Барретта многообещающим оказалось использование фотодинамической терапии. Пока еще данные собраны по небольшому числу больных, но такой способ лечения уже признан Национальным институтом клинического искусства (NICE) подходящим в некоторых случаях.
Паллиативное лечение при раке пищевода может быть очень полезным с применением Целестинского или другого постоянного протеза, лучевой терапии или лазерного лечения (а также их обоих), или иногда при обходной операции, без попытки удалить место первичной опухоли, но с созданием альтернативного канала. Для пациентов, которых нельзя подвергать радикальной операции и лучевой терапии, нужно всегда рассматривать возможность паллиативного лечения, особенно в случаях тяжелой дисфагии. Умеренные дозы облучения могут приводить к выраженным клиническиим улучшениям.
В опытных руках проведение Целестинской или растяжимой пищеводной трубки с металлической сеткой является относительно безопасной и эффективной процедурой, которую можно сочетать с лучевой терапией. Распространенные проблемы при введении трубки включают ее перемещение, желудочно-пищеводный свищ (иногда связанный с попаданием в легкие содержимого желудка), загрудинные боли и дискомфорт. Осложнения при паллиативном облучении минимальны, так как используются низкие дозы: обычно благотворно влияет лечение дозой 30 Гр на протяжении 2-недельного периода, если дисфагия не тотальная, и высокие дозы редко бывают нужны. В нашем центре широко используется внутрипищеводная брахитерапия, предлагающая простую и быструю альтернативу.
С начала 1990-х годов все больше возрастает роль лазерной терапии, которую можно применять в сочетании с лучевой терапией. При этом сразу восстанавливается способность глотать, иногда даже после первого сеанса, и процедуру легко можно повторять. Для больных с нерезектабельной опухолью такое лечение бывает наилучшим и наименее травматичным способом для временного облегчения.
Интересным дополнением к применению лазерной терапии стала идея фототерапии. При этом до начала лазерной терапии больной получает производные фталоциамина, которые захватываются преимущественно опухолью, что повышает избирательность лечения.
Рак пищевода представляет собой опухоль злокачественного характера, происходящую из эпителиальных клеток пищевода. Заболевание берет начало с внутреннего слоя, то есть слизистой оболочки, а затем распространяется наружу, преодолевая подслизистый и мышечный слои.
Существует два основных вида такого заболевания:
- Плоскоклеточный рак. Он возникает из клеток, составляющих слизистую оболочку пищевода. Чаще всего встречается в зоне шеи, а также двух верхних третей грудной клетки.
- Аденокарцинома, другими словами – железистый рак. Чаще всего диагностируется в нижней трети пищевода. Вначале происходит замещение железистого эпителия плоскоклеточным (при пищеводе Барретта).
Статистика
Чаще всего (до 80% случаев) новообразование находится в нижне- и среднегрудном отделах пищевода. С частотой 10-15% случаев диагностируется рак шейного отдела пищевода.
Факторы риска
Основные факторы риска возникновения и развития такой болезни:
- мужской пол, потому что мужчины чаще подвержены вредным привычкам – курению и употреблению спиртного в больших количествах;
- возраст – чем он больше, тем выше риск, лишь 15% пациентов были младше 55-ти лет;
- избыточная масса тела;
- курение и злоупотребление спиртным;
- употребление очень горячих напитков и еды;
- пищевод Барретта (когда в нижней части пищевода возникает клеточное перерождение, вызываемое кислотным повреждением хронической формы);
- рефлюкс;
- ахалазия (когда нарушена запирательная функция отверстия между желудком и пищеводом);
- рубцы в пищеводе, приведшие к его сужению;
- синдром Пламмера-Винсона (для такого синдрома характерна триада, то есть три вида нарушений одновременно: нарушенная глотательная функция, суженный пищевод, железодефицитная анемия);
- контакт с химикатами.
Примерно у 1/3 заболевших диагностирован ВПЧ (вирус папилломы человека).
Риск заболеть этим видом рака можно снизить, если разнообразно питаться, не пить крепкий алкоголь, а при наличии синдрома Барретта отслеживать изменения в слизистой оболочке.
Скрининг этого заболевания не проводится. Однако при повышенном риске появления рака пищевода рекомендуется проходить эндоскопическое исследование, при необходимости с биопсией подозрительной зоны.
Симптомы
Обычно рак пищевода обнаруживается на поздних стадиях, когда терапия уже осложнена, или случайно.
Наиболее частая симптоматика включает следующее:
Есть и более редкие симптомы:
- кашель;
- икота;
- хриплый голос;
- рвота;
- костные боли (при наличии метастазов);
- пищеводное кровотечение (после того как кровь проходит по ЖКТ, стул окрашивается в черный цвет);
- как следствие кровотечения – анемия (человек становится бледным, слабым, быстро утомляется, испытывает постоянную сонливость).
Важно! Наличие подобных симптомов еще не означает рак. Однако нужно обязательно обратиться к врачу и обследоваться.
Классификация рака пищевода
По области возникновения:
- внутригрудной отдел пищевода;
- шейный отдел (от нижней границы перстневидного хряща до входа в грудную полость);
- верхняя грудная зона (от входа в грудную полость до области бифуркации трахеи);
- средняя грудная область (проксимальная часть пищевода распространяется от зоны бифуркации трахеи до соединения пищевода с желудком);
- нижняя грудная область (дистальная часть пищевода примерно 10 см в длине, включая абдоминальную часть пищевода, распространяется от зоны бифуркации трахеи до соединения пищевода и желудка).
По характеру роста опухоли:
- в просвет пищевода (экзофитный);
- язвенный (эндофитный);
- круговая форма (инфильтративный склерозирующий).
По степени дифференцировки новообразования:
- степень не определена – Gx;
- высокодифференцированное образование – G1;
- умеренно дифференцированное – G2;
- малодифференцированное – G3;
- недифференцируемое – G4.

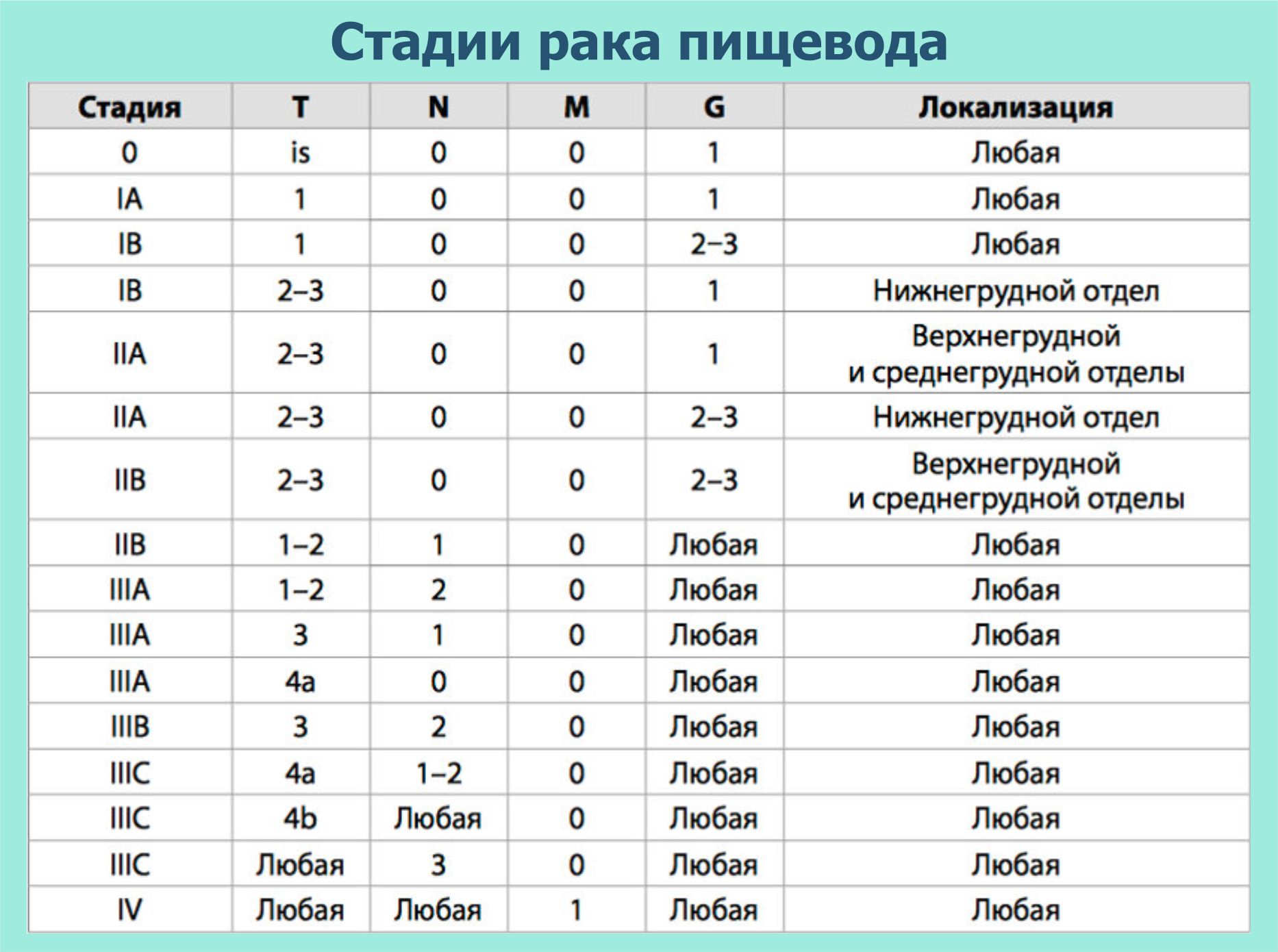
Стадии рака пищевода
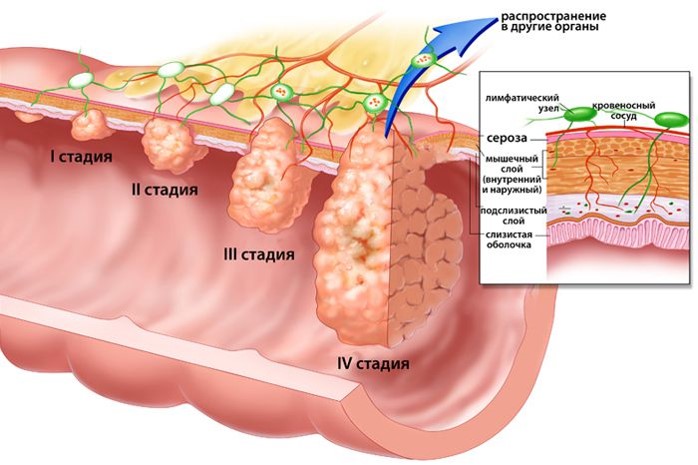
Предлагаем ознакомиться с таблицей стадирования заболевания:
Диагностика
Диагностирование осуществляется инструментальными и лабораторными методами.
-
Рентгенография с бариевым контрастом. Пациент принимает внутрь сульфат бария, который обволакивает стенки пищевода. Это позволяет увидеть на снимке рельеф стенок и обнаружить сужение просвета. На ранней стадии рак может иметь вид небольших круглых выпуклостей, то есть бляшек. На поздней стадии развития новообразование принимает вид большой опухоли неправильной формы, которая может вызывать сильное сужение пищевода. Рентгенография также позволяет диагностировать трахеопищеводную фистулу, то есть когда из-за разрушения новообразованием стенки пищевода на всю толщину пищевод начинает сообщаться с трахеей.
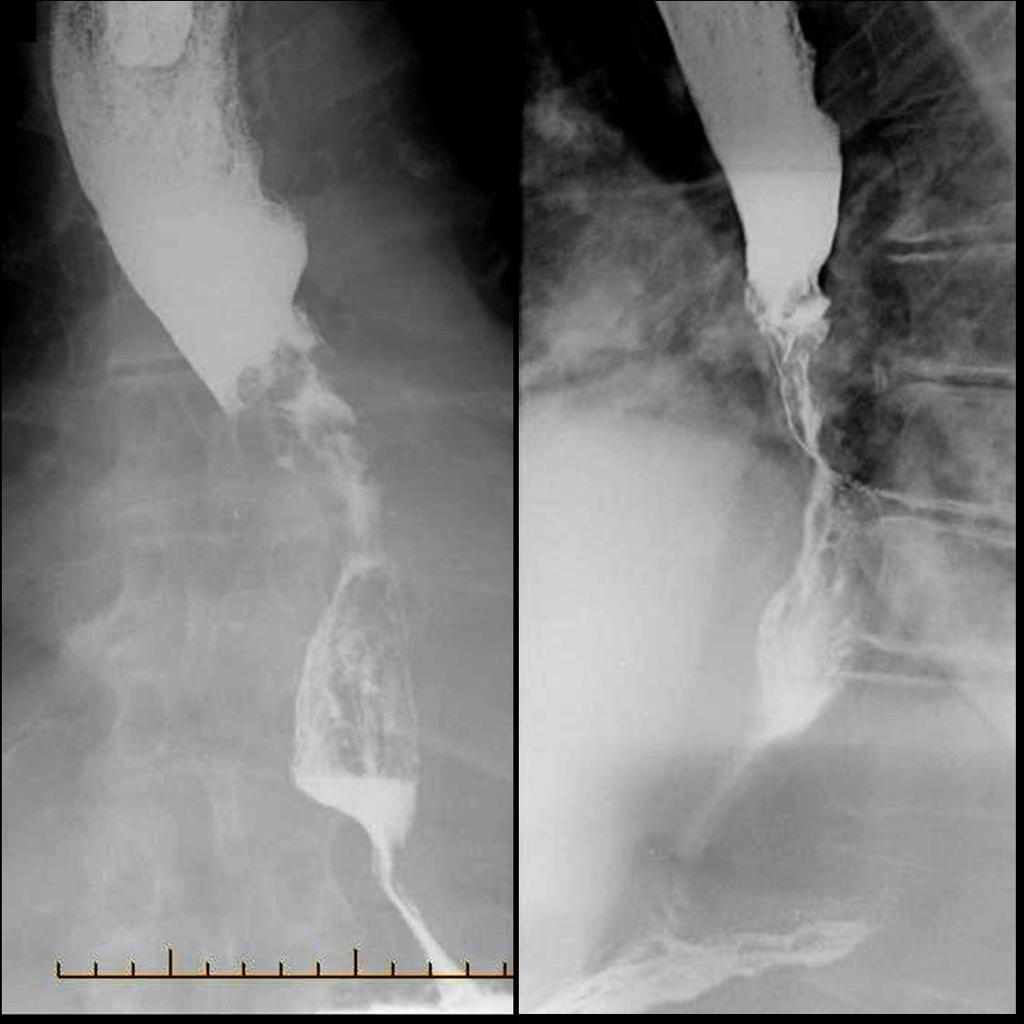
Рентгенодиагностика рака пищевода
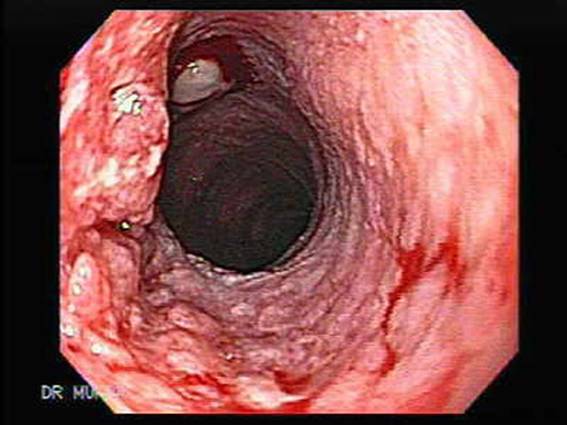
Эндоскопическая картина аденокарциномы
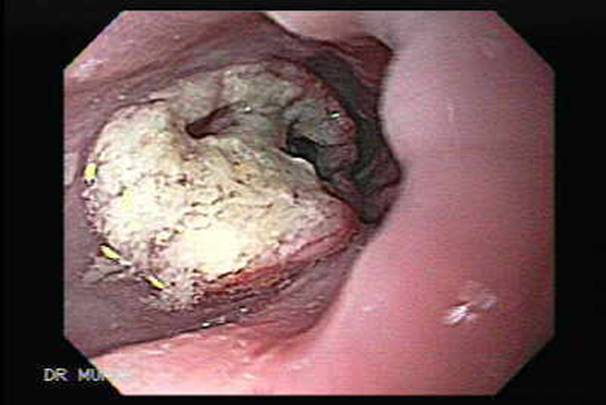
Эндоскопическая картина плоскоклеточного рака
- Клинический анализ крови. Позволяет выявить анемию, которая возникает из-за кровотечения или скудного рациона.
- Биохимический анализ крови. Он показывает состояние внутренних органов, а именно почек, печени и др.
- Анализ на онкомаркеры СА 19-9, РЭА.
- Исследование биоматериала, взятого во время биопсии. В нем определяют рецепторы белка HER2. При их наличии против новообразования можно использовать таргетную терапию.
Лечение
Основной метод лечения – хирургическая операция, однако комплексный подход позволяет улучшить результаты. Поэтому различные методики комбинируются.
В ходе операции удаляют пищевод целиком или его часть, все зависит от распространенности и локализации патологического процесса.
Когда опухоль находится в шейном отделе, удаляют большую часть пищевода. После этого желудок поднимают и подшивают к оставшейся части пищевода. Кроме того, вместо удаленной части методом пластической операции может быть использована часть толстой или тонкой кишки. При возможности выполнения резекции шейного отдела пищевода может быть выполнена пластика кишкой с микрососудистым анастомозом сосудов на шее.
При локализации опухоли в шейном отделе пищевода с большим распространением приходится выполнять операцию в объеме: удаления фаринголарингоэктомии с одномоментной пластикой пищевода желудочным трансплантатом, с пришиванием его к корню языка.
Хирургическое вмешательство по удалению части пищевода с последующим замещением трансплантатом может быть проведено открытым способом или методом торакоскопии и лапароскопии.
При любом типе вмешательства удаляют регионарные лимфоузлы, которые потом исследуют в лаборатории методом гистологии. Если в них обнаруживаются раковые клетки, то после операции пациенту прописывают лучевое лечение или химиотерапию в комбинации с ЛТ.
Также существуют паллиативные операции. Их проводят для того, чтобы пациент мог питаться, если из-за опухоли он не может глотать. Этот тип вмешательства называется гастростома, то есть введение через переднюю брюшную стенку в желудок специальной трубки для питания.
Применяется ионизирующее излучение с целью уничтожения клеток новообразования. Такая терапия может проводиться:
Разновидности лучевого лечения:
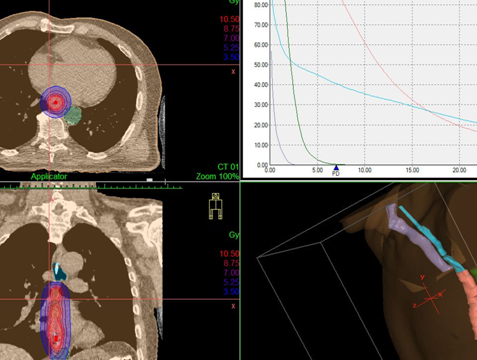
Дозное распределение, получаемое при дистанционной конформной лучевой терапии и внутрипросветной брахитерапии
Данная методика представляет собой введение в организм препаратов, затормаживающих жизнедеятельность опухолевых клеток или уничтожающих их. Лекарственные средства принимаются внутрь или вводятся в вену, после чего попадают в кровоток и достигают почти всех областей организма.
Химиотерапия осуществляется циклами. Это связано с тем, что действие препарата направлено на те клетки, которые постоянно делятся. Введение повторяется через определенное число дней, что связано с клеточным циклом. Циклы химиотерапии, как правило, имеют продолжительность 2-4 недели, больным обычно показано несколько циклов.
Как и облучение, химиотерапия показана в адъювантном и неоадъвантном режимах. Также она применяется, чтобы облегчить симптоматику тем больным, у которых рак распространен и не поддается хирургическому лечению.
Направлена на блокировку роста новообразования путем воздействия на определенные мишени, то есть на те молекулы, которыми определяются деление и рост опухоли. Если в биоматериале, взятом методом биопсии, находят такие белковые молекулы, то может быть эффективна именно таргетная терапия.
При проведении паллиативной терапии применяют следующие методики:
- Бужирование, то есть расширение пищевода.
- Установку стентов эндоскопическим методом. Стенты – это полые цилиндры, которые устанавливаются в просвет пищевода, чтобы обеспечить проходимость пищи.
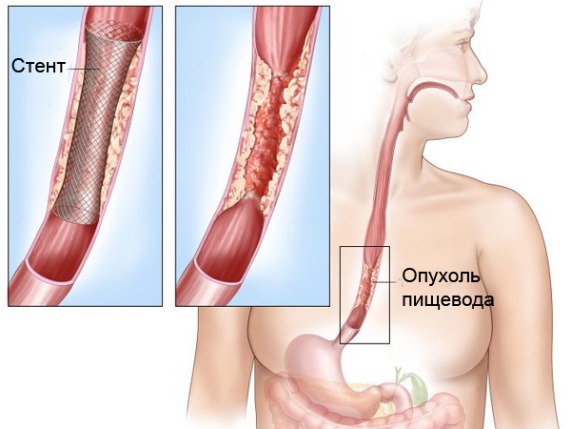
Стентирование рака пищевода
Лечение рака пищевода изменяется в зависимости от стадии
Обычно применяются эндоскопические методики лечения:
- PDT, или фотодинамическая терапия;
- RFA, то есть радиочастотная абляция;
- EMR, эндоскопическое удаление опухоли слизистой оболочки (после этого обеспечивается длительное наблюдение с применением эндоскопии, чтобы вовремя заметить рецидив, если он возникнет).
Новообразование затрагивает мышечную или собственную пластинку слизистой, но не поражает другие органы и лимфоузлы.
- Рак T1. Заболевание на ранней стадии, когда оно находится только в небольшой зоне слизистой и не достигло подслизистой основы (новообразования Т1а), может быть удалено путем эндоскопической резекции в рамках слизистой или подслизистого слоя. Иногда медики рекомендуют хирургически удалить часть пищевода, а затем провести облучение и химиотерапию.
- Рак Т2. Опухоль затрагивает мышечную пластинку слизистой. Таким пациентам перед операцией проводятся химиотерапия и облучение. Исключительно хирургическое удаление рекомендовано, только когда новообразование менее 2 см в размере.
Когда рак локализуется в зоне шеи, вместо операции в качестве основного метода лечения могут быть рекомендованы облучение и химиотерапия.
На второй стадии опухоль распространяется на главный мышечный слой пищевода либо его наружную оболочку. Также новообразование поражает 1 или 2 расположенных рядом лимфоузла.
При третьей стадии новообразование прорастает на наружную оболочку пищевода, может распространяться на соседние органы, им поражены регионарные лимфоузлы. Рекомендовано комбинированное лечение, которое включает операцию и предваряющие ее химиотерапию либо химиотерапию в сочетании с облучением. Если по состоянию здоровья для пациента есть риск не пережить операцию, то химиотерапия в сочетании с облучением становится основным методом лечения.
Рак затрагивает отдаленные лимфоузлы, есть метастазы в отдаленных органах (легких, печени). На такой стадии основная цель лечения – как можно более долгий контроль над распространением и размером новообразования. Пациентам проводится симптоматическое лечение для облегчения боли, восстановления возможности питаться и др. Применяется лучевая терапия и химиотерапия.
Профилактика
Чтобы предупредить такое заболевание, нужно исключить алкоголь и курение, контролировать массу тела. Если у человека присутствует повышенный риск развития этого типа рака (это такие патологии, как пищевод Барретта, ахалазия кардии, стриктуры пищевода, хронические эзофагит), то он должен регулярно обследоваться с обязательным применением эндоскопии.
Важно! Если рано диагностировать рак пищевода, то его можно вылечить с вероятностью от 85% до 100%.
Когда лечение рака завершено, нужно регулярно проходить контрольные обследования:
- После радикального лечения, сочетающего хирургию, химиотерапию и лучевую терапию: в первые 2 года – каждые 3-6 месяцев, в следующие 3-5 лет – каждые 6-12 месяцев, затем – каждый год.
- Тем, у кого был обнаружен ранний рак и кто подвергся эндоскопическому удалению слизистой: в первый год – каждые 3 месяца эндоскопическое обследование, во 2-й и 3-й годы – каждые полгода, затем – каждый год.


Авторская публикация:
Бекяшева Зоя Салаватовна
Ординатор хирургического отделения опухолей головы и шеи
НМИЦ онкологии им Н.Н. Петрова

Под научной редакцией:
Раджабова Замира Ахмедовна
Заведующий отделением опухолей головы и шеи, врач-онколог, научный сотрудник, доцент, кандидат наук
НМИЦ онкологии им. Н.Н. Петрова
Читайте также:

