Инновационные технологии в лечении рака легкого
По данным Минздрава РФ, только в 2018 году в мире было зарегистрировано около 18 миллионов новых случаев рака и других злокачественных новообразований. Всемирная организация здравоохранения (ВОЗ) утверждает, что с онкологическими заболеваниями сталкивается каждый пятый мужчина и каждая шестая женщина.
Новые методы лечения рака позволяют помочь пациентам, которые ранее могли рассчитывать только на паллиативную помощь.
Люди, далекие от медицины и сами врачи связывают терапию онкологических заболеваний с массивными, калечащими операциями, изнуряющей химиотерапией, которая переносится тяжелее, чем сами симптомы болезни, долгим восстановлением и постоянным страхом, что болезнь вернется.
Как развивается рак
Клетки организма размножаются делением и начинают умирать после 50-52 циклов. Процесс естественной гибели называется апоптоз. Зараженные вирусом, мутирующие клетки выставляют на своих оболочках специальные маркеры. Их распознает и немедленно уничтожает иммунная система. Соседние клетки утилизируют продукты распада.
Бесконтрольное размножение приводит к тому, что клетки не успевают созревать, утрачивают свои свойства. Они распространяются в окружающие ткани или мигрируют с кровью, лимфой, образуя метастазы. Канцерогенез - процесс перерождения обычных клеток в атипичные.
Как работает традиционное лечение
Стандартные современные методы лечения рака направлены на уничтожение опухоли различными способами:
- оперативное вмешательство;
- введение химиопрепаратов;
- лучевая или радиотерапия
- иммунотерапия
При хирургическом лечении врач удаляет массив атипичных клеток. К недостаткам метода относят невозможность убедиться на месте, что рак удален в полном объеме, и сложность проведения операции в труднодоступных местах.
Во время химиотерапии пациент получает лекарства, которые нарушают жизнедеятельность, тормозят размножение клеток опухоли или стимулируют их апоптоз. Препараты воздействуют и на здоровые ткани организма, что ухудшает переносимость лечения. У ряда пациентов рак может и не реагировать на стандартные средства.
Радиотерапия борьба с опухолью различными видами излучения. Она повреждает ДНК быстро делящихся клеток, приводя к их гибели. Недостаток метода заключается в невозможности прицельного воздействия только на патологический очаг.
Чтобы стандартное лечение помогло пациенту, необходимо стечение обстоятельств:
- небольшой размер и хорошая доступность первичной опухоли,
- низкая злокачественность и хороший ответ на препараты,
- хорошая переносимость курса терапии.
А как же быть тем, чья история борьбы с раком осложнена отягчающими обстоятельствами? В области онкологии новости лечения связаны с преодолением стандартных проблем терапии:
- нечувствительность рака к препаратам или облучению;
- невозможность воздействия только на клетки опухоли;
- большой объем образования и риск непереносимости терапии;
- риск оставить рак на месте после операции.
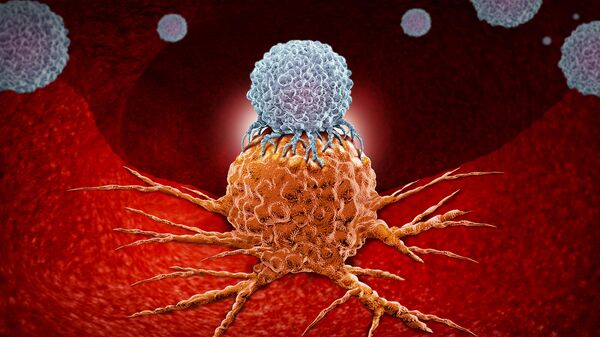
Если иммунная система пропускает начало опухолевого процесса, болезнь прогрессирует. Раковые клетки действуют хитростью, маскируя свои рецепторы специальными белками.
Микробиологи изобрели так называемые моноклональные антитела. Это белковые молекулы, имеющие сродство только к определенным рецепторам. Антитела связываются с раковыми клетками, не только делая их видимыми для иммунной системы, но активируя их уничтожение.
Моноклональные антитела созданы для молекул, отвечающих за развитие разных заболеваний. Этот принцип лег в основу таргетной (прицельной) терапии. Например, препарат Ритуксимаб эффективен при лечении B-клеточных лимфом, Цетуксимаб для борьбы с раком толстой и прямой кишки, опухолями головы и шеи. Бевацизумаб применяют при опухоли молочной железы, толстого кишечника, головного мозга и немелкоклеточном раке легких.
Эти медикаменты доступны и в России. Первое время их производством занимались только иностранные компании. Пациенты с нечувствительностью к стандартной химиотерапии могли опасаться, что препарат не придет вовремя или будет стоить дороже. С 2012 года российская компания Biocad производит биоаналоги: Гертикад, Авегра, Ацеллбия.
CAR-T – найти и уничтожить
Универсальный рецептор на поверхности позволяет настраивать иммунитет против разных опухолевых антигенов. T-клетки легко проникают внутрь раковой опухоли. Так CAR-T позволяет уничтожать самые мелкие метастазы в головном и спинном мозге, снижая риск рецидива. Генную терапию считают более эффективной по сравнению с моноклональными антителами.
Достижения иммунной терапии
Среди последних новостей в онкологии – официальное разрешение американской федерации FDA на применение CAR-T в борьбе с B-клеточными лимфомами. Препарат Yescarta - лишь второе такое средство за всю историю генной терапии.
Ученые доказали, что применение моноклональных антител в комплексе с CAR-T – один из самых эффективных методов лечения рака у пациентов с плохой переносимостью и резистентностью к традиционной химиотерапии. Так у пациентки с 4 стадией карциномы молочной железы уменьшился в объеме первичный очаг и его метастазы.
В 2018 году Нобелевская премия за метод лечения рака была присуждена двум ученым Джеймсу Эллисону (США). Их исследования продолжались более 20 лет и привели к открытию белка PD-1 и рецепторов CD152 на лимфоцитах, мешающих иммунитету находить и уничтожать раковые клетки. Затем ученые синтезировали препараты, которые решают эту проблему. В перспективе средства позволят увеличить выживаемость при опухолях различной локализации, в том числе при наличии метастазов.
Эти новые методы лечения рака доступны и в России. Среди зарегистрированных зарубежных препаратов: Китруда, Ервой, Тецентрик.
Диагностика и лечение с помощью света
Фотодинамическая терапия основана на использовании светочувствительных веществ (фотосенсибилизаторов) и лазерной установки. Их молекулы поглощают кванты света, уничтожая раковые клетки и разрушая сосуды, питающие опухоль. Невозможность прицельного воздействия лазера позволяла применять его только для видимых кожных опухолей.
Нижегородские ученые синтезировали флуоресцентный белок, который позволяет обнаруживать клетки опухолей. В 2012 году они получили патент на воспроизведение пептида, уничтожающего рак шейки матки в поле лазера.
Прицельное воздействие на опухоль
Радиотерапия сопряжена с риском получения массивного облучения. Во время лечения повреждаются не только раковые, но и здоровые клетки. К самым сложным локализациям опухоли относят голову и шею ввиду опасности повреждения головного мозга и крупных сосудов. Поражение зрения, слуха неизбежно снижает качество жизни пациента. Кроме того, до ряда опухолей нельзя добраться хирургическим путем.
Уничтожить такой рак помогает стереотаксическая гамма-терапии (или гамма-нож). Лучевые диагносты определяют точную локализацию и размеры образования, после чего в патологический очаг направляют до 200 лучей из разных точек. Единственная процедура занимает несколько часов и дает результат, сопоставимый с 30 сеансами облучения.
Гамма-нож – неинвазивная хирургическая процедура, которая позволяет пациентам возвращаться домой в день ее проведения. В 2019 году в России действует 6 установок, позволяющих помочь 3 тысячам пациентов в год. Новости онкологии в этой области обнадеживают онкобольных перспективами открытия 20 таких центров в стране.
Снизить повреждение окружающих тканей возможно благодаря замене рентгеновского излучения на протонное. Оно лучше концентрируется в очаге. В 2018 году немецкие ученые из Центра им. Гельмгольца Дрезден-Россендорф успешно соединили протонную терапию с МРТ-сканером. Ранее визуализацию опухолей выполняли с помощью компьютерной томографии, на которой хорошо отображаются только неподвижные костные образования. Среди новостей в лучевом лечении рака в 2019 году – создание прибора, позволяющего ввести протонное облучение в клиническую практику.
Экспериментальное лечение рака
Внедрение новых методик терапии возможно благодаря клиническим исследованиям. В ходе экспериментального лечения используются методы, эффективность и безопасность которых полностью не изучена. Онкологи проводят набор пациентов с определенным заболеванием. Они полностью обследуют кандидатов и отсеивают тех, кто не подходит по состоянию здоровья.
Лица, прошедшие скрининг, получают бесплатную экспериментальную терапию. К ней относят:
- генное лечение;
- локальное замораживание тканей;
- точечный нагрев тканей;
- применение бактерий-анаэробов;
- вакцины против рака;
- лечение лазером;
- нанотехнологии.
Участие в клинических исследованиях дает шанс выйти в ремиссию пациентам, которым не помогают стандартные схемы лечения.
Можно ли считать, что экспериментальная терапия позволяет победить рак? Исследователи рассказывают о протоколах с ошеломляющими результатами. Так при испытании препарата Китруда в 2013 году около 76% участников почувствовали облегчение, а полностью излечилось от рака около 20%. Так препарат был включен в схемы лечения различных агрессивных опухолей.
При обнаружении немедленных или отсроченных негативных последствий протоколы закрывают, а средства или методы не допускают до рутинной практики.
С 2018 года работает сервис, позволяющий онкологам России искать больницы, в которых проводят экспериментальную терапию, и направлять туда пациентов. Он создан непосредственно Агентством клинических исследований и Российским онкологическим обществом RUSSCO.
Последние новости в онкологии: что ожидать в 2019 году?
Специалисты в области клинической иммунологии, радиологии, регенеративных технологий из России принимали японских коллег. Трансляция семинара позволила коллегам из 38 регионов получить актуальную информацию о применении новых дендритно-клеточных вакцин от рака, культивировании стволовых клеток с помощью роботов, инженерных методиках.
Кроме того, среди новостей онкологии 2019 года в России - успешное внедрение органосохраняющих операций при раке легких и эндоскопическое удаление новообразования желудка и толстого кишечника.
1. Люминисценция. Метастазы рака заставляют светиться. Фотодинамическая терапия
Итак, ученые уже много лет проводят эксперименты не только над растениями. Свойства люциферазы и других генов, белков, ферментов или веществ (например, 5 - аминолевулиновой кислоты), способных давать люминисценцию активно исследуются для выявления новых методов диагностики и лечения рака уже более десяти лет.
-
Флуоресцентные нанозонды. Сегодня большинство операций по удалению опухолей и метастазов очень травматичны, т.к. не всегда можно визуализировать, где заканчивается опухоль и начинается здоровая ткань. В 2017 году профессор химии Хайинь Лю (Haiying Liu) из Мичиганского технологического университета (Michigan Technological University) нашел способ заставить клетки светиться так, что рак в буквальном смысле стало видно. Благодаря антителам, которые крепятся только к раковым клеткам, злокачественные опухоли светятся в около-инфракрасном диапазоне — другие ткани светятся зеленым или синим цветом. Этот же метод может позволить хирургу убедиться, что все клетки опухоли действительно удалены и не был пропущен ни один метастаз.
Помимо диагностики и лечения онкологии, разрабатываемые нанозонды могут применяться для диагностики других инфекционных, воспалительных, иммунных заболеваний и для адресной доставки лекарственных препаратов. Например, если вы заболели, вы принимаете антибиотики, которые накапливаются в тканях всего организма, убивая в том числе и полезные бактерии, негативно влияя на печень и другие внутренние органы. При помощи новых технологий лекарство будет доставляться только в участок инфекции или воспаления. Не влияя на здоровые ткани и органы. Российские и корейские ученые в Национальном исследовательском ядерном университете МИФИ совместно с Пхоханским университетом науки и технологии уже работают в этом направлении.



2. Генная терапия и вирусы
Иммунитет человека может бороться с онкологией сам. Но почему же этого не происходит? Дело в том, что рак, маскируется под нормальные, здоровые клетки человека, поэтому иммунитет его не распознает. Например, у раковых клеток больных лейкемией на поверхности есть белок CD19, который маскирует злокачественные клетки под нормальные, и они остаются незамеченными для иммунитета человека. Ученые нашли способ добавить к лимфоцитам больных гены рецепторы CD19 и вернут измененные клетки в организм больных лейкемией при помощи обезвреженных ретровирусов, обладающих способностью встраиваться в ДНК человека. Потерявшие маскировку раковые клетки были атакованы модифицированными лимфоцитами. 90% испытуемых, больных тяжелой формой лейкемии пошли на поправку.
Активно изучаются возможности использования вирусов для генной терапии:
не вызывает защитного ответа в раковых клетках
За последнее десятилетие в лечении злокачественных опухолей легких произошел немалый прогресс. Появились новые знания о том, как рак развивается и распространяется в организме, взаимодействует с иммунной системой, какие молекулярные механизмы играют в этих процессах ключевую роль.
Более эффективной стала борьба с раком легких на поздних стадиях. Теперь у онкологов есть больше возможностей, чтобы продлевать жизнь таких пациентов, избавлять их от мучительных симптомов.
Миниинвазивная хирургия

В настоящее время торакальные хирурги активно применяютвидеоассистированную торакальную хирургию – сокращенно VATS ( video-assisted thoracic surgery). Ее можно использовать при операциях на разных органах грудной клетки, в том числе при раке легкого. Вместо большого разреза врач делает несколько проколов, через которые вводит миниатюрную видеокамеру и специальные инструменты.
Преимущества миниинвазивной хирургии очевидны:
- Сильно снижается риск осложнений.
- Пациент быстрее восстанавливается после операции.
- Намного меньше беспокоят послеоперационные боли.
- Можно быстрее вернуться к привычной жизни.
- При этом подобные операции не менее эффективны, чем через разрез, не сопровождаются более высоким риском рецидива.
Миниинвазивная хирургия при раке легкого доступна не для всех пациентов. Для таких операций нужно дорогое оборудование, специально обученные врачи – во многих клиниках этого просто нет. Не все опухоли можно удалить таким способом.
Таргетная терапия

Стремительное развитие молекулярной биологии и генетики открыло для онкологов массу новых возможностей. Были изучены мутации в генах и молекулы, которые важны для выживания, размножения раковых клеток, их защиты от иммунной системы и метастазирования. Были созданы лекарства, способные блокировать эти молекулы. Такие препараты называются таргетными. Они действуют более прицельно по сравнению с классическими химиопрепаратами:
Персонализированная химиотерапия
Составление оптимальной схемы химиотерапии – очень сложная задача. Фактически не существует двух одинаковых пациентов, двух одинаковых злокачественных опухолей. Одна и та же комбинация препаратов может хорошо работать у одного больного и совершенно не приносить эффекта у другого. Сложно предсказать заранее, каким будет эффект в конкретном случае.
Иммунотерапия
Современные врачи знают, как бороться с раком, задействовав ресурсы иммунной системы. Это направление в онкологии называется иммунотерапией, сейчас оно считается одним из самых перспективных.
Один из наиболее современных методов лечение рака легких – применение моноклональных антител из группы блокаторов контрольных точек.
Контрольными точками называют молекулы, которые в норме не дают иммунным клеткам атаковать здоровые ткани, по сути это защита организма от тяжелых аутоиммунных расстройств. Опухолевые клетки могут использовать эти молекулы в своих целях, чтобы защищаться от иммунной агрессии.
Блокаторы контрольных точек снимают блок с иммунной системы, в результате она начинает распознавать и уничтожать раковые клетки. При раке легкого применяют такие препараты из этой группы, как ниволумаб (Опдиво), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
С появлением иммунопрепаратов сильно повысилась эффективность лечения рака легких на поздних стадиях.
В каких клиниках России применяют новые методы лечения рака легких?
В России есть клиники, в которых доступны практически все наиболее современные методы лечения рака легких. Чаще всего то же лечение, что на Западе и в Израиле, можно получить в Москве.
Мы обязательно сможем подобрать для вас подходящую клинику, потому что мы сотрудничаем с лучшими онкологическими центрами:
Причиной возникновения опухоли в легких (рака) является поражение бронхиального эпителия и изменения ДНК. Источниками разрушительного воздействия могут служить загазованный воздух, городская и промышленная пыль, регулярные инфекционные заболевания дыхательной системы. Однако наибольшее деструктивное влияние на легочную ткань оказывает табачный дым, содержащий более 60 канцерогенных элементов, и ионизирующее (радиационное) излучение.
Высокий процент смертности связан со сложностью выявления рака легких на ранних стадиях, когда злокачественное новообразование локализовано в одном сегменте легкого. В большинстве случаев болезнь диагностируют только на 3 и 4 стадии, когда метастазами поражена большая часть бронхов в легких, трахея, гортань и другие органы. Широкое распространение опухолей делает их неоперабельными и невосприимчивыми к другим методам лечения рака легких.
Диагностика рака легких
Решающую роль в выявлении болезни на ранних этапах играют инновационные высокоточные методы диагностики, доступные далеко не всем клиникам в России.
Для диагностирования рака легких компьютерную томографию используют наряду с позитронно-эмиссионной. Этот подход позволяет не только более точно установить размер и форму опухоли, но и получить данные о ее перемещениях во время физиологических процессов, например, при дыхании. Эти данные помогают врачу правильно разработать программу лучевой терапии.
Инновационная система бронхолегочной электромагнитной навигации представляет собой усовершенствованную бронхоскопию. Беспроводной подвижный зонд, оснащенный видеоаппаратурой для фиксирования трехмерного изображения, способен проникать в самые глубокие и труднодоступные места в легких и лимфатических узлах. Аппарат может увидеть самые маленькие очаги поражения, не различимые на рентгеновских снимках и при УЗИ, и выявить рак на начальном этапе.
Эндобронхиальное и эндоскопическое УЗИ, используемое при диагностике рака легких, позволяет получить образцы лимфоузлов и точно установить стадию развития заболевания с помощью иглы с оптикой и ультразвуком. При этом нет необходимости делать разрезы на шее или грудной клетке.
Торакоскопия и торакоцентез визуально исследуют легкие и плевру и берут образцы тканей. С помощью прибора торакоскопа через прокол в грудной клетке врач может даже удалить сформировавшиеся узелки в легких.
Современные методы лечения рака легких
Наиболее эффективным методом лечения рака легких по-прежнему остается хирургическое вмешательство. На ранних стадиях, когда опухоль мала и строго локализована, достаточно клиновидной резекции — удаления небольшого участка легкого. При развитии болезни может потребоваться сегментарная резекция: лобэктомия — удаление пораженной доли легкого — или пневмонэктомия — удаление всего легкого.
Оперативное вмешательство всегда применяется в комбинации с другими методами лечения рака легких. Используется так называемая таргетная или целевая терапия. Эти препараты отличает направленность деструктивного воздействия на опухоль и минимизация вреда организму.
Врачи-пульмонологи, задействуя широкие технические возможности медицинской техники, подбирают индивидуальную и максимально действенную программу лучевой терапии.
Если более старое оборудование подвергало облучению весь организм на протяжении 6-7 недель, то современная техника, используемая при лечении рака легких, позволяет воздействовать только на пораженную область направленным пучком интенсивного ионизирующего излучения. Так, радиохирургия на 1 и 2 стадии болезни разрушает раковые клетки за 1 сеанс.
На более поздних этапах, когда опухоль разрастается на соседние ткани, применяется хирургия сфокусированной высокодозированной модулярной радиотерапии по технологии Новалис.
Учитывая индивидуальные особенности организма и болезни, пациентам также назначают криотерапию, фотодинамическую терапию, электрокоагуляцию и радиочастотную абляцию. Узнать больше о стоимости и методах лечения рака легких можно здесь.

Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
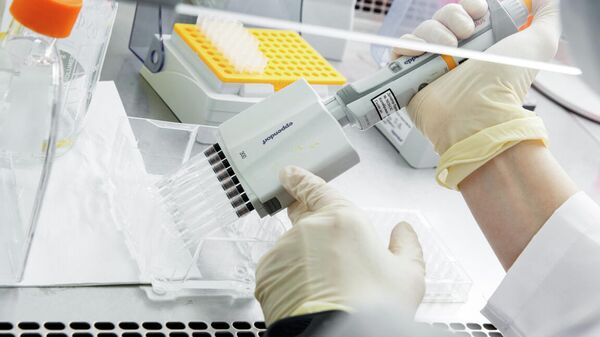
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела

С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека

Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Исследователи берут кровь у животного, привитого антигеном-мишенью, и выделяют из нее иммунные клетки, несущие гены антител
Полученный генетический материал находится в библиотеках антител — пробирках с прозрачной жидкостью, внутри которых — миллиарды разных вариантов антител
С помощью вирусов бактерий — фагов — ученые сужают число вероятных кандидатов. Затем выбирают из них два-три лучших варианта и переносят их на бактерии. Бактерии размножаются, и каждая несет на себе генетическую информацию одного варианта антитела
Из бактерий выделяют генетический материал и расшифровывают
Затем исследователи с помощью биоинформатических методов строят 3D-модель антитела, точечно меняя некоторые аминокислоты, чтобы улучшить свойства полученных белковых соединений и сделать их похожими на белок человека
Операция при немелкоклеточном раке легких на ранней стадии считается классическим подходом в лечении. В исследованиях, проведенных в последнее время в связи со стеротактической лучевой терапией тела (SBRT), которая является методом целенаправленной лучевой терапии, было установлено, что данный метод является эффективным и безопасным для данной группы больных.
Процент выживаемости в связи с заболеванием составил в 1 год 96%, процент выживаемость в 2 года составил 76%. В ходе данного исследования было доказано, что SBRT при немелкоклеточном раке легких на ранней стадии является таким же эффективным и безопасным методом, как операция, и вместе с тем необходимо дождаться утверждения имеющихся результатов.
Радиочастотная абляция использует тепло, которое производится радиоволнами для того, чтобы убить раковую клетку. Радиочастота – это вид электрической энергии. Абляция обозначает полное уничтожение. Электрическая энергия нагревает опухоль и убивает раковую клетку. Этот метод может применяться для больных немелкоклеточным раком легких ранней стадии, которые не желают проводить классическую операцию или которым невозможно ее провести. Кроме того, данный метод может также использоваться и у больных раком легких продвинутой стадии, у которых имеются жалобы на затрудненность дыхания в результате закупориванию опухолью дыхательных путей. Радиочастотная абляция (RFA) может использоваться вместе с другими методами лечения рака легких, и при необходимости ее можно выполнять несколько раз.
Радиочастотная абляция может выполняться больному под местной или под общей анестезией. При помощи маленького зонда (как игла) врач проникает через грудь напрямую в опухоль. Этот метод называется чрескожной (выполняется через кожу) радиочастотной абляцией. Данный метод, как правило, выполняется в сопровождении визуализации компьютерной томографии КТ, чтобы убедиться, что зонд, введенный внутрь через грудь, полностью достиг своей цели. Электроды, расположенные в зонде, образуют радиочастотную энергию для образования тепла и уничтожения опухолевой ткани. После выполнения данной процедуры может понадобиться, чтобы больной остался на одну ночь в больнице.
Криоабляция – это метод абляции, призванный разрушать раковую ткань путем ее замораживания. Во время процедуры аргоновый газ под высоким давлением проникает посредством иглы, размещенной внутрь опухоли; газ выпускается на самом краю иглы. Мгновенное падение давление аргонового газа производит эффект замораживания до 40-80 градусов. При этой процедуре, получившей название воздействие Жуль-Томпсона образуется ледяной шар (iceball) вокруг криоабляционной иглы. Этот ледяной шар приводит к образованию ледяных кристаллов внутри опухоли, к закупорке сосудов, питающих опухоль, и к распространенной гибели опухолевой ткани в результате самостоятельной гибели клеток (апоптоз).
Каждая игла, которая используется в данном методе, способна вызывать абляцию, то есть разрушение опухоли в зоне 2-3 см. В опухолях больших размеров количество игл увеличивается, и таким образом можно увеличить зону абляции или изменить ее форму. Например, при использовании одной иглы диаметр абляции составляет примерно 2 см, а при использовании 4 игл можно получить разрушение ткани диаметром 5 см, и, таким образом, можно лечить и крупные опухоли. Для приборов криоабляции, которые используются сегодня, можно подсоединить 25 криопроб, и при очень больших опухолях можно применять абляцию, позволяющую производить эффективную заморозку.
Одними из видов рака, при которых используется метод криоабляции, является рак легких и рак других органов с метастазами в легких.
Пока коронавирус держит в страхе всю планету, российские ученые научились с помощью вирусов уничтожать злокачественные опухоли у онкологических больных. О перспективной технологии директор Института молекулярной биологии РАН Александр Макаров рассказал президенту Владимиру Путину время совещания по развитию генетических технологий. Этот способ лечения пока экспериментальный, он не прошел стадию клинических исследований. Среди добровольцев, которые испытывают эффективность этого метода, оказалась и Анастасия Заворотнюк.

Директор Института молекулярной биологии РАН Александр Макаров. Фото: Антон Новодережкин/ТАСС
По словам Александра Макарова у актрисы диагностирована глиобластома - злокачественная опухоль мозга. Родные Анастасии передали врачам образцы клеток ее опухоли и ученые подобрали вирусы, которые способны ее уничтожить. Однако в последний момент терапию отложили. О том, почему это произошло, и насколько эффективна новая методика, мы поговорили с член-корреспондентом РАН, профессором, главным научным сотрудником Института молекулярной биологии РАН Петром Михайловичем Чумаковым. Он заведующий лаборатории пролиферации клеток, которая разрабатывает новый метод лечения.
Не надо бояться вирусов
- Петр Михайлович, на чем основан механизм лечения онколитическими вирусами?
- Обычно люди на бытовом уровне боятся вирусов, но на самом деле большая часть вирусов не вызывает никаких болезней. А некоторые даже обладают противоопухолевым эффектом. Как это работает? Когда происходит злокачественная трансформация здоровой клетки в опухолевую, то такая клетка утрачивает природные механизмы противодействия вирусу. Это не надо путать с иммунитетом организма. Каждая клетка еще обладает собственным иммунитетом к вирусной инфекции.
- Что это такое?
- При появлении вирусной инфекции нормальная клетка начинает вырабатывать интерферон и вирусы вокруг этой клетки очень неуютно себя чувствуют и погибают. Опухолевая клетка лишена такой возможности, у нее этот защитный механизм подавлен. Поэтому вирусы очень хорошо размножаются в опухолевых клетках. Мы этим пользуемся. Если вирус не болезнетворный, то его можно с успехом использовать в терапевтических целях: когда мы доставим вирус в опухоль произойдет массированное размножение вируса и опухолевая клетка гибнет. А здоровые клетки при контакте с вирусом начинают вырабатывать интерферон и не заражаются. Кроме того, вирусы вызывают сильный ответ иммунной системы всего организма. Обычно иммунная система сама очищает организм от всего злокачественного, что там возникает. Но опухолевые клетки научились защищать себя от иммунной системы - они “выключают” белок, который “сигналит”, что клетка стала злокачественной. Возникает так называемая супрессия - подавление иммунного ответа в опухоли. А вирусы стимулируют выработку белков, которые эту супрессию снимают. В результате на опухолевые клетки наводится очень мощная реакция иммунной системы организма, которая завершает процесс онколиза - разрушения опухоли. Вот очень упрощенное описание того, что происходит.
Мы спасаем тех, от кого официальная медицина отказалась
- Какие виды рака можно лечить вирусами?
- Мы видим эффект для самых разных форм рака: это и глиобластома - опухоль мозга, и рак желудка, рак легкого, рак молочной железы, рак яичника… У нас нет официальных клинических испытаний, наши пациенты - это больные четвертой стадии, от которых официальная медицина отказалась. И эффект особенно заметен, когда нам больные поступают с прогнозом, что ему осталось жить неделю, максимум - месяц. А они живут уже по 2-3 года, у многих из них даже опухоли нет. Может быть, это ремиссия, может быть, это потом вернется. Но пока так.

Член-корреспондент РАН, профессор , главный научный сотрудник Института молекулярной биологии РАН Петр Чумаков. Фото: msu.ru
- Сколько пациентов через вас прошло - единицы, десятки, сотни?
- Несколько сотен. Мы ведь начали начали применять эту технологию всего три года назад, когда немного осмелели. Потому что до этого боялись: вдруг нас засудят. Сейчас мы страх потеряли, потому что видим, это безопасно - у метода практически нет побочных эффектов. Бывает только небольшое повышение температуры, что является положительным признаком: это говорит о том, что вирус попал в организм и он действует. Эта температура легко снимается обычными жаропонижающими препаратами, поэтому никакого вреда мы не наносим, а польза есть. И потом самая главная причина, почему мы не боимся - мы не берем за это деньги. Мы чисты в этом отношении.
- А как же пациенты о вас узнают?
- Это эффект сарафанного радио. Люди рассказывают друг другу. Мы боимся это широко заявлять, потому что у нас, естественно, ограниченные возможности, мы не можем много людей принять. А пациентов, от которых отказались врачи - огромное количество! Мы это видим даже по нашему ближнему окружению. Четвертая стадия рака - это когда никакая химия особо не действует. Обычно таких больных выписывают под наблюдение районного онколога. По сути это уже приговор.
Вакцина от рака
- Ваш директор рассказывал историю Анастасии Заворотнюк, ей тоже подбирали терапию, но в итоге не стали применять. Почему? Что не сложилось?
- Вы знаете, у них сейчас ремиссия наметилась. К нам приезжал ее муж, бывший спортсмен. Он оказался очень осторожным человеком и я его прекрасно понимаю. Он говорит: давайте подождем, ей сейчас лучше, если будет совсем плохо - тогда мы приступим. Но, по крайней мере, мы провели тестирование в культуре ее клеток и сейчас знаем, какой вирус на нее действует.

Актриса Анастасия Заворотнюк. Фото: GLOBAL LOOK PRESS
- Вирусы подбираются индивидуально под пациента?
- Да, потому что опухоли очень индивидуальны, нет двух одинаковых опухолей. Если взять двух человек с глиобластомой, то если по морфологическим признакам это будет похоже, то по молекулярным признакам это очень разные опухоли. В настоящий момент мы ищем маркеры, по которым можно у больного провести быстрый тест и сказать, к какому вирусу опухоль чувствительна, а к какому - нет. Тогда, имея большой арсенал разных терапевтических вирусов, можно направленно под каждого пациента подбирать подходящий вирус. Так вот клетки из опухоли Анастасии Заворотнюк у нас в лаборатории хорошо пошли - они размножаются и мы можем их наработать сколько угодно. Это хорошо еще и потому, что на основе этих клеток можно сделать вакцину. Мы можем взять эти клетки, заразить их вирусом, а потом ввести ей в организм, и это будет стимулировать ее противоопухолевый иммунитет. Но это в том случае, если она снова обратится. Мы никогда не рекламируем и не уговариваем больных или родственников. Люди сами должны решать - рисковать или нет.
- А что людей настораживает, если противопоказаний нет?
- Все боятся вирусов, особенно во время нынешней пандемии. Когда они слышат словосочетание “лечение вирусами”, у них появляется страх в глазах. Но мы используем вирусы, которые никогда ничего не вызывали.
- Откуда вы их берете?
- Основная наша панель - это не патогенные энтеровирусы, выделенные из кишечника здоровых детей в возрасте до трех лет. Эти вирусы обеспечивают невосприимчивость детей к более серьезным инфекциям за счет того что у них вырабатывается интерферон. Кроме того, мы делаем инженерную селекцию и создаем генно-модифицированные вирусы, которые обладают усиленными противоопухолевыми свойствами. Но это пока в ограниченном масштабе.
Настя: шанс на жизнь.Анастасии Заворотнюк предложили лечение новой разработкой российских ученых, которая помогает вернуть к жизни пациентов в терминальной стадии рака
ЧИТАЙТЕ ТАКЖЕ
Онколог рассказал о способе лечения рака, которым на совещании у Путина предложили спасти Анастасию Заворотнюк
На совещании по развитию генетических технологий в РФ директор Института молекулярной биологии РАН Александр Макаров рассказал о передовой технологии лечения рака на последних, терминальных стадиях. По его словам, исследователи подбирают вирусы, которые способны разрушать клетки опухоли больного. Макаров считает, что такой метод мог бы помочь, в том числе, актрисе Анастасии Заворотнюк. Она борется с глиобластомой, злокачественным образованием в головном мозге (подробности)
Читайте также:

