Гормональная терапия при раке печени и поджелудочной железы
- Какими симптомами проявляются метастазы в печени?
- Как диагностируют метастазы в печени при раке поджелудочной железы?
- Лечение
- Химиотерапия
- Лучевая терапия
- Радиочастотная аблация
- Стентирование
- Борьба с асцитом
- Обезболивание
- Каков прогноз выживаемости?
Рак поджелудочной железы с метастазами в печень или другие органы соответствует 4 стадии злокачественной опухоли. В четвертой стадии рака поджелудочной железы выделяют две подстадии:
- IVA(локально распространенный рак): отдаленных метастазов нет, но опухоль прорастает в соседние органы, что сильно затрудняет ее хирургическое лечение.
- IVB(метастатический рак): имеются отдаленные метастазы. Чаще всего они находятся в печени.
Помимо печени, опухолевая ткань при раке поджелудочной железы нередко распространяется в легкие, желудок, селезенку, кишечник. Иногда четвертую стадию опухоли удается диагностировать только во время операции.
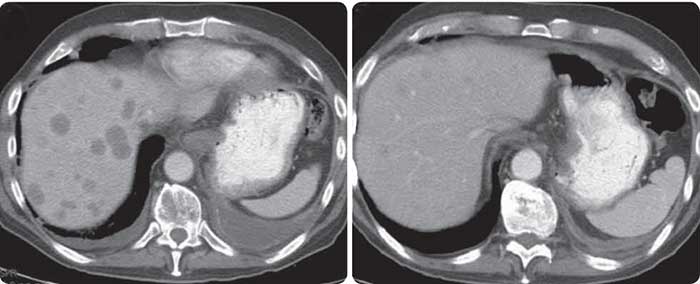
Если при раке поджелудочной железы обнаруживаются метастазы в печени, прогноз ухудшается. Радикальное хирургическое вмешательство в таких случаях невозможно. Но существуют методы лечения, которые помогают затормозить прогрессирование рака, избавить пациента от мучительных симптомов и увеличить продолжительность жизни.
Какими симптомами проявляются метастазы в печени?
Если очаги небольшие, и их немного, симптомы могут отсутствовать. Метастазы выявляются в ходе обследования. По мере ухудшения функции печени и нарастания нарушения оттока желчи появляются следующие признаки:
- Желтуха из-за повышения в крови уровня пигмента билирубина, который в норме должен обезвреживаться печенью и выводиться с желчью. Также это приводит к кожному зуду.
- Потемнение мочи из-за высокого уровня билирубина.
- Обесцвечивание стула, так как в нем билирубин, напротив, отсутствует.
- Беспричинная потеря веса.
- Снижение аппетита.
- Вздутие живота. Может развиваться асцит.
- Тошнота и рвота.
- Лихорадка, потливость.
- Увеличение печени, врач может прощупать ее во время осмотра.
Как диагностируют метастазы в печени при раке поджелудочной железы?
Обнаружить метастазы в печени и других органах помогают такие методы диагностики, как КТ, МРТ, УЗИ. Высокоинформативное исследование — позитронно-эмиссионная томография. В организм пациента вводят безопасное вещество с радиоактивной меткой, которое активно поглощают раковые клетки. За счет этого метастазы становятся видны на снимках, выполненных с помощью специального аппарата. ПЭТ помогает обнаружить метастазы, которые не могут выявить другие методы диагностики.
Назначают анализы, которые помогают оценить работу печени:
- Биохимический анализ крови.
- Развернутый общий анализ крови.
- Анализ на свертываемость.
Лечение
Лечение носит паллиативный характер. Лечебную тактику выбирают в зависимости от размеров, локализации, расположения вторичных очагов в печени, наличия осложнений (асцит, нарушение оттока желчи).
Химиотерапия
Основным методом лечения рака поджелудочной железы с метастазами является химиотерапия. Как правило, химиопрепараты вводятся внутривенно. Чаще всего применяют гемцитабин (Гемзар). Его можно комбинировать с абраксаном, эрлотинибом (Тарцева), капецитабином (Кселода).
Иногда проводят химиоэмболизацию — процедуру, во время которой в сосуд, питающий опухоль, вводят химиопрепарат в сочетании с эмболизирующим препаратом. Последний представляет собой микросферы, которые перекрывают просвет сосуда и нарушают приток кислорода, питательных веществ к опухоли.
Лучевая терапия
Лучевая терапия при раке поджелудочной железы с метастазами помогает справиться с болью, улучшить состояние пациента.
Радиочастотная аблация
Эту процедуру можно применять при небольших, до 4 см, метастазах в печени, если их общее количество не превышает 5, и они хорошо видны во время УЗИ, КТ. В очаг вводят иглу-электрод, на которую подают ток высокой частоты. Это приводит к сильному нагреванию и разрушению опухолевых клеток.
Стентирование
Если опухоль головки поджелудочной железы блокирует отток желчи, прибегают к стентированию. В желчный проток устанавливают стент — полый цилиндрический каркас с сетчатой стенкой. Он расширяет просвет протока и помогает восстановить отток желчи.
Обычно стент устанавливают с помощью эндоскопа, введенного через рот в двенадцатиперстную кишку. Если это не удается сделать, можно выполнить чрескожную чреспеченочную холангиографию и установить стент во время нее.

Борьба с асцитом
Рак поджелудочной железы 4 стадии с метастазами в печени может осложниться асцитом — скоплением жидкости в брюшной полости. Он развивается из-за портальной гипертензии (нарушения оттока крови по воротной вене) и нарушения синтеза печенью белка-альбумина, который обеспечивает онкотическое давление плазмы крови.
Для борьбы с асцитом прибегают к лапароцентезу — процедуре, во время которой на животе делают прокол и выводят избыток жидкости. Для постоянного оттока жидкости в брюшную полость устанавливают перитонеальные катетеры.
Обезболивание
Многих пациентов мучают сильные боли, поэтому важной составляющей лечения рака поджелудочной железы с метастазами является качественное обезболивание. В соответствии с современными принципами, применяют трехступенчатую систему обезболивания. На каждой ступени применяют более мощные препараты. Используют нестероидные противовоспалительные средства (НПВС), наркотические анальгетики, другие препараты.
По показаниям прибегают к блокадам нервных сплетений, невролизу.
Каков прогноз выживаемости?
Рак поджелудочной железы — одно из самых агрессивных и смертоносных онкологических заболеваний. Даже на ранних стадиях пятилетняя выживаемость составляет всего 14%. Рак поджелудочной железы с метастазами характеризуется пятилетней выживаемостью 1%.

Гормоны – это природные вещества, которые вырабатываются железами внутренней секреции нашего организма. Их сеть называется эндокринной системой. Гормоны перемещаются в кровотоке и действуют как посланники между разными частями тела. Они выполняют множество функций, одной из главных является контроль роста и активности определенных клеток и органов. Искусственные или синтетические гормоны создают в лабораториях.
Медицинский сервис Tlv.Hospital предлагает индивидуальную программу гормонотерапии в Израиле в качестве единственного варианта лечения и в сочетании с другими методами терапии раковых патологий.
Официальное представительство интересов русскоязычных пациентов дает нам право строго контролировать процесс оказания медицинской помощи.
Взаимодействуя напрямую с лучшими врачами и клиниками страны, мы предоставляем обратившимся к нам людям несколько вариантов терапии на выбор, формируя их в течение 2 дней с момента обращения пациента в компанию.
Не теряйте времени, звоните нам!
Железы и производимые ими гормоны
- Яичники - небольшие половые органы по обе стороны от матки, вырабатывают женские гормоны – эстроген и прогестерон, участвующие в репродукции.
- Яички – органы мужской половой системы, продуцирующие тестостерон, принимающий участие в воспроизводстве.
- Гипофиз – маленькая железа в основании головного мозга, синтезирующая лютеинизирующий гормон (ЛГ), стимулирующий яички и яичники.
- Надпочечники – железы над почками, вырабатывающие кортикостероиды, минералокортикоиды (например, альдостерон), эстрогены (в постменопаузальный период), тестостерон (в небольших количествах).
- Поджелудочная железа, расположенная позади и ниже желудка, продуцирует глюкагон (повышает уровень сахара в крови) и инсулин (снижает количество сахара в крови).
Что такое гормонотерапия?
Некоторые виды рака используют гормоны для роста. Гормональная терапия в онкологии применяет препараты, чтобы блокировать эффекты гормонов. Для некоторых видов злокачественных опухолей она бесполезна. К данному методу обращаются, когда болезнь чувствительна к этому лечению или гормональнозависима. К таким видам рака относят:
- онкологию молочной железы;
- рак простаты;
- опухоль яичников;
- рак матки;
- злокачественную опухоль почки.
Гормональная терапия изменяет уровень гормонов в организме. Существует три способа сделать это:
- Удалить железу, которая синтезирует гормоны.
- Воздействовать на железу с помощью лучевой терапии, чтобы уничтожить гормонопродуцирующие клетки.
- Принимать гормоны или другие препараты, препятствующие или останавливающие производство гормонов или их действие.
Лекарственные средства, хирургическое вмешательство или лучевая терапия отдельных органов влияют на уровень гормонов.
Гормонотерапию часто сочетают с другими видами лечения рака. Иногда она используется до или после них.
Гормонозависимым опухолям для роста и развития необходимы гормоны. Такое лечение может замедлить или оставить болезнь путем:
- блокировки синтеза гормонов;
- предотвращения действия гормонов на раковые клетки.
Врачи тестируют образцы опухоли с помощью анализов, чтобы установить:
- тип гормональных рецепторов на поверхности злокачественных клеток;
- количество рецепторов;
- будет ли гормональная терапия эффективна.
Чем выше уровень гормонального рецептора (положительный тест), тем более чувствительной будет опухоль к данному методу. Если рецепторы отсутствуют или их очень мало (отрицательный тест), то лечение, вероятно, не повлияет на рост раковых клеток, и другие методы терапии принесут больше результатов.
Гормональная терапия применяется как на ранних стадиях болезни, так и на поздних, если опухоль чувствительна к изменению уровня гормонов. Иногда заболевание сначала реагирует на данный способ лечения, но позднее становится устойчивым. В ряде случаев новообразование снова начинает расти и не реагирует на дальнейшую гормональную терапию. В других ситуациях недуг отвечает на смену препаратов. Например, сначала применялся тамоксифен, затем его сменили на анастрозол (Аримидекс) или летрозол (Фемара).
Виды гормонотерапии в Израиле
Существует несколько видов гормональной терапии. Выбор обусловлен определенными факторами – типом опухоли, стадией, персональными факторами (возраст, вступление женщины в период менопаузы), наличием гормональных рецепторов на поверхности раковых клеток.
Хирургическое удаление гормонопродуцирующих желез, чтобы остановить синтез гормонов или создать антигормональный эффект в организме. Это может быть операция по резекции яичников при лечении рака молочной железы или удаление яичек (орхиэктомия) при раке простаты.
Облучение разрушает гормонопродуцирующие ткани, прекращая выработку данных веществ. К примеру, радиотерапия может быть направлена на яичники, останавливая синтез эстрогена. Радиационный онколог рассчитывает дозу, количество и продолжительность лучевой терапии, чтобы адаптировать лечение для каждого больного раком. Обычно проводится дистанционная радиотерапия.
Гормональная лекарственная терапия
Некоторые препараты препятствуют гормонопродуцирующим клеткам синтезировать гормоны, другие воздействуют на эффект данного вещества в организме. Гормонотерапия применяют при следующих видах злокачественных опухолей:
- рак груди;
- рак простаты;
- рак матки;
- рак яичников;
- рак почки.
Женские гормоны – эстроген и прогестерон - влияют на злокачественные опухоли молочной железы. Врачи описывают эти виды онкологии как эстроген-рецептор положительный или прогестерон-рецептор положительный рак груди. Лечение предотвращает попадание гормонов к злокачественным клеткам молочной железы.
В ходе лечения в Израиле применяются разные лекарственные средства:
- Тамоксифен.
- Ингибиторы ароматазы.
- Ингибиторы секреции лютеинизирующего гормона.
Пациентке могут назначить один или несколько лекарственных средств. При ранней диагностике чтобы предотвратить рецидив, тамоксифен рекомендуют в течение 2-х или 3-х лет. В зависимости от наступления менопаузы предписывают ингибиторы ароматазы.
На основе результатов исследования известно, что иногда другие препараты гормональной терапии работают эффективнее, чем тамоксифен в качестве монотерапии.
Одно из наиболее распространённых лекарств, применяемых при раке груди. Женщины до наступления менопаузы и после могут принимать тамоксифен. Он предупреждает попадание эстрогена к раковым клеткам. Некоторые из них имеют области под названием рецепторы. Когда эстроген связывается с рецепторами, он стимулирует клетки опухоли к делению. Тамоксифен блокирует рецепторы.
Данные препараты назначают, если женщина достигла менопаузы. В этот период яичники прекращают производить эстроген. Но тело по-прежнему создает небольшое количество гормонов путем преобразования андрогенов в эстрогены. Чтобы это произошло, требуется фермент ароматаза. Ингибиторы блокируют его, не допуская трансформации.
Существует несколько препаратов ингибиторов ароматазы в гормонотерапии:
- анастрозол (Аримидекс);
- экземестан (Aromasin);
- летрозол (Фемара).
Гипофиз – железа в головном мозге, регулирующая количество половых гормонов, которые вырабатываются яичниками. У женщин данные блокаторы предупреждают выработку яичниками эстрогена или прогестерона. Это происходит за счет подавления сигнала, передаваемого от гипофиза к яичникам.
Данное лечение назначают, если только женщина не достигла менопаузы. После этого яичники не вырабатывают гормоны, поэтому препарат не поможет. Единственный ингибитор, который используется при раке молочной железы – гозерелин (Zoladex).
Рак простаты зависит от мужского гормона тестостерона. Гормональное лечение данного заболевания в израильских клиниках направлено на снижение или остановку выработки данного вещества. Применяются различные препараты.
Гипофиз координирует синтез вырабатываемого в яичках тестостерона. Ингибиторы подавляют производство лютеинизирующего гормона. Соответственно, яички прекращают создавать тестостерон.
Препараты, назначаемые при раке простаты - гозерелин (Zoladex), лейпрорелин (Prostap) и трипторелин (Decapetyl).
Клетки рака простаты наделены определенными областями – рецепторами. Тестостерон присоединяется к ним, что стимулирует клетки начать процесс деления. Антиандрогены прикрепляются к рецепторам, не позволяя тестостерону попасть к злокачественным сегментам. При лечении используется несколько препаратов: бикалутамид (Casodex), ципротерон ацетат (Cyprostat) и флутамид (Drogenil).
Данные препараты предотвращают поступление сообщения из гипоталамуса к гипофизу, чтобы производить лютеинизирующий гормон. Последний стимулирует яички продуцировать тестостерон. В настоящее время существует только один блокатор ГнРГ - Degarelix (Firmagon).
Женские гормоны – эстроген и прогестерон - влияют на рост и активность клеток, выстилающих орган. Врачи назначают прогестерон, чтобы уменьшить большой объем опухолей либо при рецидивах. Применяются различные лекарственные средства в клиниках Израиля, в том числе медроксипрогестерон ацетат (Провера) и Megestrol (Megace).
Некоторые виды опухолей яичников имеют рецепторы к эстрогену. Считается, что тамоксифен может принести пользу в качестве средства для их лечения. Но пока неизвестно, насколько гормональная терапия подходит для борьбы с данным заболеванием. Врачи проводят исследования с тамоксифеном и летрозолом.
Иногда при рецидиве онкологии почек препарат медроксипрогестерон (Провера) может контролировать болезнь некоторое время. Это созданная человеком версия гормона прогестерона. В настоящее время его не часто используют в лечении рака почки, поскольку новые методы, такие как биологическая терапия, оказывают лучший эффект. Но данный препарат может быть подходящим, если по каким-то причинам не применимы другие способы лечения.
Потенциальные побочные эффекты обусловлены видом гормональной терапии.
Пациентка может испытывать повышенную утомляемость в ходе лечения. Врачи дают рекомендации, как улучшить состояние.
Проблемы с пищеварением
Гормонотерапия бывает причиной определенных проблем с ЖКТ. Это может быть тошнота, но, как правило, в мягкой форме, она проходит спустя несколько дней или недель. Врач выпишет противорвотные средства.
Иногда наблюдается запор или диарея. Состояние легко контролируется с помощью диеты или лекарств. Если диарея приобретает серьезный характер, длится более 2-3 дней, то нужно сообщить врачу.
Пациентка может потерять аппетит, либо он может возрасти, что станет причиной увеличения веса.
Если женщина не достигла менопаузы, то под действием гормонотерапии этот период может начаться. Состояние бывает временным или постоянным. Если женщина принимает блокатор лютеинизирующего гормона, менструация прекратится. В случае, когда пациентке назначен тамоксифен, месячные по-прежнему есть, но они могут остановиться или стать более скудными.
Если женщина достигла менопаузы, возможно развитие других симптомов, которых не было ранее – сухость влагалища, приливы, потливость, сниженное половое влечение.
О возникающих проблемах необходимо сообщать врачу. Существует доступное лечение, которое облегчит состояние.
Некоторые виды гормонотерапии могут привести к истончению волос. Врачи дадут подробные рекомендации, как справиться с этой проблемой.
Изменения костной и мышечной ткани
У пациента может наблюдаться боль в суставах. Часто она проходит лишь спустя несколько недель. Врачи выписывает мягкие обезболивающие, чтобы контролировать состояние.
Некоторые препараты, такие как ингибиторы ароматазы, способны привести к истончению костей. Тамоксифен может стать причиной данного состояния у женщин в пременопаузе. У пациенток после менопаузы данный препарат не оказывает подобного воздействия.
Физические упражнения, где человек переносит свой собственный вес, способствуют укреплению и защите костной ткани. Это ходьба, бег, езда на велосипеде, занятия спортом в тренажерном зале. Плавание в этом вопросе не принесет пользы. Важно проконсультироваться с врачом, прежде чем приступать к какому-либо новому виду физической нагрузки, особенно, если ранее человек не занимался ею.
Истончение костей становится причиной остеопороза и переломов, если процесс длится в течение нескольких лет. Такое состояние врачи лечат с помощью бисфосфонатов, чтобы укрепить костную ткань.
Увеличение массы тела
Иногда наблюдается повышение веса. Состояние контролируют с помощью диеты и физических упражнений. Диетолог даст квалифицированные рекомендации, как управлять собственным весом.
В ряде случаев возникает данный симптом в связи с приемом некоторых препаратов гормонотерапии. Врач должен знать об этом. Могут помочь легкие анальгетики, к примеру, парацетамол.
Проблемы с памятью
Некоторые женщины отмечают, что состояние памяти ухудшается во время гормонального лечения на некоторое время. Но есть способы повысить качество жизни, к примеру, составлять списки, чтобы не забывать. Это нормально, что данный побочный эффект будет расстраивать. Следует поговорить с врачом.
Перепады настроения и депрессия
Гормонотерапия способна влиять на настроение. Некоторые пациентки отмечают перепады и даже депрессию во время лечения гозерелином. Может помочь общение с близкими, либо с квалифицированным врачом.
Тамоксифен способен увеличить риск тромбов в венах нижних конечностей. Такое состояние называется тромбозом глубоких вен.
Потенциальные побочные эффекты обусловлены выбором препаратов.
Возможно состояние слабости в ходе лечения.
Проблемы с эрекцией
Это распространенное осложнение гормонотерапии при раке предстательной железы. Происходит из-за прекращения выработки тестостерона. Как только лечение прекратиться, нарушения уйдут. Время восстановления – от 3 месяцев до года или дольше. У некоторых мужчин эти проблемы становятся постоянными, зависит от препарата и длительности его приема.
Врач даст подробные рекомендации по этому вопросу.
Приливы и потливость
Подобные симптомы наблюдаются у женщин при прохождении через менопаузу. Их вызывает снижение уровня тестостерона. Постепенно, по мере адаптации к лечению, состояние улучшается. Чаще всего приливы возникают при применении блокаторов лютеинизирующего гормона, поскольку они полностью прекращают выработку тестостерона. Употребление горячего чая, кофе, курение – ухудшают симптомы.
Но в некоторых случаях приливы сохраняются на протяжении всего лечения. При серьезных проблемах с потливостью можно обсудить их с врачом. Существуют процедуры, которые способны помочь.
Болезненность молочных желез
Подобное состояние вызывают высокие дозы бикалутамида (Casodex). Возникает болезненность, ткани груди опухают. Тамоксифен уменьшает болезненные ощущения у 6 из 10 мужчин, принимающих бакалутамид. Иногда помогает небольшая доза лучевой терапии в области молочной железы перед началом лечения гормонами.
Боль, связанная с опухолью
Боль, причиной которой является вторичный рак простаты, может временно ухудшится, когда пациент начинает гормональное лечение. Перед началом инъекций лейпрорелином (Prostap) или Zoladex (Goserilin) врач выписывает другой гормональный препарат, чтобы предотвратить вспышки боли в костях. Если боль не утихает, прописывают бисфосфонаты.
Масса тела может повыситься. Контролируют процесс с помощью диеты и физических упражнений. Но часто в ходе гормонотерапии эта борьба оказывается неэффективной.
Проблемы с памятью
В ряде случаев состояние памяти ухудшается в процессе лечения. Пользу принесет составление списков, чтобы не забывать. Следует поговорить с врачом, если этот симптом оказывает значительное влияние на жизнь.
Депрессия и перепады настроения
Лечение действует на настроение, особенно при применении Zoladex. Будет полезно общение с близкими людьми или психологом.
Нарушения в костях
Осложнением гормонотерапии при раке простаты становится истончение костей (остеопороз). Исследования доказали, что риск таких проблем, как переломы костей, выше у мужчин, имеющих длительное лечение, которое направлено на блокировку тестостерона (например, при Zoladex). Врач может предложить прием витамина Д и кальция с целью снизить риск остеопороза. Другие рекомендации:
- Не курить.
- Уменьшить количество алкоголя.
- Ввести в образ жизни такие нагрузки, как ходьбу и пр.
Риск раннего сердечного приступа
Согласно результатам исследования, у мужчин старше 65 лет вероятность смерти от сердечного приступа выше при прохождении гормонотерапии в течение 6 месяцев. Это связано с тем, что некоторые побочные действия лечения, такие как увеличение веса, способны ухудшить болезнь.
Купирование боли
Боли низкой интенсивности можно купировать с помощью ацетилсалициловой кислоты (аспирина) или парацетамола, при болях средней интенсивности назначают опиаты внутрь (сульфат морфина по 20 мг 2 раза в сут), к которым можно добавить блокаторы Н1-рецепторов гистамина. При более интенсивных болях наркотические анальгетики вводят подкожно, внутривенно, эпидурально или интратекально. Бензодиазепины (диазепам по 2 мг 3 раза в сут) или хлорпромазин (по 25мг 3 раза в сут) усиливают эффект морфина у тревожных больных.
Наиболее эффективно купируют боли наркотические анальгетики, однако их применение ограничено развитием широкого спектра побочных реакций, включающих сухость во рту, запоры, тошноту, рвоту, сонливость, возможность развития галлюцинаций и бреда, что в целом может значительно уменьшать качество жизни. Кроме того, длительное применение наркотических анальгетиков закономерно вызывает развитие физической и психической зависимости.
Непереносимые боли можно уменьшить с помощью лучевой терапии. Для симптоматического лечения используют антацидные препараты, блокаторы Н2-рецепторов гистамина, препараты ферментов ПЖ, иногда — небольшие дозы глюкокортикоидов. Для купирования зуда, связанного с желтухой, назначают колестирамин (холестирамин) или фенобарбитал.
Закономерно к купированию болевого абдоминального синдрома приводит химиотерапия.
Химиотерапия
Оценка эффективности консервативных методов лечения рака ПЖ затруднительна. Это обусловлено тем, что растущая протоковая опухоль ПЖ вызывает десмопластические реакции окружающих тканей, опухоль состоит не только из злокачественных клеток, но и из воспалительных элементов и фиброзной ткани. Кроме того, забрюшинное расположение ПЖ и отсутствие реакции фиброзной ткани на успешную химиотерапию не позволяет уточнить расположение очагов и динамику заболевания при использовании современных диагностических методов, таких, как КТ, МРТ и УЗИ. Таким образом, традиционные современные методы оценки эффективности консервативной противоопухолевой терапии при раке ПЖ не всегда объективно отражают степень регрессии первичной опухоли и метастазов в отдалённых органах и тканях.
До сих пор рак ПЖ считают резистентной к химиолучевой терапии опухолью, поэтому основное внимание исследователи уделяют не столько получению объективного эффекта в виде регрессии опухоли, сколько достижению улучшения качества жизни и продления её.
Поскольку возможности инструментальной регистрации уменьшения опухоли ограничены, были предложены дополнительные показатели оценки эффективности противоопухолевого лечения, основные из которых — качество жизни и её продолжительность. Большое внимание уделяют купированию болевого синдрома и снижению суточной потребности в обезболивающих средствах. Клинические наблюдения показывают, что даже незначительное уменьшение размеров опухоли ПЖ, которое соответствует стабилизации болезни, может сопровождаться исчезновением болевого синдрома и улучшением общего физического статуса пациента.
Таким образом, лучевая терапия, химиотерапия и иммунотерапия — только паллиативное и, в целом, малоэффективное лечение.
В течение многих десятилетий в качестве стандартного препарата для паллиативного лечения рака ПЖ применяли фторурацилиею комбинации с другими цитостатиками. Фторурацил — синтетический аналог естественного пиримидинового основания урацила. В процессе распада фторурацила несколько его метаболитов оказывают повреждающее воздействие на синтез и функционирование ДИК и рибонуклеиновых кислот опухолевых клеток.
Основная мишень — фермент тимидилат синтетаза, контролирующий синтез нормальных тимидиновых нуклеотидов — угнетается метаболитом фторурацила 5-фтордезокси-уридин монофосфатом. Другой фармакологически активный метаболит 5-фтордезоксиуридин трифосфат встраивается в ДНК опухолевых клеток вместо трифосфата тимидина, что ведёт к её разрывам. Ещё один метаболит — 5-фторуридинтрифосфат встраивается в рибонуклеиновую кислоту и серьёзно повреждает её стабильность.
Эффективность монотерапии фторурацилом и различных комбинаций с ним при раке ПЖ крайне низка (0-20%), а средняя выживаемость составляет всего 5—6 мес. Из других цитостатиков, которые проявили противоопухолевую активность при клинических испытаниях, следует отметить цисплатин, эпирубицин, митомицин, стрептозоцин, тегафур (фторафур), эффект которых колеблется в пределах 0-10%.
У ряда врачей сложилось мнение, что химиотерапевтическое лечение существенно не повышает качество жизни у больных с перезектабельным раком ПЖ. Однако, клинические исследования по изучению различных схем химиотерапии при раке ПЖ показали, что химиотерапия — лучше, чем любая симптоматическая терапия, и уж тем более её отсутствие.
Рандомизированные исследования по применению фторурацила в комбинации с доксорубицином (адриамицином), митомицином и этопозидом по сравнению с симптоматической терапией показали достоверное увеличение выживаемости в группе больных, которым проводили химиотерапию.
Внедрение в клиническую онкологию новых оригинальных противоопухолевых препаратов с различным механизмом действия на опухолевую клетку привело к увеличению эффектавности химиотерапии. При изучении препаратов из группытаксановбыли изучены паклитакселидоцетаксел, эффективность которых оказалась 20%. Ралтитрексид (томудекс) оказался активным в 12%, а иринотекан (кампто) — в 11,4% случаев. Наибольшую противоопухолевую активность при раке ПЖ проявил гемцитабин — фторзамещённый аналог дезоксицитидина, близкий по структуре к цитарабину (цитозару). Однако, в отличие от последнего, гемцитабин более липофильный, вследствие чего он быстрее проходит через мембраны опухолевых клеток. У гемцитабина больший аффинитет к мишени — дезоксицидин киназе, его активный метаболит гемцитабин трифосфат дольше, чем цитозар, находится в опухолевой клетке.
При монотерапии гемцитабином частичное уменьшение опухоли происходит в 10,6—12,8%, а симптоматический эффект — в 23,8—43% случаев. Гемцитабин эффективен у больных, рефрактерных к фторурацилу. Таким образом, гемцитабин — наиболее перспективное средство для лечения генерализованного рака ПЖ и, несомненно, препарат первой линии. В последние годы предприняты попытки разработать новые, более эффективные комбинации противоопухолевых препаратов, каждый из которых в той или иной степени эффективен при раке ПЖ. Следует отметить, что большинство применённых схем включали гемцитабин (табл. 5-8).
Учитывая синергизм действия гемцитабина и препаратов платины, были проведены клинические исследования по изучению данной комбинации. Результаты таковы: общий лечебный эффект составляет 50—57%, частичное уменьшение опухоли отмечено в 17% случаев.
При применении цисплатина, эпирубицина, фторурацила и гемцитабина у больных диссеминированным раком ПЖ объективный эффект значительно выше — 58% случаев. Средняя длительность эффекта составляет 8,5 мес, а средняя выживаемость — 11 мес. Симптоматический эффект отмечен у 78% больных.
Предприняты попытки улучшить результаты лечения путём использования комбинации таксанов и гемцитабина — клиническое улучшение происходит у 23—44,4% больных.
Комбинация митомицина и гемцитабина показывает лечебный эффект у 28,5% больных, стабилизацию — у 50%, а симптоматический эффект — у 46,6% больных.
Учитывая экспериментальные данные о радиосенсибилизирующем эффекте гемдитабина, проводят химиолучевое лечение. Средняя выживаемость при этом составляет 17.3 мес.
Таким образом, несмотря на кажущиеся скромные результаты применения гемцитабина при распространённом раке ПЖ, исследования показывают, что средняя продолжительность жизни увеличивается с 4 до 8 мес, а клиническое улучшение общего состояния наступает более чем у половины больных.
Адъювантное и неоадъювантное лечение
Одно из направлений улучшения результатов при неоперабельном раке ПЖ — сочетание лучевой терапии и перспективных противоопухолевых лекарств — позволяет достичь объективного улучшения у 27% больных и средней выживаемости 8—15 мес при хорошей переносимости режима комбинированной терапии. Низкая эффективность методов хирургического и лучевого лечения рака ПЖ создала предпосылки для активного изучения адъювантного и неоадьювантного подхода к лечению рака ПЖ (табл. 5-9). Сводные данные по результатам адъювантного химиолучевого лечения представлены в табл. 5-10.
Попытка адъювантного лечения с помощью химиотерапии без сопутствующею облучения ложа удалённой опухоли не даёт хороших результатов.
Таким образом, адъювантная терапия стала значительной ступенькой в лечении рака ПЖ. Однако полноценное её использование ограничено, потому что только 20% больных операбельны на момент первичной диагностики. Максимальный эффект адъювантного лечения можно получить лишь у 4% всех больных.
Интерес к неоадьювантной терапии рака ПЖ основан на том, что лишь небольшой процент больных обращается в клинику на ранней стадии болезни. Значительно чаще на момент первичной диагностики опухоль распространяется на окружающие ПЖ ткани, вовлекая пара-панкреатическую клетчатку и соседние органы. Другое теоретическое обоснование применения предоперационного лечения — возможность предотвращения имплантационного метастазирования во время хирургического вмешательства. Глобальной задачей неоадъювантного подхода служит попытка увеличить возможность удаления опухоли до 40% (20% за счёт потенциально излечимых больных и 20% за счёт неизлечимых пациентов на момент первичной диагностики путём рестадирования).
Средняя выживаемость при неоадъювантной терапии составляет 12—14 мес. Использование в качестве неоадъювантного лечения только химиотерапии не приводит к достоверному увеличению выживаемости. Необходимо дальнейшее развитие этого метода для лечения рака ПЖ, что позволит увеличить процент резектабельности опухоли и увеличить сроки жизни больных.
Гормонотерапия и перспективы лечения
Считают, что рак ПЖ — опухоль гормонозависимая, в пользу чего свидетельствуют указанные нами ранее половые различия в частоте рака ПЖ (у мужчин чаще), а также обнаружение рецепторов стероидных гормонов. Однако была отмечена низкая способность связывания рецепторов гормонами в культуре клеток рака ПЖ у человека. В эксперименте было показано, что тестостерон может стимулировать рост опухолевых ктеток, а эстрогены — замедлять. Возникла идея применения антагонистов андрогенов и аналогов релизипг-гормонов, но эти попытки не увенчались успехом. У пожилых женщин в ряде исследований выявлено положительное влияние тамоксифена, однако механизм полученного эффекта не совсем ясен. Весьма интересны результаты исследований с применением октреотида (300—600 мг/сут), способствующего стабилизации опухолевого процесса в 27% случаев.
Разработан препарат маримастат — ингибитор опухолевых металлопротсиназ, принимающих участие в росте и метастазировании карциномы. Идут клинические испытания ингибитора фермента фарнезил трансферазы, необходимого для встраивания в клеточную мембрану белка K-ras. На этот протеин, уже встроенный в мембрану, способны действовать монотерпены. Реальные перспективы открылись с развитием генетических аспектов лечения рака ПЖ:
• клонирование участков ДНК, комплементарных мутантным;
• создание на их основе системы переносчиков, эффекторных векторов — рекомбннантного аденовирусного вектора, аденоассоциированных вирусных векторов (из ларвовирусов), катионного липидного комплекса (излилосом) и др.;
• комплементарное внедрение этой системы в культуру поражённых клеток, устранение дефекта.
Одно из перспективных направлений в лечении рака ПЖ — вакцинация. Она основана на развитии цитолитического Т-клеточного ответа при сенсибилизации Т-лимфоцитов опухолевыми антигенами. Сенсибилизацию проводят in vitiv, а затем сенсибилизированные лимфоциты вводят больному.
Ретинодды способны тормозить рост и метастазирование опухоли, повышать дифференцированность её клеток. Это действие усиливается при сочетании ретиноидов с интерфероном-а. Последний и сам обладает антипролиферативным эффектом.
В целом молекулярно-биологические разработки генной терапии, несомненно, радикальным образом изменят лечение рака ПЖ, но это пока ешё впереди. Изменить сложившуюся ситуацию способны только профилактические диагностические подходы, особенно у лиц с отягощенным анамнезом и наличием факторов риска.
Читайте также:

