Эволюция хирургического лечения рака молочной железы
- КЛЮЧЕВЫЕ СЛОВА: рак молочной железы, лучевая диагностика, лекарственная терапия, онкология, маммология
Тенденция к уменьшению объема хирургического вмешательства при РМЖ отмечается и при проведении операций, связанных с лимфодиссекцией (I–III уровней). По европейскому стандарту она выполняется при радикальной мастэктомии и в сочетании с различными вариантами консервативной терапии. С развитием диагностических мероприятий в последние годы РМЖ часто диагностируется в ранней стадии. В связи с этим появилась методика биопсии сигнального лимфатического узла. В случае отсутствия в нем метастазов лимфодиссекцию выполнять не рекомендуется. Эти данные получены в результате ряда рандомизированных исследований: NSABR B-32 (охвачено 5 611 больных), ALMANAC trial (1 260), Sentinella/GIVOM (1 498), IEO-185 (532), OO-053 (3 369), IBCSG-23-01 (1 960), GF-GS01 (2 400).
Сегодня успешное лечение больных РМЖ невозможно без использования химиотерапии. Этапы цитостатической терапии следующие: 1970-е годы – доантрациклиновый период (CMF, CMFVP), 1980-е – антрациклиновый (AC, FAC, AVCMF, FEC, CEF), в 1990-е начала применяться высокодозная химиотерапия, в 2000-е – таксановый период (новые режимы: метрономная, dd-терапия). Все эти методики сегодня используются специалистами в их практической деятельности. В известном метаанализе группы EBCNCG (Lancet. 2005. Vol. 365. Р. 1687) показаны отдаленные результаты использования адъювантной химиотерапии. При ее использовании абсолютные показатели 5-летней безрецидивной выживаемости значительно увеличиваются: на 14,6% у N+ больных моложе 50 лет, на 9,9% – у N- больных моложе 50 лет, на 5,9% – у N+ больных в возрасте 50–69 лет, на 5,3% – у N- больных в возрасте 50–69 лет. Преимущества включения антрациклинов в проводимое лечение показаны в табл. 2.
Одной из основных методик лечения больных РМЖ также является эндокринотерапия. Ранее применялась хирургическая тактика ведения этой группы пациенток – овариэктомия. Сейчас широко используются фармпрепараты из группы антиэстрогенов и ингибиторов ароматазы. Без использования эндокринной терапии практически невозможно получить хорошие отдаленные результаты. Это демонстрируют такие масштабные исследования, как NSABBP B-14, aTTom (adjuvant tamoxifen – to offer more?), ATLAS (adjuvant tamoxifen – longer against shorter). Последнее проводилось с участием специалистов РОНЦ им. Н.Н. Блохина. Также изучались первичное лечение с использованием ингибиторов ароматазы (в рамках ATAC и BIG 1-98), варианты перевода больных на прием ингибиторов ароматазы или продолжение приема тамоксифена (IES, ARNO, ITA), совместное использование с тамоксифеном (TEAM, ABCSG), применение ингибиторов ароматазы после 5 лет такмоксифена (МА 17, В-33, ABCSG 6a trial) и т.п.
Доказана эффективность химиотерапии с последующей терапией трастузумабом в течение 1 года, антрациклин-содержащих и таксан-содержащих комбинаций (АС-ТН) с последующей терапией транстузумабом до 1 года, ТСН-комбинации (доцетаксел, циклофосфан, трастузумаб) с последующей терапией трастузумабом до 1 года. Очевидные факты: трастузумаб в течение 1 года снижает риск рецидива на 25–50%; введение трастузумаба одновременно с химиотерапевтическими препаратами сроком до 1 года более эффективно, чем его последовательное введение или применение в качестве монотерапии; ТСН-комбинация обладает меньшей кардиотоксичностью, чем АС-ТН.
Лечить пациента лекарственными методами без знаний молекулярных подтипов теперь не совсем правильно. Идентифицируя различные подтипы рака молочной железы, мы можем дифференцировано подходить к назначению различных вариантов терапии (табл. 3). Так, при HR+ (65–75% случаев) больным назначаются mTOR-ингибиторы и PI3K-ингибиторы, при HER2+ (15–20%) – лапатиниб, нератиниб, пертузумаб, TDM-1, AntiHER2 combinations, трастузумаб + Mtor, при трижды негативных формах РМЖ (15%) – новые цитостатики (эрибулин, иксабепилон, винфлюнин), соли платины, бевацизумаб, PARP ингибиторы, AntiEGFR (цетуксимаб, эрлотиниб), антиандрогены.
Сегодня распознавание белковых мишеней может стимулировать появление новых лекарственных препаратов. Мы находимся в процессе дальнейшего эволюционного развития. И от сочетания локальных методов лечения РМЖ с системной терапией, возможно, в будущем перейдем к чисто лекарственным методам лечения. О перспективах использования таргетной терапии РМЖ свидетельствуют объективные научные данные, представленные в августе 2013 г. в Санкт-Галлене (Швейцария) на 13-й Международной конференции по лечению РМЖ специалистами, прибывшими из 90 стран мира.
Шадрина И.Н., Лопаткина А.А., Макиенко А.А./ Shadrina I.N., Lopatkina A.A., Makienko A.A.
Резюме
В большинстве случаев максимальный положительный эффект при раке молочной железы наступает от комбинированной и комплексной терапии, главную роль среди которых играет хирургический метод.
Различные варианты оперативного лечения РМЖ допустимы, но значительные преимущества имеют органосохраняющие операции. Преимущество данных операций заключается в положительном влиянии на эмоциональное состояние женщины и период восстановления в реабилитации: семейной, трудовой и социальной.
Отдаленные результаты органосохраняющих операций с последующей лучевой терапией не отличаются от отдаленных результатов мастэктомии.
Ключевые слова
Статья
В данное время такая проблема, как рак молочной железы (РМЖ), входит в первые десять наиболее распространенных видов онкологических заболеваний в России и во всем мире.
Проанализирован статистический материал заболеваемости РМЖ по Саратовской области в 2011-2016 годах. В 2016 году в Саратовской области было осмотрено 176 730 человек среди женского населения старше 40 лет, это на 10 454 человека больше по сравнению с 2015 годом. Патология молочной железы (МЖ) была выявлена у 7,3 % обследованных женщин, из этого числа у 0,3% женщин найдены злокачественные новообразования, а в 2015 году - у 4,1% женского населения. В зависимости от локализации в структуре заболеваемости РМЖ находится на 2 месте и составляет 12,3 % от всех онкологических заболеваний. Среди женского населения данная патология находится на 1 месте и составляет 22,1 % . Глядя на показатель запущенности при опухолях МЖ, видно, что он за 5 лет практически не изменился: в 2011 году он составлял 22,6%, а в 2016 году - 21,4%. Пятилетняя выживаемость при РМЖ в 2016 году составляла 57,6 %, а в 2011 году - 59,1%. На 2016 год 35,2% женского населения излечено с помощью органосохраняющих операций [[1]].
Известно, в большинстве случаев максимальный положительный эффект наступает от комбинированной и комплексной терапии, главную роль среди которых играет хирургический метод. Подходы к оперативному лечению меняются в соответствии с совершенствованием знаний о типах опухолей, факторах риска, возможностях лекарственной и лучевой терапии [[2]].
Хорошие результаты от простой мастэктомии, без ориентации на стадию опухолевого процесса и заинтересованности лимфатических сосудов, были описаны Николаем Ивановичем Пироговым в десятитомном издании трудов.
Благодаря теории Фишера (1929) о распространении атипичных клеток, проникающих через базальную мембрану по всему организму в Саратове на кафедре онкологии в 1984 году впервые была выполнена операция Пейти, которая заключается в удалении МЖ и малой грудной мышцы с полной лимфоаденоктомией. Данная операция была в приоритете до 1994 года.
С 1994 года в лечении РМЖ преобладала операция Маддена: удаление МЖ с нижней подмышечной лимфоаденэктомией с сохранностью других групп лимфатических узлов и мышц. Через 6 лет данную операцию дополнили полной лимфоаденэктомией. По этой методике в Саратовской области и России было прооперировано основное число пациентов. Отмечено, что данные операции: Холстеда-Майера, Пейти и Маддена зависели в основном лишь от стадии заболевания, т.е. от ранней диагностики. С этой точки зрения оценка результатов лечения РМЖ на основании данных клиники Мейо (1915) представляет огромный интерес. Гаррингтон представляет материал 1859 больных, перенесших операцию Холстеда. Данный материал не уступает данным результатов на сегодняшний день. Десятилетняя выживаемость больных с метастазами 13,37%, а без наличия метастазов 44,09% [[4]].
В 1994 году в клинике СГМУ так же начали применять лямпэктомию и квадрантэктомию с полной лимфодиссекцией. Результаты органосохраняющих операций на МЖ дополненные лучевой терапией стоят на одной ступени с результатами операций, направленных на полное удаление МЖ, частота местных рецидивов всего на 2-3 % больше.
Многие авторы полагают, что для проведения органосохраняющих операций существуют ограниченные противопоказания, а результаты и качество жизни превосходят данные критерии при мастэктомии [[5]].
Показаниями к органосохраняющим операциям являются:
- узловая форма;
- опухоль до 3 см;
- достаточный объем молочной железы;
- отсутствие "дорожки к соску";
- отсутствие микрокальцинатов.
Учитывая локализацию опухолевого процесса, противопоказаний к проведению радикальной резекции молочной железы в настоящее время нет. Вслед за удалением квадранта или сектора при внутренней локализации опухоли по краю большой грудной мышцы через отдельный разрез производят лимфоаденэктомию. А при центральной локализации существует большое количество способов радикальной резекции, но чаще всего используются:
1.Одномоментная пластика ( подкожная мастэктомия). Производится иссечение железистой ткани с сохранением кожи и подкожно жировой клетчатки толщиной 4-5 мм. с последующей реконструкцией МЖ широчайшей мышцей спины. Мышечный аутотрансплантат фиксируется в ложе удаленной МЖ с формированием ее объема и формы. Для адекватного восполнения дефицита тканей формируется субмускулярный карман для силиконового эндопротеза при помощи большой грудной, передней зубчатой мышц и сетчатого имплантата.
Показания к одномоментной пластике:
- Размер опухоли от 2 см;
- Опухоль расположена близко к соску;
- Боль в груди.
2. Доскональная отсепаровка опухоли в пределах здоровой ткани от ареолы с последующей экстракцией квадранта или сектора с фасцией большой грудной мышцы - лампэктомия и квадрантэктомия. Лампэктомия применяется при образовании до 2,5 см, в том случае, когда опухоль большее 2,5 см прибегают к квадрантэктомии.
3. Секторальная резекция - резекция сектора вместе с ареолой и соском с дальнейшей пластикой ареолярно-соскового комплекса (АСК). Пластика АСК - завершающий штрих, который придает МЖ более естественный вид и позволяет скрыть рубцы. Ареола МЖ создается в результате пересадки кожи из области промежности или с помощью татуажа, что наблюдается чаще. Материалом для создания соска служит ткань реконструированной МЖ.
At this time, a problem such as breast cancer (BC), is included in the top ten most common cancers in Russia and around the world.
Analyzed statistical data the incidence of breast cancer in the Saratov region in 2011-2016 years. In 2016, in the Saratov region were examined 176,730 people among the female population older than 40 years, which is 10 454 more than in 2015. Pathology of the breast (breast) was detected in 7.3% of women surveyed, from this number at 0.3% of the women found malignancies, and in 2015 - at 4.1% of the female population. Depending on the location in the incidence of breast cancer is on the structure 2 and place of 12.3% of all cancers. This pathology is on the 1st place among the female population and is 22.1%. Looking at the record of neglect in tumors of breast, it is clear that he is for 5 years almost unchanged: in 2011 it amounted to 22.6% and in 2016 - 21.4%. Five-year survival in breast cancer in 2016 was 57.6%, and in 2011 - 59.1%. 2016 35.2% of the female population cured using conserving surgery.
It is known, in most cases, the maximum positive effect comes from the combination and the combination therapy, the main role of which plays a surgical method.Approaches for surgical treatment vary in accordance with the improvement of knowledge about tumor types, risk factors, possible drug and radiotherapy.
Good results from simple mastectomy, without orientation on the stage of tumor lymphatic vessels and interest have been described Nikolai Ivanovich Pirogov in a ten publication papers.
According Halstead theory, which appeared in 1889 year, the spread of malignant cells from the primary tumor to the lymph nodes is a gradual step-wise process, as well as based on works Mayer (1964), which is independent of Halstead developed a technique of radical mastectomy and suggested necessarily include single block pectoralis minor. Up to 80-ies of XX century in the world of primary surgery for breast cancer treatment has been surgery, "Halstead-Mayer." The essence of the operation - removal of the breast, lymph nodes three levels: subclavian, axillary, subscapular, the major and minor pectoralis muscles.
30 years ago, in the Saratov region and in the Russian operation "Halstead-Mayer" was the only intervention on the breast. Annually by this procedure 340 to operate the clinic patients. Focusing on breast size, location, education and its distribution, it was proposed a wide variety of approaches.
Thanks to Fisher's theory (1929) on the distribution of atypical cells, which penetrate the basement membrane around the body in Saratov at the Department of Oncology in 1984, the operation was performed for the first time drink, which is to remove the breast and pectoralis minor with full limfoadenoktomiey. This transaction was a priority until 1994.
Since 1994, in the treatment of breast cancer dominated operation Madden: removing from the lower breast axillary limfoadenektomiey with preservation of other groups of lymph nodes and muscle. After 6 years of this operation completed the full limfoadenektomiey. In this procedure, the basic number of patients were operated on in the Saratov region and Russia. It is noted that these operations: Halstead-Mayer, drink and Madden dependent essentially only on the stage of the disease, i.e., from early diagnosis. From this standpoint, the results of evaluation of the treatment of breast cancer on the basis of the Mayo Clinic (1915) is of great interest. Harrington material is 1859 patients undergoing surgery Halstead. This material is not inferior to the data of the results to date. Ten-year survival of patients with metastatic 13.37% and without metastases 44.09%.
In 1994, the clinic SSMU also started to apply lyampektomiyu and kvadrantektomiyu with complete lymph node dissection. The results of breast conserving surgery to radiotherapy supplemented stand on the same level with the results of operations aimed at complete removal of the breast, the incidence of local recurrence is only 2-3% higher.
Many authors believe that for conserving surgery there are limited contraindications, and the results and quality of life are superior to those criteria with mastectomy
The indications for nephron-sparing surgery are:
• The nodular form;
• the lack of "the track to the nipple";
• lack of microcalcifications.
Given the location of the tumor process, contraindications to breast cancer radical resection no. Following the removal of the quadrant or sector at an internal localization of the tumor on the edge of the pectoralis major muscle through a separate incision is made limfoadenektomiyu. And at the center of localization, there are many ways to complete resection, but the most commonly used:
1.Odnomomentnaya plastic (subcutaneous mastectomy). Glandular tissue excision is performed with preservation of skin and subcutaneous fat thickness of 4-5 mm. with subsequent reconstruction MF latissimus dorsi muscle. Muscle graft fixed in the bed remote MFs with formation of its volume and shape. To adequately fill the tissue deficit is formed submuscular pocket silicone prosthesis using the pectoralis major, the serratus anterior muscle and the mesh implant.
Indications for simultaneous plastic:
• Tumor size of 2 cm;
• The tumor is located close to the nipple;
2.Thorough otseparovka tumor within the healthy tissue of the areola, followed by extraction of the quadrant or sector with the fascia of the pectoralis major muscle - lumpectomy and kvadrantektomiya. Lumpectomy used in the formation of up to 2.5 cm, in the case when the tumor greater resorted to 2.5 cm kvadrantektomii.
3. Sector resection - resection sector together with the areola and nipple with further plastics teat-areola complex (ACK). Plastic ASA - the finishing touch that gives the breast a more natural look and to hide the scars. Areola breast is created as a result of skin grafts from the perineal area or the tattoo, which occurs more often. The material for the creation of the nipple tissue is reconstructed breast.
Литература
[1]. Итоги работы онкологической службы саратовской области в 2016 году. - Саратов 2017. - 39 с.
[2]. Состояние онкологической помощи населению России в 2016 году: под редакцией А. Д. Каприна, В. В. Старинского, Г. В. Петровой. - М. 2017.- 236с.
[3]. Хирургические болезни / ред. Кузин М.И. 3-е изд., перераб. и доп. М.:Медицина, 2002. - 784 с.
[4]. Пачес, А.И. Опухоли головы и шеи. 4-е изд.—М.: Медицина, 2000. – 480 с.
[5]. Клинические рекомендации по диагностике и лечению больных раком молочной железы. Москва 2014. - 43 с.
[6]. Онкология. Клинические рекомендации. Чиссов В.И., 2006. - 638 с.
[7]. Атлас онкологических операций - Чиссов В.И., 2008. - 632 с.
- Рак молочной железы
- Лечение
- Профилактика
При подтвержденном РМЖ консультация онколога-маммолога Портного Сергея Михайловича — БЕСПЛАТНО .
В нашей клинике при мастэктомии мы выполняем биопсию сигнального лимфоузла , которая позволяет предотвратить ненужное удаление лимфоузлов у пациентов, больных раком груди. Подробнее.
Также вы можете сдать анализ на выявление мутаций в генах BRCA1 и BRCA2 — данная процедура позволяет диагностировать высокую степень риска рака молочной железы. Подробнее.
Лечение РМЖ на различных стадиях
- У пациенток с операбельной опухолью (I-II стадий) лечение обычно начинается с операции.
- Пациенткам с первично иноперабельной опухолью (III стадии) необходимо проведение на первом этапе химиотерапии или сочетания химиотерапии с лучевой терапией или гормонотерапии. Операция становится возможной при успешном лечении.
- Пациенткам с диссеминированной опухолью (при наличии метастазов в других органах, IV стадии) предлагается проведение лекарственного лечения или сочетания лекарственного лечения с лучевой терапией, а в некоторых случаях – с операцией.
Сергей Михайлович Портной "Методы лечения рака молочной железы".
Рассмотрим основные положения местного и общего лечения не диссеминированного рака. Кратко анализируя эволюцию методов хирургического лечения рака молочной железы на протяжении ХХ века, можно выделить две противоположные тенденции:
- тенденцию к расширению объема операции,
- тенденцию к сокращению объема оперативного вмешательства.
Первая связана со стремлением к повышению радикализма за счет широкого удаления пораженных опухолью тканей и тканей, где такое поражение может быть. Для рака молочной железы характерно распространение по протокам и по лимфатическим сосудам, как в пределах молочной железы, так и за ее пределы в лимфатические узлы. Такое распространение при небольших, казалось бы, ограниченных опухолях, может быть выявлено только при микроскопии удаленной ткани, ни рентгенологически, ни при пальпации оно не выявляется. После лечения, ограниченного только удалением опухоли, закономерно возникали рецидивы рака в молочной железе или в ближайших лимфатических узлах. Именно с этим связано широкое применение операций, при которых полностью удаляется молочная железа и жировая клетчатка, в которой находятся ближайшие лимфатические узлы (радикальная мастэктомия).
Потеря молочной железы после радикального лечения по поводу рака представляет не только физический недостаток, но и является, прежде всего, серьезной психической травмой. Желание удалить опухоль и сохранить молочную железу выразилось в исторически более ранних операциях, так как радикальная мастэктомия была альтернативой таким операциям. Вместе с тем, органосохраняющее лечение, не худшее по результатам, чем радикальная мастэктомия, было разработано сравнительно недавно.
Современное представление о возможности сохранения молочной железы основано на представлении о том, что РМЖ даже 1 стадии к моменту его выявления уже имеет существенную вероятность наличия отдаленных гематогенных микрометастазов и проведение операции самого максимального объема не снижает риска реализации микрометастазов в клинически проявляемые метастазы (B.Fisher). К настоящему времени проведено большое количество рандомизированных исследований, сравнивающих, с одной стороны органосохраняющие операции в сочетании с лучевой терапией и радикальную мастэктомию с другой стороны.
Многолетние наблюдения за тысячами больных показали равноценность выживаемости и, следовательно, — адекватность органосохраняющего лечения. В то же время, органосохраняющие операции не могут применяться при всех формах роста и на всех этапах развития рака молочной железы.
Показаниями к органосохраняющим операциям являются:
- небольшой размер опухоли (не более 3-4 см),
- один очаг опухоли,
- отсутствие распространения опухоли на кожу.
Предположительно существующее микроскопическое распространение опухоли по лимфатическим сосудам и протокам в пределах молочной железы подавляется обязательным последующим облучением.
Объединение современных возможностей онкологии и пластической хирургии позволило разработать целую серию новых одномоментных операций, при которых онкологический этап операции (радикальная мастэктомия, органосохраняющая операция) дополняется реконструкцией молочной железы.
Облучение молочной железы после органосохраняющих операций позволяет добиться такой же низкой частоты развития местных рецидивов, как и после радикальной мастэктомии. Важно отметить, что проведение правильного органосохраняющего лечения не повышает риск развития отдаленных метастазов, вероятность и скорость их появления остается такой же, как и после радикальной мастэктомии. Пресечь или затормозить этот процесс может только системное профилактическое лечение.
Предполагается, что у значительной части больных на раннем этапе развития рака происходит рассеивание опухолевых клеток током крови по тканям организма. Здесь они могут погибнуть, но, если первичная опухоль не удалена, им на смену придут следующие партии клеток, которые могут сформировать микроскопические колонии.
Современные методы выявления метастазов рака молочной железы не идеальны, с их помощью можно выявить очаг поражения тогда, когда он достиг, по крайней мере, 0,5 см в диаметре. После удаления первичной опухоли дальнейшее поведение микрометастазов определяет судьбу больной:
- Если микрометастазов вообще нет или они настолько малы, что их развитие блокируется естественными силами организма, наступает длительное излечение.
- Если микрометастазы малы и растут медленно, рецидив болезни может развиться через десятки лет.
- Наконец, если микрометастазы относительно крупные и быстро растут, они быстро проявят себя.
При раке молочной железы наибольшую опасность представляют микрометастазы опухоли, вероятно, рассеянные по всему организму уже к моменту первого обращения к врачу. Естественно, что чем больше местное распространение опухоли (ее размер, вовлечение в опухолевый процесс регионарных лимфатических узлов, кожи молочной железы, грудной стенки), тем больше вероятность существования микрометастазов. Именно поэтому при местно-распространенном РМЖ (III стадии) часто лечение начинается не с местных воздействий на первичную опухоль, а с общего воздействия, чаще всего — с химиотерапии. Значение лекарственного лечения, предпринимаемого после радикальных операций, также чрезвычайно велико для уничтожения микрометастазов и повышения вероятности длительного выздоровления больных. Причем, чем больше стадия болезни, тем хуже прогноз и тем больше оснований к проведению профилактического системного лечения.
Химиотерапия и эндокринная терапия
Под химиопрепаратами понимаются вещества природного или синтетического происхождения, обладающие способностями убивать опухолевые клетки. Обычно они вводятся в определенных сочетаниях, позволяющих рассчитывать на успех в 50 — 70% случаев. Химиотерапия обычно проводится за несколько (от 4 до 16) курсов, с интервалами отдыха.
Из средств эндокринного лечения наибольшее применение нашли хирургическое удаление яичников, лекарственное выключение функции яичников, а также препараты, являющиеся гормонами, антигормонами, или ингибиторами образования гормонов. Эти лекарства обычно принимаются длительно и непрерывно, цель их применения — препятствовать стимуляции опухолевого роста собственными гормонами организма. Рецепторы эстрогенов (РЭ) и рецепторы прогестерона (РП) – белковые молекулы в клетках опухоли, воспринимающие воздействие соответствующих женских половых гормонов. Наличие этих молекул говорит о гормональной зависимости опухоли и о возможности снижения вероятности рецидива болезни при проведении гормонотерапии.
Рецептор эпидермального фактора роста 2 типа (HER2) – белковая молекула в опухолевой клетке, воспринимающая стимулирующее действие соответствующего фактора роста. Присутствие этого рецептора, с одной стороны, говорит об очень высокой агрессивности опухоли. С другой стороны, это позволяет применять высокоэффективные средства, по своему механизму действия являющиеся антителами к HER2.
Каким образом планировать компоненты профилактического лечения у каждой конкретной больной?
Хорошо аргументированные ответы содержатся в рекомендациях Международной конференции по адъювантной терапии рака молочной железы в Сан-Галлене (2015-2017 гг.). По современным рекомендациям, практически все больные инвазивным раком молочной железы после операции нуждаются в проведении профилактического лекарственного лечения.
Для составления индивидуального прогноза и выбора лечения больной принимаются во внимание:
- возраст,
- размер опухоли,
- степень злокачественности опухоли,
- наличие опухолевых клеток в перитуморальных сосудах,
- экспрессия РЭ, РП, HER2 и Ki67,
- наличие метастазов в лимфатических узлах.
Решение вопроса о предоперационной и послеоперационной лекарственной терапии решается консультантами-химиотерапевтами так же, как и вопрос о лучевой терапии решается консультантами лучевыми терапевтами.
Особенности лечения наследственного РМЖ
Органосохраняющие операции у больных наследственным раком молочной железы имеют значение для лечения существующей на данный момент болезни, но они не защищают от развития последующих опухолей.
В одном из наблюдений сообщается, что частота вторых раков молочной железы у таких больных составила:
- в оперированной молочной железе – 49%,
- в противоположной молочной железе – 42%.
Эти результаты резко отличаются от результатов таких операций в общей популяции, где частота местных рецидивов может составлять 5-10%.
Выполнение двусторонней мастэктомии у женщин носителей мутаций BRCA1 или BRCA2 при раке одной молочной железы более оправдано, такая операция уносит ткань-мишень, в которой могут формироваться новые опухоли; то есть операция имеет и лечебный, и профилактический смысл.
Тактика лечения наследственного РМЖ основывается на анализе общепринятых для РМЖ характеристик:
- возраста,
- соматического состояния,
- репродуктивного статуса,
- распространённости опухоли, её молекулярно-биологического портрета,
- пожеланий пациентки.
Особенностью тактики является возможность проведения одновременных мер по профилактике второго рака. В частности, при планировании хирургического лечения следует иметь ввиду, что, чем больше оставляется железистой ткани, тем больше вероятность развития второй опухоли как в ипсилатеральной, так и в контралатеральной молочной железе.
Отказ от органосохраняющей операции в пользу мастэктомии на стороне болезни и выполнение контралатеральной профилактической мастэктомии снижает вероятность развития второго РМЖ на 90-100%!
Лечение больных наследственным РМЖ направлено на решение следующих задач:
- непосредственное лечение имеющегося заболевания (РМЖ),
- профилактика второго РМЖ,
- профилактика рака яичников (при мутациях генов BRCA1 и BRCA2).
Обширные профилактические операции могут быть непереносимы по соматическому состоянию или по психологической неготовности пациентки. Решение второй и третьей задач может осуществляться одновременно с проведением лечения первичного заболевания или быть отсрочено.
Вероятно, ни в одной области медицины необходимость удаления тканей единым блоком не подвергалась такому сомнению, как при лечении рака молочной железы (РМЖ). С тех пор как в 1894 г. Halsted предложил данный метод лечения, который заключался в удалении большой грудной мышцы для более полного устранения опухоли, он претерпел множество изменений.
Стал популярным метод модифицированной радикальной мастэктомии, при котором удаляется вся молочная железа, но без большой грудной мышцы; это позволяет избежать деформации передней грудной стенки. Удаление подмышечных лимфоузлов также изменялось: от полного (I, II и III уровня с удалением малой грудной мышцы) до частичного (I и II уровня без удаления малой грудной мышцы).
В ретроспективных исследованиях показано, что продолжительность жизни не зависит от объема операции при сравнении радикальной мастэктомии по Холстеду с любым из модифицированных методов. По этой причине в 1979 г. на согласительной конференции NCI в качестве основного метода лечения был принят модифицированный подход.
Следующим вопросом было профилактическое удаление регионарных лимфоузлов. Учитывая, что при клиническом обследовании не всегда удастся выявить небольшие метастазы, на практике быстро получило распространение удаление подмышечных лимфоузлов, целью которого было не только устранение невыявленных метастазов, но и уничтожение возможного источника последующего метастазирования.
Handley впервые обнаружил, что рецидивы в подмышечных лимфоузлах после простой мастэктомии встречаются реже, чем можно было бы ожидать, учитывая частоту скрытых метастазов в этой области. Это означает, что какие-то метастазы уничтожаются иммунной системой организма.
В 1971 г. в рамках NSABP было начато исследование, которое должно было решить вопрос о необходимости профилактической резекции регионарных лимфоузлов. Больные с опухолями без поражения подмышечных лимфоузлов (1 клиническая стадия) были случайным образом разделены на группы: в одной проводилась радикальная мастэктомия, во второй — тотальная мастэктомия с ЛТ грудной стенки и регионарных лимфоузлов, в третьей — только тотальная мастэктомия.
Пациентки с поражением подмышечных лимфоузлов (II клиническая стадия) были случайным образом разделены на две группы: в одной проводилась радикальная мастэктомия, во второй — тотальная мастэктомия и ЛТ грудной стенки и всех путей лимфооттока от молочной железы. Если не удалены скрытые подмышечные метастазы и продолжается диссеминация, то прогноз при лечении только путем тотальной мастэктомии менее благоприятен.
Напротив, наличие у больных функционирующих лимфоузлов, улучшающих иммунитет, после тотальной мастэктомии должно способствовать более благоприятному прогнозу.

В течение 72 мес. наблюдали 1665 больных. Среди всех трех лечебных групп пациенток с I стадией рака молочной железы (РМЖ) отличий обнаружено не было. В целом у больных со II стадией РМЖ выживаемость была хуже, но отличий между двумя видами лечения выявлено не было. Только 60(16 %) из 365 пациенток, не прошедших профилактическое удаление подмышечных лимфоузлов, в дальнейшем (спустя 30 — 112 мес. после операции) подверглись данной процедуре в связи с прогрессированием заболевания.
При профилактическом удалении лимфоузлов метастазы в них обнаружены у 39 % пациенток. Более чем у половины больных, у которых предполагалось наличие метастазов в лимфоузлах, они не выявлены.
В 1985 г. Fisher и соавт. сообщили о такой же группе из 1665 женщин, период наблюдения за которыми составил в среднем 126 мес. Значимых отличий между группой больных с клиническими признаками метастазов в лимфоузлах, которыхлечили путем радикальной мастэктомии, и группой, в которой была проведена тотальная мастэктомия без удаления подмышечных лимфоузлов, но с регионарной ЛТ, не обнаружено. 10-летняя выживаемость в обеих группах составила около 38 %.
Использование сторожевого лимфоузла для оценки состояния лимфоузлов быстро становится стандартом медицинской помощи. Для определения первого (сторожевого) лимфоузла применяют инъекцию красителя или радиоактивного вещества, что в случае отсутствия в нем опухолевых клеток позволяет избежать полного иссечения подмышечных лимфоузлов.
После сообщения Moore в 1967 г. о частоте местных рецидивов, наблюдавшихся после частичной мастэктомии, полное удаление молочной железы стало обычной хирургической практикой. Проблема неполного удаления усугубляется наличием множества первичных очагов. Почти 50 % РМЖ развиваются более чем в одном квадранте, и этот показатель не снижается за счет раннего выявления. В более поздних исследованиях мастэктомии в меньшем объеме, чем тотальная, проводилась попытка выявить, может ли ЛТ молочной железы подавлять оставшиеся очаги опухолевого роста при удалении только первичного очага.
Очевидно, что такой подход не будет способствовать улучшению выживаемости или сохранению функции молочной железы, но может улучшить косметические результаты. Cancer Institute в Милане было проведено исследование методов лечения с сохранением молочной железы, в котором женщины с опухолями менее 2 см в диаметре и без пальпируемых подмышечных лимфоузлов были разделены на группы радикальной мастэктомии и широкой квадрантэктомии молочной железы с полным удалением подмышечных лимфоузлов с последующей ЛТ (50 Гр) молочной железы (дополнительно 10 Гр на ложе опухоли). Через 7 лет для анализа были доступны данные 701 больной.
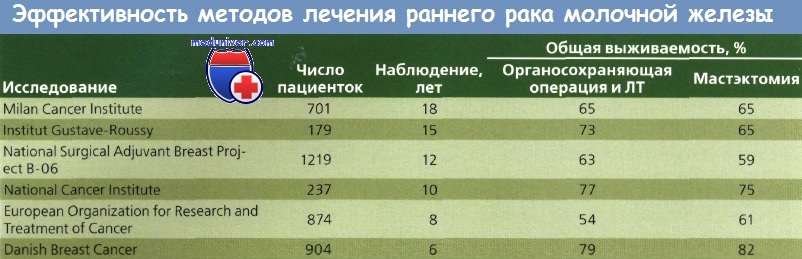
Не было обнаружено значительных различий в показателях распространения опухоли, выживаемости или продолжительности жизни до рецидива. Это исследование показало, что ЛТ высокими дозами способствует сохранению молочной железы у пациенток с локализованным РМЖ небольшого размера. Косметические результаты были удовлетворительными более чем у 70 % больных. В некоторых случаях наблюдалось появление отека руки и лучевого фиброза. До сих пор не определены долговременные канцерогенные эффекты ЛТ молочной железы.
Другое исследование, проведенное Fisher и соавт. и NSABP, представляет результаты рандомизированного исследования, сравнивавшего тотальную мастэктомию и сегментарную мастэктомию с применением ЛТ и без него (I—II стадия РМЖ диаметром не более 4 см). При сегментарной резекции хирург удалял объем ткани, достаточный для уверенности в том, что края удаляемого препарата не содержали опухолевую ткань.
Женщины были путем рандомизации разделены на группы, в которых были проведены тотальная мастэктомия, только сегментарная мастэктомия или сегментарная мастэктомия в сочетании с последующей ЛТ. У всех больных были удалены подмышечные лимфоузлы, а при наличии метастазов в лимфоузлах — проведен курс XT. Расчеты с использованием таблиц дожития и данных 1843 женщин продемонстрировали, что лечение с помощью сегментарной мастэктомии как с применением ЛТ, так и без нее приводило к 5-летней безрецидивной выживаемости, выживаемости без отдаленных метастазов и общей выживаемости, сравнимым с аналогичными показателями при тотальном удалении молочной железы. Безрецидивная выживаемость после сегментарной мастэктомии с ЛТ была даже лучше, чем тот же показатель и общая выживаемость после тотальной мастэктомии.
Рак молочной железы (РМЖ) в течение 5 лет не рецидивировал у 92 % женщин из группы прошедших лучевой терапии (ЛТ) по сравнению с 72 % в группе больных, не получавших ЛТ, что указывает на ценность этого метода лечения для снижения частоты опухолей в ипсилатеральной молочной железе после сегментарной мастэктомии.
Концепция Холстеда о распространении опухоли заключается в том, что рак молочной железы (РМЖ) возникает как местная опухоль, а затем последовательно распространяется к регионарным лимфоузлам, которые служат временным барьером, а затем к таким удаленным органам, как легкие, печень и кости. Холстед считал, что РМЖ всегда излечим хирургическим путем в случае, если молочная железа, грудные мышцы и подмышечные лимфоузлы могут быть удалены до того момента, как опухоль метастазирует за их пределы. Данные NSABP и других авторов дают основание предположить, что распространение РМЖ не полностью соответствует представлениям Холстеда.
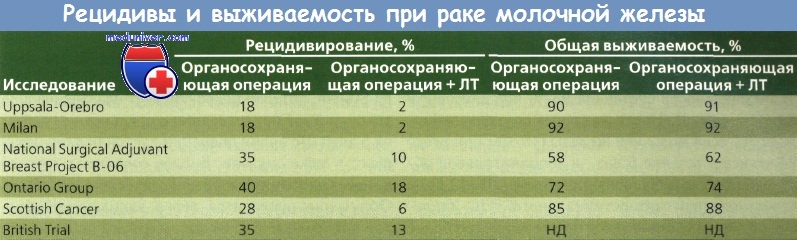
Рак может метастазировать в удаленные места до, в течение или после распространения в лимфоузлы. Обоснование для радикальной мастэктомии по Холстеду становится несостоятельным в случае, если рак не может быть остановлен на какой-то определенной точке предположительно последовательного пути. РМЖ часто бывает системным заболеванием даже на ранних стадиях.
Для исследования тактики лечения первичного рака молочной железы (РМЖ) необходимо длительное время, может потребоваться до 10 лет для возможности проведения окончательного анализа. Хотя сведения о частоте ранних рецидивов могут быть полезны при анализе, только данные долговременной выживаемости дадут окончательный ответ. При анализе этих исследований следует рассмотреть неоднородность первичного РМЖ.
Анализ подгрупп требует адекватного отбора больных для получения в результате различных категорий, зависящих от таких важных прогностических переменных, как размер первичной опухоли, клиническое и гистологическое состояние подмышечных лимфоузлов, менопауза и наличие/отсутствие эстрогеновых рецепторов (ЭР). Детальное обсуждение преимуществ и недостатков альтернативных методов первичного лечения у пациенток с излечимым РМЖ находится за рамками данной работы. Более подробную информацию по вопросам, касающимся этой интересной дискуссии, можно найти в публикациях (рекомендуем пользоваться формой поиска на главной странице сайта).
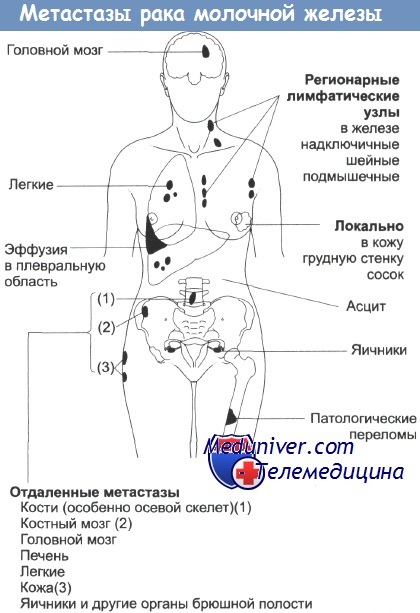
Места локального и отдаленного распространения опухоли молочной железы
Читайте также:

