Для специфической терапии лейкозов применяют
Лейкозы — это большая группа заболеваний, при которой происходит поражение системы кроветворения (гемопоэза). Чтобы лучше понять, что происходит с организмом при лейкозе, сначала нужно понимать, как организована система гемопоэза.
ГСК может пойти развиваться по двум направлениям:
- Миелопоэтическому, при котором образуются миелоидные клетки. Они названы так из-за того, что основную дифференцировку проходят в костном мозге (myelos — мозг, отсюда и название). В эту группу входят эритроциты, гранулоциты (нейтрофилы, базофилы и эозинофилы), моноциты и тромбоциты.
- Лимфопоэтическому, при котором образуются лимфоидные клетки. В процессе развития, они помимо костного мозга проходят дифференцировку в лимфатических узлах, селезенке и тимусе.
Итак, ГСК в процессе развития проходит несколько стадий:
В зависимости от того, на каком этапе развития происходит сбой, выделяют острые и хронические лейкозы. При острых лейкозах сбой происходит на уровне незрелых клеток — бластов. Поэтому их еще называют бластными лейкозами. Они имеют агрессивное течение, поскольку опухолевые клетки не могут выполнять свои функции, что без лечения быстро приводит к гибели больного. При хронических лейкозах сбой дифференцировки происходит уже на стадии зрелых клеток, поэтому они имеют более доброкачественное течение.
В зависимости от того, какой росток кроветворения поврежден, выделяют следующие виды острых лейкозов:
- Острый миелобластный лейкоз — опухоль из миелоидного ростка кроветворения. Более характерен для пожилых людей, но может встречаться и у молодых пациентов.
- Острый промиелоцитарный лейкоз — это особый тип миелобластного лейкоза, при котором сбой происходит на уровне незрелых гранулоцитов — промиелобластов. Раньше это была фатальная форма лейкоза, при которой пациенты погибали в течение нескольких недель после постановки диагноза. Но сейчас, при появлении трансретиноевой кислоты, лечение этой формы патологии достигло колоссальных успехов.
- Острый монобластный лейкоз — поражается моноцитарная линии кроветворения.
- Эритромиелоз — поражается красный росток кроветворения — эритроцитарный.
- Острый мегакариобластный лейкоз — очень редкая форма миелоцитарного лейкоза. При нем происходит поражение тромбоцитарного ростка.
- Острый лимфобластный лейкоз — это форма лимфопоэтичекого лейкоза. При нем поражается лимфоцитарный росток кроветворения. Заболевание в больше мере характерно для детского возраста.
Причины возникновения острого лейкоза
Лейкозы возникают из-за мутации ГСК. При этом разные мутации проявляются на разных этапах гемопоэза. Следует сказать, что одного факта наличия мутации недостаточно. Вообще генетические поломки в клетках, в том числе и гемопоэтических, возникают регулярно, но существуют механизмы, которые либо уничтожают такие клетки, либо блокируют ее дальнейшее развитие. Чтобы развился лейкоз, нужны особые обстоятельства:
- Повторные мутации в уже мутировавшей ГСК.
- Ослабление иммунной защиты, при которой мутировавшая клетка остается нераспознанной и начинает активно размножаться. Такие промахи иммунитета могут возникнуть как в период внутриутробного развития, так и в процессе жизни взрослого человека.
Таким образом, к факторам риска развития острого лейкоза относят следующие:
- Наследственная предрасположенность.
- Вторичные и первичные иммунодефициты.
- Воздействие ионизирующего излучения — рентген, лучевая терапия и др.
- Некоторые химикаты.
- Некоторые лекарственные препараты, например, цитостатики, которые применяются для лечения злокачественных новообразований.
- Вирусы. В частности, доказана этиологическая роль вируса Эпштейна-Барр.
Методы лечения острых лейкозов
Лечение острых лейкозов проводится в соответствии с утвержденными протоколами и проходит в несколько стадий. Целью лечения является достижение стойкой полной ремиссии. В среднем, полный курс лечения занимает около 2-х лет. При развитии осложнений этот срок может увеличиваться.

Для подбора оптимальной схемы терапии, необходимо знать вид острого лейкоза, его молекулярно-генетический профиль и группу риска для пациента. При стандартной группе риска, лечение проводится в соответствии со следующей схемой:
В ряде случаев при неблагоприятном прогнозе или возникновении рецидива, обычных курсов химиотерапии бывает недостаточно. В связи с этим, используются дополнительные методы лечения.
Профилактика нейролейкоза — поражение головного и спинного мозга лейкозными клетками. С этой целью в спинномозговой канал вводят цитостатики и проводят лучевую терапию на область головного мозга.
Трансплантация гемопоэтических стволовых клеток. В ряде случае пациентам требуется проведение высокодозной полихимиотерапии. Ее назначают для преодоления опухолевой резистентности, при возникновении многократных рецидивов и др. Такое лечение очень мощное и позволяет уничтожить даже устойчивые опухолевые клетки. Однако такая терапия опустошает костный мозг (фабрику кровяных клеток), и он не может в быстрые сроки полноценно восстановить кроветворение. Чтобы преодолеть это состояние, производят трансплантацию гемопоэтических стволовых клеток. Их могут взять у пациента после этапа индукции или консолидации ремиссии. В этом случает трансплантация называется аутологичной. Если стволовые клетки берутся от донора, это называется аллогенной трансплантацией. В этом случае пациент получает иммунитет другого, здорового человека. Иммунные клетки будут атаковать оставшиеся опухолевые клетки, оказывая дополнительный лечебный эффект. Недостатком аллогенной трансплантации является риск развития реакции трансплантат против хозяина, когда иммунные клетки начинают атаковать организм реципиента, приводя к развитию различных осложнений.
Последствия (ремиссия и рецидив)
Еще несколько десятилетий назад острые лейкозы приводили к смерти пациента в течение 2-3 месяцев после постановки диагноза. На сегодняшний день ситуация кардинально изменилась благодаря появлению новых препаратов для лечения.
На данный момент в клинике острых лейкозов выделяют следующие стадии:
- Первая атака — в этот период происходит активное размножение опухолевых клеток в костном мозге и выход их в кровь. Именно на данном этапе происходит постановка диагноза. Симптомы заболевания будут определяться тем, какой кроветворный росток поражен. Как правило, это упорные инфекции, анемии, общая слабость, увеличение лимфатических узлов и др.
- Период ремиссии. Если острый лейкоз ответил на химиотерапию, опухолевые клетки уничтожаются, и кроветворение восстанавливается. Количество бластов в костном мозге приходит в норму и не превышает 5% от общего количества клеток. Выделяют несколько видов ремиссии, в зависимости от того, насколько полно подавлен опухолевый клон. В настоящее время целью лечения является достижение полной ремиссии в течение 5 лет. По истечении этого срока, пациент считается полностью здоровым.
- Рецидив. У некоторых пациентов возникает рецидив, при котором опять увеличивается количество бластов. Они опять выходят в кровоток и могут образовывать внекостномозговые очаги инфильтрации. Рецидивов может быть несколько, и с каждым разом их все сложнее ввести в ремиссию. Тем не менее, у многих пациентов удается добиться полной пятилетней ремиссии, даже после нескольких рецидивов.
- Терминальная стадия. О ней говорят, когда все используемые методы лечения острых лейкозов теряют свою эффективность и сдерживать опухолевый рост уже невозможно. Происходит полное угнетение кроветворной системы организма.
Паллиативная помощь
Для терапии острого лейкоза имеется большое количество методов лечения. Это может быть химиотерапия, таргетная терапия, иммунотерапия. Все эти методы могут привести к ремиссии даже после многократных рецидивов. Поэтому как таковая, паллиативная терапия назначается редко и, как правило, у возрастных пациентов, которые не могут перенести тяжелое лечение.
В этом случае используется химиотерапия, медикаментозная терапия и лучевая терапия.
Химиотерапия при паллиативном лечении проводится не с целью достижения ремиссии, а для удержания опухолевого клона от стремительного размножения. На этом этапе могут применяться стандартные цитостатические препараты в меньших дозировках, иммунотерапия, таргетная терапия и другие методы противоопухолевого лечения.

Лучевая терапия может применяться для облегчения болевого синдрома при сильном поражении костей, а также при наличии внекостномозговых очагов.
Устранение болевого синдрома
Для помощи пациентам с болевым синдромом применяют различные обезболивающие препараты, начиная от нестероидных противовоспалительных препаратов (тот же ибупрофен) и заканчивая легкими и/или тяжелыми наркотическими средствами. Уменьшить выраженность болевого синдрома помогает и лучевая терапия.
Профилактика инфекций
На терминальных стадиях у больных серьезно нарушено кроветворение, и, как следствие, нет полноценной защиты от всех видов инфекций — бактериальной, грибковой, вирусной, что может привести к гибели пациента. Инфекционные осложнения являются одной из ведущих причин смерти при терминальных стадиях лейкозов.
Для предотвращения заражения, рекомендуется тщательно соблюдать принципы гигиены — уход за полостью рта, антисептическая обработка рук как самого больного, так и ухаживающего персонала, назначение профилактических антибактериальных и противогрибковых препаратов.
Трансфузионная поддержка
При сильном угнетении кроветворения, развивается тяжелая анемия и тромбоцитопения. Для купирования этих состояний могут применяться трансфузии эритроцитарной и тромбоцитарной массы.
Раньше тромбомассу переливали при снижении количества тромбоцитов ниже 20*109/л. Но потом появились рекомендации, согласно которым тромбоцитарные трансфузии проводят при падении уровня тромбоцитов ниже 10*109/л. При более высоких цифрах назначение тромбомассы не приводит к снижению риска развития кровотечения.
При появлении признаков геморрагического синдрома, тромбоцитарную трансфузию начинают немедленно и при необходимости увеличивают ее объем. Признаки геморрагического синдрома:
- Наличие петехиальных высыпаний, особенно в полости рта и других слизистых.
- Повышение температуры при отсутствии очагов инфекции.
- Наличие кровотечения.
- Возникновение инфекции.
Трансфузии эритроцит-содержащих сред
У терминальных больных желательно поддерживать целевой уровень гемоглобина не ниже 80 г/л. Особое внимание уделяется пациентам с тромбоцитопениями. При развитии тяжелых анемий показано переливание эритромассы до достижения целевого уровня.
В настоящее время во всем мире принят принцип — если больного нельзя вылечить, это не значит, что ему нельзя помочь!
Диагностика лейкозов может осуществляться при использовании различных методов. Выделяют следующие способы диагностики лейкозов:
E гематологическое исследование (анализ крови, пунктата костного мозга);
E гистологическое исследование крыла подвздошной кости (трепанобиопсия);
E иммунологическое исследование (с помощью флюоресциирующих моноклональных антител);
E цитогенетическое исследование (например, выявление филадельфийской хромосомы при хроническом миелолейкозе);
E цитохимическое исследование (выявление кислой фосфатазы, миелопероксидазы, эстеразы и других ферментов).
Гематологическое исследование
При анализе крови подозрение на лейкоз может возникнуть при:наличии в периферической крови бластов, анемии, изменении количества лейкоцитов, нейтропении, лимфоцитозе, тромбоцитопении.
Пункция костного мозга. При многих заболеваниях кроветворных органов изучение клеточного состава костного мозга имеет большое диагностическое значение и служит важным дополнением к результатам, полученным при исследовании гистологического состава крови.Значение его заключается в том, что дегенеративные изменения форменных элементов крови, усиленная регенерация, различного рода нарушения нормального эритропоэза, лейкопоэза нередко в костном мозгу проявляются раньше и в более ясной форме, чем в крови. После просмотра мазков подсчитывается миелограмма – процентное содержание различных клеток костного мозга. Вычисляется лейко-эритробластическое отношение – отношение суммы клеток лейкоцитарного ряда к сумме клеток эритроцитарного ряда. В норме оно равно 2,5:1- 4:1. При лейкозах лейко-эритробластическое отношение увеличивается.
Методика стернальной пункции.Пункцию проводят в процедурном кабинете с соблюдением правил асептики. Используют иглу Кассирского с предохранительным щитком-ограничителем и шприц на 10-20 мл. Игла и шприц должны быть стерильны и высушены спиртом и эфиром.
У взрослых пунктируют чаще грудину (рукоятку или на уровне третьего-четвертого межреберья) по средней линии. Можно пунктировать подвздошную кость, ребра. У детей пунктируют подвздошную кость, пяточную, нижний эпифиз бедренной кости, грудину.
Иглу вводят быстрым движением в костно-мозговой канал. После извлечения мандрена на иглу насаживают шприц и аспирируют костный мозг. Полученный материал переносят на стекло с луночкой или часовое стекло. Пунктат слегка перемешивают стеклянной палочкой. Учитывая быструю коагуляцию пунктата, все дальнейшие манипуляции делают быстро. Из капель пунктата готовят тонкие мазки обычным образом.
В редких случаях производится пункция лимфатического узла. Микроскопическое исследование приготовленного из пунктата и окрашенного обычным способом мазка позволяет иногда получить более детальное представление о характере кроветворения в лимфатической системе.
Следует отметить, что острый лейкоз наиболее часто протекает на фоне умеренного лейкоцитоза или лейкопении, тогда как хронический миело- и лимфолейкоз обычно сопровождаются очень высоким лейкоцитозом. При анализе миелограммы у больных с лейкозами обращает на себя внимание увеличение содержания бластных форм более 5% с различной морфологией, лимфоцитозом, отсутствием мегакариоцитов (за исключением острого мегакариобластного лейкоза).
Иммунологическая диагностика (иммунофенотипирование бластов). В диагностике лейкоза на современном этапе большое значение имеет метод проточной цитометрии. Это автоматизированная методика, суть которой состоит в том, что клетки крови обрабатывают моноклональными антителами с присоединённой флюоресцентной меткой и направляют с потоком жидкости в капилляр, освещенный лазером. Измерение интенсивности флюоресценции отдельных клеток, проходящих через лазерный пучок, позволяет оценить количество экспрессируемых ими антигенов (СD-антигенов или кластеров дифференцировки). Этот метод позволяет точно диагностировать тип лейкоза, что важно для определения схем лечения.
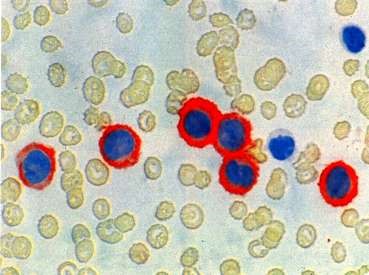
Иммунологическая диагностика лейкозов: наличие светящегося ореола вокруг лейкоцитов – следствие взаимодействия моноклонального антитела, меченного флюоресцирующей меткой, с антигеном, к которому данное антитело специфично
Цитогенетическая диагностика позволяет выявить геномные и хромосомные мутации – изменение количества хромосом (транслокации, делеции и др.) либо их качества. Хромосомные аномалии отмечаются у 80-90% пациентов с острым миелобластным лейкозом и хроническим миелолейкозом и у 50% больных – с хроническим лимфолейкозом.
Цитохимическая диагностика заключается в определении специфических для различных видов лейкозных клеток ферментов и включений.
Терапия лейкозов проводится в условиях гематологического или онкологического отделений и включает химиотерапию, лучевую терапию и иммунотерапию.
Специфическая химиотерапия направлена на достижение и закрепление ремиссии заболевания. Она состоит из нескольких этапов, различна для разных видов лейкозови проводится по стандартным схемам. Для борьбы с инфекциями, интоксикациями применяют сопроводительную терапию (антибиотики широкого спектра действия и др. противомикробные средства, стимуляторы лейкопоэза). При угрожающей тромбоцитопении, тяжелой анемии, нарушениях свертывания крови применяют заместительную терапию (эритроцитарная масса, тромбоцитарная масса или тромбоконцентрат, трансплантация стволовых клеток крови или костного мозга).
Прогноз. У 95% детей с ОЛЛ и 60-70% детей – с ОМЛ наступает ремиссия. Клиническая ремиссия – сохранение гематологических изменений при отсутствии клинических проявлений. Клинико-гематологическая ремиссия – отсутствие лабораторных и клинических признаков заболевания. Цитогенетическая ремиссия – отсутствие цитогенетических нарушений, определяемых до начала терапии.
О полном выздоровлении говорят при отсутствии рецидива в течение 5 лет после завершения полного курса терапии.
Хронические формы лейкозов труднее поддаются лечению. Средняя продолжительность жизни при проведении химиотерапии составляет 3-5 лет.
Дата добавления: 2018-08-06 ; просмотров: 719 ;
Лейкоз – это общее название гемобластозов, злокачественных опухолевых заболеваний, поражающих кроветворный росток костного мозга, в результате чего в кровь поступает большое количество незрелых (бластных форм) лейкоцитов. Этот признак определяет второе название заболевания – лейкемия, или белокровие. Лейкозы встречаются в любом возрасте, но наиболее подвержены им две возрастные группы – дети первых пяти лет жизни и пожилые люди 60-70 лет. Лейкоз у детей является самым частым онкологическим заболеванием, на его долю приходится 30% всех опухолей детского возраста.
Причины лейкоза
Непосредственной причиной лейкоза является мутация в одной-единственной кроветворной клетке костного мозга. Мутировавшая клетка начинает быстро делиться, производя неполноценные (бластные) формы лейкоцитов, которые неспособны созревать, а значит и нормально функционировать. Поскольку кровяные клетки довольно быстро обновляются, постепенно нормальные лейкоциты все больше вытесняются бластами, чем больше в крови бластных форм, тем хуже она справляется со своей функцией. На течение процесса оказывает влияние степень зрелости бластов: совершенно незрелые клетки более агрессивны и функционируют хуже всего, чем более зрелый бласт, тем больше он приближен к нормальной клетке, и тем лучше справляется со своей функцией. Степень зрелости бластных клеток определяет характер заболевания, если бласты более зрелые, развивается хронический лейкоз, если совсем незрелые – острый.
Мутация в первичной бластной клетке может быть вызвана множеством факторов: ионизирующим излучением, влиянием канцерогенов, в том числе и лекарственного происхождения (противогрибковый антибиотик левомицетин и др.), влиянием вирусов. Среди прочих причин лейкоза важное место занимает наследственная предрасположенность, а именно повреждение некоторых генов, отвечающих за кроветворение. Основной причиной лейкоза у детей является генетическая патология.
Симптомы лейкоза
Симптомы лейкоза появляются по мере накопления в крови бластных форм лейкоцитов, первые признаки выражены не ярко, от начала болезни до их проявления обычно проходит не менее полутора-двух месяцев. Характерна триада симптомов лейкоза: геморрагический синдром (кровоточивость), ночная лихорадка с повышенной потливостью, астения.
Повышенную кровоточивость больные лейкозом замечают тогда, когда от незначительных воздействий, например, надавливания рукой или трения одеждой, появляются синяки, причем достаточно обширные, а незначительные порезы или даже царапины служат причиной длительного кровотечения. Кожа больного лейкозом, особенно острым, покрывается разноцветными пятнами, образуемыми синяками разной степени зрелости.
Ночная лихорадка проявляется в виде необъяснимого подъема температуры по ночам до фебрильных значений (38°C и выше) на фоне отсутствия каких-либо простудных заболеваний. Лихорадка сопровождается проливным, или профузным потом, из-за которого приходится менять белье, иногда не один раз за ночь.
Астенический синдром, один из самых характерных симптомов лейкоза, приводит к появлению слабости, быстрой утомляемости, потере аппетита и снижению массы тела, ломотой в костях и суставах.
Также у больных лейкозом отмечается: увеличение лимфоузлов и селезенки, бледность кожных покровов, синюшность ногтей и губ, стойкое снижение иммунитета, выражающееся в подверженности многочисленным инфекционным заболеваниям, от ОРЗ до гнойничковой инфекции.
Симптомы лейкоза у детей
Пиком заболеваемости является возраст от 2 до 4 лет, то есть тот, когда ребенок еще не может четко объяснить свое недомогание. Родители должны обратить внимание на следующие признаки: изменение поведения малыша, который становится вялым, утрачивает интерес к играм со сверстниками, быстро утомляется; подверженность ребенка инфекционным заболеваниям, частое повышение температуры тела. Это наиболее характерные ранние симптомы лейкоза у детей, они не являются специфичными именно для этого заболевания, но если в течение длительного периода, недели или нескольких, обнаруживается один из них или более, это должно насторожить родителей и послужить поводом обращения к врачу, который направит ребенка на анализ крови. Обычно на этой стадии лейкоза у детей в крови уже есть характерные изменения.
Поздними симптомами лейкоза у детей являются ноющие боли в костях нелокализованного (блуждающего) характера, чаще в ногах или позвоночнике. Прогрессирует бледность кожных покровов, появляются характерные множественные синяки, кровоточивость десен, спонтанные носовые кровотечения. Увеличиваются лимфатические узлы, селезенка, печень. Ребенок теряет вес, становится апатичным и капризным.

Диагностика
Определяющими исследованиями для установления диагноза лейкоза являются общий анализ крови и цитологическое исследование пунктата костного мозга. Лейкоцитарная формула не всегда информативна на ранних стадиях заболевания, но обнаружение одной-единственной злокачественной клетки в пунктате является диагностическим признаком лейкоза.
Для установления точного вида заболевания, выработки тактики лечения лейкоза и прогноза, необходимы миелограмма, цитогенетическое, морфологическое и иммунологическое исследование бластных форм лейкоцитов.
Исходя из общего состояния больного лейкозом и по результатам основных исследований, могут быть назначены дополнительные: УЗИ органов брюшной полости, ЭхоКГ, исследование лимфоузлов и т.д.
Принципы лечения лейкоза
Лечение лейкоза проводится в специализированных гематологических отделениях, поскольку в ходе терапии значительно ухудшается и без того сниженный иммунитет, и больные лейкозом остаются практически беззащитны перед любой инфекцией, даже той, которая безопасна для здорового человека. В гематологических отделениях клиник установлен специальный режим, приближенный к стерильному режиму операционной, вплоть до фильтрации воздуха HEPA-фильтрами. Больные лейкозом изолируются от посетителей и других пациентов, в детских отделениях допускается присутствие одного из родителей, родители так же, как и персонал отделения, соблюдают режим стерильности.
Основными методами лечения лейкозов являются следующие:
- Химиотерапия при помощи мощных цитостатических препаратов;
- Гормонотерапия с применением стероидных противовоспалительных средств (СПВС);
- Антибиотикотерапия в качестве метода борьбы с вторичной инфекцией;
- Радиотерапия (облучение).
Лечение лейкоза на разных стадиях и разных форм предполагает либо последовательное применение этих методов, либо комбинацию нескольких из них. В случае упорного течения заболевания, когда несколько курсов лечения лейкоза с применением разных протоколов не дало ощутимого результата, и заболевание продолжает прогрессировать, прибегают к пересадке костного мозга.
Лечение лейкоза у детей осуществляется по тем же принципам, что и у взрослых, при этом прогноз у детей более благоприятен, несмотря на более тяжелое течение.
Современная химиотерапия позволяет получить полные ремиссии у 50-95% взрослых больных острым лейкозом, однако в большинстве случаев развивается рецидив, и заболевание в конечном итоге обычно приводит к летальному исходу (5-летняя безрецидивная выживаемость в зависимости от варианта острого лейкоза составляет 20-30%).
Лечение больных острым лейкозом необходимо начинать сразу же после установления диагноза, поскольку при отсутствии терапии продолжительность жизни пациентов не превышает трех месяцев. Терапия должна проводиться в специализированном гематологическом стационаре (отделении), имеющем необходимый опыт и оснащение. Лечение больных острым лейкозом в других стационарах и отделениях недопустимо.
Цитостатическая терапия при остром лейкозе основана на двух постулатах:
1) в организме больного имеются две пролиферирующие линии клеток: нормальная (поликлональная) и лейкемическая (моноклональная);
2) для восстановления нормального кроветворения необходима эрадикация (уничтожение) лейкозного клона, что достигается с помощью цитостатической терапии.
Выбор цитостатиков и режим их введения должны:
а) приводить к быстрому уменьшению количества бластов;
б) обеспечить преимущественный рост нормальных стволовых клеток;
в) сопровождаться относительной аплазией костного мозга без необратимой супрессии кроветворения.

Нормальные стволовые кроветворные клетки (СКК) имеют ростовые преимущества и репопулируют в костном мозге, восстанавливая поликлональный гемопоэз. Лейкозные клетки замещаются нормальными, способными к дифференцировке предшественниками, которые обеспечивают поддержание жизненно важных функций. В результате лейкозный процесс временно затихает. Транзиторная природа первичного ответа наиболее понятна в контексте громадных количеств лейкозных клеток и ограниченного влияния современной химиотерапии на эту критическую массу.
Как уже отмечалось, в дебюте заболевания в организме имеется более 10 12 лейкозных бластов общей массой около одного килограмма. Стандартные режимы химиотерапии обычно приводят к уменьшению общего количества опухолевых клеток на 90-99,9%. Это делает невозможным выявление оставшихся (резидуальных) лейкозных клеток обычными лабораторными методами (при анализе периферической крови и костного мозга). На основании морфологических критериев в этих случаях констатируется полная ремиссия, однако у большинства больных такая ремиссия далека от полной (при минимальной резидуальной болезни в организме имеется около 10 9 лейкозных клеток).
Полная ремиссия (ПР) — единственная значимая форма клинического ответа при остром лейкозе. Достижение ПР четко коррелирует с выживаемостью и является первым и необходимым шагом к излечению. Внедрение молекулярно-генетических методов, которые обладают высокой чувствительностью и дают возможность выявить одну лейкозную клетку среди 10 5 -10 6 нормальных, позволило установить, что группа больных острым лейкозом в стадии ПР разнородна: у части пациентов обнаруживается остаточная популяция лейкемических бластов (минимальная резидуальная болезнь), и в этих случаях рецидивы острого лейкоза возникают чаще и раньше.
В соответствии с современной терапевтической стратегией лечение острого лейкоза делится на две основные части: 1) индукцию ремиссии; 2) постремиссионную химиотерапию.

Индукционная терапия направлена на максимальную эрадикацию (уничтожение) лейкозного клона с целью достижения ПР. Современные схемы химиотерапии часто приводят к развитию глубокой обратимой депрессии нормального кроветворения (анемия, агранулоцитоз, тромбоцитопения) продолжительностью от 2 до 5 недель. После восстановления нормального гемопоэза у большей части пациентов развивается ПР.
Постремиссионная химиотерапия направлена на эрадикацию минимальной резидуальной болезни, обеспечивает профилактику рецидива острого лейкоза и, возможно, излечение больного. Постремиссионная химиотерапия включает в себя различные подходы: консолидацию (и/или интенсификацию) и поддерживающую терапию. При ряде вариантов острого лейкоза (прежде всего ОЛЛ) должна проводиться профилактика нейролейкоза.
Консолидирующая терапия используется после достижения ПР и проводится по тем же программам, которые использовались при индукции.
Интенсификация предполагает использование значительно более высоких доз препаратов, чем при индукции ремиссии.
Поддерживающая терапия — использование препаратов в значительно меньших дозах на протяжении длительного периода времени.
Лейкозы составляют 25-30% всех онкологических заболеваний у детей. Острый лимфобластный лейкоз – самая распространенная онкологическая патология в детском возрасте. Острый лейкоз впервые описан Вирховым в 1845 г., но до сих пор продолжает оставаться тяжелым и во многих случаях смертельным заболеванием.
Группы повышенного риска по заболеваниям опухолевой природы:
- семейный рак
- конституция (лимфатизм)
- подверженность канцерогенным воздействиям.
Для здорового ребёнка риск заболеть лейкозом составляет 1:23750, но если один из идентичных близнецов заболевает лейкозом, то вероятность заболеть для сибса составляет уже 1:8.
Лейкоз (в англоязычной литературе лейкемия) — злокачественное новообразование кроветворных клеток. Заболеваемость 2-5 на 100000 детей
Пик заболеваемости приходится на 3,5 — 4 года. При этом наиболее распространён острый лимфобластный лейкоз (70%). Только в США ежегодно регистрируется 2500 новых случаев острого лимфобластного лейкоза. В Европейских странах частота лейкоза 3 – 4 случая на 100 тысяч детского населения.
Этиология
Генез острого лейкоза не установлен. Наиболее распространённая теория гласит, что в организме человека могут находиться в репрессированном состоянии онкогены, передающиеся по вертикали. В определённых условиях онкогены активируются, и начинается безудержное размножение кроветворной клетки, теряющей способность к дифференцировке.
Теории возникновения и факторы риска возникновения лейкозов
Факторы, связываемые с риском возникновения лейкозов
- Ионизирующая радиация.
- Внутриутробное облучение внутриутробное при рентгенологическом обследовании беременной матери
- Атомные катастрофы — бомбардировка Хиросимы, Чернобыльская авария
- Лимфатизм акселерационный
- Гипопластический (лимфатико-гипопластический диатез).
- Лимфатизм алиментарно-иммунологический (при пищевой аллергии).
- Лимфатизм иммунологической недостаточности.
Развитие лейкоза можно крайне упрощенно представить следующим образом:
- Онкогены передаются антенатально вертикально и приводят к образованию мутантных клеток, рост которых до поры сдерживается, или же они уничтожаются. (первое событие).
- В трансформированном клоне перинатально или постнатально при воздействии провоцирующих факторов (вирусные инфекции или другие экзогенные причины) при наличии соответствующих констуциональных условий и преморбидных причин происходит вторая мутация (второе событие).
Лейкозные клетки происходят от одной клетки — родоначальника, прекратившей дифференцировку на ранней стадии развития. Вероятнее всего, первая мутация клеток происходит еще внутриутробно.
Дремлющая фракция периодически пополняет пролиферирующую популяцию, начиная так же активно делиться.
Для возникновения клинических проявлений лейкоза необходимо, что бы в состав клона вошло не менее 1012 клеток. Срок необходимый, для того, чтобы накопилось такое количество клеток составляет приблизительно 1 год., максимальный 10 лет, минимальный 3,5 года.
Классификации лейкозов
Лейкозы согласно современным классификациям, классифицироваться по следующим критериям: морфологическим, иммунологическим, биохимическим и цитогенетическим.
Морфологическая классификация:
Выделяют две большие основные группы лейкозов- Лимфобластные лейкозы
- Нелимфобластные лейкозы
Франко-Американско-Британская рабочая группа (FAB) по лейкемии в 1976 г. приняла общепринятую в настоящее время классификацию лейкозов по морфологическим характеристикам лейкозных лимфобластов.
А) L1 мелкие с узким ободком цитоплазмы и трудно различимым ядрышком клетки. Наиболее распространённая клетка при всех типах ОЛЛ у детей
В) L2 — крупнее L1, более широкий ободок цитоплазмы, одно или больше выраженных ядрышек. Клетки менее типичны, чем L1, их иногда ошибочно принимают за миелобласты.
С) L3 крупные клетки с базофильной вакуолизированной цитоплазмой и чётко выраженными ядрышками. Встречаются редко и, как правило, являются маркерами В-клеточного варианта ОЛЛ.
85% пациентов имеют L1 субтип ОЛЛ, менее 2% L3, 13%-L2. Такое деление практически важно, так как L1 имеют более благоприятный прогноз.
Иммунологическая классификация основана на происхождении от Т или В-лимфоцитов.
- 15%-25% — Т-клеточный лейкоз,
- 1-3% — В-клеточный и пре-В-клеточный
- 0 клеточный — неидентифицируемый
Цитогенетическая классификация. Если лейкемические клетки имеют гипердиплоидный кариотип (более 50 хромосом), это дает хороший прогноз по выживаемости.
Ферментная терминальная дезоксинуклеотидилтрансфераза (её нахождение в 90% случаев характерно для ОЛЛ у детей). Таким образом, дифференцируют ОЛЛ от ОНЛ.
Среди острых нелимфобластных лейкозов (ОНЛЛ) выделяют:
- Острый миелоидный лейкоз:
М0- недифференцированный
М1 — острый миелобластный лейкоз недифференцированный
М2 — острый миелобластный лейкоз с дифференциацией
М3 – острый промиелоцитарный лейкоз
М4 – острый миеломонобластный лейкоз
М5 – острый монобластный лейкоз
М6- острый эритролейкоз
М7 — острый мегакариобластный лейкоз - При Хроническом миелолейкозе выделяют взрослый тип, ювенильный тип, бластный криз.
- Врождённый лейкоз является особой формой острого лейкоза
Клинические проявления.
Следует отметить, что в силу полиморфности клиники у большого количества детей диагноз может устанавливаться случайно. Ниже приводим наиболее частые клинические проявления острых лейкозов.По образному выражению в основе клиники лейкозов лежат два факта:
- У больных слишком много лейкоцитов
- Слишком мало эритроцитов и тромбоцитов
Наиболее типичны:
- Повышение температуры тела на субфебрильных цифрах или умеренный фебрилитет. Гипертермия связана с тем, что лейкозные клетки могут продуцировать эндогенные пирогены, а у части больных в силу бактериемии или вирусемии.
- Костно-суставной синдром (иногда ложный ревматизм) — боли в трубчатых костях нижних и реже верхних конечностей, позвоночнике, ребрах. В некоторых случаях, а наблюдается ограничение подвижности, нарушение походки.
- Кожные покровы и слизистые оболочки. Бледность кожных покровов. Лейкемиды (пролифераты лейкозных клеток)- образования темно-желтого или бурого цвета, выступающие над поверхностью тела в области грудной клетки, волосистой части головы, таза. Пролифераты в костях орбиты могут приводить к экзофтальму. Со стороны полости рта за 1-5% месяца до начала заболевания могут проявляться кровоточивость и гиперплазия дёсен, герпетические периоральные высыпания. Сухость и заеды красной каймы губ. Стоматит от катарального до язвенного.
- Геморрагический синдром. Кровоизлияния чаще на коже нижних конечностей и реже на туловище. Необильные носовые кровотечения, кровотечения из дёсен. Редко — желудочно-кишечные кровотечения и гематурия.
- Лимфоаденопатия — патогномоничный признак лейкоза. Лимфоаденопатия, как правило, генерализованная. Наиболее часто увеличиваются передне и заднешейные, подчелюстные и паховые лимфоузлы. Более значительное увеличение лимфоузлов характерно для нелимфобластных вариантов лейкоза.
- Гепатолиенальный синдром — чаще имеет место умеренно выраженная гепатоспленомегалия. Печень и селезенка, гладкие при пальпации.
- Изменения со стороны нервной системы на ранних этапах в виде астеноневротического и астеновегетативного синдромов. На поздних стадиях в виде нейролейкоза. Клинические проявления нейролейкоза — тошнота, рвота, нарушения сознания, поражения черепно-мозговых нервов, парезы, параличи, судороги.
- Поражения слюнных желёз — синдром Микулича.
- Редкие проявления виде пневмониеподобного синдрома, кардиоваскулярные расстройства по типу функциональной кардиопатии, увеличение почек, лейкозная инфильтрация яичек др.
Диагноз острого лейкоза ставится клинически, но всегда должен быть подтверждён лабораторно:
(!) Диагноз острого лейкоза без пункции костного мозга и цитологического исследования аспирата костного мозга неправомерен.
При ОЛЛ наблюдается скопление РАS-положительного материала виде гранул вокруг ядра не менее чем у 10% бластов. Гранулярная окраска на бета глюкоронидазу при отрицательных реакциях на пероксидазу, неспецифическую эстеразу.
При ОНЛЛ — положительная реакция на пероксидазу, липиды, неспецифическую эстеразу, слабое диффузное окрашивание при ШИК реакции на бета глюкоронидазу.
(. ) Настоятельно рекомендуется избегать применения кортикостероидов до установления диагноза, так как стероидная терапия:
Лечение острого ОЛЛ.
Какова судьба больных лейкемией, которые не получают специфического лечения?(Aplenc R, 2002)При отсутствии специфического лечения от появления симптомов до диагноза при ОЛЛ и ОНЛЛ проходит в среднем 1,2 мес.
От установления диагноза до наступления смерти при ОЛЛ проходит в среднем
3,5 мес., а при остром миелобластном лейкозе смерть наступает через 1, 2 мес.Современные методы лечения лейкозов дают возможность не только продлить жизнь больным, но и в некоторых случаях излечиться от заболевания.
Современные схемы лечения позволяют достичь 70% выживаемости детей с ОЛЛ. При ОНЛЛ выживаемость составляет свыше 40%.
К сожалению, стоимость курса лечения очень высока и составляет примерно 3500 $ США. Операция по трансплантации костного мозга обходится по скромным подсчетам в 50 тыс. долларов. Следует отметить, что даже в развитых странах такие затраты не по силам среднему гражданину, поэтому основные денежные средства поступают от благотворительных фондов и из государственных источников. В наши задачи не входит конкретизированное изложение современных алгоритмов лечения лейкозов у детей. Ниже приводим только основные принципы терапии и ведения данной категории больных
Различают следующие основные виды лечения, которые применяются для лечения острых лейкозов
- Химиотерпия
- Биологическая терапия
- Лучевая терапия
- Трансплантация костного мозга
Безусловным лидером среди терапевтических методик является химиотерапия. Без химиотерапии излечение больного лейкозом в настоящее время невозможно.
Общие принципы лечения:
- Строго соблюдается оптимальный гигиенический противоэпидемический режим:
- Предусматриваются гигиенические ванны, ежедневная смена белья. Ухаживающий персонал и родители два раза в сутки принимают душ и моют волосы.
- Медикаментозное лечение начинают на фоне деконтаминации кишечника колистатином, полимиксином, нистатином. Тщательно соблюдают гигиену полости рта.
- Лечение проводят дифференцированно, предварительно устанавливают группу риска — стандартную, среднюю или высокую.
Группа неблагоприятного прогноза
- Возраст менее 2 лет или более 10 лет
- Начальное количество лейкоцитов более 50000 тыс.
- Мужской пол
- Выраженная органомегалия и поражения средостения
- Тромбоцитопения, иммунофенотип пре — В, В-клеточный, Т-клеточный.
Для групп неблагоприятного прогноза показано проведение более агрессивных видов терапии лейкоза.
Основные принципы лечения:
Лечение проводят со строгим соблюдением определенных схем (протоколов).
Существует большое количество местных и многоцентровых протоколов лечения лейкемии употребляемых для лечения во всем мире.
Однако большинство из них имеют 4 главных компонента:
- индукция ремиссии,
- консолидация или интенсификация терапии
- профилактическая менингеальная терапия
поддерживающая терапия.
Выбор препаратов и их последовательность, дозы и сроки применения варьируют в связи с типом лейкемии.
Эффективное лечение ОЛЛ включает:
- Комбинированную химиотерапию
- Профилактику нейролейкоза
- Выделение среди контингента больных “групп риска”
- Селективную интенсификацию системной терапии
- Поддерживающую терапию:
- Лечение лихорадки и нейтропении
- Профилактику пневмоцистной инфекции
- Профилактику герпетической инфекции
Наиболее часто в терапии острого лимфобластного лейкоза применяют протокол, разработанный педиатрами-гематологами Германии и Австрии (ALL-BFM-90).
1.Индукция ремиссии. 4-6 недель
Винкристин 1,5 мг/м2 один раз в неделю в\в
Преднизолон 40 мг/м2 через рот на 2-3 приема утром и днём
Жидкостная терапия в сочетании с аллопуринолом для ликвидации последствий гиперурикемии.2. Консолидация
L-аспарагиназа 6000 ед/м2 в/в 14 дней, эндолюмбальное введение метотрексата, гидрокортизона, цитозинорабинозида. или облучение головного мозга.3. Поддерживающая терапия
6-меркаптопурин 50 мг/м2 в сутки в 3 приёма ежедневно
Метотрексат 20 мг/м2 в сутки
Винкристин 1,5 мг/м2 каждые 8 недель внутривенно.
Преднизолон 40 мг/м2 в сутки внутрь 4 недели через каждые 8-12 недель внутривенно.Поддерживающее лечение и особенности образа жизни больного.
Значительная поддерживающая терапия необходима для профилактики и лечения различных осложнений, связанных с лейкозом. Для предотвращения инфекций необходима хорошая гигиена, особенно мытье рук членами семьи и больничным персоналом. Следует избегать необязательных инструментальных исследований, интубации, катетеризации, ректальных исследований, места кожных проколов для инъекций препаратов обрабатываются , число госпитализаций минимизируется.
Эффективна профилактика пневмоцистной пневмонии триметоприм-сульфаметоксазолом или диапсоном, иммуноглобулин — анти-varicella zoster модифицирует течение герпетической инфекции, если дан в первые 2-3 дня. Исследование зубов важно для определения и удаления больных зубов, которые могут быть источником бактериемии. Частота осмотра больных и назначения лечения для профилактики инфекции принципиально важны, особенно когда у больного нейтропения и лимфопения. Трансфузии гранулоцитов приносят мало или вовсе не приносят пользы. Некоторые гемопоэтические ростовые факторы могут укоротить период нейтропении поднять число гранулоцитов, но не влияют на частоту и серьезность инфекций и не эффективны для выживаемости. Их практическая значимость пока не доказана.
Тромбоцитопенические кровотечения обычно контролируются трансфузиями тромбоцитов, но употребление тромбоцитов имеет другую (оборотную) сторону, потому что имеется опасность сенсибилизации и инфекции. Переливание эритроцитов назначается при симптоматической нормоцитарной анемии. Употребляется бедная лейкоцитами кровь, лучше, чтобы она была облученной. Компенсация коагулопатий проводится свежезамороженной плазмой и концентратами тромбоцитов чаще, чем гепарином.
Для больных, у которых, кроме лейкоцитоза, выраженная висцеральная инфильтрация, Т-клеточная или В-клеточная при ОЛЛ, массивное поражение почек, или гормонсекретируемый лейкоз, метаболические проблемы становятся важными. Дают высокие объемы интравенозной жидкости без натрия, одновременно с бикарбонатом натрия и аллопуринолом, если наблюдается гиперурикемия или молочнокислый ацидоз. Сульфонат полистирена натрия употребляется при гиперкалиемии гидроксид алюминия при гиперфосфатемии, глюконат кальция при гипокальциемии, преднизон и фуросемид при гиперкальцемии. Некоторые больные при необходимости подвергаются диализу.
Средства, употребляемые для индукционной терапии, могут вызвать метаболические нарушения. Например, преднизон и L- аспарагиназа могут способствовать появлению гипергликемии, требующей инсулинотерапии. Винкристин может иногда препятствовать секреции антидиуретического гормона с гипонатриемией, что ведет к нарушению выделения жидкости и солей.
Хорошее питание важно для повышения толерантности пациента к химиотерапии и поддержания процесса роста в течение болезни. Следует избегать жирной, острой, соленой пищи, и также как и грубой с острыми краями. Могут быть нужны пищевые добавки.
Детям больным лейкозом рекомендуется избегать мест скопления людей. Противопоказаны травматичные виды спорта и занятия в плавательном бассейне.
Тем не менее, дети нуждаются в терапии играми и помощи в реинтеграции в среду сверстников, в частности в школе. Семья нуждается в социальной помощи в соответствии с экономическим и местными проблемами, вызываемыми лейкозом. Честность во взаимоотношении с ребенком и семьей – это самое важное для того, чтобы добиться доверия и кооперации помощи. Каждый больной нуждается в районном терапевте, который руководит медицинской командой и поддерживает тесный контакт с больным и семьей. Когда смерть неизбежна, обычно лучше, чтобы больной был дома, окруженный заботой домашних и медицинской службой под руководством участкового врача.
Цитостатическая болезнь и осложнения цитостатической терапии
Примеры специфических осложнений. Винкристин — нейротоксичность, алопеция. Рубомицин — кардиотоксичность.
Цитостатическая болезнь — общее угнетение кроветворения, цитостатический энтерит и колит, цитостатический гепатит, кардиомиопатия, цитостатическая пневмопатия, поражения интерстиция почек мочевой кислотой, задержка роста.
Лечение острого лейкоза цитостатиками, как правило, не предотвращает рецидива заболевания и не приводит к излечению Каждый рецидив всё более резистентен к терапии. Наиболее характерно возникновение костномозгового рецидива, нейролейкоза, рецидива в тканях яичек. Поэтому пациенты, у которых был рецидив особенно в течение 2 лет от начала заболевания подвергаются трансплантации костного мозга при наличии HLA — совместимого донора.
Более 2/3 пациентов, у которых не было рецидива в течение 5 лет, остаются затем здоровыми.Диспансерное наблюдение при остром лейкозе:
- етям назначается диета N 5 по Певзнеру. Назначаются комплексы витаминов, гепатопротекторы, в период реиндукции показаны витамины группы В.
- Исключают инсоляцию, светолечение, воздействие токов высокой частоты.
- При удовлетворительном самочувствии возможны занятия в школе с 1 дополнительным днём отдыха в неделю, освобождение от уроков труда, физкультуры, сельскохозяйственных работ и экзаменов.
- Ежемесячно ребенка осматривает педиатр. Гематолог осматривает ребенка 2-3 раза в месяц.
- ЛОР — врач — 2 раза в год
- Стоматолог — 2 раза в год.
- Окулист 1 раз в 3 месяца, невропатолог по показаниям.
Лабораторные исследования:
- Общий анализ крови 2-3 раза в месяц
- Общий анализ мочи 1 раз 3-6 месяцев.
- Билирубин, трансаминазы, остаточный азот сыворотки крови 2 раза в год.
- Стернальная и люмбальная пункции 1 раз в 3-4 месяца.
Читайте также:

