Что нового в лечении опухоли головного мозга
Несмотря на значительное развитие современной медицины, лечение такого заболевания, как опухоль головного мозга, далеко не всегда приносит свои плоды, являясь при этом довольно дорогостоящим мероприятием. К самым распространенным методам лечения относятся хирургическое вмешательство, лучевая терапия и химиотерапия. Однако все чаще в мире говорят об использовании новейших технологий, которые позволяют значительно повысить эффективность методов лечения опухолей мозга, сделав их более точными и успешными. Одним из таких достижений является так называемая стереотаксическая радиотерапия. В рамках данного метода используются трехмерные изображения, полученные с помощью магнитно-резонансной томографии, которые позволяют гораздо точнее составить карту области расположения и распространения новообразования.
К другим современным новшествам, применяемым для лечения опухолей головного мозга, можно отнести использование лазера и ультразвука при операционном вмешательстве. Это позволяет произвести значительно более точное удаление опухоли, уменьшая риск того, что какие-то раковые клетки будут пропущены и оставлены (это может привести к рецидиву опухоли). Кроме того, использование лазерной и ультразвуковой техники для проведения хирургических операций значительно уменьшает риск повреждения здоровых тканей человеческого мозга.
Некоторые из наиболее отличительных новых методов лечения опухолей головного мозга основаны на применении радиации. Лечение, в рамках которого точно нацеленный радиационный луч направляется непосредственно в опухоль в мозгу, называется стереотаксической радиохирургией. Отличие от обычного хирургического вмешательства заключается в отсутствии необходимости использования скальпеля. Метод стереотаксической радиохирургии позволяет доставить радиационный луч прямо в точку назначения, то есть, в нужную область новообразования в головном мозгу.
Кроме вышеперечисленных способов лечения, активно изучаются новые методы доставки медицинских препаратов, направленных на борьбу с раковыми клетками, непосредственно в область опухоли в мозгу. При некоторых видах новообразований достаточно успешно проявил себя новый метод терапии, в рамках которого непосредственно в область опухоли в мозгу хирургическим путем вживляется специальная пластинка, содержащая определенный химиопрепарат. По сути, речь идет о частном случае химиотерапии, при котором постепенно разлагающаяся в опухоли пластинка высвобождает борющиеся с распространением рака медицинские препараты.
Дополнительно можно упомянуть и о новом экспериментальном методе лечения, который подразумевает использование генной терапии. В рамках данного метода пациенту назначается прием медицинских препаратов, которые отрезают опухоль от кровоснабжения; другие медикаменты могут приостановить рост аномальных клеток, а также распознавать и уничтожать раковые клетки. Большинство из этих методов не скоро станут применяться повсеместно, так как сейчас лишь проходят стадию лабораторных испытаний и тестирований. Однако нельзя не подчеркнуть важнейшую роль, которую играют в данных исследованиях сами пациенты, участвуя в испытаниях многих клинических методов и препаратов, и даруя тем самым шанс на выздоровление всем людям, страдающим от различных видов опухолей головного мозга.
Неудачи операций в первую очередь связаны с отсутствием границ опухоли головного мозга, а лучевой и химиотерапии —с переменными генетическими аберрациями в клетках опухоли, их неоднородностью, невозможностью адекватной поставки лекарств из-за гематоэнцефалического барьера (ГЭБ) и устойчивостью тканей к диффузии, усиливающейся липофильной основой структуры мозга.
а) Нацеливание и доставка. Концепция нацеливания включает широкий спектр лечебных принципов, основанных на специфических свойствах клеток опухолей головного мозга, отличающих их от окружающих тканей, а также на том, что лекарства могут быть введены непосредственно в опухоль, пострезекционную полость и головной мозг.
Такая терапия включает в себя методы генной терапии и генной инженерии; терапии на основе иммунологических свойств и иммунной системы в целом, лекарственные препараты, распознающие специфические и уникальные рецепторы мембраны опухоли, в том числе использование естественных, а также искусственных лигандов и лигандов, связанных с препаратами; пути внутриклеточного вмешательства, влияние на ангиогенез опухоли, а также воздействие на свойства опухолевых клеток к миграции, которые необходимы для их выживания и распрос гранения.
Разработки в области доставки включают в себя методы, предназначенные для преодоления проблем классических перорального, внутривенного или внутриартериального путей введения лекарственных препаратов. Методы, которые развивались и были разработаны в клинике, основываются на местной доставке путем прямой интрапаренхимальной инъекции вируса во время операции, вектор-продуцирующих клеток или медленного высвобождающихся полимеров с химиотерапевтическими веществами.
Кроме того, были использованы полимерные пластины с устойчивым медленным высвобождением BCNU для внутриполостного размещения. Внутриполостная доставка через катетер, соединенный с подапоневротическим резервуаром, является еще одним вариантом радиоиммунотерапии. Ниже представлены новые методы лечения на основе специфического нацеливания, передовых методов доставки и сочетания обеих технологий.
Также применяются ретровирусы и аденовирусы. Во многих странах мира были выполнены многоцентровые исследования (фазы II и III) ретровирусной системы, однако результаты пока неудовлетворительные. Неэффективная доставка генов приводит к недостаточной скорости трансдукции. Аденовирусное направление трансфекции оказалось более эффективным, но и более рискованным.
Другой метод генной терапии направлен на восстановление одного или нескольких генов, которые удаляются в процессе онкогенеза. Наиболее сложный из них ген ТР53, участвующий в нескольких аспектах управления клеточного цикла, удаляется в значительной группе мультиформных глиобластом. С использованием аденовирусного вектора переноса генов ТР53 была достигнута успешная гибель опухолевых клеток в лабораторных условиях, а также клинических, например, при колоректальном раке. Начаты клинические исследования в отношении глиобластом, и вскоре можно будет оценить результаты.
Третья сфера, в которой генные технологии играют важную роль, охватывает повышение иммунного ответа на опухолевые клетки. Это может быть достигнуто, например, путем устранения иммуносупрессоров. Методы основываются на блокировании генов, отвечающих за формирование инсулиноподобного фактора роста I (IGF I), трансформирующего фактора роста бета (TGFbeta) и другие.
Аналогочно иммунологическим факторам, путем вмешательства в соответствующие гены могут осуществляться и манипуляции с генами, влияющими на ангиогенез опухоли. Глиомы высокой степени злокачественности имеют высокую активность ангиогенеза, необходимую для роста и выживания. Данная методика находится на стадии клинического применения (фаза I).
Вирусы также могут быть использованы для прямого влияния на клетки, вызывая их гибель. При рекомбинантных методах они могут быть безопасны и эффективны. В частности, нейротрофические вирусы, как например, вирус простого герпеса и его аналоги представляются перспективными при мутации в формы, имеющие прямое цитопатическое воздействие на опухолевые клетки, а не на нормальные ткани мозга. Были начаты или уже привели к интересным результатам различные клинические испытания. Кроме того, представляется перспективным применение аденовируса, а также другого типа вируса — реовируса.
Различные другие методы существуют и работают в лабораторных условиях, а некоторые уже достигли клинической стадии. Среди них трансдукции ИЛ-2 и ИЛ-7 в опухолевых клетках с целью повышения Т-клеточной реакции; активация естественных дендритных клеток (пассивная и активная иммунизация с риском аутоиммунных реакций в неопухолевой ЦНС) и различные формы иммунизации аутологичных опухолевых клеток. Последний метод был опробован в клиническом многоцентровом исследовании, при этом опухолевые клетки использовать для повторной вакцинации.
3. Нацеливание с помощью мембранных рецепторов:
• Как многие другие опухоли, полноценные опухоли головного мозга, такие как мультиформная глиобластома, имеют специфические рецепторы на клеточной мембране. Среди наиболее распространенных рецепторов на поверхности глиом являются EGF-R, PDGF-R, FGF-R, VEGF-R, трансферрин, рецепторы цитокинов, таких KaKTGF-бета, ИЛ-13 или ИЛ-4. При взаимодействии специфических антител с этими рецепторами образуются так называемые иммунотоксины. Некоторые из препаратов и токсинов, способные вызывать такие реакции, были подвергнуты клиническим испытаниям. Наиболее важные из них:
• Трансферрин с дифтерийным токсином (Trans-MID).
• TGF (лиганд для EGF-R) с псевдомонадным экзотоксином (ТР-38).
• ИЛ-4 лиганд с псевдомонадным экзотоксином (NBI-3001).
• ИЛ-13 с псевдомонадным экзотоксином (PRE-CISE)).
Стоит отметить, что опухолевые клетки обладают гиперэкспрессией всех этих рецепторов, а также их лигандов, что приводит к аутокринной петле, стимулирующей и поддерживающей клеточную пролиферацию. К особой группе лигандов и рецепторов следует отнести TNF-связанные апоптоз-индуцирующие лиганды (TRAIL) и TRAIL рецепторы. Многие опухоли, в том числе глиобластомы, обладают экспрессией TRAIL и TRAIL рецепторов. Таким образом, эта составляющая тоже может стать конкретной ориентацией для лекарственного апоптоза.
4. Внутриклеточные пути нацеливания, связанные с мембранными рецепторами. Большинство упомянутых лигандов и рецепторов связаны с их внутриклеточным доменом тирозинкиназы (Т3). Ее активация приводит к каскаду внутриклеточных процессов, многие из которых ведут к дальнейшему распространению клеток и/ или миграции. Прямое вмешательство в эти процессы может прервать подобные явления и в дальнейшем привести к апоптозу клеток. Было разработано множество молекул, АТФ-миметиков подобного действия, которые в настоящее время испытываются при многих видах рака, включая мультиформные глиобластомы. Например, эрлотиниб, гефитиниб (пресса), иматиниб (гливек).
5. Терапия, направленная на ангиогенез и миграцию клеток. Злокачественные опухоли, особенно глиобластомы, вызывают неоангиогенез. Неоваскуляризация необходима для дальнейшего роста, а торможение ангиогенеза может ее предотвратить. Клетками-мишенями при антиангиогенной терапии могут быть опухолевые клетки, вырабатыающие ангиогенные факторы, такие как VEGF и VEGF-R, а также сами эндотелиальные клетки, являющиеся более доступными, так как находятся вне ГЭБ.
С ангиогенной активностью опухолевых клеток тесно связан и их миграционный потенциал. Для пролиферации клетки должны вовлекаться в окружающий матрикс и синтезировать матричные металлопротеиназы (ММП). Ингибирование ММП предотвращает миграцию раковых клеток и косвенно их пролиферацию, в результате чего рост опухоли останавливается. Тесная взаимосвязь между биохимическими ан-гиогенными факторами и ММП приводит к двойному действию антиангиогенных препаратов. Так как эти лекарственные препараты не убивают опухолевые клетки, а только предотвращают их дальнейший рост, их часто называют цитостатиками.
Примеры антиангиогенных препаратов, которые были уже испытаны в клинических исследованиях: талидомид, ангиостатин, эндостатин, ZK222584/PTK787 и ингибиторы ЦОГ-2, такие как целекоксиб и циленгитид. Наиболее перспективными представляются результаты исследований, в которых эти препараты используются в сочетании с лучевой терапией и/или цитотоксической химиотерапией.
б) Доставка. За последние годы были разработаны различные методы для преодоления основных препятствий адекватной доставки лечебных препаратов к клеткам головного мозга.
1. Местные инъекции. При разработке направления лечения с помощью ретровирусов возникла необходимость использования продуцирующих клеток. Эти клетки могут быть размещены только в пределах и вокруг остаточной опухоли или полости путем прямой инъекции в паренхиму. В ряде исследований было показано, что такой способ доставки не причиняет никакого вреда пациентам и в большинстве случаев вызывает только минимальные изменения видимые при МРТ. Однако эффективность доставки даже после 50 инъекций была низкой.
Инъекции клеток или препаратов с помощью резервуара Оммайя и постоянного катетера приводит к созданию пула материала вокруг кончика катетера. Лекарственные препараты могут растворяться в тканях путем диффузии, для этого необходимо, чтобы они были липофильными и имели низкий молекулярный вес.
2. Системы медленного высвобождения. Более перспективной представляется концепция систем медленного высвобождения, хотя и при этом диффузия является движущей силой доставки препаратов с вышеупомянутыми ограничениями, особенно, при отеке мозга и высоком интерстициальном давлении. Накопленный опыт в большинстве своем связан с применением биодеградирующих пластин, содержащих BCNU. Однако он оказал незначительный эффект на показатели выживаемости.
Другими системами медленного высвобождения, проверенными в лаборатории и избирательно на пациентах, являются системы на основе липосом, сфер альгината и полимерных наночастиц.
3. Конвекционный метод доставки. В отличие от диффузии, когда градиент концентрации является движущей силой молекулы/лекарства, конвекция основывается на градиенте давления. Это позволяет поставить даже крупные молекулы на более дальние расстояния. Данная технология особенно эффективна, когда дело касается иммунотоксинов, действительно больших молекул. Этот метод хорошо воспроизводиться у небольших животных, тогда как у людей изменение в устойчивости мозговой ткани и ткани опухоли, вероятно, препятствует прогнозируемому распределению растворителей и препаратов.
После большого опыта, накопленного за последние несколько лет, возможности конвекционных методов доставки доказаны в нескольких исследованиях (например, ТП 38, PRECISE). С помощью максимум четырех катетеров, помещенных в мозг, можно покрыть довольно большую часть одного полушария. Все исследования с препаратами с большой молекулярной массой в настоящее время проходят с помощью этого метода.
в) Перспективные разработки:
- В ближайшее время еще один способ нацеливания может достичь клинической стадии: нервные стволовые клетки и клетки-предшественники, похоже, имеют тропность к клеткам опухоли головного мозга. В лабораторных условиях после трансфекции этих клеток с определенными генами было показано, что они имеют возможность преследовать и убивать клетки опухоли головного мозга, даже находящиеся далеко от места инъекции.
- Хирургические усовершенствования могут привести к реальному и значительному сокращению опухолевой нагрузки: интраоперационная визуализация посредством интраоперационной МРТ или визуализации остаточных опухолевых клеток с помощью окрашивания (ALA) сможет решить эту задачу.
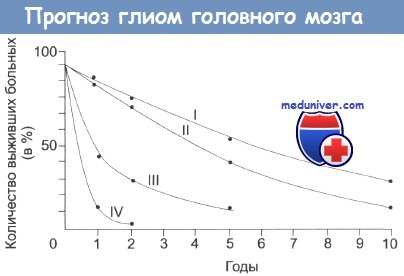
Продолжительность жизни больных со злокачественной глиомой различной степени.
Отметьте, что даже в случаях низкозлокачественной опухоли выживает немного больных.
В Институте Склифосовского бросили вызов одной из самых агрессивных опухолей головного мозга — глиобластоме. Ее трудно обнаружить, она маскируется под здоровые ткани. Поэтому диагноз ставится, как правило, слишком поздно. Но врачи искали новые подходы в лечении, и один из них оказался эффективным. Он уже подарил несколько лет жизни одному из пациентов и надежду — тысячам.
Несколько лет назад Владимиру в Институте Склифосовского удалили глиобластому — опухоль мозга размером с куриное яйцо. Потом были облучение, химиотерапия. Но прогнозы медиков не обнадеживали. Давали год, максимум 1,5. Прошло четыре.
Но недавно болезнь снова вернулась. Потребовалась повторная операция. Огромная опухоль практически вросла в крупные сосуды. Сложнейшая задача для хирургов: максимально аккуратно убрать ее, при этом не повредив артерию. Сколько времени займет операция — предсказать невозможно:
В операционной только ультрасовременная аппаратура. Нейронавигация — это множество датчиков, считывающих электрические сигналы мозга, что помогает буквально заглянуть в его глубину и определить точную локализацию опухоли. Каждое движение хирург сверяет с виртуальной картой.
А вместо скальпеля хирургический пылесос. Он всасывает частички опухоли словно ненужный мусор, сохраняя при этом здоровую ткань. Это жизненно важные зоны мозга, отвечающие за движение. Если их повредить, человек навсегда останется инвалидом. И порой борьба идет за каждый миллиметр.
На экран транслируется картинка, которую видит хирург в микроскоп. Хорошо видно опухоль, которая светится красным, так хирург определяет ее точные границы. Эффект свечения получают благодаря специальному лекарству. Оно накапливается в опухоли, что помогает обнаружить и удалить раковые клетки, невидимые человеческому глазу. Чем больше таких клеток уберет хирург, тем дольше будет жить пациент после операции.
Глиобластома — самая коварная и агрессивная злокачественная опухоль головного мозга. Она стремительно растет, ежедневно появляются миллионы новых раковых клеток. Долгое время они маскируются под здоровую ткань. И даже современные методы исследования не всегда позволяют увидеть опухоль на ранних стадиях развития.
В последние годы глиобластому выявили у нескольких российских звезд: Жанны Фриске, Дмитрия Хворостовского, Михаила Задорнова. Разумеется, малоизвестных людей среди пациентов еще больше. Если опухоль не удалить, человек погибает примерно через три месяца. Во всем мире, как и в России, пытаются найти способ борьбы с тяжелой болезнью, и часто именно наши специалисты помогают, казалось бы, безнадежным больным.
В клинике Склифосовского сегодня применяют новейшие операционные технологии, используют современные химиопрепараты и точечное облучение — комплекс мер, открывающий новые возможности для борьбы с онкологическими заболеваниями.
На следующий день после операции Владимир уже ходил по палате. А через неделю его отпустят домой. Конечно, говорить о полном излечении нельзя, мужчину будут наблюдать. Но уже сейчас понятно: результаты операции превзошли самые смелые ожидания специалистов. И это дарит надежду многим пациентам на долгую и, главное, полноценную жизнь.

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко


фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
Глиома — это аномальное разрастание опухолевой структуры в мозговой ткани человека. Это образование представлено совокупностью очень разных клеток, это "гетерогенная опухоль" по терминологии ученых. Особенностями глиомы считают ее отличное от других опухолей происхождение и отсутствие метастазирования. Однако ее опухолевые клетки обладают способностью мигрировать в здоровую ткань мозга, что значительно усложняет ее лечение. Глиобластома — самая агрессивная стадия глиомы.
Традиционные подходы: хирургическое удаление опухоли, лучевой метод и химиотерапия, к сожалению, не очень продлевают жизнь пациентам. Хирургическое вмешательство не позволяет полностью удалить опухолевые клетки, так как, во-первых, нейрохирург не может удалить лишнее, щадя жизненно важные ткани мозга; во-вторых, опухоль представляет собой неровную структуру без четких границ, и неизвестно, сколько опухолевых клеток уже проникло в ткани здорового мозга. Лучевое лечение и химиотерапия способны лишь притормозить рост опухоли, но не остановить его.
Развитие молекулярных методов позволило изучить глиомы на уровне генов. Результатом исследований явилось изменение классификации Всемирной организации здравоохранения в 2016 году, куда вошли понятия о ключевых для развития глиом мутациях нескольких генов. Классификация стала более четкой и основанной не на визуальных особенностях клеток опухоли, а на их молекулярных характеристиках.
Но и это не очень продвинуло терапию заболевания и не улучшило перспективы пациентов. Ученые во всем мире создают международные консорциумы для поиска решения.
Она объединила специалистов в области медицины, биологии, химии, физики и биоинформатики, которые разрабатывают новые подходы к диагностике и лечению глиомы. Физики, химики, биологи и медики активно ищут отличия между различными формами злокачественности глиомы.
Предполагается, что успех может быть достигнут при трех условиях: 1) максимально ранней диагностике, 2) усовершенствовании технологий, позволяющих четко визуализировать опухоль и максимально полно удалить ее, 3) индивидуальной терапии для целевого подавления опухолевых клеток на основе анализа молекулярных характеристик опухоли.
Демаркация границ опухоли
При хирургическом удалении опухоли крайне важно не затронуть жизненно важные зоны мозга. Одна из передовых технологий — это операция на головном мозге с пробуждением пациента во время удаления опухоли. В мозге нет болевых рецепторов, и достаточно местного обезболивания. Врач во время операции разговаривает с пациентом и просит его решать простые задачки. Нарушение поведения пациента говорит о том, что врач вторгся в опасную зону. Подобный подход позволяет оперировать опухоли, которые раньше считались неоперабельными.
К успешным достижениям в этой области можно отнести разработку российских нейрохирургов и физиков, которые используют методику интраоперационной нейровизуализации глиом. Перед операцией пациенту вводят перорально 5-аминолевулиновую кислоту (5-АЛК), которая совершенно безопасна для человека, поскольку является промежуточным продуктом обмена в организме. Эта кислота превращается во флуоресцирующее вещество протопорфирин IX.
«Одна из задач, поставленных перед наукой руководством России,— найти эффективные способы диагностики, обнаружения и лечения онкологических заболеваний, среди которых выделяются глиомы головного мозга человека. Российский фонд фундаментальных исследований в кратчайшее время создал соответствующее направление в своей работе: за несколько месяцев был сформирован рубрикатор, собран пул экспертов, проведены конкурсы и открыто финансирование.
Удивительным кажется тот факт, что это флуоресцирующее вещество накапливается именно в опухоли, делая ее видимой при использовании нейрохирургами специальной приставки к операционному микроскопу. Подобная технология позволяет максимально полно удалить опухоль.
На сегодня самый значительный технический прорыв наблюдается в области дооперационной диагностики опухоли. Магнитно-резонансная томография (МРТ) позволяет охарактеризовать расположение и объем опухоли еще до операции. Используют МРТ с контрастным усилением в трех проекциях и в трех режимах.
Также используют МРТ-спектроскопию для оценки метаболизма в опухоли и установки степени анаплазии (потеря клеткой внешних характеристик, по котором ее можно отнести к какому-нибудь типу), а МРТ-перфузию — для определения объема крови, проходящего через опухоль.
Появилось очень важное для пациента исследование — функциональное МРТ-картирование, которое необходимо для определения близости двигательных, речевых, зрительных зон мозга к опухоли. Это необходимо для того, чтобы нейрохирург мог рассчитать, как ему удалить опухоль, нанеся минимальный урон пациенту.
Всемирная организация здравоохранения в 2007 году ввела принцип классификации глиом, разбив их по степени злокачественности и по характеристикам клеток опухоли на четыре группы, которые назвали степенями (Grade). Самая доброкачественная I Grade, самая агрессивная IV Grade, или по-другому — глиобластома. Классификация использовала гистологические характеристики опухолевых клеток. В 2016 году ВОЗ вводит новую классификации глиом, которая требует при постановке диагноза опираться не только на гистологические особенности клеток опухоли, но и на результаты иммуногистохимии и FISH-анализа и секвенирования. Требуется оценивать мутации IDH1/2 и ТР53, делеции ATRX и ко-делеции 1p/19q.
Молекулярный паспорт опухоли
Но одних этих достижений оказывается недостаточно. Опухоли сильно отличаются друг от друга на генетическом уровне. Современные молекулярные подходы позволили характеризовать глиомы по ряду маркеров, однако ученые находят все новые генетические нарушения, которые влияют на чувствительность опухоли к терапии. Вполне вероятно, что через некоторое время ВОЗ предложит новую классификацию опухолей, основанную на большей выборке генетических нарушений и более приближенную к индивидуальной медицине.
Кроме того, растет понимание, что важны не только мутационные исследования генома пациента, но также нужно обратить внимание на транскриптом (результат прочтения генов в данном организме) и протеом опухолевых клеток (набор белков в них, синтезированных в результате прочтения их генома). Они сильно меняются и могут служить как диагностическим фактором, так и терапевтической мишенью. Так, например, обнаружено, что в опухоли часто изменяются транскрипты (молекула РНК) известных генов, подобное нарушение может приводить к продуцированию измененного белка или вовсе к тому, что белок не будет продуцироваться. Эти изменения могут служить для диагностики степени злокачественности, а также могут войти в панель прогностических признаков.
Новые направления в лекарственной терапии глиомы



Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Современные препараты химиотерапии стимулируют гибель опухолевых клеток. Но они также уничтожают и нормальные активно делящиеся клетки организма, что ухудшает общее состояние пациента. При этом не достигается полная гибель опухолевых клеток глиомы. Подобное лечение не позволяет продлить жизнь пациенту на длительный срок. Нужно искать новые подходы. Один из векторов таких исследований — это таргетная терапия, которая увеличивает вероятность доставки терапевтических молекул-киллеров непосредственно к клеткам опухоли. Например, есть разработки по использованию наночастиц, которые позволяют доставлять к клеткам глиомы пониженные дозы токсических веществ.
Как определить, преобладание какого типа клеток наблюдается в той или иной глиоме? Как понять, какое лекарство на нее подействует и насколько оно будет эффективно? Можно поставить еще много вопросов, ответы на которые можно дать, получив клеточные культуры из опухолевой ткани пациента. По ним мы можем проанализировать состав опухоли, оценить маркеры, характерные именно для этой опухоли, оценить способность клеток мигрировать и охарактеризовать их. Все современные технологии и новые лекарства могут быть проверены на клеточных культурах глиомы человека. Наконец, можно подобрать вариант терапии (условия лучевой терапии, химиотерапию), которые будут лучшими именно для этого пациента, а это большой шаг к индивидуальной терапии для каждого пациента.
Другой подход предполагает использование онколитических вирусов, которые могут как стимулировать апоптоз (образно говоря, принуждение к самоубийству) опухолевых клеток, так и вызывать иммунный ответ, который также приводит к гибели клеток опухоли. Несмотря на ряд недостатков этой терапии, известно, что некоторые из подобных вирусов уже проходят первую и вторую фазы клинических испытаний.
Появилось новое направление по применению структурированных малых молекул ДНК и РНК, называемых аптамерами, которые предполагают использовать в терапии глиом вместо антител, а также для диагностики опухолей. И такие разработки ведутся у нас в стране. Выбирается мембранный белок, наиболее характерный для опухолевой клетки, и подбирается к нему высокоточный аптамер (как ключ к замку). Подобный аптамер может служить для терапии, диагностики, а также для таргетной доставки другого лекарства.
Нельзя не упомянуть развитие иммунотерапии опухоли, за что была вручена Нобелевская премия по медицине 2018 года. Разрабатываются антитела, которые способны заставить клетки собственно иммунной системы пациента узнавать опухоль и уничтожать ее, как все чужеродное.
Понять происхождение глиом
Он не бессмертен.
Галина Павлова, доктор биологических наук, профессор РАН, заведующая лабораторией нейрогенетики и генетики развития Института биологии гена РАН
PDF-версия
- 18
- 19
- 20
Агентство продовольственной и фармацевтической безопасности в Америке (FDA) 8 октября 2015 года утвердило использование системы под названием Оптюн (Optune) для лечения мультиформной глиобластомы – опухоли мозга (GBM) для больных с повторением заболевания, а также для больных, которым впервые поставили данный диагноз.
Мультиформная глиобластомы (GBM) представляет собой разновидность первичной раковой опухоли головного мозга, наиболее чаще встречающейся у взрослых людей. Несмотря на заметные улучшения в области хирургии и радиотерапии, прогноз выживаемости при этой опухоли не является удовлетворительным. В этой статье мы расскажем об устройстве, которое благодаря использованию электрического поля способствует продлению выживания пациента с мультиформной глиобластомой (GBM).
Прибор Оптюн, который ранее был известен как система NovoTTF-100A, впервые после лечения в 2011 году получил утверждение от Агентства продовольственной и фармацевтической безопасности в Америке для лечения больных мультиформной глиобластомы, когда заболевание прогрессирует или повторяется.
Данная система Оптюн является новым выбором метода лечения для этого сложного и агрессивного вида рака. Наряду с тем, что невозможно полностью вылечиться от этого заболевания посредством данного лечения, все же было установлено, что оно значительно увеличивает продолжительность жизни.
Оптюн, не повреждая здоровые ткани мозга, предотвращает размножение и вызывает гибель раковых клеток в мозге (антимитотик), это неинвазивный переносной прибор с низкой интенсивностью, промежуточной частотностью, который воспроизводит альтернативный электрический ток. Электроды размещаются напрямую к голове пациента для того, чтобы цель служила опухоль. Кроме того, чтобы увеличить эффективность лечения на опухоль, у каждого больного определяется конкретное размещение, в зависимости от результатов магнитно-резонансной томографии.
В исследовании, проведенном в отношении прибора, одной части больных из 695, которым был только что поставлен диагноз мультиформной глиобластомы, наряду с прибором Оптюн проводилась темозоломидная терапия, а другой части больным была применена только темозоломидная терапия. В проведенном исследовании было установлено, что использование системы Оптюн итемозоломидной терапии продлило жизнь примерно на 3 месяца.
При таком заболевании, как мультиформная глиобластома, лечение которой проводится при помощи ограниченного выбора методов, прибор Оптюн предстает перед нами как новый безлекарственный метод лечения, который может увеличить продолжительность жизни у больного, начиная с самого начала лечения.
Оптюн - это переносной прибор, он может работать от батарейки или от электричества. А это обозначает легкость для больных, которые могут продолжить заниматься своими ежедневными делами, продолжая курс лечения.
Агентство продовольственной и фармацевтической безопасности в Америке (FDA), предупреждает о том, что вместо использованияОптюн в качестве стандартной терапии для больных, которым впервые был поставлен диагноз, необходимо использовать как вспомогательный метод лечения.
Методы визуализации и хирургические процедуры
В связи с высокой чувствительностью и функциональностью тканей головного мозга, довольно важное значение представляет место расположения в них и размер опухолевого образования. Несмотря на существующий риск, использование современных подходов к лечению раковой опухоли делает его более безопасным, а также увеличивает вероятность наиболее благоприятного исхода.
Флуоресцентные красители с использованием эндоскопов представляют собой новые подходы. Перед проведением операции обеспечивается окраска опухолевого образования, которое окрашивается специальным флуоресцентным красителем. Таким образом, четко определяются границы опухоли.
При операциях на мозг, выполняемых посредством эндоскопа, сводится к минимуму вероятность совершения ошибки, кроме того, обеспечивается лучшая визуализация в труднодоступных областях. Используется при хирургических опухолях желудочков и аденоме гипофиза.
Методы визуализации представляют собой также важное значение, как и хирургия. При диагностике заболеваний центральной нервной системы широко используется МРТ (магнитно-резонансная томография). Будучи разновидностью метода МРТ, функциональная МРТ и МР-спектроскопия в последние годы получили все большее применение.
Функциональная МРТ определяет, к какой функциональной области мозга ближе всего располагается опухоль. В частности, перед началом операции целесообразным будет определение при помощи функциональной МРТ локализации опухолевого образования, ближе всего расположенного в той или иной функциональной области мозга.
МР-спектроскопия представляет собой метод визуализации, отображающий картину основных метаболитов в метаболизме опухоли. Чем больше степень злокачественности новообразований, настолько их метаболизм отличается от нормальных клеток. Результаты, полученные с помощью МР-спектроскопии, до или после лечения доказывают, насколько эффективным оказалось лечение.
Радиотерапия
Химиотерапия
Для обеспечения улучшения питания, в опухолевой структуре образуются новые кровеносные сосуды. Новые лекарственные препараты разрабатываются для предотвращения образования новых сосудов (ангиогенез) и ингибирования роста опухоли. Одобренный Агентством продовольственной и фармацевтической безопасности (FDA), Бевацизумаб (Авастин) доказал эффективность воздействие, оказываемое им на замедление роста глиобластомных опухолей. Продолжаются исследования в области изучения препарата Сорафениб (Nexavar) и Требанабиб.
Факторы роста являются наиболее излюбленным химическим веществ опухолевых образований. Как можно догадаться из названия, такие факторы обеспечивают рост опухоли и приводят к увеличению клеточного деления. Новые лекарственные препараты, блокируя воздействие факторов роста, предотвращают образование раковых наростов.
Некоторые препараты, применяемые перед началом проведения лучевой терапии, повышают содержание кислорода в опухоли. Таким образом, увеличивается эффективность лучевой терапии.
Противораковая вакцина для лечения опухолей головного мозга
Образование опухоли может являться причиной нарушения генетической структуры. Выяснение изменений в структуре генома возможно позволит онкологу выбрать правильное решение при выборе лечения. Например, у пациента с олигодендроглиомой (тип опухоли головного мозга), были обнаружены потери отдельных хромосом в определенных областях. У этих пациентов наблюдалась намного лучшая реакция на химиотерапию, по сравнению с другими пациентами с наличием этой разновидностью опухоли.
При помощи разработанных методов к опухолям центральной нервной системы осуществляется более осведомленные подходы. Благодаря чему, в значительной степени упрощается процедура лечения опухолевых образований.
Читайте также:

