Взаимодействие с хлором при 600
Cl2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl2 0
Электролиз водных растворов хлоридов, чаще - NaCl:
Окисление конц. HCI различными окислителями:
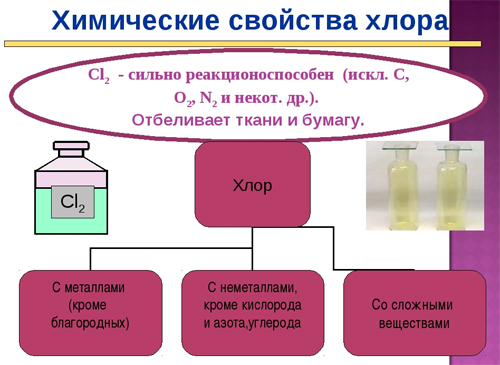
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO3 - .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 - гипохлориты; КClO3 - хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)

Кислородсодержащие соединения хлора - чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Задания с комментариями и решениями
Пример 20. К реакциям замещения относится взаимодействие
1) пропена и воды
2) пропена и водорода
3) пропена и хлора при комнатной температуре
4) пропена и хлора при 600 °С
Проанализируем предложенные варианты ответов. В первом случае происходит присоединение воды к пропену с образованием пропанола-2. Во втором случае также происходит реакция присоединения, в результате которой образуется пропан. В третьем случае хлор также присоединяется по двойной связи к молекуле пропена и образуется 1,2-дихлорпропан
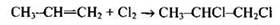
И лишь в четвертом случае происходит реакция замещения — при столь высокой температуре происходит не присоединение хлора по двойной связи, а радикальное замещение атома водорода в метальной группе на хлор.
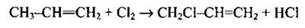
Пример 21. Реакция, уравнение которой 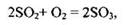
является
1) обратимой, окислительно-восстановительной
2) необратимой, окислительно-восстановительной
3) обратимой, не окислительно-восстановительной
4) необратимой, не окислительно-восстановительной
В этом задании учитываются другие классификационные признаки реакции: обратимость и изменение степени окисления. Как известно, окисление сернистого газа - процесс обратимый.
Наличие в уравнении реакции простых веществ, из которых образуется сложное вещество, указывает на то, что это реакция окислительно-восстановительная: и сера, и кислород изменяют степени окисления 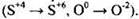
Пример 22. Взаимодействие масляной кислоты и метанола относится к реакциям
Таким образом, верный ответ - 2.
Задания для самостоятельной работы
67. К реакциям обмена относят
1) дегидрирование спиртов
2) галогенирование алканов
3) реакцию щелочных металлов с водой
4) реакцию нейтрализации
Ответ: 
68. К реакциям замещения относится взаимодействие хлора с
5) иодидом калия
Ответ: 
69. Из указанных типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие этана с хлором.
Ответ: 
70. К реакциям нейтрализации относится взаимодействие веществ
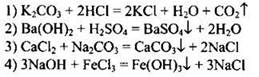
Ответ: 
71. Взаимодействие воды с натрием относится к реакциям
Ответ: 
72. Обратимой является реакция, уравнение которой:

Ответ: 
73. Необратимой является реакция, уравнение которой:
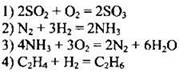
Ответ: 
74. Реакция нейтрализации происходит между
1) гидроксидом кальция и азотной кислотой
2) серной кислотой и хлоридом бария
3) цинком и соляной кислотой
4) гидроксидом натрия и сульфатом меди(II)
Ответ: 
75. Необратимой реакции соответствует уравнение:
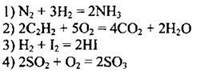
Ответ: 
76. Взаимодействие цинка с соляной кислотой является реакцией
Ответ: 
77. Взаимодействие хлорида олова(II) с цинком является реакцией
2) ионного обмена
Ответ: 
78. Взаимодействие брома с изобутаном является реакцией
Ответ: 

Хлор — токсичный, коррозийный, зеленовато-желтый газ с едким, раздражающим запахом. Весит больше воздуха, поэтому при утечке образовывается у пола желто-зеленым скоплением. В спокойном состоянии горению не подлежит, но при повышенных температурах взаимодействует с водородом, что может спровоцировать взрыв, после чего происходит выделение фосгена. Весьма ядовит, даже небольшая плотность его в воздухе (0,001 мг на 1 дм3) может привести к летальному исходу.
Где используется хлор
Большой объем CI2 идет в металлургию для хлорирования при переработке полиметаллических руд и добычи из нее золота, в нефтеперерабатывающей сфере, сельском хозяйстве, медицине, санитарии.
Хлор также используется:
- как средство для отбеливания;
- в препаратах по уничтожению вредных для урожая насекомых, но неопасных для культур;
- в пищевой индустрии действует как добавка E925;
- в химпроизводстве каустической соды;
- при изготовлении искусственного шелка;
- в мыловарении.
Применение хлора в промышленности
Активно используется в промышленных целях, с его помощью получают:
- всевозможные хлорорганические соединения для изготовления пластмассы, синтетических каучуков, химических волокон, растворителей, инсектицидов;
- медикаменты;
- средства дезинфекции.
Больше всего участвует в производстве соляной кислоты, извести, хлоратов. Очищает питьевую воду, не смотря на негативное влияние на организм человека и разрушения трубопроводов. Альтернативные средства применяются реже по причине значительных затрат на ресурсы.
Хранение и транспортировка
Техника безопасности при взаимодействии с хлором
При работе с хлором нужно помнить о его высокой токсичности. В используемых аппаратах может скапливаться взрывоопасные газовые примеси. Вдыхая воздух, содержащий 0,1 мг/л опасного вещества на протяжении 30-60 минут критично для жизни человека, более 0,001 мг/л раздражает дыхательные пути. При скоплении 3-6 мг/м3 начинается ощущение запаха, раздражение глаз и слизистой носа, при 15 мг/м3 – раздражается носоглотка, при 90 мг/м3 – начинаются частые приступы кашля. Более длительный контакт с газом заканчивается летальным исходом.
Присутствие хлора в воздухе определяется газоанализаторами на CL2: ГСА АИГ , Сигма-03 , ЭЛАН плюс , GasBadge Pro , Лидер 021 , GasAlertMicro 5 , GasAlert Extreme , Сенсон-СД-7033 , Сенсон-СД-7032 , Сенсон-СД-7031 , Сенсон-СВ-5023 , Сенсон-СВ-5021 , Сенсон-СД-7033-СМ , Сенсон-СВ-5022 , Сенсон-СД-7032-СМ , Сенсон-СД-7031-СМ , Сенсон-СВ-5021-СМ . Данным оборудованием должны быть оснащены помещения с опасным веществом, для своевременного определения превышенной концентрации и оповещения персонала.
В случае аварии работники цеха должны обезопасить себя специализированными противогазами, а также быть надетыми в защитную спецодежду. Ящики с противогазами должны быть покрашены в желтый цвет.
Для безопасной работы с опасным газом требуется:
- качественное проектирование установок;
- программа пользования и технического обслуживания;
- надлежащие приборы для обеспечения безопасности и знание последовательности действий в случае аварийной ситуации.
Время от времени в обязательном порядке должна проводиться проверка оборудования, для гарантии правильной и надежной работоспособности приборов.
Химзащитная форма персонала должна также осматриваться для определения ее надежности и эффективности, так же как и дыхательные аппараты. Обязательно наличие отдельных закрытых шкафчиков для рабочей и личной одежды.
Хлор ( Cl 2 ) класс опасности - 2
Зеленовато-желтый негорючий газ с резким удушливым запахом, в 2,5 раза тяжелее воздуха, при утечке дымит, при температуре -34 0 С сжижается, при температуре -101 0 С затвердевает. Малорастворим в воде – в одном объеме воды растворяется около двух его объемов. Жидкий хлор в 1,5 раза тяжелее воды. Один кг жидкого хлора при испарении дает 315 л. газообразного хлора, при испарении на воздухе в значительных количествах дает с водяными парами белый туман. В смеси с водородом (более 50% водорода) взрывоопасен , при нагревании емкости с хлором взрываются.
Хлор используют для хлорирования питьевой воды, отбеливания тканей и бумаги, получения хлорорганических и хлорнеорганических веществ, дезинфекции.
Хлор перевозят в контейнерах, железнодорожных цистернах, баллонах, которые являются временным его хранилищем. Обычно хлор хранят в цилиндрических (объёмом 10-250 м 3 ) и шаровых (объёмом 600-2000 м 3 ) резервуарах под давлением собственных паров 18 кгс/см 2 . Максимальные объемы хранения составляют 150 тонн. В случае разгерметизации происходит резкий выброс хлора с концентрацией, превышающей смертельную в несколько раз.
Предельно допустимая концентрация (ПДК) хлора в воздухе населенных пунктов: среднесуточная 0,03 мг/м 3 , максимальная разовая 0,1 мг/м 3 , в воздухе рабочей зоны производственных помещений составляет 1 мг/м 3 , порог восприятия запаха 2 мг/м 3 . При концентрации 3-6 мг/м 3 ощущается отчетливый запах, происходит раздражение (покраснение) глаз и слизистых оболочек носа, при 15 мг/м 3 - раздражение носоглотки, при 90 мг/м 3 - интенсивные приступы кашля. Воздействие 120 - 180 мг/м 3 в течение 30-60 минут опасно для жизни, при 300 мг/м 3 возможен летальный исход, концентрация 2500 мг/м 3 приводит к гибели в течение 5 минут, при концентрации 3000 мг/м 3 летальный исход наступает после нескольких вдохов. Максимально допустимая концентрация хлора для фильтрующих промышленных и гражданских противогазов составляет 2500 мг/м 3
При ликвидации аварий с выбросом (проливом) хлора изолировать опасную зону, удалить из нее людей, держаться с наветренной стороны, избегать низких мест, в зону аварии входить только в полной защитной одежде. Непосредственно на месте аварии и на удалении до 500 метров от источника заражения работы проводят в изолирующих противогазах ИП-4, ИП-5 (на химически связанном кислороде), дыхательных аппаратах АСВ-2, ДАСВ (на сжатом воздухе) КИП-8, КИП-9 (на сжатом кислороде) и средствах защиты кожи (Л-1, ОЗК, КИХ-4, КИХ-5 и др.). На расстоянии более 500 метров от очага, где концентрация хлора резко понижается, средства защиты кожи можно не использовать, а для защиты органов дыхания используют промышленные противогазы с коробками марок А , В, Г, Е, БКФ, а также гражданские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш, без ДПГ-3 или с ДПГ-3.
При длительном воздействии жидкий хлор разрушает резиновые детали изолирующих противогазов и прорезиненную защитную ткань защитных костюмов, при соприкосновении с кожей вызывает обморожение.
Расчеты: объемных отношений газов при химических реакциях; массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества, одно из веществ находится в избытке.
В этих заданиях от школьников требуется не просто использовать имеющиеся у них знания, но синтезировать на основе их новые. Так в школьном курсе химии достаточно много говорится о восстановительных свойствах водорода и аммиака, но лишь по отношению к оксидам металлов. Говорится и об окислительных свойствах кислородных соединений азота, но, главным образом, при рассмотрении азотной кислоты. Участникам экзамена года надо самим додумать, что при взаимодействии водорода (или аммиака) с оксидами азота пойдет окислительно-восстановительная реакция с образованием наиболее устойчивых веществ, азота и воды. К сожалению, это оказывается по силам немногим.
Задача 1 (2004 г., успешность 2,8%).Оксид азота(II) объемом 1,57 л (н.у.) смешали с аммиаком, полученным при действии избытка едкого натра на 2,64 г сульфата аммония. Полученную газовую смесь нагрели при 300 о С до завершения реакции. Установите объемные отношения газов в полученной смеси после охлаждения ее до 0 о С.
Возможное решение и критерии оценивания:
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла)
Найдено количество вещества оксида азота(II)
n(NO) = 1,57/22,4 = 0,07 моль
Составлено уравнение реакции получения аммиака и найдено количество вещества аммиака:
Составлено уравнение реакции взаимодействия аммиака и оксида азота(II), указано на то, что NO дан в избытке:
Так как NO дан в избытке, аммиак вступает во взаимодействие полностью, а часть оксида азота(II) останется после реакции
Найдено соотношение объемов газов, оставшихся после реакции:
n(NO) = 0,07 – (6/4)*0,04 = 0,01 моль
Следовательно: V(NO) / V(N2) = n(NO) / n(N2) = 1:5
При выполнении задания С-4 оказывается, что значительная часть школьников путают нитриды, нитриты и нитраты, фосфиды и фосфаты и т.п. Одной из сложных задач была задача на взаимодействие хлора с раствором щелочи с образованием хлората (причем большая часть решавших похоже просто не знала, что такое хлорат). К недостаткам выполнения расчетной части решения задач следует отнести неумение некоторых школьников использовать для расчетов молярные отношения, правильно определять вещество, полностью вступившее в химическую реакцию.
Много ошибок допускается и при определении состава раствора, полученного в ходе химической реакции, при поглощении газов, растворении веществ, выпадении осадков.
Задача 2. (2005 г., 17%). Хлор, выделившийся при взаимодействии 43,5 г оксида марганца(IV) с 36%-ным раствором HCl объемом 500 мл и плотностью 1,18 г/мл, пропустили через горячий раствор гидроксида калия массой 600 г, с массовой долей 28%. Определите массовую долю хлората калия в полученном растворе.
Решение и критерии оценивания:
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла)
Составлены уравнения реакций:
Найдены количества веществ оксида марганца(IV), хлороводорода, сделан вывод о избытке HCl и расcчитано количество вещества Cl2:
n(MnO2) = m/M = 43,5/87 = 0,5 моль; согласно уравнению необходимо 0,5*4 = 2 моль HCl;
n(HCl) = V r w/ M = 500*1,18*0,36/36,5 = 5,8 моль (избыток);
Определено количество вещества гидроксида калия, сделан вывод о его избытке и расcчитано количество вещества хлората:
n(KOH) = m(p-pa)w/M = 600*0,28/56 = 3 моль
KOH в избытке, т.к. по уравнению его требуется n(Cl2)*2 = 1 моль;
Определена масса полученного раствора и массовая доля KClO3;
m(p-pa) = m(p-paKOH) + m(Cl2) = 600 + 0,5*71 = 635,5 г
m(KClO3) = n*M = 0,167*122,5 = 20,5 г
w(KClO3) = m/m(p-pa) =20,5/635,5 = 0,032 = 3,2%
В примечаниях к критериям расчетных задач отмечается, что любая последовательность решения, приведшая к правильному ответу, оценивается максимальным баллом. Оценка снижается, когда: допущены ошибки в уравнении химической реакции или формуле (на 1 балл); имеются погрешности в расчетах (на 1 балл). При неверном ответе оцениваются лишь правильно выполненные элементы решения.
Следует отметить, что число баллов, указанное в критериях, определено исходя из удобства проверки задач. В итоговый результат оно входит с учетом коэффициента трудности, который различен для разных задач. В ходе проверки эксперты использовали и доли балла, которые затем суммировались и округлялись.
Г.М. Можаев
старший преподаватель
ТюмГУ, химический факультет;
ТОГИРРО
Хлор, можно сказать, уже постоянный спутник нашей повседневной жизни. Редко в каком доме не будет бытовых средств, основанных на обеззараживающем действии данного элемента. Но вместе с тем он очень опасен для человека! Хлор может проникнуть в организм через слизистую оболочку дыхательной системы, пищеварительных путей, кожные покровы. Отравиться им можно и дома, и на отдыхе - во многих бассейнах, аквапарках он является основным средством водоочистки. Влияние хлора на организм человека резко негативное, он может стать причиной серьезных дисфункций и даже смерти. Поэтому каждому нужно быть в курсе симптоматики отравления, методов оказания первой помощи.
Хлор - что это за вещество
Хлор - газообразный элемент желтоватого цвета. Обладает резким специфичным запахом - хлорки (хлорной извести). В газообразном виде, а также в химических формах, что подразумевают его активное состояние, опасен, токсичен для человека.
Хлор в 2,5 раз тяжелее воздуха, поэтому при утечке будет стелиться по оврагам, пространствам первых этажей, по полу помещения. При вдыхании его у пострадавшего может развиться одна из форм отравления. Об этом поговорим далее.
Симптомы отравления
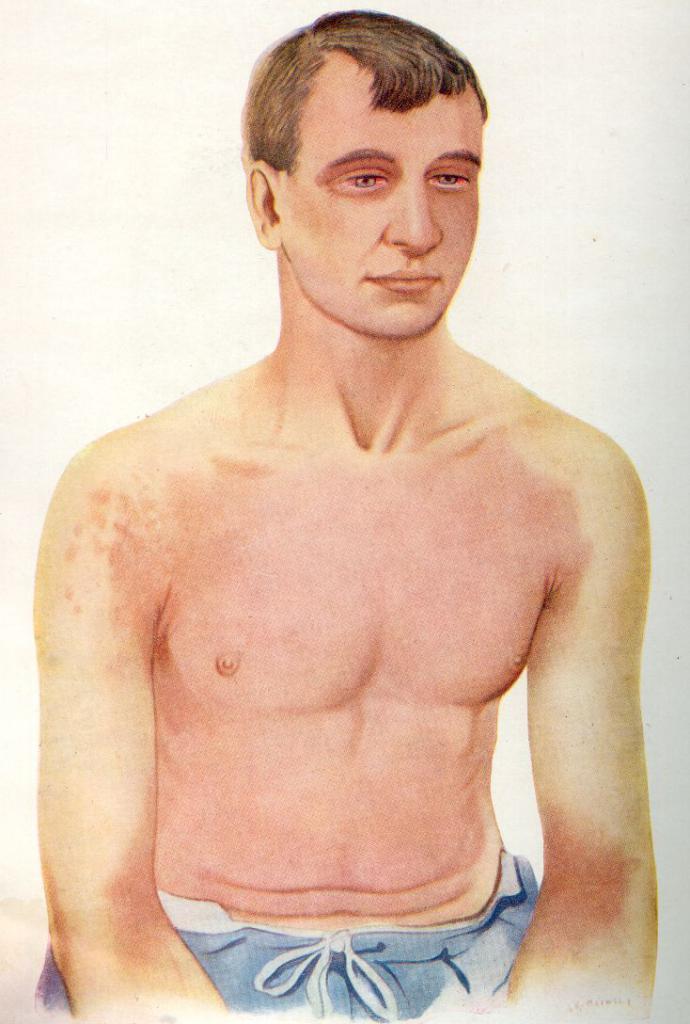
Как длительное вдыхание паров, так и иное воздействие вещества очень опасно. Так как оно активно, то влияние хлора на организм человека проявляется быстро. Токсичный элемент в большей степени поражает глаза, слизистые и кожные покровы.
Отравление может быть как острым, так и хроническим. Однако в любом случае при несвоевременном оказании помощи грозит летальный исход!
Симптоматика при отравлении парами хлора может быть разной - в зависимости от специфики случая, длительности воздействия и прочих факторов. Для удобства мы разграничили признаки в таблице.
| Степень отравления | Симптоматика |
| Легкая. Самая безопасная - проходит самостоятельно, в среднем, за три дня. | Раздражение, покраснение слизистых оболочек, кожных покровов. |
| Средняя. Требуется медицинская помощь и комплексное лечение! | Нарушение сердечного ритма, удушье, боли в области грудной клетки, нехватка воздуха, обильное слезотечение, сухой кашель, чувство жжения на слизистых оболочках. Самый опасный симптом-последствие - отек легких. |
| Тяжелая. Нужны реанимационные меры - летальный исход может наступить через 5-30 минут! | Головокружение, жажда, судороги, потеря сознания. |
| Молниеносная. К сожалению, в большинстве случаев помощь бывает бесполезна - смерть наступает практически мгновенно | Судороги, вздутие вен на лице и на шее, нарушение дыхания, остановка биения сердца. |
| Хроническая. Следствие частой работы с веществом, которое содержит хлор. | Кашель, судороги, хронические заболевания дыхательной системы, частые головные боли, депрессия, апатия, нередки случаи потери сознания. |
Таково влияние хлора на организм человека. Поговорим о том, где можно отравиться его ядовитыми парами и как оказать первую помощь в этом случае.
Отравление на работе
Газ хлор применяют во многих отраслях промышленности. Вы вполне можете получить хроническую форму отравления, если работаете на следующих производствах:
- Химическая промышленность.
- Текстильная фабрика.
- Фармацевтическая индустрия.
Отравление на отдыхе

Хотя многие и знают о влиянии хлора на организм человека (разумеется, в больших объемах), не во всех саунах, бассейнах, развлекательных водных комплексах строго следят за использованием такого бюджетного обеззараживающего средства. А ведь его дозировку очень легко случайно превысить. Отсюда хлорное отравление посетителей, которое случается в наше время достаточно часто.
Как заметить, что в ваш визит доза элемента в воде бассейна превышена? Очень просто - вы почувствуете сильный специфический запах вещества.
- кашель;
- рвота;
- тошнота;
- в редких случаях возникает воспаление легких.
Отравление дома

- Отбеливатели.
- Препараты, предназначенные для борьбы с плесенью.
- Таблетки, моющие жидкости, в составе которых есть данный элемент.
- Порошки, растворы для общей дезинфекции помещения.
Последствия воздействия хлора на организм

Постоянное воздействие даже малых доз хлора (агрегатное состояние может быть любым) на человеческий организм грозит для людей следующим:
- Фарингит.
- Ларингит.
- Бронхит (в острой либо хронической форме).
- Различные заболевания кожных покровов.
- Гайморит.
- Пневмосклероз.
- Трахеит.
- Ухудшение зрения.
Если вы заметили у себя один из недугов, перечисленных выше, при условии, что постоянно или однократно (случаи посещения бассейна сюда тоже относится) подвергались влиянию паров хлора, то это повод для скорейшего обращения к специалисту! Доктор назначит комплексную диагностику для изучения природы заболевания. Изучив ее результаты, затем он назначит лечение.
Первая помощь при отравлении

Хлор – газ, вдыхать который очень опасно, особенно в больших объемах! При средней, тяжелой форме отравления пострадавшему нужно немедленно оказать первую помощь:
- В каком бы ни был состоянии человек, не паникуйте. Вам следует первым делом взять себя в руки, а затем успокоить и его.
- Выведите пострадавшего на свежий воздух или же в проветриваемое помещение, где нет хлорных паров.
- Как можно быстрее вызовите скорую помощь.
- Позаботьтесь, чтобы человек был в тепле и комфорте - накройте его пледом, одеялом или простыней.
- Проследите, чтобы он легко и свободно дышал - снимите тесную одежду, украшения с шеи.
Медикаментозная помощь при отравлении
До приезда бригады скорой медпомощи можно самостоятельно помочь потерпевшему, используя ряд бытовых и медикаментозных препаратов:
Профилактика

Зная, насколько опасен хлор, какое вещество оказывает действие на организм человека, лучше всего заранее позаботиться о снижении или исключении его негативного влияния на свой организм. Добиться этого можно следующими способами:
- Соблюдение санитарных норм на рабочем месте.
- Регулярное прохождение медицинских осмотров.
- Использование средств защиты при работе с хлорсодержащими препаратами дома или на работе - тот же респиратор, плотные защитные резиновые перчатки.
- Соблюдение предписаний техники безопасности при работе с веществом в промышленной среде.
Работа с хлором всегда требует осторожности как в промышленных масштабах, так и в бытовых. Вы знаете, как диагностировать у себя признаки отравления веществом. Помощь же пострадавшему нужно оказывать незамедлительно!
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).

Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.

Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Хлор в организме человека:
- регулирует водный и кислотно-щелочной баланс,
- выводит жидкость и соли из организма в процессе осморегуляции,
- стимулирует нормальное пищеварение,
- нормализует состояние эритроцитов,
- очищает печень от жира.

Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Читайте также:

