Взаимодействие оксида серы 4 с хлором
Составьте химическое уравнение по схеме SO2 + Cl2 = ? Какие продукты образуются в результате реакции? Охарактеризуйте соединение оксид серы (IV): укажите его основные физические и химические свойства, а также способы получения.
В результате взаимодействия двух газов – диоксида серы и хлора (SO2 + Cl2 = ?) происходит образование хлорангидрида серной кислоты — сульфурилхлорида (соединение). Данную реакцию стоит проводить на свету в присутствии катализатора – камфоры. Молекулярное уравнение реакции имеет вид:
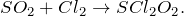
Сернистый газ (оксид серы (IV), диоксид серы) в обычных условиях представляет собой бесцветный газ с характерным резким запахом (температура плавления равна (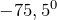
), кипения – (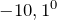
). Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов 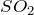
на один объем воды). Водный раствор диоксида серы (H2SO3 -> SO2) называется сернистой кислотой:
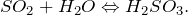
Сернистый газ химически активен; в растворе медленно окисляется. Типичный восстановитель, слабый окислитель. В жидком состоянии — неводный растворитель для азота, хлоридов металлов, галогенидов фосфора.
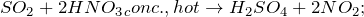
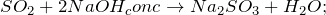
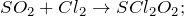
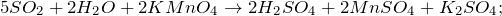
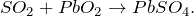
В промышленности оксид серы (IV) получают обжигом сульфида железа:
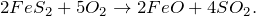
В лабораторных условиях этот газ получается при действии сильных кислот на сульфиты или гидросульфиты, а также при растворении меди в концентрированной серной кислоте.
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота
Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы водорода Н + , а в концентрированной – сульфат-ионы SO4 2+ . Ионы SO4 2+ являются более сильными окислителями, чем ионы Н + (см.схему).
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Реакция серной кислоты с цинком
Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

Реакция серной кислоты с сахаром
В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
- Получение SO2 путем обжига пирита:
- Окисление SO2 в SO3 в присутствии катализатора – оксида ванадия (V):
- Растворение SO3 в серной кислоте:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Железный купорос
Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса

Большинство школьников знают два оксида серы - SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы - SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2 , то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио - спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла - Боппа (или "Большая комета 1997 года");
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы - SO2

- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на п ланете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина - служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газа является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид - SO3

- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
-
2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен - теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы - SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 - озон.

Монооксид дисеры, субоксид серы - S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы - сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
Сера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

- FeS2 - пирит, колчедан
- ZnS - цинковая обманка
- PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск
- HgS - киноварь
- CuFeS2 - халькопирит
- Cu2S - халькозин
- CuS - ковеллин
- BaSO4 - барит, тяжелый шпат
- CaSO4 - гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
-
Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ - SO2. Реагирует со многими неметаллами, без нагревания - только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
Реакции с кислотами
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Реакции с щелочами
Сера вступает в реакции диспропорционирования с щелочами.

Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород - сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Сернистый газ - SO2 - при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты - сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли - сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота - основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия - Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты - сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли - сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке - кислая соль)

SO3 - сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Элементы VIa группы по-другому называются халькогены.
Количество валентных электронов у элементов VIa группы (в основном состоянии) - два.
Сероводород – H2S
Соединения серы -2, +4, +6. Качественные реакции на сульфиды, сульфиты, сульфаты.
Получение при взаимодействии:
1. водорода с серой при t – 300 0
2. при действии на сульфиды минеральных кислот:
газ без цвета, с запахом тухлых яиц, ядовит, тяжелее воздуха, растворяясь в воде, образует слабую сероводородную кислоту.
Кислотно-основные свойства
1. Раствор сероводорода в воде – сероводородная кислота – является слабой двухосновной кислотой, поэтому диссоциациирует ступенчато:
2.Сероводородная кислота имеет общие свойства кислот, реагирует с металлами, основными оксидами, основаниями, солями:
Все кислые соли – гидросульфиды – хорошо растворимы в воде. Нормальные соли- сульфиды - растворяются в воде по–разному: хорошо растворимыми являются сульфиды щелочных и щелочноземельных металлов, сульфиды остальных металлов в воде нерастворимы, а сульфиды меди, свинца, ртути и некоторых других тяжелых металлов не растворяются даже в кислотах (кроме азотной кислоты)
Растворимые сульфиды подвергаются гидролизу – по аниону.
Качественной реакцией на сероводородную кислоту и её растворимые соли (т.е. на сульфид-ион S 2- ) является взаимодействие их с растворимыми солями свинца, при этом образуется осадок PbS черного цвета
Окислительно-восстановительные свойства
Проявляет только восстановительные свойства, т.к. атом серы имеет низшую степень окисления -2
а) с недостатком
б) с избытком кислорода
2. с галогенами (обесцвечивание бромной воды)
б) с сильными окислителями (KMnO4, K2CrO4 в кислой среде)
в) сероводородная кислота окисляется не только сильными окислителями, но и более слабыми, например, солями железа (III), сернистой кислотой и т.д.
1. горение серы в кислороде.
2. горение сероводорода в избытке О2
3. окисление сульфидов
4. взаимодействие сульфитов с кислотами
5. взаимодействие металлов ряду активности после (Н2) с конц. H2SO4
Газ, без цвета, с удушливым запахом жженой серы, ядовит, тяжелее воздуха более, чем в 2 раза, хорошо растворим в воде (при комнатной температуре в одном объеме растворяется около 40 объемов газа).
Кислотно-основные свойства
SO2 – типичный кислотный оксид.
1.со щелочами, образуя два типа солей: сульфиты и гидросульфиты
2.с основными оксидами
3. с водой образуется слабая сернистая кислота
Сернистая кислота существует только в растворе, является слабой кислотой,
обладает всеми общими свойствами кислот.
4. качественная реакция на сульфит – ион – SO3 2 – действие минеральных кислот
Окислительно-восстановительные свойства
В ОВР может быть как окислителем, так и восстановителем, потому что атом серы в SO2 имеет промежуточную степень окисления +4.
Оксид серы (VI) SO3 (серный ангидрид)
Окисление сернистого газа
Бесцветная жидкость, при температуре ниже 17 0 С превращается в белую кристаллическую массу. Термически неустойчивое соединение, полностью разлагается при 700 0 С. Хорошо растворим в воде, в безводной серной кислоте и реагирует с ней с образованием олеума
Кислотно-основные свойства
Типичный кислотный оксид.
1.со щелочами, образуя два типа солей: сульфаты и гидросульфаты
2.с основными оксидами
Окислительно-восстановительные свойства
Оксид серы (VI) – сильный окислитель, обычно восстанавливается до SO2
Серная кислота H2SO4
Получение серной кислоты
В промышленности кислоту получают контактным способом:
3. растворение SO3 в серной кислоте
H2SO4 - тяжелая маслянистая жидкость, без запаха и цвета, гигроскопична. Смешивается с водой в любых отношениях, при растворении концентрированной серной кислоты в воде выделяется большое количество теплоты, поэтому её надо осторожно приливать в воду, а не наоборот (сначала вода, потом кислота, иначе случится большая беда)
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% - концентрированной.
Кислотно-основные
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. В водном растворе диссоциирует:
1. с основными оксидами
2. с основаниями
Ba 2+ + SO4 2- = BaSO4↓ (белый осадок)
Качественная реакция на сульфат-ион SO4 2-
Благодаря более высокой температуры кипения, по сравнению с другими кислотами серная кислота при нагревании вытесняет их из солей:
Окислительно-восстановительные свойства
В разбавленной H2SO4 окислителями являются ионы Н + , а в концентрированной – сульфат –ионы SO4 2
В разбавленной серной кислоте растворяются металлы, находящиеся в ряду активности до водорода, при этом образуются сульфаты и выделяется водород
Концентрированная серная кислота – энергичный окислитель особенно при нагревании. Она окисляет многие металлы, неметаллы, неорганические и органические вещества.
H2SO4 (к) окислитель S +6
| Активные | Средней активности | малоактивные | |
| реагирует | реагирует пассивирует Al, Fe, Cr из-за пленки оксидов | реагирует Cu, Hg | не реагирует Ag,Au,Pt |
| Кислота восстанавливается в основном до следующих продуктов | |||
| H2S | Н2S S | SO2 | - |
С более активными металлами серная кислота в зависимости от концентрации может восстанавливаться до разнообразных продуктов
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод, фосфор и др.), восстанавливаясь до оксида серы (IV)
Взаимодействие с некоторыми сложными веществами
Соли серной кислоты
2 типа солей: сульфаты и гидросульфаты
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию. Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при нагревании свыше 1000 0 С, соли менее активных металлов (Al, Fe, Cu) разлагаются даже при небольшом нагревании
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:

