Взаимодействие метана с хлором является экзотермической
Классификация химических реакций в органической и органической химии
относится к реакции
2. Окислительно-восстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой
3) сероводорода с бромной водой
4) серы с алюминием
3. Реакцией замещения является
4. Реакцией замещения является взаимодействие
1) цинка с соляной кислотой
3) этилена с бромной водой
4) серной кислотой с гидроксидом алюминия
5. Взаимодействие гидроксида натрия с серной кислотой является
1) экзотермической реакцией замещения
2) эндотермической реакцией обмена
3) эндотермической реакцией замещения
4) экзотермической реакцией обмена
6. Реакцией соединения, идущей без изменения степени окисления, является
1) горения угарного газа
2) взаимодействие углекислого газа с оксидом кальция
3) взаимодействие оксида меди с соляной кислотой
4) реакция азотной кислоты с бензолом
7. Реакция, схемы которых
3) замещения и присоединения, соответственно
4) присоединения и замещения, соответственно
8. Взаимодействие ацетилена с водой является
1) каталитической реакцией замещения
2) некаталитической реакцией присоединения
3) каталитической реакцией присоединения
4) некаталитической реакцией замещения
9. Как в реакции замещения, так и в реакции присоединения с углеводородами вступает
10. Окислительно-восстановительной реакцией является разложение
1) нитрата цинка
2) карбоната аммония
4) гидрокарбоната натрия
11. Реакцией замещения является взаимодействие
1) этилена с бромной водой
3) цинка с соляной кислотой
4) серной кислотой с гидроксидом алюминия
12. Эндометрической реакцией является
1) разложение гидроксида меди(II)
2) нейтрализация соляной кислоты гидроксидом натрия
3) взаимодействие водорода с кислородом
4) взаимодействие цинка с соляной кислотой
13. Каталитической является реакция
1) хлорирования метана
2) синтез аммиака
3) соляной кислоты с карбонатом натрия
4) бромирования анилина
14. Необратима реакция
1) разложения гидроксида алюминия
2) гидрирования этилена
3) дегидратации пропанола
4) соединения сернистого газа с кислородом
15. Окислительно-восстановительной реакцией является разложение
2) карбоната аммония
3) нитрата цинка
4) гидрокарбоната натрия
16. К реакциям гидролиза не относится реакция
17. Реакцией обмена является взаимодействие
1) оксида кальция с азотной кислотой
2) угарного газа с кислородом
3) этилена с водородом
4) соляной кислоты с магнием
18.Окислительно-восстановительной реакцией соединения является взаимодействие
1) цинка с соляной кислотой
3) сероводорода с бромной водой
4) серы с алюминием
19. Экзотермической реакцией является
1) дегидрирование этана
2) разложение перманганата клия
3) нейтрализация серной кислоты гидроксидом калия
4) электролиз воды
20. Обратимой является реакция
21. Реакция, уравнение которой
относится к реакциям
22. Реакцией нейтрализации является
23. Взаимодействие кислоты с основанием называется реакцией
24. Взаимодействие цинка с соляной кислотой относится к реакции
25. Взаимодействие карбоната натрия с гидроксидом кальция относится к реакции
26. Реакция, уравнение которой
относится к реакциям
1) обратимой, экзотемической
2) необратимой, экзотермической
3) обратимой, эндотермической
4) необратимой, эндотермической
27. Взаимодействие натрия с водой относится к реакциям
28. Реакциями замещения и присоединения соответственно являются
2) CH3COONa + HCl ? и C6H6 + Br2 к а т. ?
29. Взаимодействие метана с хлором является реакцией
1) соединения и экзотермической
2) замещения и эндотермической
3) соединения и эндотермической
4) замещения и экзотермической
30. К необратимым реакциям относится взаимодействие между
Ответы: 1-1, 2-1, 3-1, 4-1, 5-4, 6-2, 7-3, 8-3, 9-2, 10-1, 11-3, 12-1, 13-2, 14-1, 15-3, 16-2, 17-1, 18-4, 19-3, 20-3, 21-1, 22-2, 23-3, 24-4, 25-1, 26-1, 27-2, 28-1, 29-4, 30-1.
Одной из характерных особенностей насыщенных углеводородов является их способность активно вступать в реакцию с таким химическим элементом как хлор. Молекулярный хлор обладает невысокой способностью вступать в реакцию с алканами, поэтому они хлорируются катионами или атомами хлора, обладающими большей активностью. Для осуществления процесса распада хлорной молекулы на атомы необходимо затратить энергию, составляющую 242,8 кДж/моль. Подобная диссоциация может быть легко проведена при обычных температурных условиях под воздействием ультрафиолетового света. В ходе процесса молекула хлора, поглощая ультрафиолет, получает энергию в 293,0 кДж/моль. Реализация термической диссоциации хлорной молекулы на атомы должна происходить в условиях достаточно высоких температур - около 300ºC. Затраты энергии на диссоциацию молекулы для получения ионов хлора составляют порядка 1130,2 кДж/моль. Анализируя энергетические показатели разнообразных вариантов хлорирования можно сделать вывод о том, что наиболее предпочтительным способом хлорирования насыщенных углеводородов является процесс, проводимый на свету.
Процесс хлорирования алканов по сравнению с фторированием представляет собой процесс менее экзотермический, сопровождаемый выделением теплоты в количестве 108,8 кДж/моль. Осуществление хлорирования алканов фотохимическим способом проходит с применением рассеянного света, по причине того, что воздействие прямого света при проведении реакции приводит к взрыву. В ходе реакции хлорирования происходит постепенное замещение в алканах атомами хлора атомов водорода. Для реакций данного вида характерно образование в их результате хлорпроизводных насыщенных углеводородов.
Таким образом, нагревая до 200ºC смесь метана и хлора или подвергая её воздействию ультрафиолетового света, обладающего длиной волны подходящей величины, запускается реакция, сопровождаемая достаточно сильным выделением теплоты:
Для расчёта теплового эффекта, получаемого в ходе хлорирования метана, находящегося в газовой фазе, на первой стадии до состояния CH3Cl и HCl применяется закон Гесса.
Величина суммарного теплового эффекта ∆Hº равна 25 ккал/моль. Рассматриваемые показатели позволяют сделать вывод о полной вероятности проведения процесса хлорирования метана, причём сопровождающий реакцию тепловой эффект никак не связан со скоростью её протекания, определяемой количеством свободной энергии активации.
Радикальный механизм хлорирования метана
Осуществление реакции хлорирования метана, сопровождаемой нагревом и облучением, а также участием в ней инициаторов, способствующих образованию радикалов, реализует механизм радикально-цепного типа SR (Семенов), состоящий из следующих трёх базовых стадий:
инициирования цепи, или её зарождения
рекомбинация или обрыв цепи
Под воздействием света (hv) или под воздействием температуры молекула хлора Cl2 обретает избыточную энергию и переходит в возбуждённое состояние, которое заканчивается её распадом на два атома, являющиеся по своей природе радикалами. Взаимодействие или столкновение атома-радикала хлора с другими молекулами метана CH4 приводит к отщеплению от них водородных атомов, при котором образуется метильный радикал ●CH3. В свою очередь он отщепляет от следующей молекулы атом хлора Cl2 и т.д. Образование одного радикала, таким образом, инициирует многократное повторение стадии, при которой растёт цепь. Для протекающей реакции длина кинетической цепи определяется в соответствии с количеством подобных повторений. Для процесса хлорирования число повторений может достигать 10 и более тысяч.
Энергетическая диаграмма взаимодействия метановой молекулы и атома хлора изображена на рисунке.
Закономерности радикального хлорирования метана
Согласно общетеоретическим положениям, взаимодействие атомов хлора и молекулы метана будет происходить исключительно в случае равенства их свободной энергии величине энергии активации (или энергетического барьера), составляющего 16,7 кДж/моль. Сама по себе свободная энергия, как правило, немного больше простой разницы между энергией разрыва существующей в молекуле связи C–H (+425 кДж/моль), и образования связи нового вида H-Cl (-431 кДж/моль), которая составляет -6 кДж/моль. По этой причине взаимодействие реагирующих частиц запускается не каждым столкновением между ними, а только обладающими достаточной энергией для преодоления барьера.
Возникновение дополнительной активационной энергии связано с нагревом либо облучением молекул. В возбуждённом состоянии молекулы движутся с достаточно высокой скоростью, что позволяет при столкновении превратить их кинетическую энергию в энергию потенциальную. В переходном состоянии ПС1, соответствующем первой вершине кривой энергетической диаграммы, практически одновременно происходят разрыв старых связей C-H и образование связей нового вида H-Cl в активированном комплексе, который сформировался. Метильный радикал, образуемый в ходе реакции, обладает достаточной потенциальной энергией и впоследствии взаимодействует с молекулой хлора Cl2 сравнительно легко. Энергия, необходимая для активации данной стадии относительно не высока и составляет всего 2 кДж/моль. Окончательное образование соединения CH3Cl осуществляется в находящемся в переходном состоянии ПС2 активированном комплексе, сформировавшемся повторно.
Процесс хлорирования алканов и метана в частности, протекающий при температурах такой величины, представляет собой процесс, плохо поддающийся управлению. Обычно он не прекращается на стадии формирования соединения хлористого метила CH3Cl и способен протекать далее с получением промежуточных соединений – хлористого метилена, хлороформа и тетрахлорометана.
Ионный механизм хлорирования метана
Реакция хлорирования, осуществляемая в кислой среде в присутствии способствующих её протеканию по ионному механизму катализаторов (ими обычно являются кислоты Льюиса SbF5, AlCl3), обладает электрофильным характером (Se). Сущность процесса реагирования молекулы хлора с электроноакцепторного хлорида алюминия, в химическом плане, состоит в значительной поляризации связи C-C, являющейся до этого неполярной, приводящей к образованию электрофильного агента после её диссоциации. При отсутствии катализаторов хлорирование, происходящее по ионному механизму, практически не может осуществляться, по причине того, что для гетеролитического расщепления на анион и катион молекулы хлора необходима значительная энергия – порядка 1130 кДж/моль.
Цепной ионный электрофильный механизм (Se), по которому осуществляется хлорирование в присутствии катализаторов насыщенных углеводородов, изображен на рисунке:
Под воздействием катализатора происходит гетеролитический распад молекулы хлора, сопровождаясь возникновением ионной комплексной пары [AlCl4] – Cl +, из-за того, что алюминий соединён с атомами хлора, имеющими отрицательный электрический заряд, и нуждается в электронах. По этой причине алюминием от атома хлора Cl2 отщепляется пара электронов, сопровождаясь одновременным образованием катиона хлора, взаимодействующего впоследствии с молекулой метана гетеролитично разрывая связь C-H. Результатом данного процесса является образование метильного карбкатиона, который затем реагирует с хлорной молекулой, образуя, в конце концов, хлористый метил и катион хлора, взаимодействующий впоследствии со следующей молекулой. Ионные реакции, у которых промежуточными частицами являются ионы с положительным зарядом, имеют название реакций электрофильных.
По причине того, что для диссоциации хлорных молекул на ионы необходима значительная энергия, хлорирование углеводородов в насыщенном состоянии в присутствии катализаторов должно сопровождаться нагревом реакционной смеси.
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^\circ \ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
- Курсовая работа Хлорирование метана 420 руб.
- Реферат Хлорирование метана 270 руб.
- Контрольная работа Хлорирование метана 190 руб.
Итак, если смесь метана с хлором нагреть до $200^\circ \ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
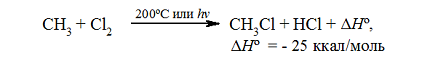
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
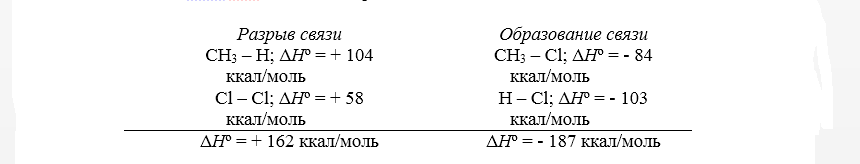
Рисунок 2. Хлорирование метана
Суммарный тепловой эффект $\Delta \underline
Задай вопрос специалистам и получи
ответ уже через 15 минут!
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
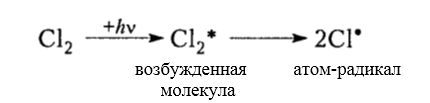
Рисунок 3. Хлорирование метана
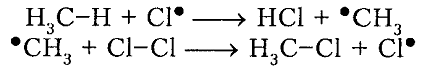
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
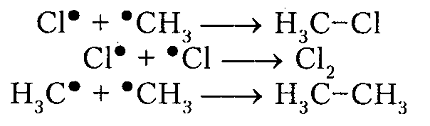
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h \nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 \ 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
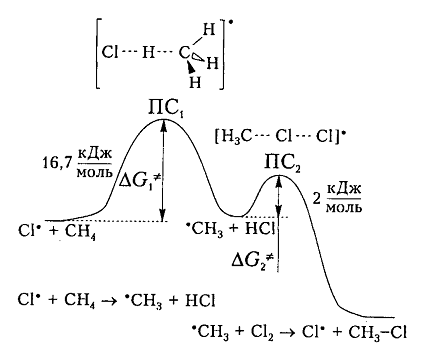
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи - связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой $<\rm H>-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах - плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
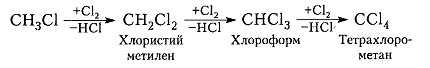
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов ( кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
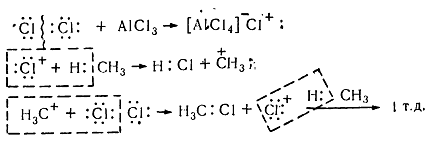
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Так и не нашли ответ
на свой вопрос?
Просто напиши с чем тебе
нужна помощь
Взаимодействие - метан
При взаимодействии метана и хлора для разрыва двух связей необходимо 102 и 58 ккал / моль, итого в сумме 160 икал / моль. [16]
При взаимодействии метана с SiCl4 при 500 С образуется метилтрихлор-силан ( выход 12 2 %), а при взаимодействии бензола с SiCl4 при температуре красного каления получается некоторое количество фенилтрихлорси-лана. [17]
При взаимодействии метана с атомным кислородом продуктами реакции являются формальдегид, метанол, оксиды углерода. [18]
При взаимодействии метана с парами воды при температуре от 800 до 900 С над никелевым катализатором ( водяной реформинг; процесс, обратный образованию метана из оксида углерода и водорода), или при реакции метана со смесью водяных паров с кислородом при 1000 - 1200 С ( в присутствии никелевого катализатора), или при 1400 - 1000 С ( без катализатора) получают синтез-газ. [19]
При взаимодействии метана , аммиака и воздуха получается цианисто-водородная кислота. [20]
При взаимодействии метана с хлором протекают четыре заместительные, экзотермические, последовательно-параллельные реакции образования четырех хлорпроизводных метана ( хлористого метила, метиленхлорида, хлороформа, и четыреххлористого углерода) и попутного хлористого в. Целевыми продуктами являются два средних хлор-метана, хлористый водород выделяют в виде товарной соляной кислоты, хлористый метил возвращают на вход реактора в качестве рецикла, а четыреххлористый углерод и более тяжелые полихлорида являются побочными продуктами. [21]
При взаимодействии метана и хлора для разрыва двух связей необходимо 102 и 58 ккал / моль, итого 160 ккал / моль. [22]
При взаимодействии метана с атомным кислородом продуктами реакции являются формальдегид, метиловый спирт, окись углерода и углекислый газ. [23]
При взаимодействии метана с атомным кислородом продуктами реакции являются формальдегид, метанол, оксиды углерода. [24]
При взаимодействии галоидированных метанов с га-лоидэтиленами в присутствии А1С13 получены хлорфтор-пропаны; некоторые из них ранее не были известны. [25]
Скорость реакции взаимодействия метана с водяным паром в отсутствие катализатора очень мала. [26]
Получение водорода взаимодействием метана с водяным паром, двуокисью углерода или с их смесями представляет собой эндотермический процесс. Подвод тепла может осуществляться различными приемами: внешним обогревом аппарата, добавлением кислорода к газовой смеси, содержащей метан ( который при этом частично сгорает), чередованием стадий взаимодействия метана с водяным паром или двуокисью углерода и сжигания метана ( ср. [27]
Получение карбидов взаимодействием метана с хлоридами проводится так же, как и взаимодействие метана с окислами. [28]
Образуется при взаимодействии метана с водяным паром. [29]
Очевидно, что взаимодействие метана с кислородом по реакции ( VII-23) менее выгодно, чем по реакции ( YII-3), так как при этом увеличивается расход кислорода и уменьшается выход На - ( - СО на единицу прореагировавшего метана. Перерасход кислорода в процессе высокотемпературной конверсии метана по сравнению с каталитической конверсией при 900 - 1000 С частично компенсируется высоким температурным потенциалом продуктов реакции, выходящих из конвертора. Путем впрыскивания конденсата в горячий газ на выходе его из конвертора может быть получена парогазовая смесь с отношением пара к газу, достаточным для последующей конверсии СО. [30]
Химия | 10 - 11 классы
Взаимодействие метана с хлором является реакцией 1)соединения, экзотермической 2)соединения, эндотермической 3)замещения, экзотермической 4)замещения, эндотермической.

Взаимодействие метана с хлором является реакцией замещения (экзотермическая реакция).
В CH4 + Cl2 водород замещается на один атом Cl и получается :
CH4 + Cl2→ (свет / высокая температура)CH3 - Cl + HCl.

Дайте характеристику реакции С(т) + O2(г) = CO2(г) + Q А реакция соединения , разложения , обмена , Замещения Б ОВР , не ОВР В обратимая , не обрат Г гомогенная , гетерогенная Д экзотермическая ?
Дайте характеристику реакции С(т) + O2(г) = CO2(г) + Q А реакция соединения , разложения , обмена , Замещения Б ОВР , не ОВР В обратимая , не обрат Г гомогенная , гетерогенная Д экзотермическая .
Эндотермическая Е каталитическая не каталитическая.

Как отличить эндотермические реакции от экзотермических реакций?
Как отличить эндотермические реакции от экзотермических реакций.

Реакции идущие с поглощением тепла : а)эндотермические б)экзотермические?
Реакции идущие с поглощением тепла : а)эндотермические б)экзотермические?

В 2. Химическая реакция, уравнение которой2СО + О2 = 2СО2 + Q является реакцией1)обмена 3) эндотермической 5) замещения2)экзотермической 4) соединения?
В 2. Химическая реакция, уравнение которой
2СО + О2 = 2СО2 + Q является реакцией
обмена 3) эндотермической 5) замещения
экзотермической 4) соединения.

Помогите?
Взаимодействие кальция и соляной кислоты относится к реакциям а) соединения, экзотермической б)замещение, экзотермической в)обмена, экзотермической г) замещения, эндотермической?

Что относится к реакциям соединения?
Что относится к реакциям соединения?
К реакциям замещения?
К реакциям с изменением степени окисления?
К экзотермическим реакциям?

Четыре уравнения по соединению, разложению, обмену и замене По тепловому эффекту : экзотермические и эндотермические?
Четыре уравнения по соединению, разложению, обмену и замене По тепловому эффекту : экзотермические и эндотермические.

Приведите примеры экзотермических и эндотермических реакцией?
Приведите примеры экзотермических и эндотермических реакцией.

1 номер) уравнение NH4CL = NH3 + HCL + Q соответствует реакции 1) соединение, эндотермической 2) разложение , экзотермической 3) соединение, экзотермической 4) разложение, эндотермической?
1 номер) уравнение NH4CL = NH3 + HCL + Q соответствует реакции 1) соединение, эндотермической 2) разложение , экзотермической 3) соединение, экзотермической 4) разложение, эндотермической.

Можно ли на глаз определить "реакция экзотермическая или эндотермическая"?
Можно ли на глаз определить "реакция экзотермическая или эндотермическая"?
На странице вопроса Взаимодействие метана с хлором является реакцией 1)соединения, экзотермической 2)соединения, эндотермической 3)замещения, экзотермической 4)замещения, эндотермической? из категории Химия вы найдете ответ для уровня учащихся 10 - 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.

3 л х C3H8 + 5O2 = 3CO2 + 4H2O 1 моль 5 моль По уравнению реакции кислорода расходуется в 5 раз больше, чем вступает в реакцию пропана. Отсюда V(O2) = 5 * V(C3H8) V(O2) = 5 * 3 = 15 л.

Решение в приложенном файле, ацетилен (в - во Х).

Конечно у каждой медали 2 стороны И в химии плюсы и минусы. Например : Огромный плюс в том, что благодаря химии у нас есть лекарства, различные лаки (для волос, ногтей) , виды топлива, краски, строительные материалы Минусы : химические заводы на кот..

Q = 24. 305 * 4. 2 * 100 / 20 * 0. 833 Q = 612. 7 = 613кДж / моль.

Найди общую массу : 60 + 60 = 120г теперь найди массовую долю сахара : 60 / 120 = 1 / 2 или 0, 5.

Be + 2KOH + 2H2O = K2(Be(OH)4) + H2 Be - 2e = Be2 + 2 1 востановитель 2H + + 2e = H2 2 1 окислитель.

Формула кислоты - Формула ангидрида (кислотного оксида) H2SO4 - SO3 H2SO3 - SO2 H2CO3 - CO2 H2SIO3 - SiO2 HMnO4 - Mn2O7 H3BO3 - B2O3.

FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl около гидроксида железа поставьте стрелочку вниз, он нерастворим и выпадает в осадок.

При определённых условиях алкены взаимодействуют с : Водородом (катализатор - платина или никель, температура = 150 градусов). Водой ( катализатор - серная кислота или ортофосфорная. Нагревание) Кислородом (Нагревание). Со всеми остальными веществ..

2Ag + H2SO4 = Ag2SO4 + H2 Ag(0) - 1e = Ag( + 1) восстановитель h( + 1) + 2e = H2(0) окислитель.
Читайте также:

