Время до прогрессирования опухоли
В арсенале противоопухолевых средств появился новый класс препаратов – ингибиторов PARP (поли(аденозиндтфосфат [ADP]-рибозы) полимераза). Этот фермент играет важнейшую роль в репарации однонитиевых разрывов ДНК. В случае отсутствия функции фермента PARP в результате ингибирования его функции все однонитиевые разрывы ДНК превращаются в двухнитиевые, которые наиболее трудны для восстановления. Наиболее эффективным методом восстановления структуры ДНК при разрыве двух нитей является метод гомологичной репарации.
Ключевую роль в инициации гомологичной рекомбинации играют белки BRCA 1 и 2. В случае нарушения функции белка BRCA (например, в результате мутации его гена) механизм гомологичной репарации заблокирован, клетка не может восстановить структуру ДНК, в которой накапливаются двухнитиевые разрывы, что в конечном случае должно приводить к остановке клеточного деления и включению апоптоза. Известно, что у 15-20% больных серозным раком яичников имеется герминальная (наследственная) мутация гена BRCA, в результате которой мутированный белок BRCA утрачивает способность запускать гомологичную репарацию. Еще у 5-15% больных имеется соматическая (определяемая только в опухолевых клетках) мутация гена BRCA. Однако нарушения гомологичной репарации за счет других механизмов – гораздо более часто встречаемый феномен (феномен BRCAness). Это может происходить за счет мутации генов, которые кодируют другие белки, участвующие в гомологичной репарации, или за счет гиперметилирования участков ДНК, контролирующих функцию гена BRCA.
Все это делает перспективным использование ингибиторов PARP у больных с отсутствием функции гомологичной репарации. Блокада PARP приводит к многочисленным двухнитиевым разрывам ДНК, которые клетка не может восстановить ввиду отсутствия механизма гомологичной репарации.
В это исследование включались больные серозным раком яичников с платиночувствительным рецидивом (6 месяцев и более от момента введения последней дозы платиновых производных до первых признаков прогрессирования), которым было проведено лечение рецидива комбинацией с включением платины с эффектом (регрессия опухоли или ее стабилизация). Согласно протоколу в исследование включалась когорта больных с наличием герминальной мутации гена BRCA (кBRCA+), в другую когорту включались больные с отсутствием герминальной мутации гена BRCA (кBRCA-). В последней когорте проводили дополнительный тест на определение дефицита функции гомологичной репарации ДНК (феномен BRCAness). Кроме того, методом секвенирования определяли наличие соматической мутации BRCA в клетках опухоли. Больные в каждой когорте были рандомизированы в соотношении 2:1 в группу нирапариба в дозе 300 мг внутрь ежедневно или в группу плацебо до признаков прогрессирования или непереносимой токсичности. Оценку противоопухолевого эффекта проводили каждые 8 недель, прогрессирование заболевания оценивали по критериям RECIST, повышение только СА-125 без клинических и радиологических симптомов не расценивалось как прогрессирование. Основным критерием эффективности считали медиану времени до прогрессирования, которую оценивали от момента рандомизации (после окончания химиотерапии рецидива) до радиологических признаков прогрессирования. Вторичными критериями были токсичность, продолжительность периода без химиотерапии, общая продолжительность жизни.
Всего в исследование было включено 553 больных: 203 больных в кBRCA+ (из них 138 в группу нирапариба и 65 в группу плацебо) и 350 больных в кBRCA- (из них 234 в группу нирапариба и 116 в группу плацебо). Средний возраст больных в кBRCA+ был 57 лет и 63 года в кBRCA-, в основном это были больные III-IV стадий, с продолжительностью безплатинового интервала более 12 мес. у 60% больных, ранее 40% пациенток получили 3 и более линий химиотерапии.
При медиане наблюдения 17 мес. медиана времени до прогрессирования была достоверно дольше в группе нирапариба во всех когортах (табл. 1). В кBRCA+ медиана составила 21 мес. и 5,5 мес. в группе нирапариба и плацебо, что соответствует достоверному относительному снижению риска прогрессирования на 73%. В группе больных с отсутствием герминальной мутации также отмечен позитивный эффект нирапариба: у этих больных относительный риск прогрессирования уменьшен на 55%. У больных с наличием нарушений гомологичной репарации в опухолевых клеток риск прогрессирования снижен на 62%. В случае, если это нарушение произошло вследствие соматической мутации гена BRCA, медиана времени до прогрессирования составила 20,9 мес. и 11 мес. соответственно. То есть нирапариб демонстрировал одинаково высокую эффективность независимо от характера мутации в гене BRCA (герминальная или соматическая). При подгрупповом анализе во всех изученных группах было показано преимущество нирипариба перед плацебо.
Таблица 1. Медиана времени до прогрессирования в группе нирапариба и плацебо.
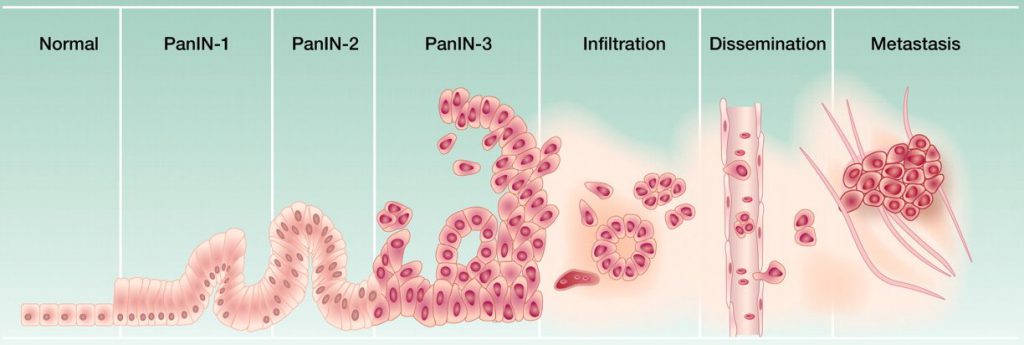
Раковые клетки в органах и тканях организма появляются у каждого человека, но не всегда и далеко не у всех возникает злокачественное новообразование. Прогрессия опухоли – это появление первичного очага рака с последующими качественными изменениями в структуре новообразования: многообразные и независимые друг от друга признаки болезни стремительно и быстро формируют злокачественный опухолевый рост у людей с ослабленной или отсутствующей противоопухолевой защитой.
Из небольшого скопления дефектных клеток возникает опухоль
Прогрессия опухоли
Любой вид рака развивается из одной клетки, дающей начало болезни, но в большинстве случаев противоопухолевая иммунная защита своевременно разрушает патологические клеточные структуры, не допуская формирования злокачественного новообразования. Прогрессия опухоли – это стадия формирования любой карциномы: с того момента, как иммунитет не удаляет первично возникшие дефектные клетки, начинаются качественные изменения, ведущие к болезни. Важнейший и обязательный признак рака – бесконтрольный опухолевый рост, являющийся основным фактором неумолимости и опасности злокачественного новообразования.
Основные признаки прогрессии рака
Когда противоопухолевая защита дает сбой, открывая ворота паразитирующему на организме человека раку, начинается болезнь, основными негативными признаками которой являются:
- Неконтролируемый рост;
- Генетические дефекты в клетках (хромосомные нарушения);
- Клеточная селекция (отбор и сохранение раковых клеток, способных противостоять любым внешним воздействиям);
- Иммунодепрессия (подавление иммунной защиты);
- Общее системное влияние на весь организм человека за счет использования питательных веществ и важных биологически активных факторов;
- Инвазивное распространение (инфильтративный рост);
- Деструкция тканей (распад опухолевых тканей);
- Пролиферация (разрастание опухолевой ткани);
- Рецидивирование (повторное возникновение рака после проведения радикального лечения);
- Метастазирование (захват новых территорий в организме за счет распространения раковых клеток по лимфатической или сосудистой системе).
Основная проблема для человеческого организма состоит в том, что все эти признаки независимы друг от друга (все опухолевые процессы могут происходить параллельно или последовательно, быстро или медленно, вне зависимости от величины и вида новообразования).
Все начинается с одной клетки
Прогрессия опухоли – это качественные и количественные изменения, необратимо и неумолимо нарушающие жизнедеятельность в органах и тканях. Опухоль-паразит оказывает отрицательное влияние на все системы жизнеобеспечения организма хозяина, но при этом может длительное время никак не проявлять себя симптомами заболевания. Применение лекарственных средств при химиотерапии может быть неэффективным за счет раковых клеток, не чувствительных к препаратам, и при этом разрастающаяся опухолевая ткань может частично разрушаться. Отдаленные метастазы порой появляются раньше, чем опухоль можно выявить стандартными методами диагностики, и при этом метастатические очаги могут быть более злокачественным вариантом новообразования, чем первичный очаг.
Противоопухолевая защита
Даже на фоне иммунодефицита и бесконтрольного роста рака организм человека продолжает бороться с болезнью. Прогрессия опухоли вовсе не означает, что уже ничего нельзя сделать: противоопухолевая защита уничтожает до 90-95% раковых клеток, тормозя рост и развитие новообразования. Но нарастающее негативное влияние рака на весь организм и постепенное ослабление иммунитета позволяют сохраняющимся 5-10% опухолевым клеткам обеспечивать медленное увеличение размеров первичного очага. Чем раньше будет выявлена онкология и быстрее будут начаты лечебные мероприятия, тем больше шансов на успех: вовремя начав помогать противоопухолевой системе борьбу с раком, можно затормозить течение болезни и создать условия для выздоровления.
В настоящее время основным методом лечения диссеминированных сkолидных новообразований остается химиотерапия. В 1970 г. Skipper Schabel Wilcox сформулировали гипотезу о дозозависимом эффекте цитостатиков, которая определила дальнейшую концепцию развития лекарственного лечения на несколько десятков лет.
Согласно этой теории, чем больше препаратов введено в организм и чем выше их доза, тем сильнее действие на опухоль. Целью является полная эрадикация злокачественных клеток. Для снижения токсичности подобного лечения цитостатики вводились с определенными интервалами (обычно 3%4 недели), чтобы позволить нормальным пролиферирующим клеткам организма (в основном, клеткам%предшественникам гемопоэза) восстановить свою популяцию. В клинической практике такой подход был успешным только при терапии лейкозов, миеломной болезни, некоторых типов лимфом и нейробластом. Для диссеминированных сkолидных новообразований он оказался не столь оптимистичным, так как заболевание остается инкурабельным, и его рецидивы неизбежно развиваются у всех пациентов.
Активно развивающаяся экспериментальная онкология и молекулярная генетика позволили определить некоторые причины низкой эффективности классического назначения химиопрепаратов:
Очевидно, что для улучшения результатов лечения необходим пересмотр существующей стратегии терапии. Лекарственное воздействие должно быть поливалентным, то есть направленным как на опухолевые клетки с учетом их молекулярно-генетических характеристик, так и на микроокружение. Кроме того, немаловажным остается контроль над иммунологическим взаимодействием новообразования и макроорганизма.
Что такое ангиогенез в опухоли и почему необходимо на него влиять?
Неоваскуляризация – это универсальный многоступенчатый процесс образования сосудов под действием определенных сигналов. Он включает несколько этапов:
Несмотря на универсальность этого процесса, популяция сосудов в опухоли гетерогенна. Фенотип эндотелиальных клеток и перицитов, набор цитокинов и ферментов отличаются от нормальных тканей и зависят от гистологического типа, характера (первичная или метастаз) и локализации опухоли.
Главный медиатор неоваскуляризации – сосудистый эндотелиальный фактор роста (VEGF), который продуцируется, в основном, перицитами, фибробластами, тромбоцитами и опухолевыми клетками. Это целое семейство молекул с проангиогенным механизмом действия. К ним относятся VEGFA (является основным), VEGFB, VEGFC, VEGFD, PIGF (плацентарный фактор роста).
Рецептором к VEGFA является VEGFR2, который в значительном количестве экспрессируется на эндотелиальных клетках, участвующих в ангиогенезе, циркулирующих клетках-предшественниках костномозгового происхождения и опухолевых клетках. В условиях гипоксии в опухоли под действием факторов HIF1-альфа и HIF2-альфа за счет паракринных механизмов происходит повышение локальной концентрацией VEGF,
что приводит к нарушению фазы созревания и стабилизации новых сосудов. Это проявляется выраженным образованием новых неправильных извитых слепозаканчивающихся измененных сосудов с множеством артериовенозных шунтов. Они имеют структурный дефект как в эндотелии, который в одной области может быть представлен несколькими слоями, а в другой отсутствовать, так и в строме (перициты и гладкомышечные клетки). Это приводит к ослаблению тока крови и снижению миграции клеток иммунной системы в опухоль.
Развитие молекулярной генетики позволило определить более 46 потенциальных мишеней на эндотелиальных клетках в опухоли. Это привело к созданию новых лекарственных средств с антиангиогенным механизмом действия. Около 100 из них были протестированы в преклинических и клинических исследованиях. К сожалению, в мире зарегистрированы и разрешены к использованию для лечения злокачественных новообразований только 4 препарата. К ним относятся бевацизумаб, сорафениб, сунитиниб.
Одновременно с развитием целенаправленной терапии на менения цитостатиков с целью снижения их токсичности и повышения эффективности. Одним из них стал метрономный режим химиотерапии, предпосылками для использования которого по%
служили следующие концепции:
Однако он недостаточно выражен для традиционного режима лечения вследствие:
1) низкой пропорции делящихся эндотелиальных клеток в
опухоль-ассоциированных сосудах;
2) защитных факторов – сосудистый эндотелиальный фактор роста (VEGF), основной фактор роста фибробластов (bFGF), ангиопоэтин;
3) репопуляции эндотелиальных клеток между циклами
химиотерапии.
● Влияние цитостатиков на костный мозг – подавление ан%
гиогенной активности клеток%предшественников гемопоэ%
за .
В экспериментальных работах было показано, что высокие дозы доксорубицина вызывают апоптоз эндотелия в опухоли толстой кишки за счет уменьшения инфильтрации ткани лимфоидными клетками. Метрономная терапия – это один из вариантов dose,dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких дозах. Кумулятивная доза назначенных препаратов может быть значительно меньше, чем при использовании стандартного подхода терапии. В связи с этим снижается уровень токсичности химиопрепаратов и, соответственно, сокращается потребность в
поддерживающей терапии (антиэметики, колониестимулирующие факторы, гемотрансфузии).
Основная мишень метрономной терапии – эндотелий в опухоль-ассоциированных сосудах . Каков механизм действия?
1) Прямой:
● супрессия циркулирующих эндотелиальных стволовых клеток;
● антипролиферативный эффект на эндотелиальные клетки.
2) Косвенный:
● повышение уровня эндогенного тромбоспондина 1, что приводит к апоптозу CD36%позитивных эндотелиальных клеток;
● уменьшение мобилизации стволовых эндотелиальных клеток;
● блокада VEGF;
● подавление матриксных металлопротеиназ;
● подавление тканевого активатора плазминогена.
Чем определяется механизм действия метрономной терапии?
Безусловно, оптимальной биологической дозой препарата и способом его введения.
Оптимальная биологическая доза
Это наибольшая доза препарата, назначенная в метрононном режиме, которая не вызывает выраженной супрессии костного мозга или иной токсичности. По данным исследований in vitro, активированные эндотелиальные клетки опухоли чувствительны к очень низким концентрациям химиопрепаратов. В среднем она составляет 10-40% от терапевтической. Из таблицы видно, что эффективная концентрация паклитаксела для подавления роста эндотелиальных клеток составляет
0,5-4х10-9 моль/л. Однако супрессия опухолевых клеток в монослое и сфере достигается при количестве цитостатика 2-27х10-9 моль/л и 3,434-10,084х10-9 моль/л, соответственно.
Однако они не являются антиангиогенными при метастатическом поражении легких, печени, костей.
Интересным является и тот факт, что химиопрепараты в определенных дозах могут влиять на ангиогенез, не вызывая апоптоза эндотелиальных клеток. Например, топотекан подавляет пролиферацию эндотелия в дозе 50х10-9 моль/л, что в 3 раза ниже той, которая приводит к его гибели. Антрациклины блокируют образование веретена деления в клетках сосудов в дозах, не являющихся цитотоксичными по отношению к эндотелию человека. Супрессия хемотаксиса и инвазивной способности эндотелиальных клеток осуществляется паклитакселом в дозах, не влияющих на их пролиферацию и жизнеспособность.
Режим введения препаратов
Метрономный режим (режим, при котором отмечаются удары прибора-метронома через короткие промежутки времени) – это ключевой аспект данного вида терапии, поскольку, блокируя мобилизацию из костного мозга и жизнеспособность клеток-предшественников, позволяет предотвратить репопуляцию опухолевого эндотелия, которая происходит во время стандартной схемы лечения. В исследованиях Bertolini et al. было показано, что у иммуннодефицитных мышей после подкожной перевивки лимфомных клеток в крови регистрировался высокий уровень предшественников эндотелиоцитов. Число этих клеток быстро снижалось после введения циклофосфамида в максимально переносимой дозе. Однако в перерывах между введениями препарата наблюдался компенсаторный эффект, т.е. количество клеток восстанавливалось до исходного и даже выше. Напротив, при введении циклофосфамида в низких дозах в течение недели или ежедневно внутрь число предшественников постепенно снижалось без компенсаторного восстановления.
Преклинические и клинические исследования
Например, для рака молочной железы – циклофосфамид и метотрексат, для рака легкого – этопозид, для рака яичников – цисплатин. Поэтому трудно утверждать, что именно – антиангиогенный механизм действия или прямой противоопухолевый эффект этих препаратов – привели к стабилизации или незначительному регрессу новообразования. Кроме того, в текущих клинических исследованиях в качестве маркера эффективности метрономной терапии были выбраны стандартные критерии RECIST. Однако, исходя из механизма действия данного режима, достигнуть значимого регресса опухолевой массы, который был бы эквивалентом увеличения продолжительности жизни, практически невозможно. Кроме того, одной из теоретических задач метрономной химиотерапии является попытка изменения кинетики роста опухоли с приостановкой его на определенном уровне, а для этого не требуется выраженного регресса новообразования. Поэтому на сегодняшний день необходимо проведение рандомизированных клинических исследований, в которых в качестве критерия эффективности метрономной терапии была бы продолжительность жизни больных.
Существуют ли суррогатные маркеры действия антиангиогенной терапии?
Если в преклинических исследованиях можно сравнительно точно определить антиангиогенный эффект (in vitro и in vivo), то в клинических исследованиях на сегодняшний день это практически невозможно. В табл. 3 представлены основные маркеры, которые находятся в стадии изучения в клинике в качестве критерия эффективности метрономной терапии.
Каково же будущее место метрономной терапии в клинике?
На основании механизма действия и проведенных клинических исследований этот режим, вероятно, не будет альтернативой стандартному методу. Однако одним из преимуществ данного вида лечения является возможность комбинации с другими антиангиогенными препаратами (антиVEGF), ингибиторами сигнальной трансдукции, вакцинами. В преклинических исследованиях T. Browder и G. Klement продемонстрировали, что химиотерапия в низких дозах за счет дестабилизации и апоптоза эндотелиальных клеток может повышать чувствительность опухолевых сосудов к антиVEGFR-антителам. Это один из путей преодоления лекарственной резистентности, поскольку известно, что цитостатики непосредственно способствуют повышению локальной концентрации VEGF. Это приводит к активации нескольких сигнальных каскадов (фосфатидил-инозитол-3-киназный, BCL2, A1, XIAP), ингибирующих апоптоз эндотелиальных клеток. Сочетание химиотерапии с анти-VEGF препаратами обеспечивает селективное проапоптотическое действие цитостатиков на активированные эндотелиальные клетки.
Еще одной точкой приложения метрономной терапии является поддерживающий режим у пациентов при достижении объективного ответа после традиционного лечения, а также ее назначение между циклами химиотерапии. Этот метод позволит остановить рост новообразования в фазе ''плато'' за счет подавления репопуляции опухолевых и эндотелиальных клеток, что теоретически должно увеличить время до прогрессирования болезни и продолжительность жизни пациентов.
Таким образом, в статье рассмотрен один из способов воздействия на сосудистый компонент в опухоли с помощью цитостатиков. К сожалению, на сегодняшний день вопросов о данном виде терапии больше, чем ответов. Необходимо дальнейшее изучение оптимальной биологической дозы препаратов и критериев эффективности данного вида лечения. Необходимо провести рандомизированные клинические исследования, которые позволят выделить группу пациентов, которым необходимо назначать метрономную терапию, а также выбрать оптимальную комбинацию препаратов.
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
- В первую очередь нужно понимать цель лечения
- На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
- Что такое ремиссия?
- Как контролируют эффективность химиотерапии в процессе лечения?
- Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.

Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Что такое ремиссия?
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.

В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В Европейской клинике этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи в Европейской клинике всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
А.Б. Моисеенко, А.В. Корнилов, В.М. Моисеенко
ГОУ ДПО СПбМАПО Росздрава, Санкт-Петербург
На сегодняшний день, несмотря на появление значительного числа новых противоопухолевых препаратов, ингибиторов тирозинкиназ, моноклональных антител, пятилетняя выживаемость больных диссеминированными солидными новообразованиями не превышает 20% [Pasquier E.
С другой стороны, выраженная токсичность стандартной терапии приводит к редукции терапевтической дозы цитостатиков и увеличению временны?х интервалов между циклами химиотерапии, что снижает эффективность проводимого лечения.
В связи с этим ведется поиск молекулярно-генетических мишеней в опухолевых клетках с целью индивидуального подхода терапии злокачественных опухолей, и предпринимаются попытки изменения стратегии лечения.
Кумулятивная доза назначенных препаратов может быть значительно меньше, чем при использовании стандартного лечения, что приводит к снижению токсичности и, соответственно, сокращению потребности в поддерживающей терапии (антиэметики, колониестимулирующие факторы, гемотрансфузии) [Kerbel R. et al., 2008].
Впервые, в 1991 году, в работах R. Kerbel с соавт. было показано, что одной из мишеней воздействия цитостатиков может быть не только геном злокачественной клетки, но и, учитывая их дедифференцировку и постоянную пролиферацию, эндотелиоциты в опухолевых сосудах.
В дальнейшем, два независимых исследования на экспериментальных моделях опухоли, резистентных к стандартной терапии, продемонстрировали эффективность постоянного введения низких доз химиопрепаратов, предполагая их антиангиогенное действие [Klement G. et al., 2000; Browder T. et al., 2000].
Это послужило, впоследствии, проведению большого числа предклинических (in vitro et in vivo) и клинических исследований метрономной терапии [Pasquier E. et al., 2010].
Однако до настоящего времени остается ряд нерешенных вопросов:
– механизм действия низких доз цитостатиков (антиангиогеный, прямой противоопухолевый, иммунный),
– оптимальная биологическая доза метрономной терапии,
– оптимальный режим введения химиопрепаратов,
– критерии эффективности метрономной терапии с точки зрения увеличения продолжительности жизни больных.
Мы проанализировали эффективность метрономного режима введения иринотекана на предклиническом и клиническом этапах.
Материалы и методы
Работа была разделена на 2 этапа – экспериментальный и клинический.
В эксперименте были использованы мыши линии FVB/N в возрасте 2-3 месяцев.
Всем животным была произведена подкожно в наружный отдел левого бедра перевивка спонтанной опухоли мышей чистой линии FVB/N, несущих ген рака молочной железы человека HER2/neu, и рандомизация на 3 группы:
1) контрольные мыши (10 мышей);
2) подопытные мыши - иринотекан внутрибрюшинно 100 мг/кг 1 раз в неделю № 5 (10 мышей) - стандартный режим терапии;
3) подопытные мыши - иринотекан внутрибрюшинно 0,9 мг/кг ежедневно – метрономный режим (10 мышей).
Два раза в неделю в течение двух месяцев производилась оценка динамики объема опухоли и взвешивание животных.
В дальнейшем все мыши были прослежены до конца жизни.
Диагноз злокачественной опухоли был верифицирован гистологически у всех больных (табл. 1).
Характеристика больных диссеминированным колоректальным раком, получавших метрономную терапию

Обязательным условием для включения пациента в исследование являлось добровольное подписание им специальной формы информированного согласия до начала любых специфических процедур и обследований.
Выраженность осложнений оценивалась в соответствии с критериями NCI CTCAE v.3, 2006. Модификация дозы введения иринотекана производилась в зависимости от степени выраженности побочных эффектов лечения и предусматривала только отмену препарата.
Динамика роста перевиваемой опухоли молочной железы трансгенных мышей HER2/neu на фоне стандартного и метрономного режимов введения иринотекана
Стандартный режим введения иринотекана 100 мг/кг еженедельно №5 приводит к достоверному уменьшению объема опухоли с 14-го по 31-й дни эксперимента. При этом максимальное торможение роста было зарегистрировано в 17-й день исследования и составило 73,5% (р=0,0001). Затем, несмотря на прекращение введения препарата, также наблюдалась тенденция к достоверному уменьшению объема опухоли до 45 дня опыта. Впоследствии был отмечен ускоренный рост новообразования до значений контрольного объема опухоли и далее кинетические кривые роста в контрольной группе и на фоне стандартного введения иринотекана практически не различались. В подопытной группе, получавшей ежедневное введение иринотекана, достоверное различие объемов опухоли наблюдалось практически на всем протяжении эксперимента, т.е. на фоне метрономного введения цитостатика опухоль не достигала своего контрольного значения (рис. 1). Максимальное торможение роста опухоли на фоне лечения было выявлено в 17-й день эксперимента.
Медиана продолжительности жизни мышей линии FVB/N с перевиваемой опухолью молочной железы в контрольной группе составила 56 сут., в группе стандартного введения иринотекана – 24 сут., в группе метрономного введения
цитостатика – 34 сут. Средняя продолжительность жизни между группами статистически не различалась. Максимальная продолжительность жизни мышей наблюдалась в группе метрономного введения иринотекана (83 дня).
Учитывая принципиальную возможность пролонгированного режима введения цитостатика влиять на объем опухолевой массы в организме и теоретическое обоснование увеличения продолжительности жизни, мы провели клиническое исследование II фазы для оценки эффективности и токсичности метрономного режима введения иринотекана у больных диссеминированным колоректальным раком.
Анализ эффективности был проведен у 22 (73%) пациентов.
Стабилизация процесса была отмечена у 10 (45%) больных, прогрессирование – у 12 (55%). При этом стабилизация опухоли на фоне метрономного введения иринотекана не зависит как от линии терапии, так и от использования данного цитостатика в стандартных предыдущих схемах лечения.
Основным маркером эффективности метрономного режима введения иринотекана, с нашей точки зрения, было время до прогрессирования опухоли, как возможный суррогатный маркер общей выживаемости больных.
Результаты представлены в табл. 2.
Медиана времени до прогрессирования опухоли на фоне метрономного режима введения цитостатиков у больных диссеминированным КРР

Данные о токсичности метрономных режимов введения цитостатиков представлены в табл. 3.
Токсичность метрономного режима введения иринотекана

Как видно из табл. 3, пролонгированное введение иринотекана приводило к развитию побочных эффектов, в основном, I и II степени, т.е. клинически незначимой, за исключением аллергической реакции III степени у 1 пациента.
Она проявлялась ознобом, цианозом лица, затруднением дыхания и была купирована введением глюкокортикоидов и антигистаминных препаратов. Описанное осложнение возникло у пациента в период с 6 по 12 неделю лечения и послужило причиной отмены препарата.
На сегодняшний день предполагается, что в основе противоопухолевого эффекта метрономной терапии лежит ее антиангиогенное действие. Оно включает селективное подавление пролиферации и активацию апоптоза эндотелиальных клеток, нарушение миграции эндотелиоцитов, повышение экспрессии эндогенных ингибиторов ангиогенеза (тромбоспондин-1), снижение числа клеток-предшественников эндотелиоцитов. Кроме того, изучаются иммунологические механизмы действия метрономной терапии (снижение T-регуляторных клеток, CD4+CD25+), ее возможное влияние на стволовые клетки и опухолевые клетки, которое приводит к торможению их деления в фазе G0. В нашей работе проведен эксперимент на модели перевиваемой опухоли молочной железы у трансгенных мышей HER2/neu, в котором мы оценили эффективность стандартного и метрономного введения иринотекана, с точки зрения торможения опухоли и продолжительности жизни животных. Данный цитостатик выбран на основании недостаточно выраженной его активности в отношении рака молочной железы (т.е. подразумевается универсальный механизм действия метрономной терапии), литературных данных, низкой малой токсичной дозы и возможного пролонгированного режима введения.
Учитывая экспериментальные данные, мы провели клиническое исследование II фазы оценки эффективности и токсичности метрономного режима введения иринотекана у больных диссеминированным колоректальным раком, резистентных к стандартной терапии. В качестве основного маркера эффективности метрономной терапии мы выбрали продолжительность стабилизации процесса, предполагая, что данный показатель наиболее полно отражает влияние пролонгированного режима цитостатика на кинетику роста опухоли и является суррогатным маркером продолжительности жизни пациентов.
Оказалось, что медиана продолжительности эффекта у больных, получавших иринотекан в метрономном режиме в качестве 3 и более линии терапии диссеминированного рака толстой кишки, сопоставима и даже несколько выше результатов, полученных при использовании цетуксимаба и иринотекана (119 суток) и симптоматического лечения (52 суток). При этом токсичность исследуемого режима не превышала I-II степени, за исключением развития аллергической реакции III степени у трех пациентов после 2 месяцев лечения.
Метрономный режим введения цитостатиков является новым перспективным рациональным подходом лечения диссеминированных солидных опухолей, влияющим на кинетику их роста. Клиническая эффективность метрономного режима введения иринотекана в качестве III и более линии терапии составляет 45%. Подобная эффективность проявляется увеличением медианы времени до прогрессирования у больных диссеминированным колоректальным раком до 118 дней, по сравнению с 52 днями на фоне симптоматического лечения. При этом спектр токсических реакций метрономного режима введения цитостатиков характеризуется незначительной частотой осложнений.
Читайте также:

