Визуализация рака молочной железы
Представлена обзорная информация о современных методах диагностики заболеваний молочных желез и возможных диагностических критериях рака молочной железы.
Survey information about the modern methods of diagnostics of mammary glands diseases and possible diagnostic criteria of breast cancer were represented.
Актуальность проблемы заболеваний молочных желез обусловлена прежде всего неуклонным ростом этой патологии во всем мире [5, 7]. Так, в популяции нераковые заболевания молочных желез встречаются у 30–70% женщин, а при одновременно имеющих место гинекологических заболеваниях их частота возрастает до 76–97,8% [7]. В России ежегодно выявляется более 34 000 новых случаев рака молочных желез, при этом отмечается значительное снижение возраста заболевших. У 25% женщин до 30 лет и у 60% после 40 лет диагностируются дисгормональные заболевания молочных желез (мастопатии) [3]. Несмотря на то, что мастопатии не являются облигатным предраком, рак молочной железы встречается в 3–5 раз чаще на фоне диффузных дисгормональных доброкачественных заболеваний молочных желез и в 30–40 раз чаще при узловых формах мастопатии с явлениями пролиферации эпителия молочных желез [3]. В связи с этим значительно возрос интерес к доброкачественным заболеваниям, а снижение заболеваемости мастопатией — реальный путь к снижению частоты рака молочной железы. В целом рак молочной железы не является предметом изучения и лечения врачей акушеров-гинекологов, но к ним часто обращаются женщины с проблемами, напрямую не связанными с содержанием специальности, в том числе и с проблемами, касающимися молочных желез. Поэтому акушеры-гинекологи могут существенно улучшить работу по сохранению здоровья женщины при экстрагенитальной патологии и при некоторых формах онкозаболеваний, в частности, при раке молочной железы. Несомненно, приоритетными для гинекологов являются вопросы диагностики и лечения доброкачественных заболеваний молочных желез. Поскольку молочные железы являются неотъемлемой частью репродуктивной системы женщины, решение проблемы ее оздоровления невозможно без наблюдения и исследования молочных желез, что несомненно должно входить в круг обязанностей акушеров-гинекологов. Выявление диффузной и очаговой патологии молочных желез и правильная трактовка полученных результатов обследования позволяют своевременно направить женщин на комплексное обследование и сориентироваться в правильном выборе метода лечения.
Традиционно в России и ряде других стран заболеваниями молочных желез занимаются в основном хирурги, онкологи и маммологи. В связи с этим акушеры-гинекологи не могли уделять должного внимания обследованию и лечению молочных желез в режиме скрининга (как это, например, проводится при заболеваниях шейки матки) [5, 7]. А без их участия врачами вышеназванных специальностей зачастую недооценивается весь спектр функциональных и органических нарушений репродуктивной системы в целом [6, 7]. Кроме того, следует отметить, что низкая выявляемость заболеваний молочных желез на ранних стадиях зачастую обусловлена недостатком знаний в области клинической маммологии у врачей акушеров-гинекологов, так как именно данная категория врачей является наиболее часто посещаемой среди женщин. При профилактическом осмотре акушером-гинекологом состояние молочных желез в схему осмотра и сбора анамнеза пациентки часто не включается. Вышеперечисленное свидетельствует о том, что ранняя диагностика патологии молочной железы представляется затруднительной. Важной задачей является организация взаимодействий врачей гинекологов и онкологов-маммологов. Участие врачей первичного звена в направлении женского населения на маммологический скрининг является важным инструментом снижения смертности от рака молочной железы.
Цель нашей статьи — дать краткую обзорную информацию о современных методах диагностики заболеваний молочных желез и возможных диагностических критериях рака молочной железы.
Доступность молочных желез для обследования и кажущаяся простота диагностики часто приводят к неправильной интерпретации результатов клинического исследования, которое зачастую проводится малоподготовленными в этом вопросе специалистами. Все это ведет как к гипо-, так и к гипердиагностике.
Поэтому мануальное обследование должно дополняться комплексным рентгенологическим, ультразвуковым (УЗИ), радиотермометрией (РТМ-диагностика), электроимпедансной маммографией (ЭИМ), другими видами инструментальных исследований.
Основным на сегодняшний день методом объективной оценки состояния молочных желез является рентгенологическая маммография. Эта методика рентгенологического исследования позволяет своевременно распознать патологические изменения в молочных железах в 95–97% случаев [8]. Именно это качество в отличие от других методов диагностики позволяет рассматривать маммографию как ведущий метод скрининга. В настоящее время во всем мире общепринято (ВОЗ, 1984) начиная с 40 лет проводить маммографическое исследование 1 раз в 2 года (при отсутствии показаний для более частого обследования), после 50 лет — 1 раз в год. Исключением являются женщины до 35 лет, кормящие, беременные женщины и подростки, которым маммография противопоказана.
Маммография — это рентгенография молочной железы без применения контрастных веществ. Метод простой, безопасный для обследуемых, отличается высокой диагностической эффективностью.
Маммографию проводят в двух проекциях (прямой — краниокаудальной и боковой) на 5–10 день менструального цикла, когда паренхима молочной железы менее отечна и болезненна, а при отсутствии менструаций — в любой день. Также можно использовать дополнительную боковую проекцию с медиолатеральным ходом луча (косая проекция). На боковых снимках при правильной укладке должны визуализироваться частично грудная мышца, ретромаммарная клетчатка, переходная складка. В прямой проекции — сосок, выведенный на контур железы, все структурные элементы молочной железы, в 20–30% — грудная мышца.
При необходимости уточнения состояния определенного участка молочной железы необходимо проводить прицельную рентгенографию с помощью специальных тубусов различной площади. Это лучше отграничивает патологический участок, а использование дозированной компрессии повышает четкость изображения. С помощью прицельных рентгенограмм удается вывести опухоль в край железы. При этом она выявляется более отчетливо, лучше определяется лимфатическая дорожка и состояние кожи в прилегающих участках. Прицельные снимки позволяют избежать ошибок, обусловленных проекционными эффектами суммации теней. В ряде случаев целесообразно использовать прицельную рентгенографию с прямым увеличением рентгеновского изображения.
Рентгеновская картина молочной железы у каждой женщины индивидуальна. Важно ориентироваться врачам первичного звена в признаках злокачественности при описании маммограмм. При маммографии различают первичные и вторичные признаки злокачественности.
К вторичным (косвенным) рентгенологическим признакам рака молочной железы относят симптомы со стороны кожи, соска, окружающей ткани молочной железы, усиленная васкуляризация и т. д.
Несмотря на эффективность рентгенологического метода, у ряда больных разрешающая способность маммографии резко снижается: при выраженных диффузных формах мастопатии, у молодых пациенток с плотными молочными железами, при наличии имплантатов, выраженных воспалительных изменениях, отеке железы и фоновых заболеваниях типа фиброаденоматоза. В этом случае на помощь приходит УЗИ молочных желез.
Основные преимущества маммографии, используемые при диагностике заболеваний молочной железы: возможность получения позиционного изображения молочной железы, высокая информативность при обследовании, возможность визуализации непальпируемых образований, возможность сравнительного анализа снимков в динамике. Недостатки метода, ограничивающие применение: дозовая нагрузка, хотя она и ничтожно мала; в 1,8–6% случаев по данным литературы имеет место рентгенонегативный рак. По данным большинства авторов процент достоверности маммографического исследования в диагностике рака составляет от 75% до 95%. Достоинства новой технологии не ограничиваются только клиническими аспектами. Появление цифровых приемников изображения позволило методу маммографии развиваться в контексте фундаментальных изменений, происходящих во всех разделах медицинской визуализации и в самой системе организации медицинской службы.
По общепринятому мнению, УЗИ является основным методом диагностики заболеваний молочных желез у женщин до 35–40 лет, при беременности, лактации, а в более позднем возрасте предпочтение следует отдавать рентгенологической маммографии. Ультразвуковая диагностика постоянно наращивает свой потенциал благодаря совершенствованию уже имеющихся и разработке новых методик диагностики. Сканирование выполняется на ультразвуковых аппаратах линейным датчиком с частотой 7,5–10 МГц при коэффициенте увеличения изображения 1,5, с использованием иммерсии — наличия слоя геля на соприкасающихся поверхностях кожи и датчика — для уменьшения содержания между ними воздуха.
Преимуществами ультразвуковых исследований молочных желез являются: безопасность в плане дозовой нагрузки, что позволяет обследовать беременных и кормящих; высокая разрешающая способность, что важно при плотном фоне молочной железы у молодых женщин (возможность визуализации рентгенонегативных опухолей, образований, расположенных вблизи грудной стенки); дифференциальная диагностика солидного и полостного образования (практически 100% диагностика кист любого размера); оценка состояния силиконовых имплантантов молочных желез, особенно при их разрывах и утечке содержимого; обследование молочных желез в острый период травмы или воспаления; визуализация регионарных лимфатических узлов; проведение прицельных пункционных биопсий под объективным визуальным контролем пальпируемых и непальпируемых образований в молочной железе; многократное динамическое исследование в процессе лечения.
Несмотря на все достоинства УЗИ молочных желез, практические врачи в большинстве случаев при назначении лечения пациенткам любых возрастных групп ориентируются в основном на данные рентгеновской маммографии. Недоверие к УЗИ молочных желез связано с тем, что молочная железа является одним из наиболее трудных объектов для ультразвуковой диагностики, так как соотношение составляющих ее тканей постоянно меняется в зависимости от возраста, фазы менструального цикла, физиологических периодов жизни, массы тела, наличия патологических процессов. Поэтому специалист, проводящий УЗИ, должен уметь не только правильно идентифицировать различные тканевые компоненты, составляющие молочную железу, но и иметь достаточный опыт, чтобы составить себе представление, какой должна быть в норме структура молочной железы у каждой обследуемой пациентки с учетом отмеченных выше факторов. В настоящее время еще не существует единого подхода к идентификации различных тканей, образующих молочную железу, поэтому одна и та же эхографическая картина разными специалистами часто оценивается по-разному [4]. Кроме того, если врач не имеет четкого представления обо всем диапазоне структурных особенностей молочной железы, выявляемых при УЗИ в норме, то он может некоторые отклонения в пределах спектра нормального развития расценить как патологические. По-видимому, этим можно объяснить удивительно высокую частоту такого диагноза, как фиброзно-кистозная болезнь (ФКБ). Большинство публикаций посвящено ультразвуковой диагностике различных новообразований молочной железы как доброкачественного, так и злокачественного характера. И здесь не возникает принципиальных разночтений эхограмм, поскольку разработана четкая эхосемиотика узловых образований молочной железы [4]. Другое дело ультразвуковая диагностика такого заболевания, как ФКБ, суть которого состоит в дисплазии молочной железы доброкачественного характера с различной степенью выраженности пролиферативных и регрессивных изменений ее тканевых элементов. Учитывая очевидную гипердиагностику ФКБ по данным УЗИ, вновь встает вопрос о необходимости разработки корректной эхографической идентификации тканевых компонентов молочной железы в норме [4]. Отдельным пунктом стоит масталгия, диагностика которой существующими методами визуализации молочных желез представляется абсурдной. А своевременная дифференциальная диагностика масталгии разной этиологии предполагает правильный выбор дальнейшей тактики ведения женщин. Разночтения в интерпретации одной и той же эхографической структуры молочной железы разными авторами диктуют необходимость совершенствовать старые методы и проводить разработку новых методов исследования молочных желез.
К эхографическим критериям рака молочной железы относят: неправильную форму, нечеткие контуры, гипоэхогенную неоднородную структуру, гиперэхогенные включения разной величины, акустические тени, преобладание переднезаднего размера образования.
Новой технологией измерения температуры тканей молочной железы и ее цифрового изображения является метод микроволновой радиотермометрии (РТМ-исследование) с использованием компьютеризированного диагностического комплекса (РТМ-01-РЭС), предназначенного для измерении интенсивности собственного электромагнитного излучения внутренних тканей пациента в диапазоне сверхвысоких частот, которое пропорционально температуре тканей (рис. 1).
.jpg)
В настоящее время в дополнение к существующим методам диагностики появилась возможность визуализации тканей молочной железы с помощью электроимпедансной томографии (рис. 2), метода получения изображения распределения импеданса в тканях. Для визуализации тканей молочной железы используется многочастотный 256-электродный электроимпедансный маммограф (МЭМ), разработанный Институтом радиотехники и электроники РАН, на частотах 10 кГц и 50 кГц.
С целью реализации метода электроимпедансной маммографии разработана измерительная система и алгоритм реконструирования изображений, которые позволяют, используя набор электродов, располагающихся в виде двумерной матрицы на плоской поверхности, визуализировать статические распределения электропроводности среды, прилегающей к поверхности с электродами. Результатом визуализации является набор изображений поперечных сечений среды плоскостями, параллельными плоскости электродов и располагающимися на разной глубине от поверхности среды [1, 2, 9–12].
Во время обследования матрица прижимается к молочной железе в направлении ребер, так что максимальное количество электродов оказывается в контакте с телом пациента, а толщина обследуемых тканей минимальна. Два отводящих электрода, один из которых используется как общий электрод источника тока, а второй — как опорный электрод измерителя разности потенциалов, состыкованы между собой и располагаются на запястье пациентки (рис. 3).
.jpg)
Последовательность работы измерительной системы следующая. Измеритель разности потенциалов подключается мультиплексором к первому электроду матрицы, выполняется процедура компенсации контактной разности потенциалов, а затем источник тока последовательно подключается к каждому из оставшихся электродов матрицы и производятся измерения. После этого цикл повторяется для другого регистрирующего электрода. Полный набор данных, используемых для реконструирования трехмерных распределений электропроводности, состоит из 65 280 результатов измерений. Обработка данных и инициирование процесса измерения осуществляется с помощью персонального компьютера, соединенного с прибором по универсальной последовательной шине (USB).
Результатом реконструирования являются электроимпедансные изображения семи поперечных сечений исследуемой среды, параллельных плоскости с электродами, взятых с шагом 0,7 см по глубине (рис. 4).
.jpg)
Длительность процедуры реконструкции составляет около 15–20 секунд для персонального компьютера с тактовой частотой порядка 1 ГГц.
В распоряжении врачей, занимающихся диагностикой заболеваний молочных желез, появился новый, доступный, безопасный и высокоинформативный метод электроимпедансной маммографии, существенно дополнивший существующий арсенал современных методов обследования, который можно использовать как метод скрининга у женщин всех возрастных периодов, так и в качестве надежного контроля состояния молочной железы при приеме комбинированных оральных контрацептивов и препаратов заместительной гормонотерапии без ограничения числа процедур обследования.
Метод ЭИМ существенно расширяет возможности акушеров-гинекологов и врачей других клинических специальностей в отношении инструментальной диагностики заболеваний молочных желез и дает им уникальные возможности объективной оценки их состояния как составной части неотъемлемого звена единой репродуктивной системы.
Предлагаемая программа многочастотного электроимпедансного обследования позволяет выделить четкие диагностические критерии различной диффузной и очаговой патологии молочных желез, дифференцировать масталгию различной этиологии, что важно для правильного выбора тактики ведения женщин с заболеваниями молочных желез.
Для рака молочной железы характерно:
- На электроимпедансных томограммах в месте вероятного расположения опухоли появляются гипоимпедансные районы с нечеткими размытыми контурами, распространяющиеся на несколько плоскостей сканирования с высокой электропроводностью (чаще всего более 0,95 усл. ед.).
- При использовании дополнительного контрастирования участки с высокой электропроводностью окрашиваются красным цветом.
- При визуализации в режиме цветной шкалы зоны расположения рака выделяются белым цветом с ярким красным контуром.
- Разница в изображениях в зависимости от стороны сканирования из-за нарушения архитектоники внутренних структур пораженной молочной железы при неизмененной здоровой молочной железе.
- Разница в показателях электропроводности в пораженной молочной железе в зависимости от позиции при исследовании.
- Наличие деформаций контуров изображения пораженной молочной железы и четкие недеформированные контуры здоровой молочной.
- Смещение внутренних структур.
- Резкое смещение графика частотного распределения электропроводности вправо по сравнению с непораженной молочной железой и с графиком распределения электропроводности пораженной молочной железы
Несмотря на огромный арсенал методов диагностики рака молочной железы в практике акушера-гинеколога, необходимо помнить, что только комплексное обследование пациенток и цитологическая или гистологическая верификация диагноза, осуществляемые в специализированных лечебных учреждениях, позволяет квалифицированно оказать необходимый перечень медицинских мероприятий. Если есть хоть минимальные подозрения на возможность малигнизации, пациентку необходимо отправить в онкологическое учреждение. В такой ситуации гипердиагностика и ложная тревога может в худшем случае стать тактической ошибкой, однако это может позволить избежать стратегической ошибки, что значительно важнее.
Литература
Ч. Н. Мустафин*, кандидат медицинских наук, доцент
О. В. Троханова**, доктор медицинских наук, доцент
*ГБОУ ДПО РМАПО МЗ РФ, Москва
**ГБОУ ВПО ЯГМА МЗ РФ, Ярославль

ИГХ при раке молочной железы — необходимость современной онкологии. Его результаты позволяют подобрать максимально подходящее женщине противоопухолевое лечение.
Что такое иммуногистохимия при РМЖ?
Иммуногистохимический анализ или коротко ИГХ основан на способности иммунитета синтезировать вещества, нейтрализующие инородные агенты — бактерии, вирусы, грибы и выделяемые ими токсины. Инородные агенты — это антигены, в их присутствии иммунные клетки вырабатывают определённое антитело, на каждое антитело имеется свой антиген.
Рак молочной железы умело скрывается от санкций иммунитета, тем не менее раковые клетки и их структурные элементы — антитела, иммунитет их не видит, но ИГХ выявляет эти антитела.
При ИГХ кусочек опухоли обрабатывают реагентами с антигенами, которые находят своё антитело и соединяются с ним, изменяя окраску исследуемого кусочка злокачественной ткани.
Для чего проводят иммуногистохимию при РМЖ?
Иммуногистохимия нужна не для научной работы, а для практического использования:
- Обнаружение в клетках рецептора половых гормонов, чувствительного к эстрогену (ЭР) или прогестерону (ПР), прогнозирует чуть более плавное течение рака с меньшей вероятностью метастазирования, с преимущественной локализацией метастазов в костях, большую продолжительность жизни даже при генерализации процесса;
- Разная концентрация ЭР и ПР позволяет выбрать для конкретной женщины оптимальное лечение, так при высоком уровне ЭР в сочетании с ПР и даже без них можно рассчитывать на хороший результат гормональной терапии, без рецепторов обязательна химиотерапия;
- Наличие в клетке НЕR2 в высокой концентрации указывает на агрессивность рака, что требует химиотерапии и специфического нейтрализатора НЕR2;
- Сочетание позитивного гормонального статуса с НЕR2 вызывает сомнения в результативности гормонотерапии, поэтому в программу лечения включается химиотерапия;
- Высокая концентрация Ki-67 — свидетельство высокой степени злокачественности и, опять-таки, не позволяет избежать химиотерапии.
Показания к иммуногистохимии при РМЖ
При раке молочной железы для ИГХ только одно показания — определение степени агрессивности рака по его структурным компонентам для подбора оптимальной программы лечения.
Обычный морфологический анализ — гистология показывает степень злокачественности опухоли и её клеточный состав, часто неоднородный, но не позволяет определить белковые структуры:
- Чувствительность каждой клетки к лекарствам определяется наличием у нее рецепторов половых гормонов;
- Активность клеточного размножение и скорость роста ракового узла контролирует белок НЕR2, если его слишком много, то рак будет расти быстрее и формировать защиту клетки от лекарств вплоть до полной устойчивости;
- Способность быстро воспроизводить замену погибшим клеткам, захватывая при этом новые территории, определяет маркер пролиферации Ki-67.
Концентрацию всех этих клеточный субстанций и определяет ИГХ.
Подготовка к исследованию
ИГХ при раке молочной железы проводится вне организма больной, но с кусочком её опухоли. Сегодня всем женщинам с впервые обнаруженным новообразованием в железе на этапе диагностики специальной иглой выполняется биопсия — кор-биопсия.
Взятый небольшой столбик раковой ткани подвергается гистологическому исследованию и ИГХ, что позволяет верифицировать, то есть доказать наличие рака, и планировать первичное лечение. Удалённую во время операции на молочной железе опухоль тоже подвергают гистологическому и ИГХ исследованиям для уточнения плана лечения.
Женщине перед биопсией надо только успокоиться, никакой определенной подготовки от неё не требуется.
Проведение исследования
Взятый при биопсии или из удалённых при операции тканей молочной железы кусочек рака в пробирке с формалином (для консервации) отправляется в патоморфологическую лабораторию. Кусочек разрезается на тончайшие пластинки, которые консервируются на очень длительный срок — несколько десятилетий, чтобы при необходимости имелся материал для анализа. Пластинки также подвергают иммуногистохимии.
ИГХ делается двумя способами: внесённые с реактивом антигены напрямую контактируют с антителами или через антиген-посредник, который сначала ищет свое антителом, а затем этот дуэт находится вторым антигеном, концентрация которого и измеряется.
О чем говорят результаты?
Обнаружение в раке молочной железы рецепторов ЭР и ПР предсказывает относительно доброкачественное течение при эффективности гормональных препаратов, но в реальной жизни опухоль может не среагировать на эндокринную терапию, правда процент устойчивости невысок.
Обнаружение Ki-67 прогнозирует неспокойную жизнь и интенсивное лечение с использованием максимальных возможностей химиотерапии для изменения негативного прогноза болезни.
Рецептор НЕR2 — прогностический фактор, предлагающий сосредоточение на химиотерапии без особых надежд на антигормональное воздействие, но с другой стороны, предсказывает необходимость использование таргетного препарата, связывающего патологический белок.
Расшифровка исследования
Формально считается, что 1% ЭР уже положительно, но до 10% ЭР сомнительна надежда на значимый результат эндокринной терапии. Иммуногистохимический анализ рецепторного статуса рака молочной железы предполагает следующие ответы:
- от 0 до 2 баллов — нет гормональной зависимости;
- при 3 — 8 баллах — возможна зависимость от эндокринного воздействия, чем больше баллов, тем выше уровень рецепторов, тогда как при 3 баллах только десятая часть раковых клеток имеет рецептор.
Градации ответов при определении НЕR2:
Белок Ki-67 констатирует:
- меньше 15% — невысокая активность пролиферации;
- 16% — 30% — умеренная агрессивность;
- выше 30% — высокая агрессия.
Определяемые при иммуногистохимии структурные элементы не гарантируют исполнения предначертанного — в процессе лечения рак изменяет свои характеристики. В нашей клинике определяют реальные характеристики злокачественного процесса в конкретный момент времени и подбирают оптимальное лечение по панели из множества генов.
Анастасии 28 лет. Год назад она закончила лечение от рака груди и согласилась рассказать Onliner свою историю, чтобы показать: жизнь после рака существует. Более того — счастливая жизнь.
— До 27 лет я, конечно, знала, что онкология существует. Но искренне думала, что меня это никогда не коснется.

Когда в поликлинике мне делали биопсию (берут большой шприц, вставляют иголку — и прямо в грудь, без анестезии), я потеряла сознание. Пришлось онкологу нашатырь мне нести. А потом сказали ждать 10 дней — и будет готов результат.

Онколог сказал, что мне придется удалять грудь полностью. Тяжело было это принять. Я каждый день плакала. Долго думала, советовалась с мамой, с женихом, но в итоге согласилась. Меня оперировал Ростислав Киселев — спасибо ему большое, он человечный доктор. Успокаивал меня, объяснял нюансы. В итоге мне вырезали не только грудь, но и лимфоузлы. Операция прошла хорошо.

На химию я ездила на метро, боялась садиться за руль из-за слабости. Представьте: лето, я сижу в парике, мне жарко, ресниц уже нет, на руках синяки от капельниц… И мне кажется, что все, абсолютно все в вагоне смотрят на меня и понимают, что я онкобольная. Такое неприятное чувство.

Честно, я не ожидала такого поступка от мужа. Я ведь специально рассказала ему все в максимально страшных подробностях. А он все равно от меня не отказался.

Пока что я стесняюсь своего тела — такого, каким оно стало после операции. Пробовала ходить в бассейн, но там раздевалки общие. Я прямо в шкафчик этот залажу, только бы никто не увидел меня без купальника. На очередном осмотре онколог посоветовал удалить и вторую, здоровую грудь, чтобы обезопасить себя. А потом сделать операцию по восстановлению груди, вставить импланты. Сама операция бесплатная, но один имплант в среднем стоит около $1500 по курсу. То есть нужно $3000. Это очень большие деньги для нашей семьи. Как собрать такую сумму.
Мне хотелось бы сказать всем женщинам: пожалуйста, не забывайте, не откладывайте, регулярно делайте УЗИ и маммографию! При малейших подозрениях сразу же идите к врачу. Об этом нужно говорить в СМИ постоянно.

— Маммография — наследница рентгена?
— Это самый первый метод лучевой диагностики, который подарил нам Вильгельм Рентген, когда в 1895 году открыл икс-лучи. Изначально о маммографах речь не шла, возможность рентгеновской визуализации молочной железы появилась после изучения удаленного постоперационного материала на обычном рентген-аппарате. Технический прогресс с 1900 года и до наших дней занимался тем, чтобы улучшить качество изображения, а еще — снизить лучевую нагрузку, ведь ткань молочной железы очень чувствительна к излучению. Сначала появились аналоговые маммографы, а начиная с 2000-х годов — цифровые. Сегодня и в Центральной Европе, и в Минске практически все исследования молочной железы проводятся с помощью цифровой аппаратуры.

— Что изменила цифровая эпоха?
Но, несмотря на высокое качество оборудования, опыт и квалификация врача имеют решающее значение. Важно иметь возможность эту квалификацию поддерживать на высоком уровне. Например, в Великобритании, в Лондоне, где я была на стажировке, есть программа по обучению и аттестации врачей-рентгенологов. Есть пакет изображений, врач должен их оценить, а система начислит определенное количество баллов за правильно поставленный диагноз. И доктор тут же увидит, какое место он занимает среди коллег своего района, области, Лондона, всей Великобритании. Это не карательная мера. Смысл в том, чтобы врачи более тщательно подходили к обучению и стандартам. Важный момент — эта программа с помощью видеозаписи может фиксировать, как именно доктор читает снимки: на всех ли изображениях он начинает с соска и ареолы, потом идет по часовой стрелке, рассматривая всю молочную железу, и заканчивает аксиллярным отростком? Если у доктора есть стандарт чтения снимка, вряд ли он что-либо пропустит.
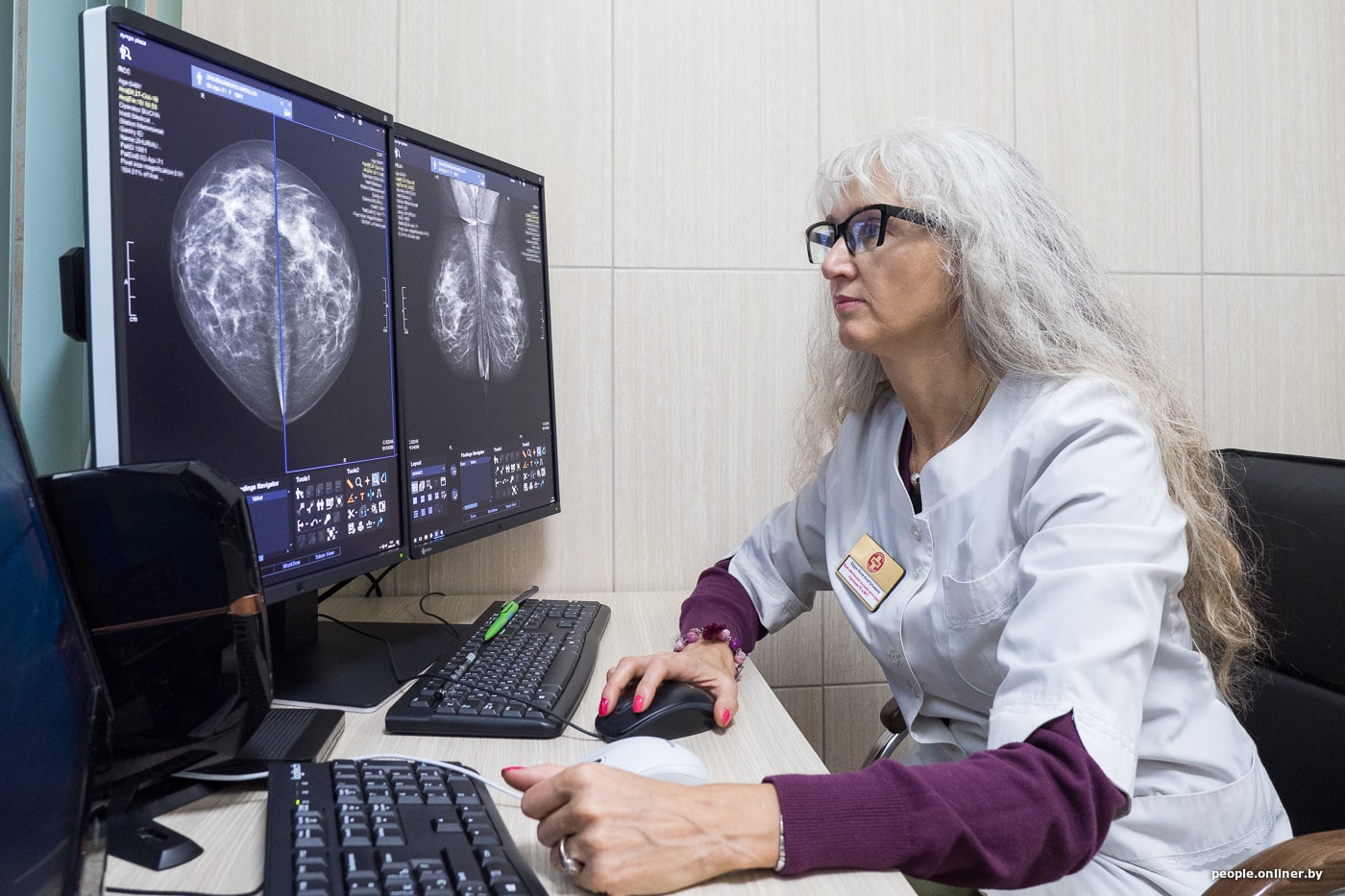
— Многие женщины опасаются, что маммография вредна. Почему-то этот миф очень устойчив. А что на самом деле?
— Это миф, конечно. Любое направление на лучевое исследование (и маммографию в том числе) обосновывается врачом. Цифровые маммографы последнего поколения обладают малой лучевой нагрузкой, которая сопоставима с рентген-исследованием органов грудной клетки.
Наблюдать за состоянием молочных желез нужно начинать с 20 лет. В первую очередь, необходимо раз в год проводить УЗИ молочных желез, а также раз в год посещать маммолога. Это касается тех женщин, которых ничего не беспокоит. Если же что-то беспокоит, то начать нужно с посещения врача-маммолога, который, учитывая возраст пациентки, направит изначально либо на УЗИ, либо на маммографию.
Начиная с 45—50 лет женщина в первую очередь выполняет маммографию с последующей консультацией маммолога, который при необходимости может добавить УЗИ молочной железы. Такая комбинация методов в разном возрастном периоде у женщин обусловлена разным структурным состоянием молочных желез.
— МРТ молочных желез подходит молодым женщинам?
— МРТ — это не метод массового обследования. МРТ молочных желез применяется в трудных диагностических случаях, когда результаты УЗИ и маммографии не совпадают; когда у женщины известен генетический статус: она является носителем BRCA1 и BRCA2; когда в семье было заболевание молочной железы у близких родственников: мамы, родной сестры, тети и так далее.
Читайте также:

