Веществу которое может реагировать с хлором
Cl2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl2 0
Электролиз водных растворов хлоридов, чаще - NaCl:
Окисление конц. HCI различными окислителями:
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO3 - .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 - гипохлориты; КClO3 - хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)

Кислородсодержащие соединения хлора - чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название "хлорин", которое вскоре было сокращено до "хлор" с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название "галоген", но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре - на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору "по барабану" с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений - хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35 Cl - 75,5%
- 37 Cl - 24,5%
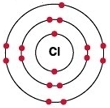
Рис. Строение атома хлора.
Электронная конфигурация атома хлора - 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора - этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой - кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор "охотно" вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Задачи для практики
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует хлор.
- $O_2$
- $N_2$
- P
- $H_2SO_4$
- NaOH (р-р)
Запишите в поле ответа номера выбранных веществ.
Хлор вступает в реакцию с фосфором, образуя хлорид фосфора ($PCl_5$), также хлор способен реагировать с щелочами, происходит реакция диспропорционирования.
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует сера.
- NaOH (тв.) и $H_2SO_4$ (разб.)
- $Br_2$ и $HNO_3$ (конц.)
- KOH (конц.) и $H_2SO_4$ (конц.)
- $H_3PO_4$ (конц.) и $O_2$
- $H_2O$ и HCl
Запишите в поле ответа номера выбранных веществ.
Сера, как типичный неметалл, вступает в реакцию с основаниями, также вступает в реакцию конпропорционирования с серной кислотой с выделением $SO_2$.
Из предложенного перечня выберите два оксида, с каждым из которых могут реагировать $Ca(OH)_2$, $HNO_3$, BaO.
- $CO_2$
- $Fe_2O_3$
- $NO_2$
- MgO
- BeO
Запишите в поле ответа номера выбранных оксидов.
оксид железа 3 и оксид бериллия являются амфотерными, поэтому реагируют с кислотой и основанием. С оксидом бария получается бериллат бария и феррат бария
Из предложенного перечня выберите два оксида, с каждым из которых могут реагировать HCl, C, $NO_2$.
- $P_2O_5$
- CrO
- FeO
- $SO_3$
- NO
Запишите в поле ответа номера выбранных оксидов.
Реагировать с данными веществами могут только оксиды металлов. В данном случае оксид железа(II) и оксид хрома (II).
Из предложенного перечня выберите два вещества, которые преимущественно образуются при взаимодействии оксида железа(II) с концентрированной азотной кислотой.
- $Fe(NO_3)_2$
- NO
- $NO_2$
- $H_2$
- $Fe(NO_3)_3$
Запишите в поле ответа номера выбранных веществ.
Железо является металлом средней активности, поэтому его оксид при взаимодействии с $HNO_3$ дает $NO$, так как не может дальше окислить азот, а из оксидов металлов получаются нитраты, но не в той же степени окисления, а в более высокой из-за того, что это ОВР.
Из предложенного перечня выберите два оксида, с каждым из которых могут реагировать Al, NaOH, $H_3PO_4$.
- $CO_2$
- $Cr_2O_3$
- BaO
- NO
- ZnO
Запишите в поле ответа номера выбранных оксидов.
И с кислотой ($H_3PO_4$), и с основанием (NaOH) из оксидов способны реагировать только амфотерные. В данном списке это $Cr_2O_3$ и ZnO. В реакции с алюминием будет происходить замещение металла более активным.
Из предложенного перечня выберите два вещества, которые не взаимодействуют с кремнием.
- гидроксид натрия
- магний
- серная кислота
- плавиковая кислота
- водород
Запишите в поле ответа номера выбранных веществ.
Кремний Si - неметалл с малой электроотрицательностью, не реагирует с неметаллами, кроме самых активных, с кислотами, кроме плавиковой (фтороводородной), из представленных не реагирует с серной кислотой и водородом.
Из предложенного перечня выберите две пары веществ, которые могут реагировать друг с другом.
- FeO и CuO
- FeO и Pb
- FeO и $H_2O$
- FeO и $O_2$
- FeO и $H_2$
Запишите в поле ответа номера выбранных пар веществ.
Оксид железа (II) умеет гореть, а также можно восстановить железо из оксида водородом, а с холодной водой данный оксид не реагирует.
Из предложенного перечня выберите два оксида, которые не реагируют со щелочами.
- $Al_2O_3$
- CO
- $K_2O$
- $N_2O$
- $CrO_3$
Запишите в поле ответа номера выбранных оксидов.
С щелочами не способны реагировать основные и несолеобразующие оксиды. В данном списке это $K_2O$ (основный) и $N_2O$ (несолеобразующий). Угарный газ, несмотря на то, что он несолеобразующий, все-таки способен реагировать с сильно концентрированными растворами некоторых щелочей в жёстких условиях.
Из предложенного перечня выберите два вещества, каждое из которых может реагировать с $H_2$, KOH, $H_2S$.
- $SO_2$
- ZnO
- CaO
- $N_2O$
- $Fe_2O_3$
Запишите в поле ответа номера выбранных веществ.
$Н_2$ - водород - неметалл, хороший восстановитель, способен восстанавливать металлы из их оксидов.
КОН - гидроксид калия - сильное основание, реагирует с кислотами, кислотными и амфотерными оксидами.
$Н_2S$ - сероводород - слабая кислота, реагирует с основаниями, основными и амфотерными оксидами.
Среди предложенных веществ есть два амфотерных оксида металлов - ZnO и $Fe_2O_3$.
В реакцию с оксидом цинка вступает каждое из двух веществ:
Запишите в поле ответа номера выбранных рядов веществ.
Оксид цинка ZnO — амфотерный оксид. Амфотерные оксиды реагируют с кислотами, щелочами, оксидами и карбонатами активных металлов с образованием солей и могут участвовать в окислительно-восстановительных реакциях.
Цинк в этом соединении имеет высшую степень окисления и не может реагировать с окислителями.
Вывод: ответ неверный, взаимодействие со вторым веществом рассматривать не будем.
2) $ZnO + H_2 = Zn + H_2O$
Восстановление мало- и среднеактивных металлов из оксидов с помощью водорода при нагревании — способ получения металлов.
$ZnO + H_2S = ZnS + H_2O$
Взаимодействие оксида цинка с сероводородом возможно, потому что образуются малорастворимый сульфид цинка и вода.
Вывод: ответ правильный.
3) $ZnO + К_2O = К_2ZnO_2$ (цинкат калия)
$ZnO + 2HCl = ZnCl_2 + H_2O$
Вывод: правильные ответы (2, 3) найдены, оставшиеся варианты ответов рассматривать не будем.
Из предложенного перечня выберите два вещества, с каждым их которых бром не взаимодействует.
- гидроксид калия
- хлорид натрия
- йодид лития
- водород
- азот
Запишите в поле ответа номера выбранных веществ.
Бром — активный неметалл. Бром способен: 1) реагировать с металлами и менее активными, чем бром, неметаллами; 2) вытеснять менее активные неметаллы из их соединений; 3) вступать в реакции диспропорционирования; 4) окислять сложные вещества.
Составляем уравнения возможных реакций:
1) $Br_2 + 6KOH = 5KBr + KBrO_3 + 3H_2O$ (при нагревании) или $Br_2 + 2KOH = KBr + KBrO + H_2O$ (без нагревания)
2) $Br_2 + NaCl ≠$ (менее активный галоген, расположенный ниже в Периодической таблице, не вытесняет более активный, расположенный выше, из его соединений, потому что окислительная активность уменьшается в группе сверху вниз).
3) $Br_2 + 2LiI = I_2 + 2LiBr$
4) $Br_2 + H_2 = 2HBr$
5) $Br_2 + N_2 ≠$ (азот реагирует из неметаллов с водородом, кислородом и фтором).
Вывод: правильные ответы 2, 5.
Из предложенного перечня выберите две реакции, при протекании которых может выделиться водород.
- Ag + HCl →
- Fe + CuSO4 →
- Al + NaOH(водн. р-р) →
- P + HNO3(конц.) →
- C + H2O →
Запишите в поле ответа номера выбранных реакций.
Водород будет восстанавливаться из соединений, в которых он имеет степень окисления +1, некоторыми сильными восстановителями.
1) Водород из кислот могут вытеснять металлы, расположенные в ряду активности левее $H_2$, или, другими словами, катион $H^+$ окисляет более активные металлы. Проверяем по ряду активности: … $H_2$ … Ag … .
Вывод: Ag + HCl ≠, водород не выделяется.
2) Так как железо более активный металл, чем медь (в ряду активности …Fe …$H_2$ …Cu), то реакция возможна: $Fe + CuSO_4 = FeSO_4 + Cu$
Вывод: водород не выделяется.
3) Алюминий — активный металл и способен восстанавливать катионы водорода $H^+$.
На воздухе алюминий покрыт защитной пассивирующей оксидной плёнкой, которая растворяется в щелочах ($Al_2O_3$ и $Al(OH)_3$ — амфотерные вещества). Поэтому реакция протекает: $2Al + 2NaOH + 6H_2O = 2Na[Al(OH)_4] + 3H_2↑$
Вывод: водород выделяется.
4) Азотная кислота $HNO_3$ проявляет окислительные свойства не за счёт катиона водорода $H^+$, а за счёт $N^<+5>$, и продукты восстановления (в зависимости от условий реакции и восстановителя) — соединения азота в более низких степенях окисления — $N^<+4>O_2, N^<+2>O, N_2^<+1>O, N_2^<0>$ или даже $N^<–3>H_4NO_3$.
$P + 5HNO_3 = H_3PO_4 + 5NO_2 + H_2O$
Вывод: водород не выделяется.
5) Взаимодействие раскалённого угля с водяным паром — способ получения смеси угарного газа и водорода: $C + H_2O → CO + H_2$
Вывод: водород выделяется.
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
- оксид цинка
- азот
- гидроксид алюминия
- азотная кислота (разб.)
Запишите в поле ответа номера выбранных веществ.
Кислота и гидроксид не реагируют с водородом потому, что в них уже присутствует водород. С оксидом серы водород не реагирует. Водород восстанавливает металлы из их оксидов (кроме активных) и реагирует с простыми веществами.
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует хлор.
- O2
- N2
- P
- H2SO4
- NaOH (р-р)
Запишите в поле ответа номера выбранных веществ.
Хлор может реагировать со слабыми кислотами, с щелочами, с металлами и с неметаллами, кроме углерода, азота, кислорода и инертных газов. Есть щелочь, фосфор и кислота, но серная кислота сильная, поэтому реакция не протекает.
Из предложенного перечня выберите два вещества, которые преимущественно образуются при взаимодействии оксида железа(II) с концентрированной азотной кислотой.
Запишите в поле ответа номера выбранных веществ.
Железо является металлом средней активности, поэтому его оксид при взаимодействии с $HNO_3$ дает $NO$, так как не может дальше окислить азот, а из оксидов металлов получаются нитраты, но не в той же степени окисления, а в более высокой из-за того, что это ОВР.
Из предложенного перечня выберите две пары веществ, которые могут реагировать друг с другом.
- FeO и CuO
- FeO и Pb
- FeO и H2O
- FeO и O2
- FeO и H2
Запишите в поле ответа номера выбранных пар веществ.
Два основных оксида реагировать не могут, свинец никак не может реагировать с оксидом железа, а с водой оксид железа не реагирует, так как он амфотерный.
Читайте также:

