Валентность титана с хлором
Общие сведения о валентности титана
В Виде простого вещества титан представляет собой серебристо-белый металл. Относится к легким металлам. Тугоплавок. Плотность – 4,50 г/см 3 . Температуры плавления и кипения равны 1668 o С и 3330 o С, соответственно.
Титан коррозионно-устойчив при на воздухе при обычной температуре, что объясняется наличием на его поверхности защитной пленки состава TiO2. Химически устойчив во многих агрессивных средах (растворы сульфатов, хлоридов, морской воды и т.д.).
Валентность титана в соединениях
Титан находится в четвертом периоде в IVB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 22. В ядре атома титана содержится 22 протона и 26 нейтронов (массовое число равно 48). В атоме титана есть четыре энергетических уровня, на которых находятся 22 электрона (рис. 1).

Рис. 1. Строения атома титана.
Электронная формула атома титана в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
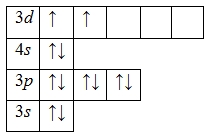
Наличие двух неспаренных электронов свидетельствует о том, что титан в своих соединениях может проявлять валентность II (Ti II O).
Атом титана способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 3d-подуровня:
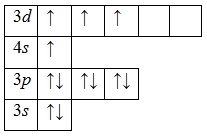
Наличие четырех неспаренных электронов свидетельствует о том, что титан также проявляет валентность IV в своих соединениях (Ti IV O2, Ti IV F4).
Известно, что у титана есть валентность III (Ti III 2O3, Ti III Cl3).
Примеры решения задач
| Задание | Рассчитайте массу титана, полученного термическим разложением йодида титана (IV)TiI4, на образование которого затрачен йод массой 10,16 г. |
| Решение | Запишем уравнение реакции термического разложения йодида титана (IV): |
Найдем количество вещества йода, вступившего в реакцию (молярная масса – 254 г/моль):
n (I2) = 10,16 / 254 = 0,04 моль.
Согласно уравнению реакции n(Ti) :n(I2) = 1:2, значит,
n(Ti) = ½ ×n (I2) = ½ ×0,04 = 0,02 моль.
Тогда, масса титана будет равна (молярная масса – 48 г/моль):
m (Ti) = n (Ti) × M (Ti);
m (Ti) = 0,02 × 48 = 0,96 г.
TiCl4 + 2Mg = Ti + 2MgCl2 =477 кДж.
TiCl4 + 2Mg = Ti + 2MgCl2 =477 кДж.
Согласно уравнению реакции, в неё вступили 1 моль хлорида титана (IV) и 2 моль магния. Рассчитаем массу хлорида титана (IV) по уравнению, т.е. теоретическую массу (молярная масса – 190 г/моль):
mtheor (TiCl4) = 1 × 190 = 190 г.
Тогда, количество теплоты, выделяющейся при восстановлении хлорида титана (IV) магнием равно:
Qprac = 477 × 47,5/ 190 = 119,25 кДж.
Титан в таблице менделеева занимает 22 место, в 4 периоде.
| Символ | Ti |
| Номер | 22 |
| Атомный вес | 47.8670000 |
| Латинское название | Titanium |
| Русское название | Титан |
Электронная схема титана
Ti: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Короткая запись:
Ti: [Ar]4s 2 3d 2
Одинаковую электронную конфигурацию имеют атом титана и V +1 , Mn +3 , Fe +4 , Co +5 , Ni +6
Порядок заполнения оболочек атома титана (Ti) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Титан имеет 22 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
2 электрона на 3d-подуровне
Степень окисления титана
Атомы титана в соединениях имеют степени окисления 4, 3, 2, 0, -1, -2.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы титана
Валентность Ti
Атомы титана в соединениях проявляют валентность IV, III, II.
Валентность титана характеризует способность атома Ti к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ti
Квантовые числа определяются последним электроном в конфигурации, для атома Ti эти числа имеют значение N = 3, L = 2, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам .
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.

Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):

Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Например , высшая валентность хлора равна VII, низшая валентность хлора равна I, промежуточные валентности — III, V.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
Например , валентность (число связей) атома кислорода в молекуле O2 равна II, а вот степень окисления атома кислорода равна 0.

Большинство элементов проявляют переменную валентность в соединениях, но некоторые элементы проявляют постоянную валентность . Их необходимо запомнить:
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |

Как определить валентность атома в соединении?
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s 2 2s 1 .
+3Li 1s 2 
2s 1 
Следовательно, литий может образовывать одну связь и валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s 2 2s 2 .
+4Be 1s 2 
2s 2 
В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s 2 2s 1 2p 1 .
+4Be * 1s 2 
2s 1 
2p 1 
Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две ваканнтные электронные орбитила. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Например , в хлориде бериллия валентность бериллия равна II:

Однако, на внешнем энергетическом уровне атома бериллия остаются еще 2 вакантные энергетические орбитали. Следовательно, бериллий может образовывать еще связи по донорно-акцепторному механизму, выступая в качестве акцептора двух электронных пар. Таким образом, максимальная валентность бериллия равна IV.
Например , соединения бериллия растворяются в избытке щелочи с образованием гидроксокомплекса – тетрагидроксобериллата натрия Na2[Be(OH)4]. Валентность бериллия в этом соединении равна IV. Связи между центральным атомов бериллия и гидроксид-ионами образованы по донорно-акцепторному механизму.
Ээлектронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 
2s 2 
2p 1 
В возбужденном состоянии: +5B * 1s 2 2s 1 2p 2 .
+5B 1s 2 
2s 1 
2p 2
Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Например , в трихлориде бора BCl3 валентность бора равна III.

Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары, и образует еще одну связь по донорно-акцепторному механизму.
Таким образом, бор может проявлять валентность IV.
и еще 1 связь за счет вакантной орбитали на p-подуровне по донорно-акцепторному механизму. Максимальная валентность бора равна IV. Однако чаще мы встречаем валентность бора III. Таким образом, простейший анализ строения внешнего энергетического уровня позволяет определить валентные возможности атома.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s 2 2s 1 2p 3 , следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может проявлять валентность III (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s 2 2s 2 2p 3 . За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность атома азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Хлори́д тита́на(IV) (тетрахлори́д титана, четырёххло́ристый тита́н) — бинарное соединение титана и хлора с формулой TiCl4. При нормальных условиях - бесцветная подвижная прозрачная ядовитая жидкость, дымящая на воздухе.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Токсичность
- 6 Примечания
- 7 Литература
Физические свойства
- Температура кипения: 136,4 °C [1]
- Температура плавления: −24,1 °C
- Относительная плотность (вода = 1): 1,7
- Растворимость в воде — реагирует
- Давление паров, кПа при 21,3 °C: 1,3
- Относительная плотность пара (воздух = 1): 6,5
- Критическая температура 365 °C, критическое давление 5,01 МПа
Химические свойства
Гидролизуется водой и водяным паром с выделением хлористого водорода и образованием оксидов и оксихлоридов титана. На этой реакции основано применение хлорида титана(IV) на флоте в качестве образователя дымовой завесы. Способен присоединять NH3, ароматические соединения, простые эфиры.
Выше 500—600 °C окисляется О2 воздуха до ТiO2, в присутствии паров воды образуются также оксихлориды TiOCl2, Ti2O3Cl2.
Бурно реагирует с водой с получением ТiO2· n Н2О, в качестве промежуточных продуктов образуются гидрат TiCl4·5H2O и гидроксохлориды Ti(OH) n Cl4− n · x H2O. Растворим в этаноле и диэтиловом эфире.
При очень медленном добавлении воды с тщательным перемешиванием и охлаждением можно получить устойчивые концентрированные растворы TiCl4.
С парами воды при 300—400 °C даёт ТiO2.
В TiCl4 растворим хлор Сl2 (7,6 % по массе при 20 °C), незначительно растворим хлороводород НСl.
Смешивается во всех соотношениях с жидким НСl, а также с хлоридами Sn, С, Si.
Растворим в соляной кислоте при пропускании газообразного НСl с получением ярко-жёлтого раствора гексахлортитановой кислоты (H2TiCl6).
Получение
Тетрахлорид титана можно получить взаимодействием диоксида титана с хлором в присутствии восстановителя (углерода):
T i O 2 + 2 C l 2 + C → T i C l 4 + C O 2 <\displaystyle <\mathsf
Для получения TiCl4 высокой чистоты используют ректификацию и адсорбцию примесей на силикагеле.
В промышленности хлорид титана(IV) производится в процессе хлорирования, который предусматривает обработку титановой руды хлором. Реакция ильменита (FeTiO3) с хлором и углеродом (в виде кокса) происходит при температуре 900 °C:
2 F e T i O 3 + 7 C l 2 + 6 C ⟶ 2 T i C l 4 + 2 F e C l 3 + 6 C O <\displaystyle <\mathsf <2FeTiO_<3>+7Cl_<2>+6C\longrightarrow 2TiCl_<4>+2FeCl_<3>+6CO>>>
После хлорирования полученный тетрахлорид титана очищают фильтрованием, гидролизом с помощью увлажнённого NaCl (удаление As), восстановлением медью, алюминием или сероводородом H2S (удаление ванадия, серы, хрома, органики), дистилляцией и ректификацией.
Применение
Используют TiCl4 для получения титана, оксида TiO2, катализаторов (для полимеризации этилена и пропилена, для алкилирования ароматических углеводородов и др.) и как дымообразователь.
- в производстве губчатого титана;
- в производстве пигмента — титановых белил;
- в качестве катализатора в химической промышленности (см. Катализаторы Циглера — Натта).
Токсичность
Тетрахлорид титана токсичен при вдыхании паров и воздействии на кожу, поражает слизистые оболочки рта и верхних дыхательных путей, а также роговицы глаз. Вызывает ожоги кожи и бронхит. ПДК паров 1 мг/м 3 .
Примечания
- ↑ 12Rocket NXT
Литература
- Фёдоров П. И.Титана хлориды // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М. : Большая Российская энциклопедия, 1995. — Т. 4: Пол—Три. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Борид титана(II) (TiB2)
- Бромид титана(II) (TiBr2)
- Бромид титана(III) (TiBr3)
- Бромид титана(IV) (TiBr4)
- Гидрид титана(II) (TiH2)
- Гидрид титана(IV) (TiH4)
- Гидроксид титана(II) (Ti(OH)2)
- Гидроксид титана(III) (Ti(OH)3)
- Дигидроксид-оксид титана (TiO (OH)2)
- Дисилицид титана (TiSi2)
- Иодид титана(II) (TiI2)
- Иодид титана(III) (TiI3)
- Иодид титана(IV) (TiI4)
- Карбид титана (TiC)
- Нитрид титана (TiN)
- Оксид-сульфат титана (TiOSO4)
- Оксид титана(II) (TiO)
- Оксид титана(III) (Ti2O3)
- Оксид титана(IV) (TiO2)
- Сульфат титана(III) (Ti2(SO4)3)
- Сульфат титана(IV) (Ti(SO4)2)
- Сульфид титана(II) (TiS)
- Сульфид титана(III) (Ti2S3)
- Сульфид титана(IV) (TiS2)
- Титанат бария (BaTiO3)
- Титанат кальция (CaTiO3)
- Титанат свинца (PbTiO3)
- Титанат стронция (SrTiO3)
- Титанаты
- Титановая кислота (H4TiO4)
- Фосфид титана(III) (TiP)
- Фторид титана(II) (TiF2)
- Фторид титана(III) (TiF3)
- Фторид титана(IV) (TiF4)
- Хлорид титана(II) (TiCl2)
- Хлорид титана(III) (TiCl3)
- Хлорид титана(IV) (TiCl4)
- Цирконат-титанат свинца (Pb(ZrxTi1−x)O3)
Что такое wiki.moda Вики является главным информационным ресурсом в интернете. Она открыта для любого пользователя. Вики это библиотека, которая является общественной и многоязычной.
Основа этой страницы находится в Википедии. Текст доступен по лицензии CC BY-SA 3.0 Unported License.
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | PH3, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | H2S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | CaH2 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, TiH4 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, H3AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | H2SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, SbH3 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | TeH2, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | LaH3 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, PbH4 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).
- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4+, азотная кислота и д.р).
Читайте также:


