Вайдаза при остром лейкозе

Онкологическое заболевание, которое провоцирует костный мозг вырабатывать измененные незрелые клетки (миелобласты), именуется острым миелоидным лейкозом (ОМЛ). При этом заболевании осуществляются нарушения во всем организме человека, так как производство нормальных здоровых клеток резко уменьшается.
ОМЛ имеет отношение к тем, которые быстро распространяются по организму и воздействует на неправильную работу многих органов. Именно поэтому при остром миелоидном лейкозе необходимо оперативно и как можно быстрее начать назначенное врачом лечение.
ОМЛ делится еще на несколько видов. Отличие между ними составляет то, сколько и какие именно измененные клетки крови, выявленные на момент установки диагноза, были зафиксированы в организме человека.
Острый промиелоцитарный лейкоз является одним из подвидов данного заболевания крови. Причиной болезни чаще всего становится соединение участков одного гена с участком другого гена.
В зрелом возрасте человек придается такой вредной привычке, как курение. Именно она способна увеличить риск заболевания наравне с лечением химиотерапией, а также радиоактивным облучением. Следует также учесть тот факт, что мужчины болеют намного чаще, нежели женщины.
Признаки острого миелоидного лейкоза у взрослых на раннем этапе иногда невозможно отличить от признаков других заболеваний, поэтому нужно периодически проверяться у врача, проходить обследования для своей же безопасности.
Симптомы болезни таковы:
- Повышенная температура;
- Утрата аппетита;
- Маленькие кровотечения, чаще всего капиллярные;
- Слабость, сильная утомляемость;
- Нехватка воздуха;
- Быстрая потеря веса.
Чаще всего диагноз данного заболевания ставится после получения результатов анализов костного мозга и крови.
Хронический миелоидный лейкоз
Одним из самых распространенных видов лейкоза, что существует на планете, является именно хронический миелоидный лейкоз. В процентном соотношении на него приходится 20% случаев заболеваний крови у взрослых и около 5% у детей. Частота заболеваемости, как и при остром миелоидном лейкозе, возрастает с тем, сколько времени человек живет на земле. Среди юных людей болезнь не слишком-то распространена.
Хронический миелоидный лейкоз (ХМЛ) — миелопролиферативная хроническая болезнь. Характеризуется она повышенным образованием гранулоцитов, которые и есть предшественниками опухоли.
Чаще всего исходом данной болезни становится бластный криз. Он проявляется появлением многочисленных бластных клеток, и если не прибегнуть к помощи врача вовремя, приводит к смерти человека.
Признаки заболевания несколько разнятся с теми, которые возникают при острых лейкозах. ХМЛ в скорости развития дает фору острому миелоидному лейкозу и виртуально делится на четыре стадии, среди которых: доклиническая, хроническая, прогрессирующая и бластный криз.

Как и при ОМЛ на начальном этапе на заболевание можно едва ли обратить внимание, поэтому хронический миелолейкоз может быть обнаружен слишком поздно для медицинского вмешательства.
Самой тяжелой из четырех фаз является, конечно же, завершающая. Именно тогда у больного поднимается температура, иногда замечаются боли в костях, кровотечения как маленькие, так и масштабные. Редким случаем является разрыв селезенки. Главной характеристикой при заболевании является изменения в составе крови человека, а поэтому существует вероятность выявления болезни на первом ее этапе. Именно поэтому каждый из нас, особенно в зрелом возрасте, должен периодически сдавать кровь на анализы.
Прогноз же зависит в большей степени от возраста больного, как было уже описано ранее. Но не только он способен повлиять на выживание человека при подобном заболевании. Также к факторам можно отнести количество измененных клеток, ответ организма на лекарства и терапию и многое другое.
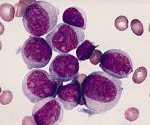
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
- Причины острого миелоидного лейкоза
- Классификация острого миелоидного лейкоза
- Симптомы острого миелоидного лейкоза
- Диагностика и лечение острого миелоидного лейкоза
- Прогноз острого миелоидного лейкоза
- Цены на лечение
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.

Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Исследование фазы 1b было опубликовано онлайн 12 января в онкологии Ланцет.
Исследование проводилось у 57 пожилых пациентов с ОМЛ, средний возраст 75 лет, для которых интенсивная химиотерапия не была вариантом.
Результаты показывают, что 61% пациентов достигли полной ремиссии (CR) или полной ремиссии с неполным восстановлением костного мозга (CRi). Девять из этих пациентов продолжали получать аллогенные трансплантации стволовых клеток, находясь в состоянии ремиссии, что указывает на то, что Венетоклакс с децитабином или азацитином может стать мостиком для целебной стратегии.
Д-р Müller-Tidow и Dr Schlenk также дают некоторые сведения о том, почему это исследование заслуживает внимания. Они указывают на то, что в отличие от других гематологических злокачественных новообразований для пациентов с ОМЛ не доступны новые варианты лечения для улучшения выживаемости и надежды на лечение.
Исследование было проведено у недавно диагностированных пациентов с гистологически подтвержденным острым миелоидным лейкозом, возраст которых составлял 65 лет и старше, имел прогнозируемую продолжительность жизни по меньшей мере 12 недель и не соответствовал стандартной индукционной химиотерапии, как определено исследователем.
Пациенты с цитогенетикой с благоприятным риском или активным участием центральной нервной системы были исключены.
Исследование включало фазу эскалации дозы и включало три группы (от A до C) пациентов - каждая группа с четырьмя когортами по меньшей мере трех пациентов в каждом. Пероральное введение venetoclax началось на 2-й день, с обязательным ежедневным скачком в дозе . В когортах с 1 по 4 в течение 20 дней вводили venetoclax в дозе 20 мг, 50 мг, 100 мг и 100 мг, чтобы достичь конечной дозы 400 мг, 800 мг, 800 мг и 1200 мг на 6-й день. Конечная доза была предоставлена для остальной части 28-дневного цикла.
В группе А децитабин 20 мг / м 2 вводили внутривенно в дни от 1 до 5 каждого цикла. В группе B азацитидин 75 мг / м 2 вводили внутривенно или подкожно в дни от 1 до 7 каждого цикла. Лечение продолжалось до прогрессирования заболевания или возникновения невыносимых побочных эффектов.
Пациенты группы С были зачислены на исследование взаимодействия препаратов, подробности которого уже опубликованы (Clin Ther. 2017, 39: 359-367). В этой группе в исследовании оценивалась комбинация венетоклакса плюс позаконазола, противогрибкового агента и децитабина.
Все пациенты получали профилактику против синдрома лизиса опухоли, начиная с 72 часов до введения. Синдром лизиса опухоли контролировали до дозирования и через 6 часов и 12 часов после дозирования для каждой эскалации дозы и через 24, 48 и 72 часа после введения максимальной дозы венециклакса. Все пациенты также принимали меры по оказанию поддержки и получали профилактические неазольные противогрибковые средства в соответствии с протоколом .
Первичные конечные точки были безопасностью, фармакокинетикой и определяли дозу venetoclax фазы 2.
Из 57 пациентов, включенных, 45 были в группах A (n = 23) и B (n = 22). Двенадцать пациентов были в группе C.
Медианное наблюдение за общей пробной популяцией составляло 12,4 месяца. Средний возраст составил 75 лет, у 21 (37%) пациентов была цитогенетика с низким риском, а у 8 (14%) было антецедентное гематологическое расстройство.
По данным авторов, Venetoclax хорошо переносится у этой пожилой популяции больных ОМЛ с низкой ранней смертностью. Пациенты в группах А и В имели сходные профили безопасности.
30-дневная и 60-дневная смертность составляли 7% и 16% соответственно и были связаны с такими причинами, как сепсис, бактериемия, инфекция легких и респираторная недостаточность. По словам доктора Поллии и его коллег, эти показатели ниже, чем можно было ожидать в популяции, сопоставимой с возрастом, которая получает интенсивную терапию и аналогична тем, которые наблюдаются при монотерапии децитабином или азацитидином.
Тромбоцитопения (47%), фебрильная нейтропения (42%) и нейтропения (40%) были наиболее распространенными побочными явлениями 3/4 степени, которые были связаны с прерыванием дозы у 51% пациентов. Снижение дозы Venetoclax, также из-за побочных эффектов, вызванных лечением, было зарегистрировано у 17%, 14% и 8% пациентов в группах A, B и C соответственно.
Желудочно-кишечные расстройства уровня 2 и цитопения были наиболее распространенными побочными явлениями, возникающими во всех группах. Следует отметить, что в когортах пациентов, принимавших 1200 мг венетоклакса, наблюдались частые желудочно-кишечные расстройства, включая тошноту (82%), диарею (64%), запор (55%) и рвоту (45%), которые ограничивали непрерывное дозирование и приводили к снижению дозы вплоть до прерывания.
В этом исследовании не наблюдалось никаких лабораторных или клинических событий синдрома лизиса опухоли, таких как те, которые были связаны с венотоклаксом при хроническом лимфоцитарном лейкозе. Этот потенциальный риск был смягчен требованием, чтобы все пациенты имели количество белых клеток 25 × 10 9 / л. Кроме того, не сообщалось о дозирующих токсичность. Несмотря на то, что максимальная переносимая доза не была достигнута, опыт применения дозы 1200 мг приводил к тому, что в качестве дозы фазы 2 рекомендовал венероклаксом 800 мг.
Исследование взаимодействия лекарственного препарата показало, что одновременное использование venetoclax (субстрат CYP3A) и posaconazole (сильный ингибитор CYP3A) увеличивало максимальную концентрацию плазмы венозно-кликса примерно в семь раз. Следовательно, у пациентов, получающих профилактику с позаконазолом, дозу венециклакса необходимо уменьшить примерно на 75%, отмечают авторы.
Тем не менее, пациенты в группах А и В не получали противогрибковые азолы, но альтернативные противогрибковые препараты, которые не являются ингибиторами CYP3A, а также эффективны.
Конечные точки клинической эффективности были одинаковыми во всех группах. Показатели CR и CRi составляли 61% для группы A, 59% для группы B и 67% для группы C. Среднее время для CR / CRi составляло 1,0, 1,2 и 0,9 месяца для групп A, B и C соответственно.
Аналогичные показатели были зарегистрированы для пациентов с ОМЛ, у которых были промежуточные группы риска (66%) и бедные (52%) цитогенетики. Ответы также были представлены пациентам.
Выживание не оценивалось отдельно для группы C. Средняя выживаемость медианных составила 12,3 месяца для всех пациентов, 15,2 месяца для групп A и B, 15,2 месяца для группы A и 14,2 месяца для группы B.
Это первое исследование для оценки эффективности и безопасности venetoclax в сочетании с децитабином или азацитидином у пожилых пациентов с недавно диагностированным острым миелоидным лейкозом. Исследование продолжается с фазой расширения, поэтому большее число пациентов будут лечиться этими комбинациями Венетоклакса.
Тем не менее, д-р Müller-Tidow и Dr Schlenk отмечают, что venetoclax также оценивается с другими препаратами для ОМЛ, такими как цитарабин.
13 марта 2020 г. 9:07
Пациенты с раком имеют подавленную иммунную систему и более восприимчивы к инфекциям.
12 марта 2020 г. 8:26
Исследователи представили структуру и механизм белков, которые экспрессируются при различных формах рака и связаны с плохим прогнозом пациента.
9 марта 2020 г. 12:07
В низких дозах тетродотоксин заменяет опиоиды для облегчения боли, связанной с раком.
5 марта 2020 г. 14:24
Новый метод картирования сил, которые кластеры клеток оказывают на микроокружение, может помочь в изучении развития тканей и метастазирования рака.
Лейкемия означает рак белых клеток крови (лейкоцитов). Большинство типов этого заболевания вызывают синтез аномальных лейкоцитов в костном мозге. Они могут попасть в кровоток и распространиться по всему телу. Поскольку эти клетки не работают полноценно, то не способны защитить организм от инфекций и бактерий.
Лейкоз разделяют на две основные группы – острый (очень быстро развивается болезнь) и хронический (отмечаются медленные темпы, на протяжении нескольких месяцев или лет, в основном бессимптомно).
Острый лимфобластный лейкоз (лимфоцитарный, лимфолейоз, ОЛЛ) поражает незрелые лимфоидные клетки, быстро прогрессирует. При отсутствии необходимой терапии завершается летальным исходом.
Симптомы острого лимфобластного лейкоза
Основная задача лейкоцитов – бороться с инфекций. Поскольку аномальные клетки не способны полноценно работать, возрастает риск инфекции, которая тяжело поддается лечению.
Избыточное количество лимфоцитов переполняет костный мозг, не хватает места для других типов клеток крови. Возникает недостаток эритроцитов и тромбоцитов. Дефицит эритроцитов провоцирует анемию, тромбоцитов - проблемы со свертываемостью крови.
Из-за увеличивающегося количества лейкоциты начинают накапливаться в селезенке, костном мозге, лимфоузлах, вызывая отек. Иногда это происходит в печени, спинном или головном мозге, у мужчин – в яичках.
Разница между острым лимфобластным лейкозом и лимфомой
Острый лимфолейкоз развивается в костном мозге, а потом проникает в другие части тела; лимфома – в лимфоузлах и иных органах, а затем может поразить костный мозг.
Если аномальные лимфоциты есть и в костном мозге, и в лимфатической системе, иногда трудно сказать, лейкоз это или лимфома.
Многие симптомы острого лимфобластного лейкоза у взрослых являются расплывчатыми. Состояние напоминает грипп. Возможные признаки:
- Общая слабость.
- Усталость.
- Высокая температура.
- Потеря веса.
- Частные инфекции.
- Легко возникающие ушибы, без какой-либо очевидной причины.
- Кровотечение из десен и носа.
- Кровь в моче и стуле.
- Боли в костях и суставах.
- Одышка.
- Увеличение лимфатических узлов.
- Ощущение переполненности и дискомфорта в области живота из-за опухшей печени или селезенки.
Эти симптомы возникают вследствие избытка аномальных лейкоцитов и недостатка здоровых лейкоцитов, эритроцитов и тромбоцитов.
Отмечаются трудности у организма человека с ОЛЛ, справиться с инфекцией, поскольку нет достаточного количества белых клеток крови для борьбы с бактериями или вирусами.
Скопление лейкозных клеток происходит в лимфоузлах, суставах и костях, провоцируя боль и отек.
Дефицит тромбоцитов приводит к проблемам со свертываемостью крови, недостаток эритроцитов – к анемии.
Симптомы Т-клеточного лейкоза
Данный тип лейкемии может вызывать опухание лимфоузлов в центре грудной клетки и вилочковой железы. Они оказывают давление на трахею, провоцируя одышку и кашель. Помимо этого, возможно давление на вены, по которым проходит кровь от головы. Это становится причиной давления в кровеносных сосудах; лицо, шея и руки опухают и приобретают красный цвет. Такое состояние носит название обструкция верхней полой вены.
Причины острого лимфобластного лейкоза (ОЛЛ)
Данное заболевание реже возникает у взрослых, однако, это наиболее распространенный тип лейкемии у детей. Чаще болезнь диагностируют у мужчин, чем у женщин.
Исследования обозначают следующие факторы риска:
- Радиационное облучение. Давно известно, что высокие дозы радиации увеличивают риск острого лимфоцитарного лейкоза. Существует ряд доказательств, что проведение рентгена во время беременности повышает вероятность лейкемии у ребенка в детском возрасте.
- Воздействие бензола. Взаимодействие с этим химическим веществом возможно в таких отраслях промышленности, как химическая, фармацевтическая, полиграфическая; по производству резины, обуви, бензина. Чем выше уровень воздействия в течение многих лет, тем больше риск. Бензол также содержится в сигаретном дыме.
- Курение и потребление кофе. Обзор исследований (мета-анализ) в 2009 году показал, что курение родителей в доме повышает риск ОЛЛ у детей. Это включает курение отца до зачатия ребенка. Данные французского исследования (ESCALE) 2013 года показали, что потребление более 2 чашек кофе в день во время беременности незначительно увеличивает вероятность возникновения ОЛЛ у ребенка в детском возрасте. Однако требуются дополнительные исследования.
- Генетика. Некоторые редкие наследственные заболевания повышают риск острого лимфобластного лейкоза: синдром Дауна, анемия Фанкони, атаксия телеангиоэктазия. Также в качестве возможной причины лимфоцитарного лейкоза называют химиотерапию. Лечение такими химиопрепаратами, как этопозид, митоксантрон, амсакрин и идарубицин – увеличивает вероятность ОЛЛ спустя много лет.
- Вирусы. Т-лимфотропный вирус человека повышает риск редкого типа лейкоза Т-клеток.
- Электромагнитные поля. Некоторые исследования говорят, что воздействие очень высоких уровней электропередач увеличивает вероятность лейкемии у детей, однако их результаты недостаточно ясны.
- Избыточный вес. Некоторые исследования отмечают, что у людей с ожирением наблюдается повышенный риск лейкемии.
- Воздействие краски в качестве возможного фактора риска отметило одно из исследований. Однако требуется дальнейшее изучение данного вопроса.
- Ослабленный иммунитет. Увеличение вероятности развития лимфоцитарного лейкоза вдвое или втрое отмечается у людей с ВИЧ (СПИД) и у тех, кто перенес трансплантацию органов.
Факторы, снижающие риск лейкемии:
- Грудное вскармливание.
- Воздействие инфекций в детстве. Сниженная вероятность ОЛЛ отмечается у детей, которые ходили в ясли или с раннего возраста были под присмотром няни.
Врачи подразделяют острый лейкоз на миелоидный и лимфобластный. Но миелоидный и лимфобластный разделяют также на более мелкие группы (подтипы). Идентификация лейкоза помогает врачу правильно спланировать лечение в Ассуте.
Израильские врачи используют систему классификации ВОЗ. Она основана на типе лимфоцита, который стал злокачественным. Выделяют три подтипа:
- Пре-В-клеточный – наиболее распространённый тип лейкоза у взрослых.
- Зрелый В-клеточный – идентифицируется в связи с конкретными генетическими нарушениями. Также его называют тип Беркитта, поскольку он похож на другой вид рака – лимфому Беркитта.
- Пре-Т-клеточный – чаще всего развивается у молодых взрослых, в большинстве случаев – у мужчин.
Более редко применяется французско-американо-британская классификация, которая подразделяют ОЛЛ на три типа:
- L1 – лимфоциты выглядят как зрелые.
- L3 – лимфоциты являются незрелыми и выглядят аномальными.
- L2 – средний показатель между L1 и L3, наиболее распространенный тип у взрослых.
Лейкозные клетки изучают под микроскопом, чтобы идентифицировать и соотнести с каким-либо подтипом. Кроме того, проводится исследование белков (маркеры антител) в аномальных клетках, изменения в хромосомах злокачественных клетках (цитогенетика).
Смешанный тип лейкемии
Иногда лейкоз оказывается сочетанием ОЛЛ и острой миелоидной лейкемии (ОМЛ). Аномальные клетки обладают белками (маркерами) от обоих типов. Это острая бифенотипическая лейкемия. Бифенотипический означает оба типа.
Диагностика острого лимфобластного лейкоза у взрослых в клинике Ассута
С пациентом работает гематолог, возможно проведение нижеперечисленных видов тестов.
Могут быть выполнены:
- полный анализ крови (FBC), в процессе которого исследуются различные типы клеток;
- анализы крови, чтобы выяснить, насколько хорошо работает печень или почки;
- если присутствует инфекция, выполняются тесты для ее определения и назначения типа антибиотика.
Исследование костного мозга
Костный мозг синтезирует клетки крови. Врач может взять образец органа, чтобы проверить на наличие признаков лейкоза и других заболеваний. Есть два типа диагностики острого лимфобластного лейкоза – аспирация костного мозга и биопсия или трепанобиопсия.
При аспирации врач берет пробу жидкости костного мозга из кости бедра. Больному предварительно делают инъекцию локального анестетика.
В процессе биопсии врач используют иглу большего размера, чтобы удалить небольшое количество кости и костного мозга. Обычно эти две процедуры проводят одновременно.
В дополнении гематолог может проверить, есть ли изменения в хромосомах лейкозных клеток. Такие тесты называются цитогенетическими. Проводится анализ на наличие конкретных белков, которые производят определенные типы лейкозных клеток. Этот тест называют иммунофенотипированием.
В ряде случаев заболевания у людей с острым лимфолейкозом в лейкозных клетках есть мутация под названием филадельфийская хромосома. Она образуется, когда ген ABL на 9 хромосоме отрывается и присоединяется к гену BCR на 22 хромосоме, что приводит к созданию нового гена - BCR-ABL. Это провоцирует синтез избыточного количества белка – тирозинкиназы, стимулирующей рост и деление лейкозных клеток.
Этот тест помогает выявить мутации в генах клеток и правильно подобрать лечение.
Пункция необходима, чтобы выяснить, есть ли аномальные клетки в ликворе (жидкости вокруг мозга и позвоночника). С помощью иглы, введенной в позвоночник, врач собирает небольшое количество ликвора.
Рентген грудной клетки
Данный тест проводится, чтобы проверить общее состояние здоровья. При остром лимфолейкозе иногда возникают опухоли из лейкозных клеток в центре грудной клетки, в области вокруг сердца (зона средостения).
КТ выполняют, чтобы выявить конкретные признаки лимфоцитарного лейкоза или изучить общее состояние здоровья.
На протяжении всего курса лечения в Израиле и последующего наблюдения будет проводиться диагностика костного мозга. Это может помочь:
- В первую очередь, определить правильный тип лейкоза.
- Узнать, как лейкемия реагирует на лечение.
- Проверить лейкозные клетки после окончания терапии. Оценить минимальную остаточную болезнь.
Могут быть выполнены следующие виды обследований:
- КТ проводится с целью визуализировать увеличенные лимфатические узлы или иные аномалии в органах тела.
- МРТ отображает подробную картину тела, более четко, чем КТ, визуализирует мягкие ткани.
- УЗИ выполняется, чтобы проверить, есть ли острый лимфолейкоз в селезенке или в яичках (у мужчин).
- Тканевое типирование проводится, если врач рассматривает пересадку стволовых клеток в качестве подходящего лечения. Это специальный анализ крови, который покажет, насколько ткань костного мозга возможного донора совпадает с тканью пациента. Лейкоциты на своей поверхности имеют белки - HLA маркеры. Если клетки костного мозга пациента и донора имеют очень похожие HLA маркеры, больше шансов, что иммунная система пациента не отвергнет донорский орган.
Обнаружение лейкозных клеток после лечения
Часто после химиотерапии кажется, что пациент излечился. В крови и образцах костного мозга не находят аномальных клеток, такое состояние означает ремиссию. Но лейкозные клетки могут сохраниться. Тест на минимальную остаточную болезнь поможет убедиться, присутствует ли болезнь.
Есть два способа. Один – полимеразная цепная реакция (ПЦР) – ищет генетические изменения в клетках. С его помощью можно найти одну лейкозную клетку среди миллионов здоровых. Другой тест – иммунофенотипирование – проверяет белки, созданные аномальными клетками. Таким образом, эти тесты определят эффективность химиотерапии и вероятность рецидива.
Выживаемость при остром лимфобластном лейкозе
Лечащий врач может дать самую полную информацию о прогнозе для конкретного пациента. Приведенная здесь статистика предоставлена для общего ознакомления. Термины 5-летняя и 10-летняя выживаемость при остром лимфобластном лейкозе означает число людей, участвовавших в испытаниях, которые были живы спустя 5 или 10 лет после диагностики и проведенной терапии.
Успешность лечения рака обусловлена рядом факторов:
- Типом лейкемии.
- Развитием болезни.
- Ответом на лечение цитостатическими препаратами.
Более 8 из 10 человек достигают ремиссии. Если наблюдаются рецидивы, иногда возможно достижение второй ремиссии с помощью цитостатического лечения.
Перспективы при остром лимфобластном лейкозе
Возраст очень влияет на исход. Отчасти это связано с тем, что люди молодого возраста лучше справляются с очень интенсивной терапией.
В среднем для всех возрастных групп для 70% человек отмечают выживаемость 5 лет и более после постановки диагноза. Далее выживаемость 5 лет и более обозначают:
- Для 90% пациентов в возрасте 14 лет и младше.
- Для 66% человек в возрасте 15-24 года.
- Для 40 % - в возрасте 25-64 года.
- Для 15% - в возрасте 65 лет и старше.
- Возраст.
- Пол (у женщин прогноз лучше, чем у мужчин).
- Количество лейкоцитов (если высокое, прогноз хуже).
- Конкретный тип лейкоцитов.
- Генетические мутации в хромосомах.
Прогноз при остром лимфолейкозе хуже, если аномальные клетки находят в мозгу или цереброспинальной жидкости при постановке диагноза. Некоторые конкретные генетические мутации в лейкозных клетках затрудняют успешное лечение онкологии. Если патологические клетки остаются после индукционной химиотерапии, лейкемия может с трудом поддаваться терапии.
Лечение лейкоза в Израиле
Лечение лейкоза в Израиле дает положительный эффект в 98% случаев. Созвонитесь с экспертами клиники Ассута, чтобы договориться об обслуживании.
ЗАЯВКА НА ЛЕЧЕНИЕ
Отправляя форму Вы соглашаетесь с политикой конфиденциальности
Читайте также:

