Увеличивает чувствительность опухолей к облучению
Побочные действия
Со стороны пищеварительной системы: тошнота, рвота, потеря аппетита, кишечная колика, диарея, запор, обложенность языка, горький, металлический привкус во рту, стоматит, сухость во рту, глоссит, панкреатит.
Со стороны кроветворной системы: обратимая нейтропения (лейкопения).
Со стороны ЦНС: периферическая невропатия (чувство онемения конечностей), головные боли, судороги, сонливость, головокружение, нарушение координации движений, атаксия, спутанность сознания, депрессия, повышенная возбудимость, слабость, бессонница, галлюцинации, раздражительность.
Аллергические реакции: кожная сыпь, крапивница, кожный зуд, многоформная экссудативная эритема, ангионевротический отек и анафилактическая реакция, гиперемия кожи, заложенность носа, лихорадка, артралгия.
Местные реакции: в месте введения возможен тромбофлебит (боль, гиперемия или отечность в месте инъекции).
Со стороны гепатобилиарной системы: повышение активности печеночных ферментов, холестаз желтуха.
Со стороны мочеполовой системы: дизурия, цистит, полиурия. недержание мочи, кандидоз слизистой оболочки влагалища, окрашивание мочи в красно-коричневый цвет (вызывает метаболит метронидазола, не имеет клинического значения).
Прочие: повышение температуры тела, уплощение зубца Т на ЭКГ.
Показания
— протозойные инфекции;
— внекишечный амебиаз, включая амебный абсцесс печени;
— кишечный амебиаз (амебная дизентерия);
— трихомониаз;
— трихомонадный вагинит;
— трихомонадный уретрит;
— инфекции, вызываемые Bacteroides spp. (в т.ч. Bacteroides fragilis, Bacteroides distasonis, Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides vulgatus);
— инфекции костей и суставов;
— инфекции ЦНС, в т.ч. менингит;
— абсцесс мозга;
— бактериальный эндокардит;
— пневмония;
— эмпиема;
— абсцесс легких;
— сепсис;
— инфекции, вызываемые видами Clostridium spp., Peptococcus niger и Peptostreptococcus spp.;
— инфекции брюшной полости (перитонит, абсцесс печени);
— инфекции органов малого таза (эндометрит, абсцесс фаллопиевых труб и яичников, инфекции свода влагалища);
— псевдомембранозный колит (связанный с применением антибиотиков);
— гастрит или язва двенадцатиперстной кишки, связанные с Helicobacter pylori;
— профилактика послеоперационных осложнений (особенно вмешательства на ободочной кишке, параректальной области, аппендэктомия, гинекологические операции);
— лучевая терапия больных с опухолями - в качестве радиосенсибилизирующего лекарственного средства, в случаях, когда резистентность опухоли обусловлена гипоксией в клетках опухоли.
Противопоказания
— лейкопения (в т.ч. в анамнезе);
— органические поражения ЦНС (в т.ч.эпилепсия);
— печеночная недостаточность (в случае назначения больших доз);
— беременность (I триместр);
— период лактации;
— повышенная чувствительность.
С осторожностью
Беременность (II и III триместры) только по жизненным показаниям, почечная/печеночная недостаточность.
Не нашли, что искали? Воспользуйтесь поиском:
Еще с самого начала XX века многие медицинские исследователи посвящали себя изучению загадочных процессов, которые происходят в живой ткани под действием ионизирующей радиации. Уже известно, что радиационное поражение может приводить к смерти за счет гибели клеток, а может быть сублетальным, если пораженные клетки полностью или частично восстанавливаются.
Применительно к онкологии можно сказать, что степень радиочувствительности каждой конкретной опухоли (определяемой врожденной чувствительностью к радиации) будет зависеть не только от непосредственного поражения клеток, но и от способности ткани опухоли к репарации. Хотя при планировании радиотерапевтического лечения в основном руководствуются радиочувствительностью клеток опухоли, на исход лечения может влиять также целый ряд других факторов. Таким образом, собственно радиочувствительность опухоли не является достаточным условием для успешного лечения.
Например, острый лимфобластный лейкоз (ОЛЛ) высоко радиочувствителен, так как его злокачественные малые лимфобласты обладают крайне высокой чувствительностью даже к малым дозам ионизирующей радиации. В то же время, из-за своей распространенности в организме, когда он поражает практически весь костный мозг и многие питаемые кровотоком органы, до недавнего времени было невозможно проводить эффективную радиотерапию этого заболевания без фатальной передозировки всего организма.
Только разработка современной методики аллогенной костномозговой трансплантации (КМТ) позволила проводить тотальное облучение организма достаточно высокими дозами, вызывающими гибель основной массы злокачественных клеток. В данном случае трансплантация оказывает не терапевтический эффект, а позволяет применять повышенные дозы облучения, летальные для лейкозных клеток.
Основной же эффект воздействия ионизирующего излучения состоит в образовании нестабильных высоко реакционноспособных молекул свободных радикалов. Эти свободные радикалы в свою очередь реагируют с молекулами ДНК, вызывая их деструкцию. Вероятность гибели клетки от действия излучения зависит не только от количества энергии, поглощенной тканью (которая в свою очередь зависит от мощности источника облучения), но и от интенсивности пучка и типа радиоактивного излучения: y - излучение, электроны, нейтроны или другие частицы.
Эти различия легли в основу концепции линейной поглощенной дозы (ЛПД), которая характеризуется как количество поглощенной тканью энергии на единичном отрезке пробега конкретного пучка. В общих чертах, киловольтный пучок рентгеновского излучения имеет более высокий коэффициент ЛПД, чем мегавольтный пучок, а пучок нейтронов обладает гораздо более высоким коэффициентом ЛПД, чем рентгеновское излучение или у-излучение. Таким образом, если мы применяем нейтронную терапию, необходимо вводить соответствующие поправки интенсивности облучения по сравнению с обычными источниками.
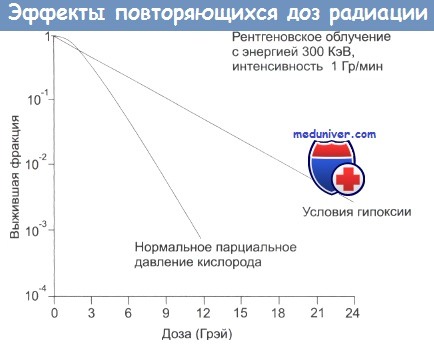
Еще одним существенным моментом является то, что гипоксия, присущая опухолевым тканям, может оказывать радиопротекторное воздействие, особенно при использовании пучков с низким коэффициентом ЛПД. Именно поэтому нейтронное облучение, да еще в сочетании с оксигенацией опухолевых тканей, уже давно считается эффективным способом борьбы со злокачественными опухолями.
Фракционирование: эффект последовательно повторяющихся доз радиации.
Фракционирование увеличивает разницу в реакции на облучение между здоровыми и злокачественными тканями.
Экспериментальные исследования показывают, что человеческие опухолевые клетки значительно отличаются друг от друга по радиочувствительности. Современный уровень знаний позволяет постулировать два типа клеточной гибели: так называемую а-компоненту, которая является линейно-логарифмической (экспоненциальной) и на графиках дозо-зависимой гибели будет представлена прямой линией, и b-компоненту, которая отражает гибель клеток при краткосрочном облучении малыми дозами.
Наиболее существенные различия в радиочувствительности клеток отмечаются именно в этом низкодозном диапазоне (который одновременно имеет наибольшее значение для клинической практики) при облучении дозами до 2 Гр (200 рад). Более того, облучение низкими дозами, по-видимому, увеличивает разброс в чувствительности клеток. С другой стороны, облучение низкими дозами радиации приводит к тому, что некоторые клетки становятся более устойчивыми к действию радиации. Все эти факты позволяют многим выступать за необходимость применения высоких доз облучения для низкочувствительных опухолей.
В построении линейно-квадратических математических моделей с использованием а-компонентов как линейной дозово-зависимой функции и b-компонентов как квадратичной функции выживание клеток используется для анализа конечных результатов. Фракционированный подход в облучении чаще применяют к поздне-реагирующим опухолевым тканям, чем к быстро-реагирующим опухолям.
В ряде клинических случаев неудача при использовании радиотерапии происходит потому, что часто даже после относительно успешного сеанса облучения тем ни менее происходит развитие рецидивов заболевания. Довольно часто это случается, например, при лечении плоскоклеточной карциномы бронхов, когда даже точная рентгенография грудной клетки и бронхоскопия фиксируют удовлетворительный эффект проведенного лечения. Как мы можем объяснить возникновение рецидива через 1-2 года после завершения первичного лечения? Одна из наиболее распространенных точек зрения, которая к тому же согласуется с экспериментальными данными, состоит в том, что в момент проведения первичного лечения в организме присутствуют клетки с различной чувствительностью к излучению.
Этот факт, а также различия в степени оксигенации клеточных субпопуляций являются ключевыми факторами, влияющими на эффективность лечения. Таким феноменам посвящено множество радиобиологических исследований, и почти во всех экспериментах (как на экспериментальных животных, так и в клеточных культурах in vitro) четко показано, что повышение окигенации клеток значительно увеличивает их радиочувствительность по сравнению с клетками, находящимися в состоянии аноксии.
Различие в чувствительности клеток может быть таково, что для эффективного воздействия на клетки в состоянии аноксии требуется применять в два-три раза более мощные дозы облучения. Эта проблема имеет большое клиническое значение, так как если клетки лишаются хорошего артериального кровоснабжения, они неизбежно начинают страдать аноксией.
Предполагается, что в крупных опухолях со сравнительно быстрым ростом и обширными некротическими областями с низкой насыщенностью кровеносными сосудами аноксия может стать основным фактором, определяющим радиорезистентность опухолевой ткани. Эксперименты с использованием микроэлектродов для замеров парциального содержания кислорода подтверждают эти теоретические предположения.
Клетки-предшественники тоже могут иметь различную радиочувствительность, но эти различия не связаны с кислородным эффектом. Рецидивы, возникающие после успешно проведенного курса радиотерапии, в этом случае могут быть обусловлены регенерацией радиорезистентных стволовых клеток опухоли. Причем регенерация может происходить как после окончания полного курса радиотерапии, так и очень быстро, буквально в промежутках между сеансами облучения. Существует ряд наблюдений, показывающих, что возобновление популяции стволовых клеток нормальной ткани после облучения происходит несколько более быстро, чем у опухолевой ткани.
Этот факт может лечь в основу лечения, так как регенеративные способности нормальной ткани позволяют использовать такие дозы облучения, которые при слабом на нее воздействии окажут эффективное поражающее действие на опухоль. В некотором смысле этот эффект аналогичен воздействию химиотерапевтических препаратов, которые тоже воздействуют на все клетки — как нормальные, так и опухолевые — но в разной степени. Признание важности эффектов восстановления популяции опухолевых клеток и клеточной гипоксии ведет к росту числа исследований в данной области.
Среди множества попыток найти эффективное лечение следует отметить разработки методов гиперфракциональной радиотерапии и попытки повысить кислородное снабжение опухолевой ткани, чтобы добиться максимальной локальной эффективности при облучении внешними источниками радиации.
- Вернуться в оглавление раздела "Онкология"
Злокачественные опухоли более чувствительны к лучевому воздействию, чем доброкачественные. По степени чувствительности их делят на радиочувствительные и радиорезистентные.
К радиочувствительнымновообразованиям относятся:
неходжкинская лимфома,
лимфогранулематоз,
мелкоклеточный рак легкого,
Sопухоли семейства Юинга.
Радиорезистентными являются:
фибросаркома,
остеогенная саркома,
хондросаркома,
гипернефрома.
Промежуточное место занимают плоскоклеточный рак и аденокарцинома желудочно-кишечного тракта.
О Чувствительность к излучениювзначительной мере зависит от клеточного состава злокачественной опухоли.
Каждая злокачественная опухоль состоит из четырех клеточных фракций. Одна из них активно пролиферирует. За счет клеток этой фракции происходит рост опухоли. При одинаковой скорости деления клеток темп роста новообразования тем выше, чем больше в ее составе активно делящихся клеток. В быстро растущих опухолях выше, чем в медленно растущих, процент клеток, участвующих в клеточном цикле.
Вторую фракцию составляют клетки полностью жизнеспособные, но временно не участвующие в процессе деления (фаза Go). Они являются резервом клеточного роста. При определенных условиях, в том числе и при гибели клеток первой фракции под влиянием лучевого лечения или химиотерапии, эти клетки начинают делиться, и рост опухоли возобновляется.
Две другие фракции представлены постепенно умирающими живыми клетками и полностью некротизированными. Ни те, ни другие делиться не могут и не оказывают влияния на рост и метастазирование опухоли.
• Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения.
Наибольшей чувствительностью обладают клетки в фазе G2 и М, меньшей - находящиеся в фазах Gs и особенно клетки, не участвующие в делении.
• На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительней к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
Способы повышения радиочувствительности.Чувствительность опухоли к ионизирующему излучению можно повысить сочетая
лучевую терапию с приемом некоторых химиопрепаратов,
Синхронизирующее действие химиопрепаратов. Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и тем самым задерживают прохождение клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны.
Гидроксимочевинатормозит цикл в фазе G1, более чувствительной к лучевой терапии по сравнению с фазой синтеза, 5-фторурацил - в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Другие химиопрепараты, в особенности препараты платины, при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Своеобразной способностью влиять на радиорезистентные клетки в состоянии гипоксии, обладает митомицин С. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
Сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 43-44°С вызывает гибель многих, но не всех, клеток злокачественного новообразования. За счет сохранившихся клеток через некоторое время рост опухоли возобновляется. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на опухоль каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
При повышенном содержании кислорода количество делящихся клеток и скорость роста опухоли возрастают. Поэтому при прочих равных условиях хорошо кровоснабжающиеся опухоли более чувствительны к ионизирующему излучению. Злокачественные новообразования небольших размеров лучше кровоснабжаются, чем массивные опухоли. Они легче поддаются лучевому воздействию.
Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных в барокамере или вводят кислород в окружающие опухоль ткани.
• Такой же эффект получают при использовании лазерного излучения и радиомодификаторов (метронидазол, мизонидазол и др.).

Введение: Степень восприимчивости к излучению называют радиочувствительностью. Клетки, ткани, органы человека в разной степени чувствительны к облучению. Радиочувствительность тканей и клеток не является величиной постоянной, она меняется в зависимости от состояния организма и от действия внешних факторов, а также от уровня пролиферативной активности органов и тканей. Согласно заключению экспертов ВОЗ, успех лучевой терапии примерно на 50% зависит от радиочувствительности опухоли, на 25% от аппаратного оснащения, на 25% от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения[3].
Цель: разделение опухолей по степени восприимчивости к ионизирующему излучению; изучение факторов, от которых зависит радиочувствительность; рассмотрение всех способов радиомодификации.
С целью представления о радиочувствительности различных опухолей и тканей приведем таблицу 11.
Степень восприимчивости к ионизирующему излучению
Неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга
Кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа
Опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы
Железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки
Фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли
Хрящевая, костная, мышечная, фиброзная ткани
Из данной таблицы следует, что наиболее чувствительны к облучению кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа. Далее по степени радиочувствительности идут железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки хрящевая, костная, мышечная, фиброзная ткани. К радиочувствительным опухолям относят неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга. Промежуточной радиочувствительностью обладают опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы. Резистентными являются фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли. Несмотря на то, что в данной таблице отмечены железистый аппарат желудка, толстой кишки, эпителий слизистой тонкой кишки, обладающие промежуточной радиочувствительностью, при опухолях с локализацией в этих органах лучевую терапию применяют редко либо вовсе не применяют, так как опухоли данных локализаций подвижны из-за перистальтических движений желудка и кишечника[4]. А при раке печени не применяют лучевую терапию из-за низкой толерантности печени к ионизирующему излучению[5].
Радиочувствительность злокачественной опухоли к ионизирующему излучению определяется большим числом факторов: возрастом, состоянием больного, формой роста, гистологическим типом новообразования, состоянием тканей, окружающих опухоль, соотношением в опухоли клеточных и стромальных элементов, скоростью репопуляции клеток, степенью оксигенации тканей, наличием некротических участков и гипоксических клеток[3].
Рассмотрим некоторые факторы, влияющие на чувствительность опухолей:
- На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительный к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
- Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения: наибольшей чувствительностью обладают клетки в фазе G2 и M, меньшей – находящиеся в фазах G1 и S.
- Чувствительность к излучению в значительной мере зависит от клеточного состава злокачественной опухоли.
Способы радиомодификации. Достижения в области радиобиологии – изучение прямого и косвенного действия радиации – привели к исследованию процессов радиомодификации.
Прежде чем перейти к способам радиомодификации необходимо знать некоторые понятия о радиомодификации: Радиомодификация – это целенаправленное изменение чувствительности тканей к облучению. Радиомодифицирующие агенты – это физические и химические факторы, с помощью которых эффективность лучевых воздействий может быть повышена путем усиления радиопоражаемости опухоли и ослабления лучевых реакций нормальных тканей. Радиосенсибилизация лучевого воздействия – это процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция - действия, направленные на снижение поражающего эффекта ионизирующего излучения. Соответственно радиопротекторы – это вещества, снижающие радиочувствительность.
На основании выше сказанного способы радиомодификации можно разделить на две большие группы. Первая группа это способы, повышающие радиочувствительность опухолей или, другими словами, повышающие радиопоражаемость, вторая группа – способы, понижающие радиочувствиетльность нормальных тканей.
Подробно рассмотрим каждую группу.
Первая группа способов, повышающих радиочувствительность опухолей:
- Чувствительность опухоли ионизирующего излучения можно повысить, сочетая лучевую терапию с приемом некоторых химиопрепаратов. Используя химиопрепараты в качестве синхронизаторов клеточного цикла (5-фторурацил, платидиам, винкристин и др.), можно на некоторое время задерживать опухолевые клетки в фазе S. Затем большинство клеток синхронно вступает в наиболее радиочувствительные фазы G2 и М, и именно в этот период желательно производить облучение опухоли.
В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалколоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1. Препараты платины при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Митомицин С – влияет на радиорезистентные клетки в состоянии гипоксии. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
- Терморадиотерапия – сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 42-44 °С вызывает гибель многих клеток злокачественного новообразования. Осуществляют с помощью генераторов электромагнитного излучения в СВЧ-, УВЧ-диапазонах. Используют при лечении больных меланомой, рака прямой кишки, молочной железы, опухоли головы и шеи, саркомы костей и мягких тканей.
- Сочетание лучевой терапии с повышением содержания в опухоли кислорода. Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных с использованием для дыхания чистого кислорода при обычном давлении (оксигенорадиотерапия) либо в барокамере под давлением 3-4 атм. (оксигенобарорадиотерапия). Особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
В качестве модифицирующего агента также используют электрон-акцепторные соединения (ЭАС) – метронидазол, мизонидазол, имитирующие функцию кислорода – его сродство к электрону.
- Сочетание лучевой терапии с искусственной гипергликемией. В связи с активным поглощением и накоплением опухолевой тканью глюкозы крови, введение глюкозы больному приводит к временной гипергликемии. Что, в свою очередь, приводит к снижению рН в опухолевых клетках. Следовательно, будет повышаться радиочувствительность за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемию обуславливает значительное усиление противоопухолевого действия ионизирующего излучения.
На основании данных о способах радиосенсибилизации рассмотрим частоту использования трех основных методов повышения радиочувствительности (оксигенобарорадиотерапия, терморадиотерапия, химиолучевая терапия) при различных видах опухолей (табл.2)[1,2].
Злокачественные опухоли более чувствительны к лучевому воздействию, чем доброкачественные. По степени чувствительности их делят на радиочувствительные и радиорезистентные.
К радиочувствительнымновообразованиям относятся:
неходжкинская лимфома,
лимфогранулематоз,
мелкоклеточный рак легкого,
Sопухоли семейства Юинга.
Радиорезистентными являются:
фибросаркома,
остеогенная саркома,
хондросаркома,
гипернефрома.
Промежуточное место занимают плоскоклеточный рак и аденокарцинома желудочно-кишечного тракта.
О Чувствительность к излучениювзначительной мере зависит от клеточного состава злокачественной опухоли.
Каждая злокачественная опухоль состоит из четырех клеточных фракций. Одна из них активно пролиферирует. За счет клеток этой фракции происходит рост опухоли. При одинаковой скорости деления клеток темп роста новообразования тем выше, чем больше в ее составе активно делящихся клеток. В быстро растущих опухолях выше, чем в медленно растущих, процент клеток, участвующих в клеточном цикле.
Вторую фракцию составляют клетки полностью жизнеспособные, но временно не участвующие в процессе деления (фаза Go). Они являются резервом клеточного роста. При определенных условиях, в том числе и при гибели клеток первой фракции под влиянием лучевого лечения или химиотерапии, эти клетки начинают делиться, и рост опухоли возобновляется.
Две другие фракции представлены постепенно умирающими живыми клетками и полностью некротизированными. Ни те, ни другие делиться не могут и не оказывают влияния на рост и метастазирование опухоли.
• Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения.
Наибольшей чувствительностью обладают клетки в фазе G2 и М, меньшей - находящиеся в фазах Gs и особенно клетки, не участвующие в делении.
• На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительней к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
Способы повышения радиочувствительности.Чувствительность опухоли к ионизирующему излучению можно повысить сочетая
лучевую терапию с приемом некоторых химиопрепаратов,
Синхронизирующее действие химиопрепаратов. Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и тем самым задерживают прохождение клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны.
Гидроксимочевинатормозит цикл в фазе G1, более чувствительной к лучевой терапии по сравнению с фазой синтеза, 5-фторурацил - в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Другие химиопрепараты, в особенности препараты платины, при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Своеобразной способностью влиять на радиорезистентные клетки в состоянии гипоксии, обладает митомицин С. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
Сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 43-44°С вызывает гибель многих, но не всех, клеток злокачественного новообразования. За счет сохранившихся клеток через некоторое время рост опухоли возобновляется. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на опухоль каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
При повышенном содержании кислорода количество делящихся клеток и скорость роста опухоли возрастают. Поэтому при прочих равных условиях хорошо кровоснабжающиеся опухоли более чувствительны к ионизирующему излучению. Злокачественные новообразования небольших размеров лучше кровоснабжаются, чем массивные опухоли. Они легче поддаются лучевому воздействию.
Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных в барокамере или вводят кислород в окружающие опухоль ткани.
• Такой же эффект получают при использовании лазерного излучения и радиомодификаторов (метронидазол, мизонидазол и др.).

Академик РАМН,Доктор медицинских наук, врач-хирург высшей квалификационной категории,Заведующим Торако-Абдоминальным отделением РНИОИ,Заслуженный врач РФ, Профессор Касаткин Вадим Фёдорович

Доктор медицинских наук, Заслуженный врач РФ, врач-хирург высшей квалификационной категории, Профессор Круглов Сергей Владимирович Прочитать о докторе подробнее

Академик РАМН,Доктор медицинских наук, врач-хирург высшей квалификационной категории,Заведующий гинекологическим отделением РНИОИ,Заслуженный деятель науки РФ,Заслуженный изобретатель России ,Лауреат Государственной премии РФПрофессор Сидоренко Юрий Сергеевич

Редактор страницы: Семенистый М.Н.
Внимание радиоонкодогов-экспериментаторов сосредоточивалось почти исключительно на том периоде после облучения, когда удается наблюдать явные изменения структуры или функции опухолевых элементов. С того же момента, как эти изменения ликвидируются, — морфологические признаки альтерации исчезают, а пролиферативная способность достигает исходного уровня, —опухолевые клетки принято считать ничем не отличающимися от необлученных. Между тем в радиобиологии было установлено, что облученные клетки испытывают длительное латентное последействие. В этот период изменение их реактивности может быть выявлено с помощью, дополнительного воздействия. Пережившие лучевое воздействие инфузории, ничем в обычных для них условиях не отличавшиеся от необлученных форм, обнаруживали измененную реактивность при самых разнообразных альтерирующих влияниях; бактерии, выжившие после воздействия бета-лучами, оказались сенсибилизированными к действию высоких и низких температур, а также к повторному облучению. Эти данные и послужили основанием для исследования чувствительности облученных опухолевых клеток в тот период, когда их принято считать неотличимыми от необлученных.
В условиях организма изменение чувствительности может быть результатом как прямого, так и непрямого действия радиации. Воздействуя на опухолевые элементы, in vitre можно было выяснить значение в этом плане только прямого, непосредственного влияния лучистой энергии.
Исходным источником опухолевого материала служила мышь с асцитом в брюшной полости (асцитный вариант карциномы Эрлиха). Полученная от нее асцитическая жидкость была разделена на две
части: одна часть (3 мл) в стерильных условиях в стеклянном бюксе, крышкой которому служил слой бумаги, подвергалась облучению дозой в 1600 р (напряжение — 190 кв, сила тока — 20 мА, без фильтра, фокусное расстояние — 30 см; мощность дозы — 300 р/мин.), сразу же после облучения опухолевый материал перевивали по 0,25 мл под кожу спины 10 мышам. Одновременно другим 10 мышам точно так же перевивали исходную необлученную асцитную жидкость от той же мыши (контроль). Среднесуточный прирост опухоли в контроле равнялся 0,89, а в опыте — 0,73. На 21-й день после первой перевивки опухоль из облученного материала, наименее заторможенную в росте (К — 0,79), извлекали из организма и подготавливали для перевивки описанным выше стандартным способом. Опухолевую суспензию вво-

ИЗМЕНЕНИЕ ЧУВСТВИТЕЛЬНОСТИ ОБЛУЧЕННЫХ ОПУХОЛЕВЫХ КЛЕТОК
Рис. 16. Чувствительность опухолевых клеток к повторному облучению:
1—интервал между облучениями 42 дня, 2— интервал
между облучениями 126 дней, 3— облученные однократно.
По вертикали — средний размер опухолей по Шреку; по горизонтали — дни после перевивки.
дили по 0,2 мл под кожу спины.10 мышам. Так же поступали-и с опухолью из необлученного материала. Во втором пассаже среднесуточный прирост новообразований из облученного материала у шести мышей не отличался от контроля. Одну из таких опухолей (на 21-ые сутки после перевивки), как и опухоль из необлученного материала, использовали для третьего пассажа. Другую мышь одновременно с контрольной подвергали тотальному облучению дозой в 2000 р (напряжение — 190 кв, сила тока — 20 мА, фильтр — 0,5 мм меди и 1 мм алюминия, пола 6X8 см, фокусное расстояние — 30 см, мощность -дозы — 88 р/мин).
Затем материал от каждой из этих мышей перевивали по 0,2 мл под кожу спины 10 мышам в каждом случае. Как видно на рис. 16, значительно более сильное. торможение роста испытывают трансплантаты из материала подвергнутого повторному облучению. Это выражается, как в большем латентном периоде появления опухолевых
узелков, так и в меньшей скорости их роста в дальнейшем. Впоследствии четыре опухоли, рост которых был сильнее всего заторможен, рассосались в период с 40-го по 60-й день после перевивки.
В третьем пассаже рост опухолей из облученного материала не отличался от контроля. Среднесуточный прирост опухоли в контроле был равен 0,86, а в опыте — 0,89. На 21-й день после 3-й перевивки, то есть через 63 дня

ИЗМЕНЕНИЕ ЧУВСТВИТЕЛЬНОСТИ ОБЛУЧЕННЫХ ОПУХОЛЕВЫХ КЛЕТОК
Рис. 17. Чувствительность опухолевых клеток к повторному облучению:
1 — интервал между облучениями 63 дня, 2 — облученные однократно, 3 — контроль.
после облучения исходного материала вне организма, одна мышь из опыта и одна из контроля подвергались тотальному облучению дозой в 2000 р, при тех же условиях, что животные из второго пассажа. Сразу же после облучения опухолевый материал перевивали на 10 мышей в каждом случае. И в этом опыте более сильное торможение роста испытывали трансплантаты из повторно облученного материала (рис. 17). Правда, угнетение роста здесь было выражено слабее, чем при повторном облучении с интервалом в 42 дня между обоими воздействиями (см. рис. 16). Не наблюдалось здесь и рассасывания трансплантатов. Наконец, в шестом пассаже, то есть через 126 дней после исходного облучения вне организма, повторное лучевое воздействие по биологическому эффекту оказалось эквивалентным первичному облучению (см. рис. 16).
Таким образом, влияние ионизирующей радиации на опухолевые клетки не ограничивается только явными морфологическими изменениями; оно приводит также и к латентному последействию, носящему длительный характер. В этот период, с помощью функциональной пробы— повторного облучения удается обнаружить изменения реактивности злокачественных элементов; облученные опухолевые клетки оказываются сенсибилизированными к повторному лучевому воздействию, причем тем сильнее, чем меньше интервал, отделяющий первое облучение от второго. Эта сенсибилизация, по-видимому, особенно резко выражена в первые 15 дней после облучения, насколько можно судить на основании побочных данных из работы П. Монтгомери и С. Уоррена (393). К сожалению, этими побочными данными, на которые авторы не обращают никакого внимания, и ограничиваются в доступной нам радиоонкологической литературе все сведения относительно сенсибилизации облученных вне организма опухолевых, клеток к повторному действию радиации.
Длительная следовая реакция измененной реактивности, которая наблюдается после непосредственного действия радиации на опухолевые клетки, является, таким образом, одной из причин кумуляции биологического эффекта при повторном облучении.
Облученные опухолевые клетки сенсибилизированы, по-видимому, не только к действию радиации; есть основания считать, что этот эффект, так же как и в опытах Н. Ковалевой (104) и 3. Я. Граевского, носит в известной мере неспецифический характер.
Установлено, что в культуре ткани, облученные опухолевые клетки, не испытывающие угнетения роста при определенных дозах лучевого воздействия, начинают расти медленнее или вовсе перестают расти после перенесения их в новую питательную среду. Это явление неизменно связывали не с самой процедурой перенесения клеток в новую питательную среду, а с большей продолжительностью культивирования, необходимой для выявления лучевого эффекта. Такое объяснение, однако, является маловероятным. Зависимость торможения роста от времени после облучения в данном случае выступает далеко не столь четко, как связь с самим перенесением опухолевых элементов в субкультуру, точнее, с механической травмой, которой они при этом подвергаются. Имен
но после этого каждый раз и начинается торможение роста; эксплантатов. Травма не оказывает существенного влияния: на рост интактных опухолевых клеток, но приводит к торможению пролиферации облученных злокачественных элементов.
К. Сугиура (459) обнаружил повышение чувствительности облученных опухолевых клеток по отношению к гипотонии. Внутриопухолевое повторное введение дистиллированной ‘воды повышало процент рассасывания облученных новообразований в 2—10 раз по сравнению с контролем, когда опухоль подвергалась только облучению. Само по себе повторное введение дистиллированной воды в опухолевую ткань не отражалось на росте необлученных опухолей.
Таким образом, вся совокупность представленных данных свидетельствует о повышении чувствительности облученных опухолевых клеток, постепенно угасающем в длинном ряду их потомков.
КРАТКОЕ ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ ДАННЫХ
Собственные наблюдения и литературные данные, представленные в настоящей главе, свидетельствуют об отсутствии вне организма различий в чувствительности между злокачественными клетками и их нормальными прототипами при действии самых разнообразных повреждающих агентов и, в частности, ионизирующей радиации. Совокупность представленных данных заставляет признать также, что in vitro соотношения в радиочувствительности между элементами стромы и паренхимы опухоли довольно непостоянны и в значительной степени зависят от их специфических особенностей. Все это приводит к предположению о том, что большая радиочувствительность опухолевых элементов формируется в организме. В связи с этим организму принадлежит, по-видимому, активная роль в процессе лучевой терапии злокачественных новообразований.
Целый ряд радиобиологических и онкологических данных, полученных за последнее время, дают возможность поставить вопрос о значении регуляторных систем организма в этом процессе. Результаты проведенного цитологического исследования позволяют наметить основные направления, по которым может осуществляться участие этих систем в изменении опухолевых элементов при лучевом воздействии:
1. Было установлено, что эффективность лучевого воздействия зависит от состояния опухолевых элементов в момент альтерации. В связи с этим ставится вопрос о зависимости результатов лучевого воздействия в условиях организма от характера регуляторных влияний на опухо
левые клетки в момент альтерации. По существу, это означает выяснение роли регуляторных систем в эффекте прямого действия лучистой энергии.
2. Было установлено, что результат лучевого воздействия зависит от условий, существования опухолевых клеток после облучения. Условия существования опухолевых клеток после облучения в организме связаны с теми изменениями, которые вызваны в нем ионизирующей радиацией. Влияние этих условий на опухолевые клетки относится поэтому к области непрямого ее действия. В связи с этим ставится вопрос о значении регуляторных систем в непрямом действии лучистой энергии.
При выяснении этих вопросов необходимо учитывать те закономерности клеточного уровня реагирования (зависимость радиочувствительности от морфофункциональных особенностей опухолевых клеток, повышение их чувствительности после облучения), которые и независимо от регуляторных влияний могут иметь значение в процессе лучевой терапии.
Читайте также:

